一种检测吡虫啉的试纸条、吡虫啉半抗原的制备方法及检测吡虫啉残留的方法与流程
本发明涉及吡虫啉检测,具体涉及一种检测吡虫啉的试纸条、吡虫啉半抗原的制备方法及检测吡虫啉残留的方法。
背景技术:
吡虫啉(imi)是烟碱类超高效杀虫剂,具有广谱、高效、低毒、低残留,害虫不易产生抗性,对人、畜、植物和天敌安全等特点,并有触杀、胃毒和内吸等多重作用。
目前,含imi的农药产品已在120多个国家的140余种农作物上登记使用,应用范围涉及粮食、蔬菜、果树、茶叶等60余种作物,防治对象涉及同翅目、半翅目、缨翅目、双翅目、鞘翅目、鳞翅目等7个目50多种害虫。imi的大量使用不仅对环境造成了严重影响,同时畜禽因长期食用含imi残留的植物,使其在体内富集,最后经食物链进入人体,危害人体健康。土壤是农药在环境中的主要归属。农药无论以何种方式施用,大都会直接或间接进入土壤中。农药在土壤中的降解归宿是农药环境行为的重要部分。因此,测定土壤、门窗洞等砌体墙中吡虫啉残留量,对科学评估农药残留动态及其对环境现实和潜在的污染是必要的。
从文献报道看,有关imi残留的检测方法主要集中于高效液相色谱法(hplc)、气相色谱法(gc)、电化学分析法(ea)和免疫分析法(elisa)四个方面,更倾向于色谱技术和免疫检测技术。尽管色谱法是目前公认的药物残留检测方法,但这类方法普遍存在着所需仪器昂贵、仪器操作技术要求高、样品前处理繁琐和分析耗时长、检测成本高、不适于现场实时检测等问题。而药物残留免疫检测技术在残留样本检测过程中的复杂程度、速度、灵敏度、准确性、特异性、单位时间内样本分析容量、检测成本等方面与仪器分析法的比较优势突出,几乎克服了仪器分析法所表现出来的所有不足,近年来已经在食品质量安全检测中得到了越来越广泛的应用,且逐渐被人们所认可。
残留物的免疫学检测方法不仅检测限低、特异性强,而且操作简便、检测速度快、检测成本低,非常容易推广,是当前药物残留检测的研究热点。尽管国外已有imi残留免疫学检测的文献报道,但均不同程度地存在着残留样本前处理程序复杂、费用高、检测限偏高,不能满足国际上imi在食品中的mrls等问题。因此,找到一个更有效的方法解决这些问题,是摆在我们面前亟待解决的重要问题。
技术实现要素:
本发明的目的是提供一种检测吡虫啉的试纸条、吡虫啉半抗原的制备方法及检测吡虫啉残留的方法,其能够快速对残留的吡虫啉进行检测,解决现有技术中的问题。
本发明采用的技术方案,如下所示:
一种检测吡虫啉的试纸条,包括底板,底板的上设有样品吸收垫和吸水垫;底板上还设有结合物释放垫,结合物释放垫的一部分位于样品吸收垫与底板之间;被样品吸收垫覆盖,另一部分不被样品吸收垫覆盖且位于样品吸收垫与吸水垫之间;在结合物释放垫与吸水垫之间设有反应膜,反应膜上具有包被有吡虫啉半抗原-载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线,结合物释放垫上设有吡虫啉单克隆抗体-胶体金标记物。
作为一种优选方式,此试纸条装在试纸壳内,试纸壳上设有加样孔,加样孔内滴加的液体首先与样品吸收垫接触。
作为一种优选技术方案,所述吡虫啉半抗原-载体蛋白偶联物是由吡虫啉半抗原与载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白、卵清蛋白、血蓝蛋白、甲状腺蛋白、人血清白蛋白中任意一种。
作为一种优选技术方案,所述吡虫啉单克隆抗体是以吡虫啉半抗原-载体蛋白偶联物作为免疫原制备获得,是由吡虫啉单克隆抗体杂交瘤细胞株分泌获得。
作为一种优选技术方案,检测线的制备包括以下过程:
步骤1,将吡虫啉半抗原与载体蛋白偶联,得到吡虫啉半抗原-载体蛋白偶联物;
步骤2,将吡虫啉半抗原-载体蛋白偶联物包被在反应膜上构成检测线。
作为一种优选技术方案,质控线的制备包括以下过程:
步骤1,提取小鼠igg免疫健康山羊,得到羊抗鼠抗抗体;
步骤2:将羊抗鼠抗抗体包被在反应膜上构成质控线。
作为一种优选技术方案,制备上述吡虫啉单克隆抗体-胶体金标记物包括以下过程:
步骤1,制备吡虫啉单克隆抗体:用吡虫啉半抗原-载体蛋白偶联物免疫小鼠,将小鼠脾细胞和骨髓瘤细胞通过融合、筛选,得到吡虫啉单克隆杂交瘤细胞株;
步骤2,用柠檬酸三钠与氯金酸反应制备胶体金;
步骤3,将吡虫啉单克隆抗体加入胶体金中,得到吡虫啉单克隆抗体-胶体金标记物。
作为一种优选技术方案,上述样品吸收垫用含0.5%牛血清白蛋白、ph为7.2、0.1mol/l磷酸盐缓冲液浸泡2h,37℃下烘干2h,牛血清白蛋白按体积分数计算。
一种吡虫啉半抗原的制备方法,包括以下步骤:
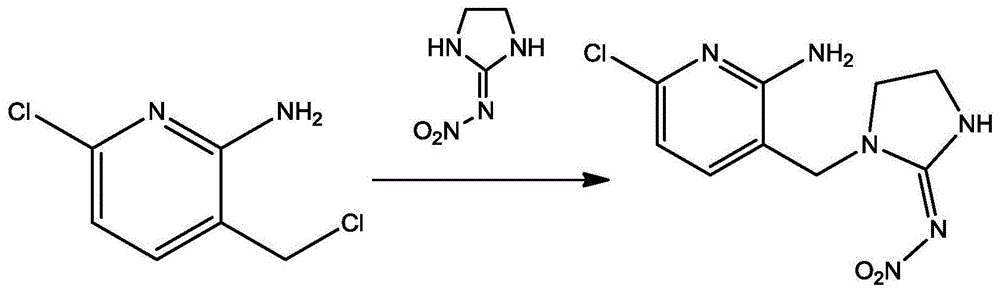
取6-氯-3-(氯甲基)吡啶-2-胺0.5g,加二甲基亚砜80ml溶解,加氢化钠0.27g,搅拌,加2-硝基亚氨基咪唑烷0.41g,油浴加热,90℃搅拌反应8h;
停止反应,冷却至室温,加蒸馏水100ml,加乙酸乙酯80ml×3,萃取三次。合并有机相,蒸干,上硅胶柱,二氯甲烷/甲醇(v/v,10/1)洗脱分离,得到氨基吡虫啉半抗原产物。
作为一种优选技术方案,吡虫啉半抗原的分子结构式为:
一种检测吡虫啉残留的方法,包括以下步骤:
s1:样本处理;
s2:利用权利要求1~7任一项所述的检测吡虫啉的试纸条进行检测;
s3:分析检测结果。
此检测方法特别适合对土壤、门窗洞等砌体墙中吡虫啉残留进行检测。
本发明的吡虫啉快速检测试纸条采用高度特异性的抗体抗原反应及竞争抑制免疫层析分析技术,将吡虫啉单克隆抗体-胶体金标记物固定于结合物释放垫上,样品中的吡虫啉在流动过程中,与结合物释放垫上的吡虫啉单克隆抗体-胶体金标记物结合,形成药物-抗体-胶体金标记物。样本中的药物与反应膜检测线上的吡虫啉半抗原-载体蛋白偶联物竞争结合吡虫啉单克隆抗体-胶体金标记物,根据检测线红色条带有无或颜色深浅来判断待测样品液中是否含有吡虫啉残留。
检测时,样品经处理后滴入加样孔内,当吡虫啉在样品中的浓度低于检测限或为零时,单克隆抗体-胶体金标记物在层析过程中会与固定在反应膜上的吡虫啉半抗原-载体蛋白偶联物结合,在检测线(t)和质控线(c)内各出现一条红色条带;如果吡虫啉在样品中的浓度等于或高于检测限,单克隆抗体-胶体金标记物会与吡虫啉全部结合,从而在t线处因为竞争反应不会与吡虫啉半抗原-载体蛋白偶联物结合而不出现红色条带。
本发明的试纸条具有灵敏度高、特异性强、成本低、操作简单、检测时间短、适合各种单位使用、储存简单、保质期长的优点。用本发明试纸条检测吡虫啉残留的方法简便、快速、直观、准确、适用范围广、成本低、易推广使用。
附图说明
图1为吡虫啉半抗原合成图。
图2为试纸条剖面结构示意图。
其中,附图标记如下所示:
1-吸收垫,2-结合物释放垫,3-反应膜,4-吸水垫,5-检测线,6-质控线,7-底板。
具体实施方式
以下通过具体实施方案进一步描述本发明,本发明也可通过其它的不脱离本发明
技术特征的方案来描述,因此所有在本发明范围内或等同本发明范围内的改变均被本发明包含。
实施例
如图1~2所示,一种检测吡虫啉的试纸条,包括底板、样品吸收垫、吸水垫、结合物释放垫、反应膜、检测线、质控线。
其中,反应膜上具有包被有吡虫啉半抗原-载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线。
对于试纸条可部件的制备和组装过程进行一一陈述:
1、吡虫啉半抗原的制备
取6-氯-3-(氯甲基)吡啶-2-胺0.5g,加二甲基亚砜80ml溶解,加氢化钠0.27g,搅拌,加2-硝基亚氨基咪唑烷0.41g,油浴加热,90℃搅拌反应8h。停止反应,冷却至室温,加蒸馏水100ml,加乙酸乙酯80ml×3,萃取三次。合并有机相,蒸干,上硅胶柱,二氯甲烷/甲醇(v/v,10/1)洗脱分离,得到氨基吡虫啉半抗原产物0.68g,收率89.47%。
2、免疫原的制备
取氨基吡虫啉10mg,加乙醇0.5ml溶解,加1mol/l盐酸0.2ml,搅拌混匀,加水0.3ml,0-5℃搅拌30min,加入还有3.8mg亚硝酸钠的水溶液0.5ml,继续搅拌1h,得到半抗原活化液a液;取牛血清白蛋白(bsa)50mg,加0.05m碳酸钠水溶液3ml溶解,得到b液,将a液缓慢滴加到b液中,0-5℃搅拌2h,0.02mpb缓冲液透析纯化,得到吡虫啉-bsa免疫原,-20℃保存备用。
3、包被原的制备
取氨基吡虫啉6mg,加乙醇0.3ml溶解,加1mol/l盐酸0.1ml,搅拌混匀,加水0.2ml,0-5℃搅拌30min,加入还有2.6mg亚硝酸钠的水溶液0.6ml,继续搅拌1h,得到半抗原活化液a液;取卵清蛋白(ova)50mg,加0.05m碳酸钠水溶液3ml溶解,得到b液,将a液缓慢滴加到b液中,0-5℃搅拌2h,0.02mpb缓冲液透析纯化,得到吡虫啉-ova包被原(即吡虫啉半抗原-卵清蛋白偶联物),-20℃保存备用。
4、吡虫啉单克隆抗体的制备
(1)动物免疫
将上述免疫原注入balb/c小鼠体内,免疫剂量为150μg/只,使其产生抗血清。
(2)细胞融合和克隆化
取免疫balb/c小鼠脾细胞,按8:1(数量配比)比例与sp2/0骨髓瘤细胞融合,采用间接竞争elisa法测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到稳定分泌单克隆抗体的杂交瘤细胞株。
(3)细胞冻存和复苏
将杂交瘤细胞用冻存液制成1×106个/ml的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
(4)单克隆抗体的制备与纯化
增量培养法:将杂交瘤细胞置于细胞培养基中,在37℃条件下进行培养,用辛酸-饱和硫酸铵法将得到的培养液进行纯化,得到单克隆抗体,-20℃保存。
所述细胞培养基为向rpmi1640培养基中添加小牛血清和碳酸氢钠,使小牛血清在细胞培养基中的终浓度为20%(质量分数),碳酸氢钠在细胞培养基中的终浓度为0.2%(质量分数);所述细胞培养基的ph为7.4。
5、羊抗鼠抗抗体的制备
以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。
6、吡虫啉单克隆抗体-胶体金标记物的制备
(1)胶体金的制备
用双蒸去离子水将1%氯金酸稀释成0.01%(质量分数),取100ml置于锥形瓶中,用恒温电磁搅拌器加热至沸腾,在持续高温、持续搅拌下加入2.5ml1%柠檬酸三钠,继续匀速搅拌加热至溶液呈透亮的红色时停止,冷却至室温后用去离子水恢复到原体积,4℃保存。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物。
(2)吡虫啉单克隆抗体-胶体金标记物的制备
在磁力搅拌下,用0.2mol/l碳酸钾溶液调胶体金的ph值至7.0,按每毫升胶体金溶液中加入20~50μg的标准向胶体金溶液中加入吡虫啉单克隆抗体,继续搅拌混匀30min,加入10%bsa,使其在胶体金溶液中的终浓度为1%(体积分数),静置10min。12000r/min、4℃离心40min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/10的复溶缓冲液将沉淀重悬,置4℃备用。
复溶缓冲液:含酪蛋白0.02%~0.1%(质量分数)、吐温-800.05%~0.2%(质量分数)、ph7.2的0.02mol/l磷酸盐缓冲液。
7、结合物释放垫的制备
将结合物释放垫浸泡于含有牛血清白蛋白(牛血清白蛋白在缓冲液中的浓度为0.5%)、ph为7.2、0.5mol/l的磷酸盐缓冲液中,均匀浸湿1h,37℃烘3h备用。用isoflow喷膜仪将制备好的吡虫啉单克隆抗体-胶体金标记物均匀喷涂在结合物释放垫上,每1cm结合物释放垫喷涂0.01ml吡虫啉单克隆抗体-胶体金标记物后,置于37℃环境中(湿度<20%)60min后取出,置于干燥环境(湿度<20%)中保存备用。
8、反应膜的制备
将吡虫啉半抗原-卵清蛋白偶联物包被到反应膜上构成检测线,将羊抗鼠抗抗体包被在反应膜上构成质控线。
包被过程:用磷酸缓冲液将吡虫啉半抗原-卵清蛋白偶联物稀释到10mg/ml,用isoflow点膜仪将其包被于硝酸纤维素膜上的检测线(t线),包被量为0.8μl/cm;用0.01mol/l、ph7.4的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200μg/ml,用isoflow点膜仪将其包被于硝酸纤维素膜上的质控线(c线),包被量为1.0μl/cm。将包被好的反应膜置于37℃条件下干燥2h,备用。
9、样品吸收垫的制备
将样品吸收垫置于含0.5%牛血清白蛋白(体积分数)、ph7.2、0.1mol/l磷酸盐缓冲液中浸泡2h,37℃烘2h备用。
10、试纸条的组装
将样品吸收垫、结合物释放垫、反应膜、吸水垫依次按顺序粘贴在底板上;结合物释放垫从起始端有1/3区域被样品吸收垫覆盖,结合物释放垫的末端与反应膜的始端连接,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与底板的始端对齐,吸水垫的末端与底板的末端对齐;所述反应膜上有检测线和质控线,检测线(t线)和质控线(c线)均为与所述试纸条的长相垂直的条状带;检测线位于靠近结合物释放垫的末端的一侧;质控线位于远离结合物释放垫的末端的一侧。
将试纸条用机器切成3mm宽的小条,装在特制的塑料制卡中,4~30℃条件下可保存12个月。
作为一种优选实施方案,所述底板可为pvc底板或其他硬质不吸水的材料。吸水垫,可以为吸水纸。
作为一种优选实施方案,反应膜除了为上述硝酸纤维素膜,还可以为醋酸纤维素膜。
实验例1:对样品中吡虫啉残留的检测:
1、用试纸条进行检测
用吸管吸取待检样品溶液垂直滴加3滴于加样孔,液体流动时开始计时,反应5~10min,判定结果。
2、分析检测结果
通过胶体金分析仪(简称“分析仪”)读取结果:
试纸条阴性表示样品中吡虫啉浓度<低检测限(22mg/kg);
试纸条疑似阳性表示样品中低检测限≤吡虫啉浓度≤高检测限(22mg/kg-107mg/kg);
试纸条阳性表示样品中吡虫啉浓度>高检测限(107mg/kg)。
实验例2:样品检测实例
1、检测限试验
取空白土壤及砌体墙样本,在其中分别添加吡虫啉至终浓度为11、22、43、107、214mg/kg,取试纸条进行检测,每个样本重复测定三次。
用试纸条检测土壤及砌体墙样本时,当其中吡虫啉添加浓度为11mg/kg时,分析仪显示为阴性;当其中吡虫啉添加浓度为22、43mg/kg时,分析仪显示为疑似阳性;当其中吡虫啉添加浓度为107、214mg/kg时,分析仪显示为阳性。
2、假阳性率、假阴性率试验
取已知吡虫啉含量大于107mg/kg的土壤及砌体墙阳性样本各20份和含量小于22mg/kg的土壤及砌体墙阴性样本各20份,用三批试纸条进行检测,计算其阴阳性率。结果见表1,表2。
表1土壤检测样本结果
表2砌体墙检测样本结果
结果表明:用3个批次生产的试纸条检测阳性土壤及砌体墙样本时,结果全为阳性,可知阳性样本符合率为100%,假阴性率为0;检测20份阴性土壤及砌体墙样本时,结果全为阴性,可知阴性符合率为100%,假阳性率为0。说明本发明的检测吡虫啉的试纸条可以对土壤及砌体墙中吡虫啉残留进行快速检测。
实验例3:特异性试验
用吡虫啉试纸条检测500mg/kg啶虫脒、多菌灵、甲霜灵、异菌脲等药物。结果显示,试纸条质控线和检测线均显色,呈阴性。说明本试纸条对500mg/kg啶虫脒、多菌灵、甲霜灵、异菌脲等药物无交叉反应。
值得说明的是,基于上述结构设计的前提下,为解决同样的技术问题,即使在本发明上做出的一些无实质性的改动或润色,所采用的技术方案的实质仍然与本发明一样,故其也应当在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!