一种快速、特异性测定RNA含量的方法与流程
本发明涉及一种快速、特异性测定rna含量的方法,属于生物技术领域。
背景技术:
rna是重要的生物分子,负责许多功能,其中包括物理传递、遗传信息解释、分子机器的结构支持以及基因表达的调控等。在生物样品和活细胞中定量rna具有非常重要的作用。现有的rna检测方法包括紫外吸收光谱法和地衣酚比色法,前者利用rna在260nm处有最大吸收峰对核酸进行定量,而后者是利用在酸性环境下,核糖发生降解成糠醛,利用地衣酚和糠醛显色对糠醛定量,从而间接的对rna进行定量。此外,定磷法也经常用于核酸类物质的检测,主要利用核酸中的磷与钼酸的显色反应来实现核酸物质的定量。但是这几种方法无法避免生物样品中其他物质的干扰,比如蛋白质、dna类物质对于紫外吸收法测定rna会有较大干扰,核糖类物质对地衣酚法以及其他含磷物质如磷酸盐对定磷法检测的干扰等。
近年来,由于荧光的灵敏度高,检测快速,通量高的优点,核酸的荧光测定已经得到了广泛的发展。最常用的用于核酸检测的荧光染料是hochest33258,但是hochest33258是一种能够同时结合dna和rna的非特异性染料,因此在测定的样品中含有dna时,需要先用rna酶降解rna,先对样品中的dna进行定量,之后再rna定量时减去样品中的dna含量,此方法操作过程繁琐费时,增加了实验中的误差。
因此需要开发出一种快速、特异性测定rna含量的方法,排除rna定量过程中杂质的干扰,提高rna定量的准确性,同时简化操作,提高效率。
技术实现要素:
有鉴于此,本发明的目的在于克服现有技术的不足,提供一种快速、特异性测定rna含量的方法。
为了解决上述技术问题,本发明采用如下方案实现:
本发明提供一种测定rna含量的方法,将rna特异性染料与rna样品混合孵育,通过测定荧光强度计算rna的含量。
在本发明的一种实施方式中,所述rna样品中还含有dna、酚类、醇类物质、蛋白质。
在本发明的一种实施方式中,所述rna样品中的rna含量至少为2μg/ml
在本发明的一种实施方式中,所述rna特异性染料为sytotmrnaselecttmgreenfluorescentcellstain。
在本发明的一种实施方式中,所述rna特异性染料的浓度为5~10μmol/l。
在本发明的一种实施方式中,利用酶标仪测量荧光强度,测量条件为激发波长400~500nm,发射波长500~600nm。
在本发明的一种实施方式中,孵育时间为2~7min。
在本发明的一种实施方式中,测定总时间不超过10min。
本发明提供一种特异性测定rna的方法,向待测样品中加入rna特异性染料,荧光强度计算rna的含量;在激发波长400~500nm,发射波长500~600nm的条件下检测荧光;检测结果具有荧光反应即为样品中含有rna。
在本发明的一种实施方式中,所述rna样品中还含有dna、核糖、磷酸盐和/或蛋白质。
在所述rna样品中还含有dna、核糖、磷酸盐和/或蛋白质。
在本发明的一种实施方式中,所述dna的浓度不低于2μg/ml。
在本发明的一种实施方式中,核糖的浓度不低于0.6μg/ml;所述磷酸盐的浓度不低于0.6μg/ml;所述蛋白质的浓度不低于0.6μg/ml。
本发明还保护所述方法在测定rna中的应用。
本发明的优点:本发明所提供的测定rna的方法,可以通过sytotmrnaselecttm染料与样品的混合,再利用酶标仪快速测定荧光强度,根据标准曲线即可得到对应的rna含量,快速、简便。对于rna的纯度要求较低,能够在含有多种杂质的环境中特异性与rna进行结合,并准确测定其含量;且在低浓度rna(2μg/ml)时,也能准确测定其含量。且检测时间短,对于快速、特异性测定rna含量具有重要意义。
附图说明
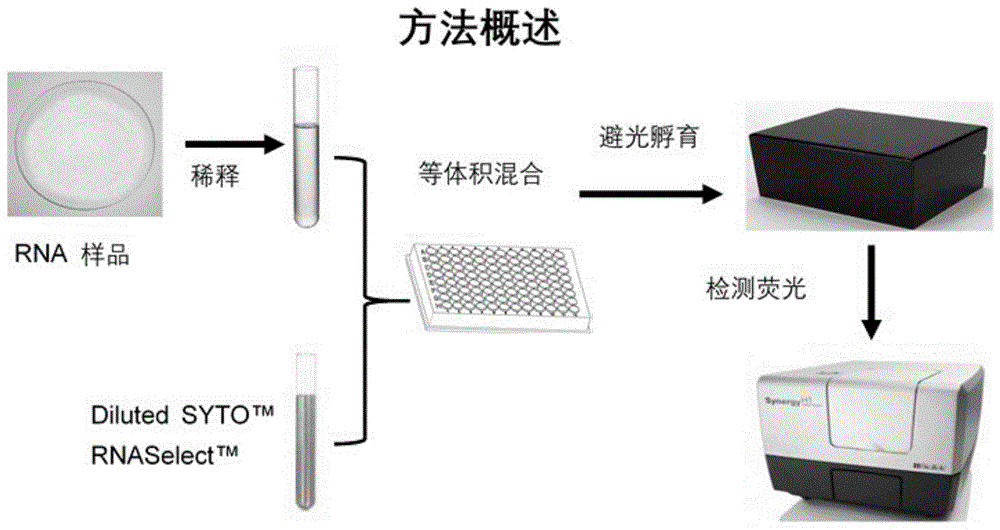
图1为本发明检测方法的流程示意图。
图2为sytotmrnaselecttm检测不同浓度rna的荧光强度。
图3为荧光强度与rna浓度的标准曲线。
图4为sytotmrnaselecttm与hoechst33255对不同rna样品荧光定量结果。
图5为样品中含有其他杂质的rna检测结果。
图6为紫外分光光度法、地衣酚法和sytotmrnaselecttm法检测rna含量的比较结果。
具体实施方式
一、材料和设备
rna标准品(sigma):酵母单链rrna
dna标准品(sigma):鲑鱼精dna
pbs缓冲液(1l):nacl8g,kcl0.2g,na2hpo41.44g,kh2po40.24g
rna染料(thermofisher):sytotmrnaselecttmgreenfluorescentcellstain
rna染料(sigma)hoechst33258
酶标仪synergyh4/elx800(biotek)
黑色平底微孔板(96孔)(corning3603)
二、标准曲线的制作
1、精确称量rna标准品,超纯水稀释至合适的浓度,制备成特定浓度的rna标准溶液。
2、分别吸取不同体积rna储备液加入到微孔板中,然后用去离子水补足至100ul,每个梯度2个平行。
3、sytotmrnaselecttmgreenfluorescentcellstain染料用pbs溶液稀释至浓度为合适的浓度,吸取一定体积的染液到孔板中与样品混匀。
4、将反应体系放置暗处避光静置5min。
实施例1:sytotmrnaselecttm最适浓度探究
1、用pbs缓冲液将sytotmrnaselecttm分别稀释500,1000,2000,5000倍,分别制成10μmol/l,5μmol/l,2.5μmol/l,1μmol/l储液浓度的染液,4℃放置备用。
2、精确称取rna标准品10mg,定容至100ml,得到100mg/l的rna标准溶液。
3、分别吸取2,5,10,15,20,25,30,35,40,50μlrna标准溶液至黑色96微孔板中,加入去离子水,补足至100μl,每个梯度两个平行。
4、吸取100μl第1步中制备的不同浓度的染液,分别与上述rna样品混合,避光孵育5min,置于酶标仪synergyh4/elx800(biotek)中以超纯水作为对照,测定荧光,其中激发光为490nm,发射光为530nm。
5、测得的荧光强度减去空白,使用矫正的数据对rna浓度与荧光强度进行线性拟合(图2)。
如图,随着sytotmrnaselecttm浓度的上升,rna浓度与荧光强度的线性关系逐渐上升,当sytotmrnaselecttm浓度在10μmol/l时,线性关系良好,r2=0.9965。结合实验成本和线性关系结果,染料的浓度最优为10μmol/l。
实施例2:rna浓度—荧光强度标准曲线
1、精确称取rna标准品10mg,定容至100ml,得到100mg/l的rna标准溶液。
2、分别吸取2,5,10,15,20,25,30,35,40,50μlrna标准溶液至黑色96微孔板中,加入去离子水,补足100μl,分别配置成2,5,10,15,20,25,30,35,40,50μg/ml的rna溶液,每个梯度两个平行。
3、用pbs缓冲液将sytotmrnaselecttmgreenfluorescentcellstain稀释至10μmol/l,每孔加入100μl稀释好的染液。
4、将96孔板避光孵育5min后,置于酶标仪synergyh4/elx800(biotek)中以超纯水作为对照,测定荧光,其中激发光为490nm,发射光为530nm。
5、测得的荧光强度减去空白,使用矫正的荧光强度与对应的rna浓度计算标准曲线(图3)。
由图可以看出,rna浓度在2~40μg/ml的范围内,rna浓度与相应的荧光强度具有良好的线性关系(r2=0.9965),这说明用sytotmrnaselecttm可以较为精确的对rna进行定量。
实施例3:测定含dna干扰的样品中rna的浓度并验证sytotmrnaselecttm的特异性
1、含有dna干扰的rna样品制备:
在rna标准品中加入相应的dna样品,分别制成含有10mg/ml,20mg/ml,30mg/ml,50mg/ml,100mg/mldna的rna样品,溶解在去离子水中,使rna样品的浓度为100mg/l。
2、dna标准溶液的制备:
精确称取10mgdna标准品,定容至100ml去离子水中,制备成100mg/ldna标准溶液。
3、将rna样品按照实施例1中的方法,将其配置成2,5,10,15,20,25,30,35,40,50μg/ml的rna溶液;
将含有dna干扰的rna样品,配置成2,5,10,15,20,25,30,35,40,50μg/ml的rna溶液,同时溶液中dna的浓度分别为:
表1不同浓度rna样品中dna的浓度
将dna样品配置成2,5,10,15,20,25,30,35,40,50μg/ml的dna溶液;
将上述样品分别与10μmol/l的sytotmrnaselecttm混合,并测定对应的荧光强度(图4a)。
如图4a所示,为了验证sytotmrnaselecttm的特异性,将其与dna样品混合,测定的最大荧光强度仅为40μg/mlrna的2.9%,并且荧光强度不会随着dna浓度的增加而增加,这说明sytotmrnaselecttm特异性高。
另外,在rna样品中混入不同浓度的dna,然后对荧光强度和rna浓度进行拟合,发现拟合的曲线相似度极高,这说明用此方法对于含有dna的rna样品定量结果影响不大。
对比例1
具体实施方式参见实施例3,区别在于,将sytotmrnaselecttm替换为hoechst33258。
将hoechst33258用pbs缓冲液稀释至15μmol/l,按照sytotmrnaselecttm相同的方式与rna样品,含有dna干扰的rna样品,dna样品混匀孵育,在350nm/461nm条件下测定荧光值。
结果如图4(b)所示,利用hoechst33258对不同rna样品进行定量时发现,当rna样品混入不同浓度的dna后,拟合曲线发生了巨大的改变,不同样品之间的曲线差异较大,说明在用hoechst33258对rna进行定量时,dna对实验结果影响较大。
经过图4a和图4b两图的比较可以发现,sytotmrnaselecttm对rna定量显现出高度的特异性和敏感性,无需用dnase或者rnase对样品进行处理即可快速检测rna,整个检测过程可以在10min内完成,并且通量高,大幅度提高了rna定量效率。
实施例4:测定含多种干扰的样品中rna的浓度并验证sytotmrnaselecttm的特异性
1、含有dna、多糖、蛋白质、醇类、酚类物质干扰的rna样品制备:
按照实施例2的方式,向rna溶液中添加核糖、蛋白质、磷酸盐,配置成2,5,10,15,20,25,30,35,40,50μg/ml的rna溶液,其中蛋白质的浓度分别为0.6,1.5,3,4.5,6,7.5,9,10.5,12,15μg/ml,核糖的浓度分别为0.6,1.5,3,4.5,6,7.5,9,10.5,12,15μg/ml,磷酸二氢钾的浓度分别为0.6,1.5,3,4.5,6,7.5,9,10.5,12,15μg/ml。
2、将上述样品与10μmol/l的sytotmrnaselecttm混合,并测定对应的荧光强度。
结果如图5所示,在样品中添加了蛋白质,核糖,磷酸盐后,测定的曲线与纯rna样品曲线高度重合,说明蛋白质,核糖,磷酸盐对sytotmrnaselecttm定量rna的结果影响不大。但是核糖对地衣酚测定rna有较大的干扰,磷酸盐对定磷法测定rna有较大的干扰。由此可以看出sytotmrnaselecttm定量rna具有较高的特异性。
对比例2
具体实施方式参见实施例4,区别在于,利用紫外分光光度计nanodrop2000,分别测定2μg/ml,20μg/ml,40μg/mlrna样品,结果如图6所示。rna浓度在2μg/ml时,紫外分光光度计测量是吸光值小于0.1,使得计算的rna浓度误差较大,但sytotmrnaselecttm测得的浓度与实际浓度相差不大。rna浓度在10μg/ml和40μg/ml时,sytotmrnaselecttm和紫外分光光度计测得的rna浓度相差不大。
对比例3
具体实施方式参见实施例4,区别在于,利用地衣酚法,结果如图6所示,分别测定2μg/ml,20μg/ml,40μg/mlrna样品,结果如图6所示。rna浓度在2μg/ml时,地衣酚测定的结果误差较大,rna浓度在20μg/ml和40μg/ml时,sytotmrnaselecttm与地衣酚测得的结果相差不大。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!