一种低硒高油脂植物硒形态测定的前处理方法与流程
1.本发明涉及一种低硒高油脂植物硒形态测定的前处理方法,属于分析测试领域。
背景技术:
2.由于植物中硒形态多样化并且各个硒形态含量较低,大部分硒代氨基酸还具有热不稳定性,因此在分析硒形态的过程中前处理方法既要考虑方法回收率,也要保证方法的重现性及稳定性。当待测目标物为硒蛋白、硒多糖等大分子含硒化合物时,通常利用液相萃取的方式将不同含硒化合物提取之后,再进行总硒检测,例如有现有技术利用适量水、70%乙醇溶液、0.1mol/l nacl溶液、0.1mol/l hcl溶液和0.1mol/l naoh溶液分别提取富硒花生中水溶蛋白、醇溶蛋白、盐溶蛋白、酸溶蛋白及碱溶蛋白,进而测得这些蛋白质结合态的硒含量。而这些现有方法的时间成本很大,可能造成样品形态不稳定,也容易受到其余离子干扰。
技术实现要素:
3.有鉴于此,本发明的主要目的在于提供一种低硒高油脂植物硒形态测定的前处理方法。
4.为了实现上述目的,本发明提供了一种低硒高油脂植物硒形态测定的前处理方法,包括以下步骤:
5.(1)样品酶解:将待测样品中依次加入蛋白酶xiv与脂肪酶,混合均匀,之后加入超纯水,水浴超声30
‑
60min,振荡5
‑
15h后静置;
6.(2)样品酶解液提取:向步骤(1)得到的产物中中加入氯仿,密封,振荡1
‑
2min后,2500
‑
3500rpm/min离心10
‑
12min,吸取20
‑
25%(v/v)的样品上清液,按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒;
7.(3)样品浓缩:吸取步骤(2)中的剩余上清液浓缩直至完全干燥,加入2
‑
3ml超纯水使样品复溶;
8.(4)样品除杂:将步骤(2)复溶后的样品取2
‑
3ml分三至四次进行洗脱,并将洗脱液混合,之后将该洗脱液浓缩至0.4
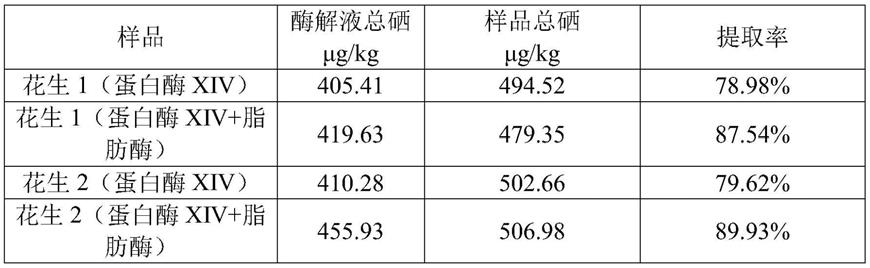
‑
0.6ml;之后将其复溶、离心,进行后续的hplc进样。
9.优选地,其中在步骤(1)的样品酶解之前还包括样品称取的步骤。
10.优选地,其中所述样品称取步骤包括:称取待测样品于40
‑
50ml玻璃瓶中,并在玻璃瓶上标注编号,在记录本上记录其编号和质量。
11.优选地,其中所述待测样品的质量偏差控制在10%以内。
12.优选地,其中步骤(1)中,所述蛋白酶xiv、脂肪酶与超纯水的质量比为(0.01
‑
0.05):(0.01
‑
0.05):10,优选为0.01:0.01:10,这样优选后可以在不影响实验结果的条件下最大程度上节省成本;所述超纯水的电导率为18.2mω
·
cm。
13.优选地,其中步骤(1)中,所述水浴的温度为35
‑
40℃,优选为37℃;所述振荡的温度为35
‑
40℃,优选为37℃,转速为250
±
20rpm/min,优选为250rpm/min,这样优选后可以免
样品形态发生改变。
14.优选地,其中步骤(1)中,所述超声时间为45
±
5min,振荡时间为5
‑
6h,这样可以在不影响实验结果的条件下最大程度地减少实验时间。
15.优选地,其中步骤(2)中,所述氯仿与步骤(1)得到的产物的体积比为1:1.2。
16.优选地,其中步骤(3)中,所述浓缩的冷阱温度为
‑
105℃(冷阱的作用是把样品冷冻升华的水和甲醇冻住,防止回流),所述浓缩温度为
‑
3℃
‑‑
4℃。
17.优选地,其中步骤(4)中,所述离心机的温度为3
‑
4℃,优选为4℃,转速为10000
‑
12000r/min,优选为10000r/min,离心时间为20
±
5min,离心时间为20min,这样优选后可以使样品完全离心。
18.优选地,其中步骤(4)中,所述洗脱是采用
‑
20℃冰冻的无水甲醇激活的sep
‑
pak c18一次性小柱进行的。
19.相比于现有技术,本发明具有以下有益效果:
20.采用本方法作硒形态测定的前处理方法,相比于现有方法操作更加简单快捷,提升高油脂样品硒形态的提取效果,降低检测方法检测限。
具体实施方式
21.下面结合具体实施例对本发明进行进一步说明。
22.以下材料或试剂,除非特别说明,均为市售。
23.本发明的实施例提供了一种低硒高油脂植物硒形态测定的前处理方法,包括以下步骤:
24.(1)样品称取:称取0.8
‑
1.2g待测干燥粉末样品于40ml玻璃瓶中,并在玻璃瓶上标注编号,在记录本上记录其编号和质量,称量样品时样品质量偏差应控制在10%以内;
25.(2)样品酶解:向玻璃瓶中依次加入0.01
‑
0.05g蛋白酶xiv与0.01
‑
0.05g脂肪酶,混合均匀,之后加入10ml18.2 mω
·
cm超纯水,水浴超声45min后置入气浴恒温振荡器中,振荡5h后静置;
26.(3)样品酶解液提取:向步骤(3)得到的产物(10ml)中加入10ml氯仿,盖紧聚四氟乙烯盖子(密封),振荡1min后将样品置入低速离心机,3000rpm/min,离心10min,吸取20%(v/v)的样品上清液,转移到另一个新的平底锥形瓶,按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017);
27.(4)样品浓缩:吸取步骤(4)中的剩余上清液转移到50ml锥形聚丙烯管中,置入真空冷冻离心浓缩机中,调节冷阱温度到
‑
105℃,浓缩机温度到
‑
4℃,浓缩直至完全干燥或呈冻状,加入2ml超纯水使样品复溶;
28.(5)样品除杂:将步骤(2)复溶后的样品经过已用甲醇激活的sep
‑
pak c18一次性小柱迁移到15ml的离心管中,再用1ml的
‑
20℃冰冻无水甲醇对sep
‑
pak c18一次性小柱进行三次洗脱,并收集到同一个离心管中,最后将该离心管置入真空冷冻离心浓缩机内浓缩至约0.5
±
0.2ml以去除溶液中的甲醇。之后用1.5ml超纯水复溶,转移到2ml的微型离心管中,4℃,10000r/min离心20min后,用移液枪转移管中的上清液至hplc专用进样瓶。
29.以下结合具体的实施例进行进一步说明。
30.实施例1花生样品不同酶解方式对比
31.取花生1,花生2两种样品(两种花生为多批次试验,无其他变量)按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017)并记录;花生1分两份分别称取0.8
‑
1.2g,记录为
①
和
②
,花生2分两份分别称取0.8
‑
1.2g,记录为
③
和
④
;向
①②③④
中分别加入0.01g蛋白酶xiv后混匀,再向
②④
中分别加入0.01g脂肪酶,混匀,之后加入10ml18.2 mω
·
cm超纯水,水浴超声45min后置入气浴恒温振荡器中,振荡5h后静置;加入10ml氯仿,盖紧聚四氟乙烯盖子(密封),振荡1min后将样品置入低速离心机,3000rpm/min,离心10min,吸取20%(v/v)的样品上清液,转移到另一个新的平底锥形瓶,按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017);计算提取率并作对比。
32.表1 样品经脂肪酶酶解与加脂肪酶酶解提取率对比
[0033][0034]
由表1结果可得,对于高油脂样品前处理时加入脂肪酶酶解后提取率相对无脂肪酶的样品总硒提取率有显著提高,这是由于而酶提法不仅可以高效地水解出绑定于蛋白质中的硒化物,而且提取条件较为温和,可以最大程度的减少形态间的转变。
[0035]
实施例2大豆样品振荡时长不同的酶解液提取率对比
[0036]
取大豆1,大豆2两种样品(两种大豆为多批次试验,无其他变量)按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017)并记录;大豆1分四份分别称取0.8
‑
1.2g,记录为
①②③④
,大豆2分四份分别称取0.8
‑
1.2g,记录为
⑤⑥⑦⑧
;向
①‑⑧
中分别加入0.01g蛋白酶xiv和0.01g脂肪酶后混匀,之后加入10ml18.2 mω
·
cm超纯水,水浴超声45min后置入气浴恒温振荡器中,
①⑤
振荡3h后静置,
②⑥
振荡5h后静置,
③⑦
振荡10h后静置,
④⑧
振荡15h后静置;向
①‑⑧
中分别加入10ml氯仿,盖紧聚四氟乙烯盖子(密封),振荡1min后将样品置入低速离心机,3000rpm/min,离心10min,吸取20%(v/v)的样品上清液,转移到另一个新的平底锥形瓶,按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017);计算提取率并作对比。
[0037]
表2样品不同振荡时间的酶解液提取率对比
[0038]
[0039][0040]
由表2结果可得,振荡10h和15h的提取率与振荡5h相比差别不大,而振荡不足5h的提取率明显下降,因此初步判断振荡5h为最佳时长,相对于现有振荡15h的方法极大地节约了时间成本。
[0041]
实施例3核桃样品浓缩与否酶解液提取率对比
[0042]
表3样品加入氯仿与未加入氯仿提取率对比
[0043]
取核桃1,核桃2两种样品(两种核桃为多批次试验,无其他变量)按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017)并记录;核桃1分两份分别称取0.8
‑
1.2g,记录为
①
和
②
,核桃2分两份分别称取0.8
‑
1.2g,记录为
③
和
④
;向
①②③④
中分别加入0.01g蛋白酶xiv和0.01g脂肪酶,混匀,之后加入10ml18.2 mω
·
cm超纯水,水浴超声45min后置入气浴恒温振荡器中,振荡5h后静置;向
②④
中分别加入10ml氯仿,
①③
中不加,盖紧聚四氟乙烯盖子(密封),振荡1min后将样品置入低速离心机,3000rpm/min,离心10min,吸取20%(v/v)的样品上清液,转移到另一个新的平底锥形瓶,按照湿法消解
‑
氢化物发生
‑
原子荧光光谱法流程检测总硒(gb 5009.93
‑
2017);计算提取率并作对比。
[0044][0045]
由表3结果可得,未加入氯仿的酶解液提取率明显低于加氯仿后提取酶解液的提取率,因此在对低硒高油脂样品进行前处理时需要加入氯仿或其他非极性有机溶剂步骤。
[0046]
以上所述实施例仅是为充分说明本发明而所举的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1