一种提高拟南芥茎尖超低温保存后再生率的方法与流程
本发明属于冷冻再生技术领域,尤其涉及一种提高拟南芥茎尖超低温保存后再生率的方法。
背景技术:
植物超低温保存(cryopreservation)是在液氮温度下(-196℃)保存植物材料的方法。由于在液氮温度下所有的细胞活动都暂时停止,所以理论上植物材料可以在不发生变化的情况下无限期保存。植物茎尖分生组织具有再生完整植株的能力,是植物超低温保存的主要对象。植物超低温技术发展的一个重要瓶颈是对超低温处理过程细胞水平的研究非常有限。超低温处理的主要对象是离体茎尖(分生组织)等具有再生能力的植物组织。在处理过程中,离体茎尖将经受预培养,渗透保护,脱水,液氮处理,解冻,复水和恢复培养等剧烈的人工处理。上述过程中,植物细胞膜系统和细胞骨架等将发生剧烈的变化和响应,这些变化及其恢复是超低温处理方案成败的关键。但是,植物茎尖超低温保存过程中细胞骨架的变化模式是怎样的,微管结构状态与植物茎尖超低温保存后的再生率的关系等问题尚不清楚。
技术实现要素:
针对现有技术中存在的问题,本发明的目的是在于提供一种提高拟南芥茎尖超低温保存后再生率的方法,旨在解决超低温保存植物材料的问题。本发明以拟南芥茎尖为研究对象,解析了超低温保存过程中细胞的微管变化模式,并通过加入微管稳定剂紫杉醇和促进微管解聚的药物oryzalin来改变微管状态,进而验证微管结构对超低温保存后植株再生率的影响。本发明方法弥补了超低温保存技术中有关细胞学变化方面的研究空白,同时为提高植物茎尖超低温保存再生率提供了方法支持,对研究超低温保存技术有重要意义。
为了达到上述目的,本发明采用以下技术方案予以实现。
一种提高拟南芥茎尖超低温保存后再生率的方法,该方法包括以下步骤:
(1)将消毒处理过的拟南芥种子播种在MS培养基上,经4-6℃低温处理之后在22-25℃12h/12h昼夜周期的培养条件下培养一周获得拟南芥幼苗,随后在解剖镜下切割茎尖;
(2)选取90个茎尖,平均分成三组,每组30个茎尖,第一组加入20μmol/L的紫杉醇并处理20分钟,标记为T组;第二组加入20μmol/L的黄草消oryzalin处理20分钟,标记为O组;第三组的茎尖直接标记为C组。
(3)加载处理,将T组、O组和C组茎尖同时放在加载溶液中,25℃下处理18-25分钟;
(4)植物微滴玻璃化处理,在加载溶液处理结束以后,将三组茎尖同时转入预冷的PVS2溶液,在冰上处理25-30分钟;
(5)超低温保存,将经过PVS2处理的茎尖转移到无菌铝箔条上并插入液氮中,待不再有气泡产生时将铝箔条转入冻存管,并放置在液氮中保持30分钟;
(6)解冻和卸载处理,将铝箔条从液氮中移出并直接转入卸载溶液中,并在25℃下处理20-30分钟;
(7)恢复培养,将解冻后的茎尖转移到恢复培养基上进行恢复培养,恢复培养的前7天为暗培养;暗培养之后,继续在光照下培养,并定期统计南芥茎尖成活率。
进一步地,所述步骤(3)中加载溶液是含有2M甘油和0.4M蔗糖的MS培养液。
进一步地,所述步骤(4)中PVS2溶液是含有30%(w/v)甘油、15%(w/v)乙二醇、15%(w/v)DMSO和0.4M蔗糖的MS培养液。
进一步地,所述步骤(6)中卸载溶液是含有1.2M蔗糖的MS培养液。
进一步地,所述步骤(7)中恢复培养基是含有30g/L蔗糖、1.0mg/L BA和3g/L植物凝胶的MS固体培养基。
相比于现有技术的缺点和不足,本发明具有以下有益效果:
(1)解析了超低温保存过程中细胞微管结构的变化,填补了超低温保存过程中细胞学方面的研究空白;
(2)在装载处理前加入微管稳定剂有利于提高植株的再生率,改进了现有的植物茎尖超低温保存技术;
(3)在装载处理前加入微管解聚试剂降低了植物茎尖超低温保存的再生率。
附图说明
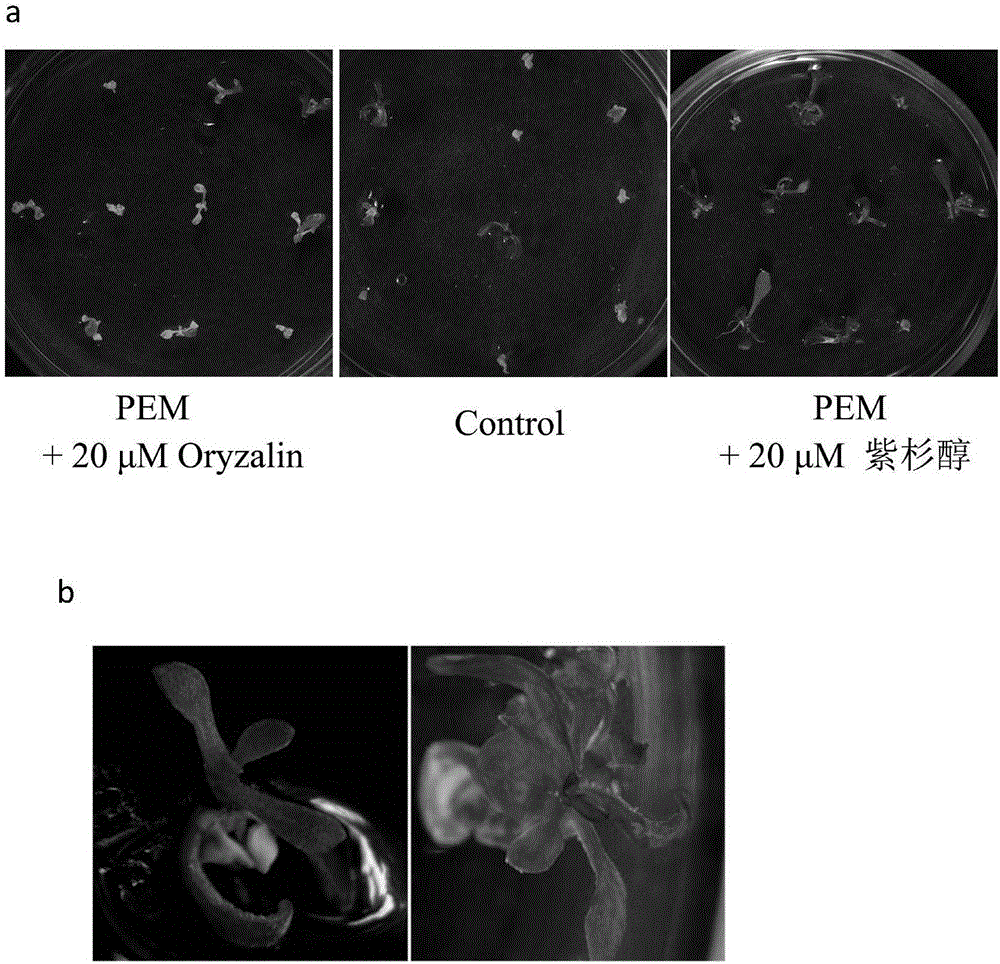
图1为微管试剂对拟南芥茎尖超低温保存后再生率的影响,其中:a、超低温保存后拟南芥茎尖再生情况;b、再生后植株;
图2为拟南芥茎尖超低温保存后再生率统计情况;
图3为超低温保保存过程中微管结构变化情况;
图4为微管试剂对超低温保存过程中微管结构的影响;
具体实施例
下面结合具体实施例对本发明做进一步详细说明,但本发明不限于这些实施例。
实施例1
(1)拟南芥茎尖的获取
将表达α-tublin-GFP融合蛋白的拟南芥种子经消毒处理之后播种在MS培养基上,经4-6℃低温处理,在22-25℃12h/12h昼夜周期的培养条件下培养一周获得拟南芥幼苗,并在解剖镜下切割茎尖;
(2)微滴玻璃化超低温保存
取90个茎尖,平均分成三组,每组30个茎尖,第一组加入含有20μmol/L的紫杉醇的微管固定剂(微管固定剂含有50mmol/L Pipes、2mmol/L EGTA、2mmol/L 0.05%MgSO4)处理20分钟,标记为T组;第二组加入含有20μmol/L的黄草消oryzalin的微管固定剂(微管固定剂含有50mmol/L Pipes、2mmol/L EGTA、2mmol/L 0.05%MgSO4)处理20分钟,标记为O组;第三组的茎尖直接标记为C组,等T组和O组处理完之后,三组茎尖同时做后续处理。
将三组茎尖转入冻存管中加入1mL加载溶液,在25℃下处理20分钟。加载溶液为含有2M甘油和0.4M蔗糖的MS培养液。在加载溶液处理结束以后,用1mL冰上预冷的PVS2溶液替换加载溶液,并在冰上处理25-30分钟。PVS2溶液是含有30%(w/v)甘油、15%(w/v)乙二醇、15%(w/v)DMSO和0.4M蔗糖的MS培养液。在PVS2处理结束前1分钟,将茎尖和一滴PVS2溶液(15μL)转到一个8×25mm的无菌铝箔条上。在PVS2处理结束后,用一把细镊子将铝箔条直接插入液氮中,待不再有气泡产生时(约5-20秒钟),将铝箔条转入放置在液氮中的冻存管,并保持在液氮中30分钟。解冻时,将铝箔条从液氮中取出,并快速插入6厘米直径培养皿中的10mL卸载溶液里,并在25℃下处理20分钟。卸载溶液是含有1.2M蔗糖的MS培养液。在卸载溶液处理结束后,将茎尖转入恢复培养基。恢复培养基为含有30g/L蔗糖、1.0mg/L BA和3g/L植物凝胶的MS培养基。恢复培养的前7天为暗培养。暗培养之后,继续在光照下培养,并定期统计成活率。
(3)微滴玻璃化超低温保存过程中微管结构变化及微管试剂对超低温保存过程中微管结构的影响
通过激光扫描共聚焦显微镜来检测拟南芥茎尖的GFP(绿色荧光蛋白)信号,进而观测不同处理条件下的拟南芥茎尖的微管结构(488nm激发光和520nm发射光)。
镜检取样点安排如下:
C组:装载处理之前,装载处理之后,PVS2处理之后,卸载处理之后,共计四个检测点;
T组:装载处理之后,PVS2处理之后,卸载处理之后,共计三个取样点;
O组:装载处理之后,PVS2处理之后,卸载处理之后,共计三个取样点;
每个取样点10个茎尖,放在载玻片上,镜检。
本发明中,测试了微滴玻璃化途径中在装载处理之前用微管稳定剂紫杉醇和促进微管解聚的药物Oryzalin预处理茎尖20分钟对超低温保存茎尖的存活率和再生率的影响。结果表明:T组、O组和C组对应的再生率为分别为77.2%、32.3%和39.5%(参照图1、图2)。可见,相对于C组来说,T组的微管稳定剂紫杉醇的加入有利于提高超低温保存茎尖的存活率和再生率,而O组促进微管解聚的药物oryzalin的加入降低了超低温保存茎尖的存活率和再生率。在超低温保存过程中,在装载处理和PVS2溶液处理之后,微管完全解聚,恢复培养之后微管又开始聚合(参照图3);在超低温保存过程中,在装载处理之前加入微管稳定剂紫杉醇之后微管解聚状况较未加紫杉醇的处理明显缓解;在超低温保存过程中,在装载处理之前加入促进微管解聚试剂黄草消oryzalin之后微管解聚状况较未加黄草消的处理明更为剧烈(参照图4)。
以上所述,仅是本发明的较佳案例,并不对本发明做出任何限制,凡是针对本发明技术内容对以上实施案例所做的任何简单修改、变更、模仿均属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!