用于非酒精性脂肪肝疾病的动物模型的制作方法
本申请要求于2017年6月22日提交的第62/523,755号的美国临时专利申请的优先权,其公开内容通过引用并入本申请。
资助信息
本发明是在美国国立卫生研究院授予的sbir基金号2r44dk082065的政府支持下完成的。政府对本发明享有一定的权利。
发明领域
本发明大体涉及动物模型、制造动物模型的方法及其用途。具体来讲,本发明涉及用于非酒精性脂肪肝疾病和用于代谢综合征的动物模型。
背景技术:
非酒精性脂肪肝疾病(nafld)是一种在没有过度饮酒的情况下多余脂肪在人体肝脏中储存的病症。据估计,全世界25%的普通人群符合nafld的诊断标准;nafld在男性中更常见,并且随着年龄的增长而增加。nafld的发病率在各人种之间似乎也是分层的:拉美裔(45%)>高加索人(33%)>非洲裔美国人(24%)。
nafld的初始阶段以异位脂肪在肝细胞中的积聚(脂肪变性)为特征。脂肪变性通常是良性的、无症状的病症;然而,伴随同时发生的肥胖/代谢紊乱,脂肪变性可发展为非酒精性脂肪性肝炎(nash),并且在严重的情况下,发展为肝细胞癌(hcc)和肝功能衰竭。在组织学上,nash以肝细胞气球样变性、炎症和肝纤维化风险增加为特征。与良性脂肪变性不同,nash表现出显著的健康威胁,在10-28%的患者中发展为纤维化/肝硬化。从nash到纤维化/肝硬化的进一步发展对这些患者的死亡率具有高度预测性。
对人类nafld及其进展的研究受阻于疾病缓慢(长达几十年)的发展以及可用于对疾病分期的工具。与通常是良性的脂肪变性相对,归因于nash的显著健康威胁使得早期的区分在预测哪些患者将发展为纤维化并最终发展为肝衰竭方面,成为了必要步骤。目前,对脂肪肝环境的分期依赖于来自肝活检的组织学评估,肝活检具有侵入性、价格昂贵,并且不适用于筛查所有的nafld患者。虽然正在进行大量研究以确定用于分期的非侵入性工具,但活检仍然是黄金标准,尚不可获得可靠的临床生物标志物。因此,已尝试开发脂肪肝疾病的啮齿动物模型以帮助研究对nafld病理生理学和形态学上的特征的发现以及容易受到人类肝脏肿瘤的影响的组织学特征,如脂肪变性、小叶间炎症、肝细胞气球样变性、纤维变性。
在过去的几年中,研究人员采取了不同的方法来开发nafld和nash小鼠模型,包括甲硫氨酸-胆碱缺乏饮食(machadomv等,plosone.10(5):e0127991)、c57bl/6j和ob/ob小鼠中含果糖和不含果糖的高脂饮食(charltonm等,amjphysiolgastrointestliverphysiol.301(5):g825-34;itagakih等,intjclinexppathol.6(12):2683-96;kristiansenmn等,worldjhepatol.8(16):673-84;tetrilh等,amjphysiolgastrointestliverphysiol.295(5):g987-95)和stam模型,其中将链脲佐菌素加上高脂饮食给予4天大的小鼠(jojimat等,diabetolmetabsyndr.8:45;saitok等,scirep.5:12466)。
但是,这些动物模型未能准确显示nafld的特征。例如,最初的关注点是用蛋氨酸-胆碱缺乏(mcd)饮食尽可能快地产生纤维化。用mcd饮食饲喂的小鼠并不肥胖,实际上体重显著减轻(30%),且在疾病进展过程中不是胰岛素抵抗或高脂血症的。stam模型的特点是用高脂肪饮食饲喂用诱导链脲佐菌素的1型糖尿病,而非2型糖尿病小鼠,并在饲喂12周后产生纤维化,并最终产生hcc。因此,需要不断开发新的用于nafld的动物模型。
技术实现要素:
在一个方面,本发明公开提供一种产生非酒精性脂肪肝疾病(nafld)的非人类动物模型的方法。在一个实施方式中,所述方法包括获取幼年的fatzo小鼠以及给所述fatzo小鼠饲喂高脂肪、高胆固醇和高果糖的饮食一段时间。
在某些实施方式中,所述饮食包括40%kcal的脂肪和含有5%果糖的饮用水。
在某些实施方式中,所述nafld是脂肪变性、非酒精性脂肪性肝炎(nash)、肝硬化或肝癌。
在某些实施方式中,所述幼年为6-12周龄(例如,约6周龄,7周龄,8周龄,9周龄,10周龄,11周龄,12周龄)。
在某些实施方式中,所述一段时间约为4周、16周或20周。
在第二个方面,本发明公开提供一种nafld的非人类动物模型。在某些实施方式中,所述nafld的非人类动物模型通过给幼年的fatzo小鼠饲喂高脂肪、高胆固醇和高果糖的饮食一段时间来产生。
在第三个方面,本发明公开提供一种筛选用于治疗或预防nafld的药剂的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用候选药剂;以及(b)评估对nafld的改善效果。
在第四个方面中,本发明公开提供一种评估用于治疗nafld的药物的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用所述药物;以及(b)评估对nafld的改善效果。
在第五个方面中,本发明公开提供一种用于产生糖尿病并发症的非人类动物模型的方法。在一个实施方式中,所述方法包括:(a)获取幼年的fatzo小鼠;(b)确定所述fatzo小鼠的体重在体重范围内;以及(c)选择所述fatzo小鼠用于研究所述糖尿病并发症。
在某些实施方式中,所述幼年为约6周龄。
在某些实施方式中,所述糖尿病并发症为肾病、心肌病、血管疾病、视网膜病或神经病。
在某些实施方式中,所述体重范围为23-26.9g。在某些实施方式中,所述体重范围为27-29.9g。在某些实施方式中,其中所述体重范围为至少30g。
在第六个方面中,本发明公开提供一种筛选用于治疗或预防糖尿病或糖尿病并发症的药剂的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用候选药剂;以及(b)评估对糖尿病或糖尿病并发症的改善效果。
在第七个方面中,本发明公开提供一种评估用于治疗糖尿病或糖尿病并发症的药物的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用所述药物;以及(b)评估对糖尿病或糖尿病并发症的改善效果。
附图说明
并入本申请的附图构成说明书的一部分。附图进一步用于连同以下书面描述一起解释制造和使用本发明的原理,并且使相关领域的技术人员能够制造和使用本发明。
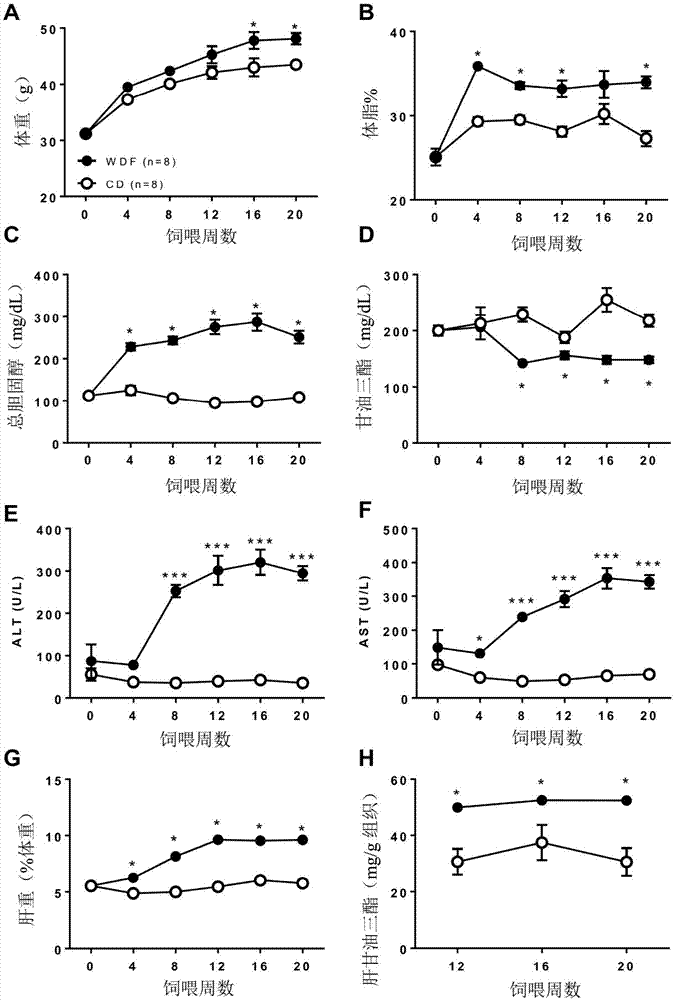
图1a-1h示出了用cd或wdf饮食饲喂的fatzo小鼠中nafld/nash的发展。图1a示出了用cd或wdf饲喂20周的fatzo小鼠的体重。图1b示出了用cd或wdf饲喂20周的fatzo小鼠中的体脂。图1c示出了用cd或wdf饲喂20周的fatzo小鼠中的总胆固醇。图1d示出了用cd或wdf饲喂20周的fatzo小鼠中的甘油三酯。图1e示出了用cd或wdf饲喂20周的fatzo小鼠中的alt。图1f示出了用cd或wdf饲喂20周的fatzo小鼠中的ast。图1g示出了用cd或wdf饲喂20周的fatzo小鼠的肝重。图1h示出了使用cd或wdf饲喂20周的fatzo小鼠中的肝甘油三酯含量。数据呈现为平均值±sem。相对于载体对照*p<0.05,***p<0.005。
图2示出了wdf饲喂的fatzo小鼠中的nafld/nash的组织学特征。从饲喂wdf或cd4、16和20周的fatzo小鼠中取出的肝脏的h&e和天狼星红苦味酸(psr)染色的代表性图像。★表示脂肪变性,*表示气球样变性,
图3a-3e示出了来自wdf或cd饲喂16和20周的小鼠的肝脏的nash评分。图3a示出了脂肪变性评分。图3b示出了肝气球样变性评分。图3c示出了小叶炎症评分。图3d示出了纤维化评分。图3e示出了nas评分。数据呈现为平均值±sem。相对于载体对照*p<0.05,***p<0.005。
图4a-4h示出了oca治疗改善了wdf饲喂的fatzo小鼠中的肝功能和脂质代谢。图4a示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠的体重。图4b示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的血液甘油三酯。图4c示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的总胆固醇。图4d示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的ldl。图4e示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的alt。图4f示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的ast。图4g示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠的肝重。图4h示出了用载体或oca(30mg/kg,皮下注射)处理的wdf饲喂的fatzo小鼠中的肝甘油三酯含量。数据呈现为平均值±sem。相对于载体对照*p<0.05。
图5示出了oca治疗改善了nashfatzo小鼠的肝气球样变性。从用oca或载体处理15周的nafld/nashfatzo小鼠中取出的肝脏的h&e和天狼星红苦味酸(psr)染色的代表性图像。
图6a-6e示出了用oca处理的wdf饲喂的fatzo小鼠的组织学改善。图6a示出了肝气球样变性评分。图6b示出了脂肪变性评分。图6c示出了小叶炎症评分。图6d示出了纤维化评分。图6e示出了nas评分。数据呈现为平均值±sem呈现。相对于载体对照*p<0.05。
图7a-7f示出了初始体重和饮食对体重、葡萄糖和胰岛素水平的影响。最高的数字显示了chow(图7a)和hfd(图7b)饲喂的动物的体重增加。中间的板块(图7c、7d)显示了两种饮食对葡萄糖水平的影响。chow组(图7e)和hfd组(图7f)中的胰岛素水平在底部板块中示出。图1a和图1b中的*表示在所有时间点,对于每种饮食,所有体重组彼此都在统计学上不同。来自其他组(图1c-1f)的统计学上的差异用*表示,而+号表示最高值和最低值之间的差异(双向方差分析,随后进行sidak氏多重比较检验,*或+p<.05)。正文中总结了各体重类别中饮食之间的其他差异。
图8a-8f示出了ogtt中初始体重和饮食对空腹葡萄糖和葡萄糖处置的影响。顶部的图中示出了饲喂chow饮食(图8a)和hfd的小鼠在ogtt中的葡萄糖响应。在饲喂chow饮食的小鼠的低、中、高体重组中,禁食17小时后的基线葡萄糖水平(图8c),而在饲喂hfd的动物中,中体重组和高体重组中的葡萄糖水平显著更高(图8d)。下面两个板块中的图中显示了饲喂chow饮食(图8e)和hfd(图8f)时各体重组中动物的ogtt的葡萄糖auc。(单向方差分析,随后进行sidak氏多重比较检验。+表示与低体重组相比的统计学差异,并且*表示与所有其他组的统计学差异,p<.05)。
图9a-9e示出了ogtt期间初始体重和饮食对胰岛素水平的影响。该图示出了饲喂chow饮食(图9a)或hfd(图9b)时,在低体重、中体重和高体重组中18周龄时胰岛素对葡萄糖负荷的响应。图9a和图9b中的*表示该组中与基线相比的显著增加(双向方差分析,随后进行sidak氏多重比较检验)。还示出了上述ogtt(图9a、图9b)的胰岛素auc(图9c、图9d);**表示低体重组与其他两组之间的显著差异(单向方差分析,随后进行sidak氏多重比较检验)。最下面的板块(图9e)示出了在21周龄时来自用两种饮食饲喂的不同体重组的胰腺胰岛素含量。在各自的体重配对(高体重、中等体重和高体重)中测试了饮食的效果;
图10a和10b示出了体重与葡萄糖和胰岛素的相关性,绘制14周龄时的葡萄糖(图10a)和胰岛素(图10b)水平并根据动物在6周龄时的体重进行分析(体重vs葡萄糖,r=0.7033,p<.0001;体重vs胰岛素,r=0.5317,p<.0001)。
图11a和图11b示出了瘦素水平和瘦素对食物摄入的影响,本附图示出了在两个周龄的瘦素水平(图11a)和瘦素对食物摄取的影响(图11b)(单因素方差分析,随后进行sidak氏多重比较检验)。以p<.001(**)和p<.0001(***)来表示与其他组的统计学差异。
图12a和12b示出了未治疗的雄性fatzo小鼠(6-22周龄)中的膳食后葡萄糖(图12a)和胰岛素(图12b)浓度。高血糖自发形成,并且在年幼至6周龄的动物中明显可见(图12a)。胰岛素对发生高血糖的响应在明显的胰岛素抵抗期期间产生高胰岛素血症(图12b)。每个值均表示平均值±sem,n=72。分析表明血液葡萄糖浓度在12-22周龄相对于基线增加,且胰岛素浓度在8-22周龄相对于基线增加(单向重复测量方差分析,与基线相比*p<.05)。
图13a-13c示出了与对照小鼠相比,未处理的雄性fatzo小鼠中的体重、体脂和血清甘油三酯。与年龄匹配的c57bl/6j对照小鼠(●)相比,fatzo小鼠(▲)在每个年龄显著较重(图13a)(平均值±sd)。fatzo小鼠中体脂水平的增加有助于增加体重(图13b)。与6-18周龄的对照小鼠(●)相比,fatzo小鼠(▲)中的体脂显著更高。在未治疗的雄性fatzo小鼠(▲)中,膳食后血清甘油三酯随着年龄的增长而增加,并且与10周龄和14周龄的对照小鼠(●)相比显著升高(n=6,双向重复测量(图13a、13b)或双向普通方差分析(图13c),与对照组相比*p<.05)。
图14a-14c示出了在进行口服葡萄糖耐受试验(ogtt)期间,对照组(图14a)、fatzo小鼠(图14b)中葡萄糖对葡萄糖负荷的响应,以及两组(c)的曲线下区域。与年幼至6周龄的对照小鼠相比,在fatzo小鼠中明显可见年龄依赖性的葡萄糖处置受损。与对照小鼠(●)相比,在fatzo小鼠(▲)中葡萄糖auc(图14c)随着年龄的增长而增大(双向重复测量,方差分析,与对照相比*p<.05)。
图15a-15c示出了罗格列酮或二甲双胍施用8周后,fatzo小鼠中ogtt期间葡萄糖(图15a)和胰岛素(图15b)响应的曲线下区域分析(auc)和计算出的胰岛素敏感性指数(图15c)(isi)。两种胰岛素敏化剂均引起fatzo小鼠中葡萄糖的auc显著减小(图15a)。罗格列酮组的胰岛素auc虽然减小,但未达到显著性,但二甲双胍组的胰岛素auc显著减小(图15b)。二甲双胍治疗还显示isi的显著改善,而罗格列酮治疗尽管改善了isi,得与载体处理相比未达到统计学显著性(单向方差分析,与载体相比*p<.05)。
图16a-16d示出了雄性fatzo小鼠在施用索马鲁肽期间的体重食物摄取(1-10nmol/kg,皮下注射,每三天一次,16天)。在治疗开始的2天内,与载体处理相比,索马鲁肽引起剂量依赖性的体重减轻(图16a)。在研究结束时,与基线值相比,施用索马鲁肽的动物比载体处理的动物减轻显著更多的体重(图16b)。所有组中食物日摄取量的变化都很明显(图16c)。在每次索马鲁肽施用之后的24小时中观察到,与给药前的数值相比,食物摄取量短暂的剂量依赖性降低(图16d)。值得注意的是,锅炉故障导致一天的湿度降低约25%,这与第2天和第3天之间的食物摄取量短暂增加相关[载体●,1nmol/kg■,3nmol/kg和10nmol/kg
图17a-17d示出了施用索马鲁肽后,雄性fatzo小鼠中进行口服葡萄糖耐受试验期间血糖和葡萄糖对葡萄糖负荷的响应的变化。在研究过程中,与载体处理相比,在施用索马鲁肽后24小时测量的膳食后葡萄糖剂量依赖性地降低(图17a)(双向方差分析,与基线相比*p<.05)。还以与基线相比葡萄糖浓度的%降低绘制终端葡萄糖数据。所有索马鲁肽组的响应均显著高于载体处理的动物(图17b)。以10nmol/kg施用时,与载体处理相比,葡萄糖处置的改善是剂量依赖性的且显著的(图17c、17d)[载体●,1nmol/kg■,3nmol/kg和10nmol/kg
具体实施方式
在更详细地描述本发明公开之前,应该理解,本发明公开不限于所描述的特定实施方式,并且因此当然可变化。还应理解的是,这里使用的术语仅用于描述特定实施方式的目的,并不旨在限制,因为本发明公开的范围将仅由所附权利要求限制。
除非另外定义,本文使用的所有技术术语和科学术语具有与本发明公开所属领域的普通技术人员通常所理解的相同的含义。尽管在实践或测试本发明公开时也可以使用与本申请中描述的方法和材料类似或等效的任何方法和材料,但在此描述了优选的方法和材料。
本说明书中引用的所有出版物和专利均通过引用并入本申请,如同每个单独的出版物或专利被具体和单独地指示为通过引用并入,并且通过引用并入本申请以公开和描述引用了这些出版物的与其相关的方法和/或材料。对任何出版物的引用是为了在提交日期之前对其进行公开,并且不应该被解释为承认本发明公开由于先前的公开而无权先于该出版物。此外,提供的公开日期可能与需要独立确认的实际公开日期不同。
本领域技术人员在阅读本发明公开后将显而易见的是,本发明描述和示出的每个单独的实施方式具有分离的组分和特征,其可以容易地与任何其他几个实施方式中的特征分离或组合,而不偏离本发明公开的范围或精神。任何所记载的方法都可按所记载事件的顺序或以逻辑上可能的任何其他顺序执行。
定义
提供以下定义以协助读者。除非另外定义,否则本申请中使用的所有技术术语、符号和其他科学或医学用语或术语旨在具有本领域技术人员通常理解的含义。在一些情况下,为了清楚和/或为了便于指代而在本申请中定义了具有通常理解的含义的术语,而且在本申请中包括这样的定义不应当必然地被解释为表示与该术语在本领域中一般理解的定义相比具有实质性差异。
本申请中使用的单数形式“一种”、“一个”和“所述”包括对复数的指代,除非上下文另外明确指出。
本申请中使用的“动物模型”是指具有遗传的、天然获得的或经诱导的病理过程的活生物体,所述病理过程在一个或多个方面类似于人体中的相同现象。
应注意的是,在本公开中,诸如“包含(comprises)”、“包含(comprised)”、“包含(comprising)”、“含有(contains)”、“含有(containing)”等的术语具有美国专利法中所赋予的含义;它们是包含性的或者是开放性的,并且不排除另外的、未记载的要素或方法步骤。诸如“基本上由……组成(consistingessentiallyof)”和“基本上由……组成(consistsessentiallyof)”的术语具有美国专利法中所赋予的含义;它们允许包含不实质影响要求保护的发明的基本和新颖特征的附加成分或步骤。术语“由……组成(consistsof)”和“由……组成(consistingof)”具有美国专利法中赋予它们的含义;即这些术语是封闭式的。
本申请中使用的fatzo小鼠是指通过将c57bl/6j小鼠与akr/j小鼠杂交,然后选择性地针对肥胖、高血糖和胰岛素抵抗同系繁殖,从而开发出的多基因模型。与肥胖和2型糖尿病的ob/ob或db/db小鼠单基因模型不同,该模型的独特之处在于它具有完整的瘦素途径,从而使其更易于转化成人类疾病。
本申请中使用的奥贝胆酸(obeticholicacid)(oca)是指一种半合成胆汁酸,其作用于主要在肝、肾和肠中表达的核法尼酯x受体(fxr),以调节胆汁酸稳态、肝脏脂质代谢以及免疫功能。它最初是为治疗原发性胆汁性胆管炎而开发的,目前正在几项临床试验中进行针对nash的检测。oca在人类和临床前nash模型中显示出改善肝功能和病理学的效果。
nafld的动物模型
非酒精性脂肪肝疾病(nafld)是一个涵盖面广泛的术语,用于描述不存在过量饮酒时的脂肪肝环境。据估计,全世界25%的普通人群符合nafld的诊断标准;nafld在男性中更常见,并且随着年龄的增长而增加。nafld的发病率在各人种之间似乎也是分层的:拉美裔(45%)>高加索人(33%)>非洲裔美国人(24%)。
nafld的初始阶段以异位脂肪在肝细胞中的积聚(脂肪变性)为特征。脂肪变性通常是良性的、无症状的病症;然而,伴随同时发生的肥胖/代谢紊乱,脂肪变性可发展为非酒精性脂肪性肝炎(nash),并且在严重的情况下,发展为肝细胞癌(hcc)和肝功能衰竭。在组织学上,nash以肝细胞气球样变性、炎症和肝纤维化风险增加为特征。与良性脂肪变性不同,nash表现出显著的健康威胁,在10-28%的患者中发展为纤维化/肝硬化。从nash到纤维化/肝硬化的进一步发展对这些患者的死亡率具有高度预测性。
对人类nafld及其进展的研究受阻于疾病缓慢(长达几十年)的发展以及可用于对疾病分期的工具。因此,需要准确显示nafld的特征的动物模型。
因此,本发明公开在一个方面中提供一种产生非酒精性脂肪肝疾病(nafld)的非人类动物模型的方法。在一个实施方式中,所述方法包括获取幼年的fatzo小鼠以及给所述fatzo小鼠饲喂高脂肪、高胆固醇和高果糖的饮食一段时间。
如在本申请中使用的,认为约3周龄至约8周龄的小鼠是幼年的。在一些实施方式中,本申请所述的幼年为约3周龄、4周龄、5周龄、6周龄、7周龄或8周龄。
本申请所述的小鼠饮食是指小鼠,特别是在实验室或设施中饲养的小鼠消耗的食物的总和。小鼠食物的成分和组成在本领域中是公知的。例如,配制的实验室小鼠饮食的成分可包括但不限于磨碎的玉米,大豆粕,全麦,鱼粉,小麦中浆,用bha和柠檬酸保存的猪动物脂肪,甘蔗糖蜜,猪肉和骨粉,地面燕麦,小麦胚芽,啤酒酵母,脱水苜蓿粉,干甜菜浆,乳清,碳酸钙,盐,甲萘醌二甲基嘧啶亚硫酸氢盐(维生素k的来源),氯化胆碱,胆钙化醇,dl-甲硫氨酸,维生素a乙酸盐,吡哆醇盐酸盐,dl-α-生育酚乙酸酯(维生素e的形式),叶酸,硫胺素单硝酸盐,烟酸,泛酸钙,核黄素补充剂,维生素b12补充剂,氧化亚锰,氧化锌,碳酸亚铁,硫酸铜,硫酸锌,钙碘酸盐,碳酸钴。
本申请中使用的高脂肪小鼠饮食意指其中至少约20-40%kcals(例如,约20%、25%、30%、35%或40%)来自脂肪的饮食。
在一个实例中,高脂小鼠膳食具有表1中所列的制剂。
表1:高脂小鼠饮食的配方
如本文所用的高果糖的小鼠饮食意指饮食中包含(例如在饮用水中包含)约5%-20%(例如,约5%、10%、15%或20%)的果糖。
在某些实施方式中,所述饮食包括40%kcal的脂肪和含有5%果糖的饮用水。
如在本申请中使用的,用饮食来饲喂小鼠意指主要用所述饮食来饲喂小鼠,即喂给小鼠的食物的至少80%、85%、90%基于所述饮食。
在某些实施方式中,所述一段时间约为2周、3周、4周、5周、6周、7周、8周、9周、10周、12周、14周、16周、18周、20周或更长。
在一个实例中,与饲喂正常cd的fatzo小鼠相比,饲喂wdf饮食的fatzo小鼠在20周后发展出具有进行性脂肪变性和纤维化的nafld和nash,其同时具有相应的气球样变性和炎症。在肉眼尸检时,与饲喂cd的小鼠相比,来自饲喂wdf饮食的小鼠的肝脏明显更大且颜色苍白。在wdf饮食饲喂的动物中,早在饲喂4周时观察到了血浆中肝酶、alt和ast以及胆固醇的增加,并且在20周的观察期间,与获取自用cd饲喂的动物的数值相比保持显著更高。与饲喂cd的动物相比,wdf饮食饲喂的动物中的血浆甘油三酯没有升高;正如在ob/obnash模型中所观察到的那样。然而,与cd饲喂的小鼠相比,在12、16和20周时,wdf饮食饲喂的小鼠中的肝甘油三酯升高(高1.4-2.9倍)。与饲喂cd的小鼠相比,饲喂wdf的小鼠具有升高的葡萄糖水平,但不会患上糖尿病(>250mg/dl);这在高脂肪/果糖饲喂的c57bl/6和ob/ob模型中是常见的发现。在wdf和cd饲喂组中,fatzo小鼠同样具有高胰岛素血症和胰岛素抵抗。
在肉眼尸检时,来自wdf饮食饲喂的fatzo小鼠的肝脏颜色苍白,并且与cd饲喂组相比具有显著更高的肝/%体重比。在组织学上,来自wdf饮食饲喂的fatzo小鼠的肝脏在饲喂4周时表现出脂肪变性,其发展为以气球样变性、小叶炎症和纤维化为特征的脂肪性肝炎。wdf饲喂的fatzo小鼠中的综合nas评分在饲喂16周和20周时相当于“5”;表示“确定”的nash。分别早在饲喂16周时在50%wdf饲喂的动物中观察到轻微的纤维化,并且在20周时发展为100%的动物表现出1.5的中度纤维化评分。
在第二个方面,本发明公开提供一种由本发明所述方法产生的nafld的非人类动物模型。在某些实施方式中,所述nafld的非人类动物模型通过给幼年的fatzo小鼠饲喂高脂肪和高果糖的饮食一段时间来产生。
糖尿病的动物模型
开发fatzo小鼠的目的是产生用于理解导致糖尿病的生理和细胞机制的更易于转化的模型。该模型的优势之一是延长了动物高血糖的时间,而没有循环胰岛素水平的流失或胰腺胰岛素含量的下降。作为胰岛素抵抗的生物标记,高胰岛素血症与高血糖同时发生,使得这种小鼠成为研究导致胰岛素敏感性增加的机制的可行模型。
fatzo模型的特点使其与常用模型相比具有几个优点。用于基础研究和药物筛选的最常提及的糖尿病小鼠模型是具有瘦素途径缺陷的小鼠模型(db/db和ob/ob)和c57bl/6dio模型。由于单基因瘦素途径缺陷在人群中非常罕见,具有这些缺陷的动物并不具有临床前景上的代表性。c57bl/6j背景下的ob/ob模型缺乏活性瘦素。它具有通过释放胰岛素来响应葡萄糖升高的大型胰岛的。c57bl/6j背景下的这种基因破坏已被表征为具有β细胞增殖、食欲过盛、高胰岛素血症、高血糖、新陈代谢减少和体温调节能力降低的“糖尿病前期状态模型”。由于ob/ob小鼠不表现出β细胞衰竭,并且年龄较大时实际上具有降低的葡萄糖水平,因此它们作为测试抗糖尿病化合物的模型的可用性有限。c57bl/ks上的db/db突变具有功能失调的瘦素受体。ks背景下的这种突变导致肥胖和极早发病的具有β细胞衰竭的高血糖。这些特征产生了非常严重的糖尿病和β细胞衰竭模型。db/db模型中β细胞的快速衰竭限制了其在对调节β细胞健康的药物和对天然胰腺胰岛素效力的研究中的可用性。在ob/ob和db/db模型中,瘦素信号传导中的缺陷也干扰下丘脑负责控制体重、摄食和能量消耗的正常反馈机制。因此,对于测试用于调节通过cns介导的机制的化合物,这些模型效果不佳。具有完整瘦素信号的dio模型已成功用于证明过量的热量摄入对肥胖的影响。尽管dio模型表现出肥胖、胰岛素抵抗和葡萄糖耐受不良,但适度的葡萄糖水平缩小了用于测试抗高血糖化合物作用的治疗窗口。
fatzo小鼠是通过将两种常用的dio模型c57bl/6和akr/j杂交,随后进行选择性同系繁殖以达到遗传纯合性(30+代)而开发出的。优选地选择繁育较高体重的动物,以促进肥胖;然而,过量的体重会导致怀孕率降低、产仔减少,以及后代的存活率降低。这种选择过程的结果是有效的,但不是最佳的,并且在饲喂正常的标准饲料时导致fatzo后代体重的显著变化。这种变化在断奶时很明显,并持续到成年。与初始体重无关,异常的葡萄糖处置与对照小鼠相比明显。因此,需要开发出用于产生一致性地显示糖尿病和糖尿病并发症特征的fatzo小鼠模型的改进方法。
因此,本发明公开在另一个方面提供一种产生糖尿病或糖尿病并发症的非人类动物模型的方法。在一个实施方式中,所述方法包括:(a)获取幼年的fatzo小鼠;(b)确定所述fatzo小鼠的体重在体重范围内;以及(c)选择所述fatzo小鼠用于研究所述糖尿病或糖尿病并发症。
在某些实施方式中,所述幼年为约6周龄。
在某些实施方式中,所述体重范围为23-26.9g。在某些实施方式中,所述体重范围为27-29.9g。在某些实施方式中,其中所述体重范围至少为30g。
在某些实施方式中,所述糖尿病并发症为肾病、心肌病、血管疾病、视网膜病或神经病。
在某些实施方式中,用高脂肪和高果糖的饮食来饲喂所述fatzo小鼠。
在又一个方面,本发明公开提供一种由本发明所述方法产生的糖尿病或糖尿病并发症的非人类动物模型。
在另一个方面,本发明公开提供一种由本发明所述方法产生的糖尿病并发症的非人类动物模型。
动物模型的使用
在另一个方面,本发明公开提供一种筛选用于治疗或预防nafld的药剂的方法。在一个实施方式中,所述方法包括:(a)给本公开所述的非人类动物模型施用候选药剂;以及(b)评估对nafld的改善效果。
在又一个方面,本发明公开提供一种评估用于治疗nafld的药物的方法。在一个实施方式中,所述方法包括:(a)给本公开所述的非人类动物模型施用所述药物;以及(b)评估对nafld的改善效果。
用于专门治疗nash的多种药物正在开发阶段。其中,作用于核法尼酯x受体(fxr)的半合成胆汁酸奥贝胆酸(obeticholicacid)(oca)处于临床试验的最后阶段,显示出血浆肝脏alt和ast水平的显著缓解以及脂肪变性、肝气球样变性、小叶炎症和纤维化的轻度改善。在临床前啮齿动物研究中,尽管所选的模型和给药方案可能在很大程度上影响最终呈现出的药物效力,但oca已显示出减少肝脏脂质积聚、肝酶活性、脂肪变性和纤维化的益处。
在一个实例中,饲喂wdf的fatzo小鼠,从饲喂8周时开始进行oca治疗15周,显著降低了血浆alt和ast水平,几乎达到wdf诱导前的水平(图4e和4f)。结果反映了见于对nash患者的治疗中的情况。另外,与治疗了8周的用amln饮食饲喂的ob/ob小鼠相比,oca似乎更有效地减少了饲喂wdf的fatzo中的肝酶,其中后一种模型中oca对血浆肝酶的影响极小。此外,oca治疗改善了肝气球样变性,导致nas评分总体降低,并且增加了wdf饲喂的fatzo小鼠中不存在纤维化的动物的数量(图5和图6)。数据表明,用wdf饮食饲喂的fatzo小鼠可在适于抗nash药物干预的时间范围内提供nash表型。
在另一个方面,本发明公开提供一种筛选用于治疗或预防糖尿病或糖尿病并发症的药剂的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用候选药剂;以及(b)评估对糖尿病或糖尿病并发症的改善效果。
在另一个方面,本发明公开提供一种评估用于治疗糖尿病或糖尿病并发症的药物的方法。在一个实施方式中,所述方法包括:(a)给本发明所述的非人类动物模型施用所述药物;以及(b)评估对糖尿病或糖尿病并发症的改善效果。
二甲双胍被认可为2型糖尿病患者的一线治疗药物,也是口服降血糖疗法的基石。二甲双胍在糖尿病前期以及显性糖尿病个体中降低空腹血糖,并且改善葡萄糖耐受。二甲双胍有效改善高脂肪饲喂的小鼠的葡萄糖处置。作为在人体中的单一疗法,在非糖尿病以及肥胖糖尿病患者中均发生适度的体重减轻。另外,二甲双胍的施用与肥胖dio小鼠的体重减轻相关。
罗格列酮是噻唑烷二酮(tzd)胰岛素敏化剂,已经显示其有利地影响糖尿病啮齿动物模型中胰腺β细胞的存活和功能。在用罗格列酮治疗后,在人和肥胖小鼠中观察到胰岛素抵抗减少和高血糖降低。罗格列酮的主要临床副作用是体重显著增加。
胰高血糖素样肽(glp-1)对胰岛素释放的作用和对糖尿病患者激素作用的明显损害导致glp-1受体激动剂形成,以改善糖尿病患者的葡萄糖体内平衡。在糖尿病未被二甲双胍或tzd充分控制的患者中,通常添加glp-1受体激动剂以达到治疗目标。正在进行的使glp-1疗法最大化的努力致力于延长作用的持续时间以减少给药频率。虽然索马鲁肽(semaglutide)是一种较为长效的glp-1激动剂,并且每周给药一次时表现出在人体中有效,但其在啮齿动物有效期缩短。与其他蛋白质(比如,丙种球蛋白和白蛋白)相似,内部资料显示,啮齿动物中索马鲁肽的半衰期显著短于在人类中的。基于这些内部数据,我们选择每3天给药一次。其他基于长效glp-1的受体激动剂现在临床上可用。glp-1受体激动剂也被表明在dio小鼠中抑制累积食物摄取量、降低体重并改善葡萄糖耐受。
在一个实例中,显示肥胖、胰岛素抵抗的fatzo小鼠以与人类和其他2型糖尿病肥胖模型相当的方式对响应上述三类抗糖尿病药。在用二甲双胍(150mg/kg/天)治疗的肥胖fatzo小鼠中,观察到体重减轻以及改善的葡萄糖耐受,并且在罗格列酮(10mg/kg/天)治疗后,观察到葡萄糖耐受的改善以及显著的体重增加。施用索马鲁肽(1-10nmol/kg,皮下注射,每三天一次)引起体重减轻、葡萄糖耐受改善和食物摄取量急剧降低。
实施例1
本实施例表明,用wdf饮食饲喂的fatzo小鼠将产生显著的肝脏疾病模型,其将符合更易转化的进行性nafld和nash的动物模型的标准。
方法
动物研究
雄性fatzo小鼠(fatzo/pco,n=88)在冠科生物技术公司的设备上(印第安纳州印第安纳波利斯)繁育并维持。将动物单独圈养并且持续对purina5008标准饲料(labdiet,密苏里州圣路易斯)的对照饮食和去离子水自由采食,直到研究开始。将8周龄的小鼠根据体重随机分为3组。另外,为确保所有组都是根据胰岛素抵抗状态匹配的,使用研究开始前的空腹(6小时)血清葡萄糖和胰岛素水平计算附加随机化参数(homa-ir)。随机组被分配为3组:1.对照饮食(cd)(n=32);2.western饮食(d12709b,researchdiets,新泽西新布伦瑞克)+含有5%果糖(wdf)的饮用水,饲喂5个月(n=32);3.wdf,并且从饲喂2个月起进行附加的oca治疗(30mg/kg,口服,每日一次),持续15周(n=8)。在开始wdf之前,首先对8只动物终止饲喂以作为实验的起始基线。每周记录体重和全血葡萄糖(statstripexpress血糖仪,novabiomedical;马萨诸塞州沃尔瑟姆)。使用qnmr(echomri-500;德克萨斯州休斯顿)评估全身脂肪含量(%)。在研究期间每个月处死来自每个组的八只动物。所有动物实验均由印第安纳州冠科生物技术公司的机构性动物管理和使用委员会批准。
生化测量
在处死前使小鼠禁食(6小时),获得血清样品,用于包括葡萄糖、胰岛素、胆固醇、甘油三酯、ast和alt的临床化学(au480临床分析仪,beckman-coulter;加利福尼亚州布雷亚)。使用小鼠/大鼠胰岛素试剂盒(mesoscalediscoveryk152bzc-3,马里兰州罗克维尔)从冷冻样品中测定血浆中的胰岛素含量。通过在蒸馏水中制备20%组织匀浆,将其置于lysingmatrixdtubes(mpbiomedicals,加利福尼亚州圣安娜)中并在fastprep-fp120细胞破碎机(thermofishersavant)中旋转30秒,从在液氮中急冻的样品中分析肝甘油三酯含量。将匀浆保持冷却并在制备后30分钟内在临床分析仪(beckman-coulterau480,印第安纳州印第安纳波利斯)上进行分析。
组织学
组织处理:将肝组织在4℃下在10%中性福尔马林缓冲液(nbf)中固定24小时,随后浸浴在标准浓度的酒精中,然后浸浴在二甲苯中,以制备用于石蜡包埋的组织。被包埋在石蜡中并冷却后,切下5微米切片并用于常规h&e染色和天狼星红苦味酸染色。
全切片数码成像:aperio全切片数码成像系统用于成像。使用aperioscanscopecs系统(360parkcenterdrive,加利福尼亚州维斯塔)。该系统对所有切片20倍成像。扫描时间从1.5分钟至最长时间为2.25分钟。完整图像被安置并存储在其spectrum软件系统中,并且拍摄来自全切片的图像。
nash评分:使用nash肝脏评分标准对肝脏进行评估。最近公开的nash临床研究网络(nashcrn)的组织学评分方案越来越受到临床和研究界的欢迎。原则上,该评分系统包括nafld活性评分(nas)、纤维化阶段和通过模式识别确定nash。nas的范围可以为0到8,并且通过来自h&e染色切片的脂肪变性(0-3)、小叶炎症(0-3)和肝细胞气球样变性(0-2)的得分的总和来计算。从天狼星红苦味酸染色的切片中对纤维化评分(0-4)。nash系统用于人类肝脏18号活检。系统地评估了脂肪变性、小叶炎症、肝细胞气球样变性、纤维化、nas和通过模式识别确定存在的nash。在这项研究中,对于本研究中每只小鼠,我们评估了一个肝脏总横截面积。这是18号人类肝活检规模的15倍。病理评分被确定为0、+1、+2或+3。根据位置(门静脉周、小叶中心和中部)和脂肪堆积(局灶、门静脉周和/或小叶中心)对病灶评分。评分的另一部分是病灶的分布:局灶性、多灶性和/或弥漫性。此外还有病变的轻度、中度和严重度。这些参数构成了nash总分。
统计学
使用单向或重复测量方差分析与prism(graphpad,7.01版)多重比较t检验,比较wdf的治疗效果。统计学差异表示为p<0.05。所有数值报告为平均值±sem。使用以下等式计算homa-ir:空腹胰岛素(μiu/ml)×空腹葡萄糖(mg/dl)/22.5。所有分配的动物都完成了研究。
结果
wdf在fatzo小鼠中加剧了代谢紊乱、肝功能受损和整合至nafld/nash的组织学改变
饲喂wdf的fatzo小鼠显示出显著更大幅度的体重增加(图1a),其与体脂相比于年龄匹配的cd饲喂的小鼠显著的增加相关(图1b)。饲喂4周后,wdf组的血胆固醇水平比cd对照组几乎高出2.5倍,并且在整个饮食诱导期间,wdf组的血胆固醇水平始终高于cd组(图1c),但wdf组的甘油三酯水平稍低(图1d)。
饲喂wdf的小鼠的肝的代谢应激引起肝酶的显著升高,与对照饮食(cd)饲喂的小鼠相比,在暴露于饮食20周后显示出在丙氨酸转氨酶(alt)(图1e)和天冬氨酸转氨酶(ast)(图1f)水平上分别几乎高出6倍和4倍。两组的肝重均随时间增加,然而,含果糖的western饮食(wdf)中肝重的增加显著高于cd组(图1g)。在第12-20周时从饲喂wdf的小鼠中测得的肝甘油三酯含量显示出2倍的差异,与饲喂cd的小鼠相比具有显著更高的水平(图1h)。
饲喂wdf的fatzo小鼠发展出以进行性脂肪变性、肝细胞气球样变性、小叶炎症和纤维化早期阶段为特征的脂肪肝。在nafld的早期进展期间,来自饲喂wdf的fatzo小鼠的肝脏与cd饲喂的小鼠相比,尸检时颜色非常苍白(图2)。与cd相比,早在wdf饲喂4周时,h&e染色显示出具有气球样变性的发展完全的脂肪变性。随着时间的推移,fatzo小鼠表现出进行性的nafld的恶化。在每个时间点,与对应的饲喂cd的fatzo小鼠相比,饲喂wdf的小鼠的肝脏颜色更为苍白。与对应的cd饲喂组相比,在来自wdf饮食饲喂16周的组的肝脏切片中观察到显著的指示nafld的组织学变化(脂肪变性、肝细胞气球样变性、小叶炎症),包括轻度纤维化(图2)。
当评估切片的nash活性评分时,与对应的来自cd饲喂的小鼠的肝脏相比,来自wdf饲喂的小鼠的肝脏表现出显著更高的脂肪变性(图3a)、肝细胞气球样变性(图3b)、小叶炎症(图3c)和纤维化(图3d)的评分。在观察复合nafld活性评分(nas)时,与来自cd饲喂的小鼠的肝脏相比,来自wdf饲喂的小鼠的肝脏表现出明显更多的病理学发现(图3e)。
oca在饲喂wdf的fatzo小鼠中改善了的肝功能和肝气球样变性
wdf饮食饲喂8周的fatzo小鼠进行15周的oca治疗(30mg/kg,每天一次)对于体重(图4a)或血液甘油三酯水平(图4b)没有影响。相比之下,oca治疗缓解了血液总胆固醇(图4c)和ldl(图4d)的升高,导致与载体对照相比显著更低的水平。另外,早在oca治疗后4周就可见肝功能的改善,因为oca治疗组中的血液alt(图4e)和ast(图4f)水平显著低于其自身的治疗前基线以及cd饲喂的小鼠。oca治疗15周后,与载体对照相比,相对肝重(图4g)和肝甘油三酯水平显著降低(图4h)。
评估肝脏组织学(图5)时,oca治疗倾向于改善nas评分(图6e),显著缓和了显示肝气球样变性的病灶数量(图6b)。nas评分的其他部分的变化不明显,如脂肪变性(图6a)、小叶炎症(图6c)和纤维化(图6d)。
总之,多基因fatzo小鼠模型饲喂wdf饮食时发展出与人类相似的进行性nafld和nash。nafld和nash的fatzowdf模型代表了推动这一领域研究进展的另一科学工具,与目前的模型相比,这种模型潜在地更易转化为人类疾病。
实施例2
该实施例说明了fazto小鼠中疾病严重程度与体重和高脂肪饮食的相关性。
材料和方法
fatzo的产生
繁育群落中的fatzo小鼠以purina5008啮齿动物饮食和反渗透水维持。小鼠繁育至6至10周龄之间(7-8周龄最佳)。将动物圈养于控制光照(12小时光照/12小时黑暗)和温度(25℃)的环境中。
高脂肪饮食的影响
将6周龄的雄性fatzo/pco小鼠(n=48)称重(24-43g),并在6-8周龄时从cbin群落(冠科生物技术公司-美国印第安纳州印第安纳波利斯)转移到lillyresearchlaboratories(美国印第安纳州印第安纳波利斯)。适应后,平均10周龄的fatzo小鼠根据其6周龄时的体重分配至以下各组:低体重组(低体重,23-26.9g),中体重组(中等体重,27-29.9g)和高体重组(高体重,≥30g)。在研究开始时,各组10周龄小鼠的平均体重为:低体重组(29.4±0.7g),中体重组(35.7±0.7g)和高体重组(38.9±0.7g)。将每个体重组的小鼠随机分为两个亚组(n=8/亚组),分别饲喂purina5008,16%脂肪标准饮料(chow),或者来自researchdiets(hfd,美国新泽西新布伦瑞克)的d12492,60%脂肪饮食。每周记录体重;从10周龄至18周龄每周记录全血糖(accuchekaviva仪)水平,并在21周龄时再次记录。自10、12、14、18和21周龄的小鼠采集血液,并准备血浆用于胰岛素分析。在进食状态下通过剪尾获取葡萄糖和胰岛素的血液样品。18周龄的小鼠在禁食17小时后进行口服葡萄糖耐受试验(ogtt)以评估葡萄糖处置;从在葡萄糖负荷(3g/kg,口服)后0、15、30、60和120分钟时取得的样品中测定葡萄糖和胰岛素水平。使用小鼠/大鼠胰岛素测定试剂盒(k152bzc,mesoscalediscovery,美国马里兰州罗克维尔)对整个研究期间和ogtt期间采集的血液样品中的血浆进行胰岛素分析。
在21周龄时用co2使动物安乐死。将每个胰腺切开,称重,在液n2中急冻并置于etoh-hcl(5ml)提取缓冲液(23.5份水,75份乙醇,1.5份浓hcl)中并在4℃下保存。用polytron匀浆器彻底切碎后,通过在4℃振荡过夜,在所述缓冲液中提取胰脏。通过离心从提取物中分离出组织,并用含有0.1%bsa的earle氏平衡盐溶液(ebss)将组织稀释,用于胰岛素分析。还使用小鼠/大鼠胰岛素测定试剂盒(k152bzc,mesoscalediscovery,美国马里兰州罗克维尔)分析这些提取物。
瘦素水平和瘦素对食物摄入的影响
选择两个年龄组的雄性fatzo小鼠用于分析瘦素水平和瘦素对食物摄取的影响。对其他年龄匹配组的c57bl/6放血,用于测定瘦素水平。在进行方案之前使动物对逆转光周期适应7天。将灯关掉之前的30-60分钟,采集来自5周龄(n=7)和11周龄(n=8)的雄性fatzo小鼠,以及来自大致相同周龄的雄性c57bl/6小鼠(n=6)的血液,用于分析瘦素水平。自尾血制备血清并分析瘦素水平(mesoscalediscovery,k152byc,美国马里兰州罗克维尔)。采集血液后,给动物注射盐水或瘦素(10mg/kg),记录黑暗中前4小时的食物摄入数据。
统计学
除了所提到的以外,所有数据均以平均值±sem表示。使用prismforwindows(6.07版graphpad,美国加利福尼亚州圣地亚哥)完成统计分析。比较各组时,进行单向方差分析,随后进行sidak氏多重比较检验;随着时间的推移比较各组时,进行双向方差分析,随后进行sidak氏多重比较检验。对配对的(6周龄时的体重与14周龄时的葡萄糖和胰岛素)进行线性回归,随后进行相关分析。
结果
fatzo的产生
fatzo小鼠模型的开发和繁殖需要一些特殊条件。基于这些动物体重的快速增加,繁殖年龄与通常的小鼠群落相比更加受限。在7-8周龄时进行繁殖是最成功的。来自较低体重动物的成功产仔可在较长的时间段期间产生;然而,这种做法导致后代体重较低,并增加了向较不肥胖的模型漂移的可能性。可以繁育年龄较大、体重较重的动物,但是这导致了较低的妊娠率和较少的产量。在较高温度下的繁殖和圈养也是一个重要的考虑因素,因为较高的温度较接近热中性,提高了体重增加和疾病表现。对fatzo小鼠53批产仔的分析表明,产仔量与雄性仔鼠的体重呈负相关(r=-0.6986,p<0.0001)。由于较大的产仔量包含较低体重的动物,因此限制产仔量的大小会产生较重的后代。尽管对产仔量进行了归一化,但仍然观察到动物体重的变化。
动物体重
根据其6周龄时的(初始)体重对动物进行分组,以确定早期体重对后来的体重增加、胰岛素水平、葡萄糖耐受和高血糖的影响。各体重组在每种饮食下的平均值对于chow和hfd饮食在所有时间点都保持显著不同(图6a和6b)。饲喂hfd的小鼠(图7b)均比体重匹配的chow饲喂的动物体重增长更快(图7a)。双向重复测量方差分析显示每个体重类别在开始饮食饲喂后的每个时间点均在chow和hfd之间存在显著的体重差异(p<.0005)。表2显示hfd饲喂的小鼠的所有体重组与chow饲喂的动物相比,吃的饮食质量更少。然而,与高体重chow饲喂组相比,高体重hfd组具有更高的卡路里摄入量。
表2.采食量
*表示体重组中chow和hfd之间存在统计学差异。
葡萄糖水平
尽管在10周龄时各体重组之间的葡萄糖水平相似(图7c和7d),但chow和hfd组中的葡萄糖差异随时间变得明显。chow(图7c)和hfd(图7d)组葡萄糖水平初始的升高与初始体重相关。chow饲喂的高体重和中体重组具有相当的葡萄糖水平从13周龄至21周龄的升高,而低体重chow组在实验期间保持接近基线的水平(图7c)。类似地,最重的两组hfd饲喂的动物随时间达到最高的葡萄糖水平,而低体重组在整个实验过程中具有显著较低的葡萄糖水平(图7d)。对于体重,双向重复测量方差分析发现各体重类别中的chow与hfd之间的葡萄糖曲线存在显著差异(p<.005)。sidak氏多重比较检验也显示,除了的低体重组中的10-12周龄和中体重组中的10周龄、11周龄、15周龄和18周龄,以及高体重组中的10周龄和11周龄以外,在所有周龄都存在饮食之间的差异显著(p<.01)。
胰岛素水平
结果显示在10-12周龄的数据中体重与血浆胰岛素水平之间呈正相关。高体重组最初10周龄的胰岛素水平显著高于两个较低体重组(图7e和7f)。在chow饲喂/高体重组中,平均胰岛素水平不随时间而改变(图7e)。然而,在中体重和低体重组中,胰岛素水平随时间而增加,中体重组在14周龄时、低体重组在21周龄时,变得与高体重组类似(图7e)。相比之下,hfd组中的胰岛素水平在饲喂hdf的前4周内急剧增加,平均胰岛素水平在14周龄时变得相似。之后,胰岛素水平在两个较高体重组中下降(图7f)。
葡萄糖耐受
动物在约18周龄时进行ogtt(图8a和8b)。图8c和8d示出了禁食过夜后的空腹葡萄糖水平。这些附图显示chow-饲喂组的空腹葡萄糖水平在基线时十分相似(图8c),而在两个较重的hfd组中仍然显著升高(图8d)。ogtt中chow饲喂的葡萄糖水平显示出显著偏移,其大于通常可见于对照小鼠的显著偏移(在相当的研究中为约30*103,pco未公开),但随着禁食过夜,葡萄糖水平在120分钟内降至接近空腹的水平;auc数据显示三组的数值相似(图8e)。中体重和高体重的hfd组显示出升高的空腹血糖水平(图8d)和延迟的葡萄糖处置(图8b和8f)。在ogtt中的各时间点测定血清胰岛素水平。chow饲喂组中的胰岛素响应在葡萄糖负荷后显示出短暂增加(图8a),而饲喂hfd的动物具有钝化的响应(图8b)。chow饲喂组中的空腹胰岛素水平相对于体重增加。响应葡萄糖负荷,胰岛素水平在30和60分钟时与基线相比显著增加(图9a)。在chow饲喂组中,ogtt期间的胰岛素的auc(图9c)也表明体重和auc之间存在关联,最轻的体重组具有显著更小的胰岛素auc。在hfd组中,高、中体重组中没有相比于基线胰岛素水平的增加,但在低体重组中,与基线水平相比有显著的增加(图9b)。
胰腺胰岛素
实验结束时,取出胰腺并测定胰岛素含量。根据血浆胰岛素数据,与chow高体重组相比,hfd高体重组中的的胰腺胰岛素也显著降低(图9e)。
体重、葡萄糖和胰岛素相关性
对73个fatzo雄性小鼠的组群的回顾性分析表明,14周龄小鼠中的葡萄糖和胰岛素与6周龄小鼠的体重呈正相关(图10)。
瘦素水平和瘦素对食物摄入的影响
在5周大龄时,fatzo和c57bl/6小鼠之间的瘦素水平没有显著差异,但是随着fatzo小鼠变得更加肥胖,其瘦素水平迅速增加,而c57bl/6小鼠保持低水平并且与5周龄的动物没有显著差异(图11a)。在年轻的fatzo动物中注射瘦素显著减少了采食量,但由于10周龄时内源性瘦素水平的增加,食物摄入量不会显著减少(图11b)。
总之,fatzo小鼠在表现出基于体重的各种严重程度的功能失调的葡萄糖稳态。在同一个年龄组中,较瘦的动物表现出受损的葡萄糖处置,而较重的动物通常表现出更严重的葡萄糖不耐受。这种表型差异使得能够选择所需的处于代谢综合征/2型糖尿病阶段的动物。体重选择标准可用于设计针对减缓糖尿病进展(中等体重)或治疗糖尿病(高体重)的研究。fatzo小鼠被提议作为用于研究肥胖/代谢综合征及其发展的新型动物模型。在饲喂hfd的所有体重组中,葡萄糖刺激的胰岛素释放均被钝化。这种葡萄糖负荷后的响应缺乏表示胰腺β细胞失去了其对升高的葡萄糖有效响应的能力。高脂肪饮食的引入促进更严重的糖尿病的发展,其以高血糖、降低的胰岛素释放和敏感性为特征,可能最终导致β细胞衰竭。
实施例3
这个实施例说明了fatzo小鼠中葡萄糖调节异常和对普通抗糖尿病剂的响应
方法
年龄相关的葡萄糖稳态的变化
fatzo/pco小鼠在preclinomics(现在的冠科生物技术公司-印第安纳州)上繁育并维持。每笼饲养2只雄性小鼠(n=72)。监测室温并保持在72-77°f,光周期设定为12小时(0600-1800小时)。普瑞纳5008标准啮齿动物饲料和家庭用水供自由采食。从6至22周龄,每隔2周记录房间灯亮起2小时内的体重、进食血糖和胰岛素。使用au480临床分析仪(beckman-coulter,美国加利福尼亚州布雷亚)在新鲜血浆中分析血清葡萄糖。使用小鼠/大鼠胰岛素试剂盒(mesoscalediscoveryk152bzc-3,美国马里兰州罗克维尔)从冷冻样品中测定血浆中的胰岛素含量。
与年龄匹配对照组的比较
在平行研究中,评估雄性fatzo小鼠(n=6)的身体组成和葡萄糖处置并与年龄匹配的对照c57bl/6j小鼠(n=6)比较;两组的饮食均为普瑞纳5008。从6至18周龄,每4周进行一次口服葡萄糖耐受试验(ogtt)。禁食12小时后,通过灌胃口服施用葡萄糖(2g/kg)。剪尾取血液样品,在葡萄糖负荷后的0、30、60、90和120分钟,通过statstrip(xpress,datascienceinternational,美国明尼苏达州)分析葡萄糖。使用葡萄糖给药前的每个个体基线血糖测量值作为参考(t=0),通过梯形法[37]计算对应于每只动物的血糖响应曲线的面积。计算对应于每只动物的0、30、60、90和120分钟的时间点之间的梯形面积的总和,以获得曲线下面积(auc)。在6、10和14周龄的动物中测定以进食状态下的血清甘油三酯。
从6至18周龄,在清醒小鼠中每4周使用qnmr(echomri-700,美国德克萨斯州休斯顿)评估一次身体组成。在即将开始ogtt的禁食之前进行全身qnmr。所有数据均以平均值±sem表示(n=6/组)。
对二甲双胍和罗格列酮的响应
将雄性fatzo小鼠(9周龄,n=40)随意维持于自由采食普瑞纳5008常规啮齿动物饮食和反渗透水。在进行研究之前每笼饲养3只小鼠并对研究环境适应7天。在10周龄时,将小鼠禁食6小时,记录体重并进行ogtt。在2g/kg葡萄糖负荷后的0、30、60、90、120和180分钟测定葡萄糖和胰岛素。从statstrip血糖仪中获取葡萄糖浓度,并使用上文提到的胰岛素试剂盒在每个时间点测定胰岛素。使用修改自matsuda和defronzo[39]的公式,通过将分子改变为10,000并且使用葡萄糖和胰岛素auc代替平均葡萄糖和胰岛素水平(10万/[空腹血糖×空腹胰岛素]×[ogtt期间的葡萄糖auc×胰岛素auc]的平方根]),来计算胰岛素敏感性指数(isi)。
根据基线isi和体重将动物随机分为3组,每组10只。分配各组接受载体(0.5%cmc,0.1%吐温80)、罗格列酮(kemprotec有限公司,英国)(10mg/kg/天)或二甲双胍(torontoresearchchemicals,加拿大安大略省北约克)(150/kg/天)。化合物通过灌胃每天一次口服施用8周。每周记录体重。
治疗8周后,施用化合物后1小时重复ogtt。剪尾取全血并加工成血清。对于葡萄糖处置、进食血清葡萄糖、hba1c和isi的治疗效果与载体进行比较。
对glp-1激动剂索马鲁肽的响应
每笼饲养一只雄性fatzo小鼠(n=32),并维持在恒定的室温(77-78°f)下,并从断奶时起用purina5008常规啮齿动物饮食饲喂至12周龄。此时,启动12小时的逆转光周期(以适应葡萄糖和ogtt活性)(黑暗周期0700-1900小时),并在余下的研究中将饮食改为purina5015。动物对这种环境适应2-3周。在适应期的最后5天期间,通过每天皮下施用一次磷酸盐缓冲盐水(pbs)使动物适应处理。在研究开始前24小时,进入黑暗周期2-3小时后获取基线值(全血葡萄糖和体重)。在进食状态下通过剪尾获取血液样品,用于测定全血葡萄糖水平(statstrip)。接受体重≥40.0g且进食葡萄糖水平≥250mg/dl的动物用于研究基于体重和进食葡萄糖,随机分为4组,每组8只,并分配接受载体(20mm柠檬酸盐缓冲液,ph7),或接受1.0、3.0或10.0nmol/kg索马鲁肽的皮下注射,q3d(每三天给药一次)。索马鲁肽由印第安纳州印第安纳波利斯的elilillyandcompany使用与已公开方案相似的方案合成。在即将开始黑暗循环之前(0600-0700小时)递送化合物并继续递送6次剂量。每天调整剂量体积以保持在10ml/kg。最后一次给药24小时后,将动物禁食6小时(0800-1400小时)以进行口服葡萄糖耐受试验(ogtt)。在葡萄糖负荷(2g/kg,口服)后的0、30、60、90和120分钟剪尾取血液样品,以测定全血葡萄糖。通过co2窒息和颈椎脱位将动物处死。每天在即将开始黑暗周期(0600-0700小时)之前记录采食量和体重。使用施用葡萄糖之前的每个个体基线血糖测量值作为参考(t=0),通过梯形法计算对应于每只动物的血糖响应曲线的面积。将对应于每只动物的0、30、60、90和120分钟的时间点之间的梯形面积求和,以获得曲线下面积(auc)。
统计学
除了所提到的以外,所有数据均以平均值±sem表示。使用prismforwindows(6.07版graphpad,加利福尼亚州圣地亚哥)完成统计分析。适当时,进行单向方差分析或单向方差分析重复测量,随后进行dunnett氏多重比较检验。此外,随着时间的推移研究不同的组时,进行双向方差分析和双向重复测量方差分析,随后进行sidak氏多重比较检验。
结果
年龄相关的葡萄糖稳态的变化
每2周在fatzo小鼠的组群(n=72)中测定血清葡萄糖浓度。从进食状态下的清醒动物中获取样品。饲喂标准啮齿动物饲料时,在fatzo小鼠中自发发展出高脂血症并且迅速进展。从6周龄至10周龄,血糖保持稳定(≈210mg/dl),之后在12周龄时迅速增加至380.4±16.6mg/dl。随着动物成长至22周龄,随后葡萄糖浓度更缓慢地增加并达到约420mg/dl的平台(图11a)。与正常小鼠的文献值相比,6周龄的fatzo动物中的血清胰岛素浓度显著更高(9.15±1.5ng/ml对约0.5至1.5ng/ml)(图11b)。在葡萄糖浓度逐渐增加的同时,10周龄动物的胰岛素浓度上升6倍至57.9±6.1ng/ml,18周龄动物的胰岛素浓度上升15.0倍至142.0±9.7ng/ml。当葡萄糖浓度在18周龄后处于400mg/dl的范围时,胰岛素浓度开始下降(图12a和12b)。
与年龄匹配的对照小鼠比较
将一个小组群的fatzo小鼠与6-18周龄的对照c57bl/6j小鼠(每组n=6)进行比较。与对照小鼠相比,当饲喂标准啮齿动物饲料时,fatzo小鼠自发发展出高血糖、高胰岛素血症和高甘油三酯血症。如异常葡萄糖处置所示,胰岛素抵抗早在6周龄时就已经很明显,并且与过量全身脂肪的积聚同时发生。
饲喂标准啮齿动物饲料时,与整个研究中年龄匹配的对照小鼠相比,fatzo小鼠显著更重。6周龄的fatzo小鼠的基线体重为27.0±0.6g,体重稳步增加,在19周龄时达到38.8±0.6g。6周龄的对照组小鼠体重为20.0±0.6g,在研究结束时增加至31.4±0.6g(图13a)。与6-18周龄的对照小鼠相比,fatzo小鼠的身体组成也显著不同。与对照小鼠相比,在6周龄(9.7±0.9对5.9±0.8%,p<.05)和18周龄(20.6±1.8对8.3±1.0%,<.05)的fatzo小鼠中观察到较高的体脂百分比(图13b)。研究过程中的饲料摄入量(累计的)在这些动物组之间没有显著差异(c57bl/6j的310.0±23.0g对fatzo的330.0±5.6)。血清甘油三酯(进食)在6-14周龄的对照小鼠中保持稳定,范围为167.8±31.1至137.0±21.9mgsdl。与6周龄时的对照小鼠相比,fatzo小鼠中的血清甘油三酯略高,但没有显著差异(202.6±21.2比167.8±31.4mg/dl)。,fatzo小鼠中的甘油三酯在10周龄时(331.3±50.6对173.3±12.9mg/dl,p<.05)和14周龄时(318.2±11.6对137.0±21.9mg/dl,p<.05)显著高于对照组(图13c)。
对照小鼠每月进行的口服葡萄糖耐受试验(ogtt)表明从6周龄至18周龄,对葡萄糖负荷相对稳定的处置(图14a)。相比之下,在fatzo小鼠中,早在6周龄时就存在突出的葡萄糖处置异常。在fatzo小鼠中处置葡萄糖负荷的能力随着年龄增加而变差(图14b)。当以曲线下面积表示时,与对照小鼠相比,fatzo小鼠中葡萄糖负荷后的葡萄糖auc在6周龄时没有显著更大,但在10、14和18周龄时达到显著性(图14c)。
罗格列酮和二甲双胍的作用
在平行研究中,我们研究了罗格列酮和二甲双胍在2型糖尿病/代谢综合征的fatzo小鼠模型中对代谢紊乱的影响。
在研究开始时,十周龄fatzo小鼠的体重平均为36.0±0.4g。
与载体处理的动物相比,以10mg/kg/天施用罗格列酮在8周的观察期中引起体重的显著增加(1.8±0.2比5.3±0.7g,p<0.05)。相比之下,与载体处理的动物相比,二甲双胍治疗导致轻微但显著的体重减轻(1.8±0.2对-0.2±0.6g,p<0.05)。
在施用载体8周的动物中,进食状态下的血清葡萄糖浓度为315.6±35.4mg/dl。与载体处理相比,用罗格列酮治疗后,血清葡萄糖浓度略低,但未达到统计学显著性(315.6±35.4对333.3±7.7mg/dl),而用二甲双胍治疗后,血清葡萄糖浓度显著降低(315.6±35.4对250.0±12.8mg/dl,p<.05)。
与载体处理相比,施用两种化合物8周后,葡萄糖的曲线下面积(auc)(图15a)均显著降低。然而,只有二甲双胍引起胰岛素auc和计算出的胰岛素敏感性指数(isi)的显著改善(图15b和图15c)。
glp-1受体激动剂索马鲁肽的作用
fatzo小鼠中的基线(15-16周龄)体重平均为43.0±0.2g,并且在基线时处理组之间没有差异(载体,以及1、3和10nmol/kg的索马鲁肽分别为43.1±0.5、43.2±0.5、42.9±0.5和42.7±0.5g)。在整个研究期间,载体处理的动物中的体重保持相对稳定,在施用载体16天后,与基线相比减少了1.9±1.1%的体重。相比之下,在用索马鲁肽治疗的动物中观察到剂量依赖性且进行性的体重减轻。在研究过程中,在1、3和10nmol/kg索马鲁肽治疗后(对于1、3和10nmol/kg的剂量分别为7.0±1.3、9.9±1.4和10.6±0.6%)观察到与基线相比剂量依赖性的体重减少。对于所有施用的剂量,与载体处理相比,这种体重减轻是显著的(图16a和图16b)。
研究开始前6天的基线食物摄取量平均为4.1±0.09g/天。与载体处理相比,索马鲁肽治疗的动物中的采食量在每次药物施用(第1、4、7、10、13和16天)后的24小时显著降低。在所有索马鲁肽组中,6次药物施用中索马鲁肽对采食量的平均作用(食物摄入与给药前的数值相比减少的百分比)与载体处理相比显著更高(-6.7±4.6%)(对于1、3和10nmol/kg的索马鲁肽分别为-22.4±2.2、-36.1±3.5和-44.7±2.5%)。这种影响是短暂的,因为采食量在下一次剂量之前恢复到给药前的数值(图16c和16d)。
在选择用于研究的动物中,基线血糖平均为408.9±11.0mg/dl。除了在第一剂之后的1nmol/kg的组之外,与施用载体的动物相比,在第一剂、第三剂和第五剂的24小时后测量的进食血糖在索马鲁肽治疗的动物中显著降低。在第五次施用后,与基线相比,载体和1、3和10nmol/kg的索马鲁肽的葡萄糖值分别下降16.3±6.8、39.4±5.3、57.3±4.8和56.6±2.5%(图17a和17b)。
索马鲁肽的施用引起了葡萄糖处置的改善。在口服葡萄糖耐受试验(ogtt)后,观察到施用索马鲁肽的葡萄糖auc的剂量依赖性降低(图17a和17b)。在施用索马鲁肽(3.0nmol/kg)后观察到与载体处理(-11%)相比的减少;然而,这种响应没有达到显著性。对于10nmol/kg的剂量,auc与载体处理相比显著减小(对于载体和1、3和10nmol/kg的索马鲁肽分别为40.04±2.4、41.5±3.4、35.7±2.8和28.7±1.0auc)(图17c和17d)。
尽管已经参照具体的实施方式(其中一些是优选实施方式)特别地示出和描述了本发明公开,但本领域技术人员应该理解,可以在其中进行形式和细节上的各种改变而不脱离本发明公开所述的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!