一种生物刺激剂及其应用的制作方法
本发明涉及生物刺激剂及其应用,属于植物保护
技术领域:
。
背景技术:
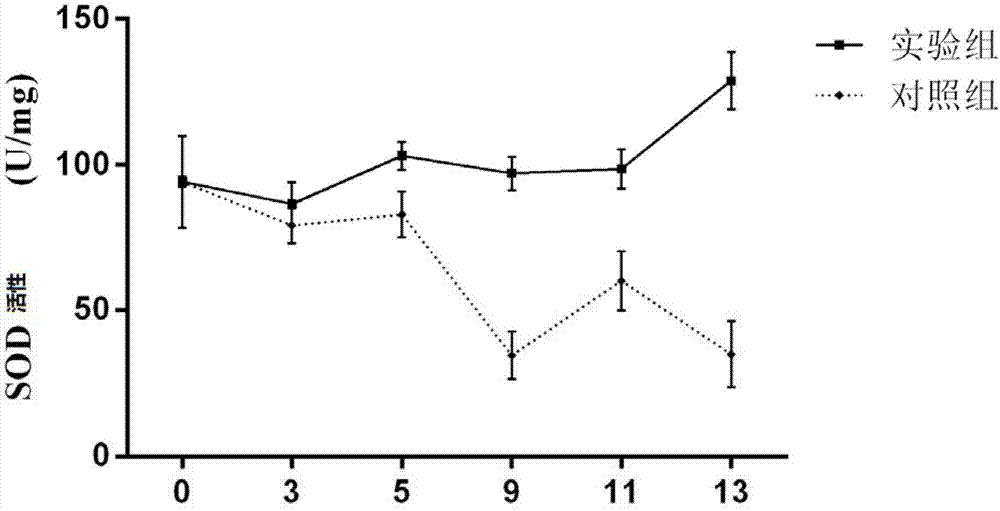
在自然条件下,植物在其一生中经常面临很多的生物胁迫和非生物胁迫。生物胁迫主要来自细菌、真菌、病毒、线虫、昆虫、鸟类等,它们通过影响植物根、茎、叶正常生理活动,使植物发生病害、虫害最终影响植物的正常生长和产量、品质下降。非生物胁迫主要是一些不利的环境因素,包括干旱、高盐、重金属、冷害等,通过影响植物的光合作用、呼吸作用、营养代谢、激素调节、渗透平衡等方式使得植物不能充分发挥其遗传潜力。关于抗逆境胁迫的激发子,本领域的技术人员研究了很多物质,包括非生物类的激发子和生物类的激发子。非生物类的激发子,诸如硅(参见文献:周秀杰等,2007),水杨酸、草酸、脯氨酸(参见文献:胡慧芳和马有会,2008),海藻肥(参见文献:刘明军等,2003),海藻糖(参见文献:liuetal.,2009),海藻提取物(参见文献:孙杰等,2006),酮康唑(参见文献:abduletal.,2007),2-氨基乙醇(参见文献:mascheretal.,2005),油菜素甾醇(参见文献:yuanetal.,2010)等。生物类的激发子,诸如菌根真菌(参见文献:osonubietal.,1991;asraretal.,2011),内生真菌(参见文献:sunetal.,2010;kaneetal.,2011),根瘤菌romdhane和一些有益微生物(参见文献:邵嘉鸣等,2004;vázquezetal.,2001;benabdellahetal.,2011)等。目前来看,应用较多的是非生物类激发子,这类激发子在促进植物抗逆的同时或多或少会影响植物生长发育,长期使用还会影响环境,造成土壤退化等不利影响,存在一些环境安全性的问题;生物类的抗逆胁迫激发子应用比较少,抗逆效果不是很理想。因此,本领域技术人员希望能够开发一种环境安全性更好,且抗逆效果更佳的生物刺激剂。技术实现要素:为了解决上述技术问题,本发明一方面提供了一种生物刺激剂,其中,所述生物刺激剂的活性成分包含胺类物质,所述胺类物质为乙醇胺、腐胺和亚精胺的组合;其中,所述胺类物质中,按重量计,乙醇胺:腐胺:亚精胺的比值为0.8~1:18~15:2~5。优选的,所述生物刺激剂的活性成分还可以包含有机酸类物质,所述酸类物质为己酸,所述有机酸类物质与所述乙醇胺的重量比值为800~1000:1。优选的,所述生物刺激剂还可以包含辅料,所述辅料为单糖,所述辅料与所述乙醇胺的重量比值为300~500:1。优选的,所述辅料为甘露醇、半乳糖、葡萄糖中的任意一种或任意几种的混合物。优选的,所述生物刺激剂包含乙醇胺、腐胺、亚精胺、有机酸和辅料,其中,按重量计,乙醇胺:腐胺:亚精胺:有机酸:辅料的比值为:0.8:18:2:800:240,或者,0.9:21.5:3.5:850:350,或者1:25:5:900:500。优选的,所述的生物刺激剂还可以包含载体或助剂,其剂型为粉剂、乳油、颗粒剂、悬浮剂或微胶囊剂。本发明另一方面还提供了上述的生物刺激剂在调节植物生长和诱导植物抗逆、抗病中的应用。优选的,所述植物为蔬菜。优选的,所述蔬菜为番茄、玉米或辣椒。本发明的生物刺激剂模拟生防菌的代谢产物和植物根部次生代谢物,采用特定的胺类物质的组合,对人体和环境无害,也无残留,并且还能激发植物的抗逆因子,增强植物的抗逆和抗病的能力,以及改善植物的营养状况,促进植物的生长发育,增强植物对胁迫环境的适应能力。附图说明图1为实施例1的生物刺激剂对番茄体内sod酶活变化影响的实验结果;图2为实施例1的生物刺激剂对番茄体内pod酶活变化影响的实验结果;图3为实施例1的生物刺激剂对番茄体内cat酶活变化影响的实验结果。具体实施方式以下通过实施例对本发明作进一步的说明,但本发明并不限于这些具体实施方式。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1-3实施例1-3的生物刺激剂(剂型:溶液)其配方包括如下重量的组分:表1其中,乙醇胺购自于南京寿德生物科技有限公司,cas号:141-43-5,纯度≥99.0%,分子量:61.08;腐胺购自于南京寿德生物科技有限公司,cas号:333-93-7,纯度≥98%,分子量:161.07;亚精胺购自于南京寿德生物科技有限公司,cas号:124-20-9,纯度≥99.0%,分子量:145.25;己酸购自于南京寿德生物科技有限公司,cas号:142-62-1,纯度≥98%,分子量:116.16;其中,上述实施例1-3的辅料采用单糖,实施例1采用甘露醇,实施例2采用葡萄糖,实施例3采用半乳糖;这些单糖均购自于南京寿德生物科技有限公司。上述实施例1-3的制备过程:按照上述配方称取各个组分重量,加入到反应釜中混合均匀,然后再加入蒸馏水将体积定量到1l,混合均匀后获得实施例1-3的生物刺激剂产品。实施例4的生物刺激剂(剂型:粉剂)实施例4的生物刺激剂粉剂,其配方包括如下重量的组分:乙醇胺0.8g,腐胺18g,亚精胺2g,己酸800g,甘露醇240g;在常温下,将上述配方的乙醇胺、腐胺、亚精胺、己酸和甘露醇放入反应釜中搅拌均匀,再向混合物加入海藻酸钠100g,硅藻土500g充分混合均匀。实施例5的生物刺激剂(剂型:颗粒剂)实施例5的生物刺激剂粉剂,其配方包括如下重量的组分:乙醇胺0.8g,腐胺18g,亚精胺2g,己酸800g,甘露醇240g;在常温下乙醇胺,将上述配方的乙醇胺、腐胺、亚精胺、己酸和甘露醇放入反应釜中搅拌均匀,再向混合物加入海藻酸钠50g,硅藻土200g,高岭土300g,充分混合均匀后在滚筒造粒机中造粒,粒径约为3-5mm。效果数据1)本申请的生物刺激剂对番茄抗旱能力影响播种前,先对番茄种子进行表面消毒,用1.5%(w/v)naclo消毒2min,无菌水进行彻底漂洗5次,均匀铺撒于用蒸馏水润湿的灭菌滤纸上,置于温室培养,培养条件是光周期为12h(200μe/m2s)/12h,22℃,70%相对湿度。培养4叶期后进行移栽,每个盆钵1株苗,移栽后置于相同的培养环境进行生长。挑选取长势较为一致的番茄苗进行实验。实验组有3组,分别为实验组1、2和3,对应地采用上述实施例1-3配制获得的生物刺激剂;阴性对照组采用清水;阳性对照组采用费托蜡乳液(该物质为低密度氧化聚乙烯蜡,是常规的抗旱保水剂(化学刺激剂),购买自上海新诺化工有限公司的we-404a1型号产品)。每个组(实验组、阴性对照组或阳性对照组)各24颗苗,移栽时每棵苗浇灌20ml样品(实验组1-3分别浇灌实施例1-3配制获得生物刺激剂,阴性对照组浇灌清水,阳性对照组浇灌稀释500倍的费托蜡乳液20ml);正常浇灌诱导5天(每天浇灌20ml样品)之后进行断水,模拟干旱处理,模拟干旱处理20天后重新浇灌20ml样品,24小时后统计各组的存活率和萎蔫严重度,并计算各组的抗旱程度,具体数据参见下表2。表2存活率(%)萎蔫严重度(%)抗旱能力(%)实验组191.67±1.1151.5±0.9646.36±0.46实验组287.5±1.5362±1.5335.4±2.35实验组387.5±1.0761.33±1.7336.11±1.56阴性对照组20.83±2.2496±1.150.00阳性对照组87.5±1.0464.67±2.5232.65±1.91表格中的数值为平均值±标准误差,以下表格皆同。从上述表2的结果可以看出,本发明中实验组1相对于阴性对照组表现出明显的抗旱能力,并且均强于阳性对照组(实施组1远高于阳性对照组,实验组2-3略高于阳性对照组),这说明本发明实施例1-3的生物刺激剂对于番茄具有显著的抗旱效果。另外,在上述的模拟干旱处理20天后,重新浇灌,每天浇灌20ml样品。当阴性对照组中的50%以上的番茄苗呈现中度萎蔫(叶片卷曲和下垂,且早晨和晚上不能恢复),则在该时间点停止浇灌,检测各组叶片相对含水量、根系活力、mda含量、相对电导率和叶绿素含量。表3从上述表3的结果可以看出,1)叶片相对含水量:实验组1-3的番茄叶片的平均相对含水量均在82%以上,与阴性对照处理组的平均值相比高出40%以上;2)根系还原能力:实验组1-3的番茄的根系还原强度均在阴性对照处理组的1.5倍以上;3)叶片mda含量:实验组1-3的番茄的叶片mda含量,与阴性对照处理组相比,均低42%以上;4)叶片相对电导率:实验组1-3的番茄的叶片相对电导率为56.0%,与阴性对照处理组相比,低32%以上;5)叶绿素含量:实验组1-3的番茄的叶片的总叶绿素含量分别为2.38mgg-1fw,1.84mgg-1fw和1.97mgg-1fw,与阴性对照处理组相比,分别高出64%,54%和57%。综合上述结果表明,实验组1-3能通过保护细胞膜的完整性、保持根系活力和维持较高水平的叶绿素含量来提高番茄的耐旱能力。2)本申请的生物刺激剂对番茄体内酶活变化影响实验参上述第(1)部分第1段的表述,挑选取长势较为一致的番茄苗进行实验。实验组:采用上述实施例1配制获得的生物刺激剂;阴性对照组:采用清水;每个组(实验组和阴性对照组)各24颗苗,在番茄4叶期时进行移栽,移栽后每天每棵苗分别浇灌20ml样品(实验组浇灌20ml实施例1配制获得生物刺激剂,阴性对照组浇灌20ml清水),温室生长条件均为28℃,相对湿度30%,光周期16h/8h,分别在3天、5天、7天、9天、11天、13天取样,分别检测超氧化物歧化酶(sod)、过氧化物酶(pod)、过氧化氢酶(cat)活性,具体方法参考陈建勋,王晓峰主编的《植物生理学实验指导》。实验结果参见图1,从图1中的结果可以看出干旱胁迫条件下,实施例1配制获得生物刺激剂处理番茄后,超氧化物歧化酶(sod)活性相对稳定,但是处理13天之后,sod活性快速上升至128.82u·mg-1;而在对照组中,sod活性逐渐下降,在13天后急剧下降至34.93u·mg-1。检测发现实施例1配制获得生物刺激剂处理的番茄叶片中过氧化物酶(pod)活性在处理5天后达到一次高峰(38.78u·mg-1),之后在9天降至26.33u·mg-1,但在13天又快速恢复至48.71u·mg-1,而在对照组中,pod活性在第11天稍有上升(25.28u·mg-1)后就急剧下降至16.16u·mg-1。过氧化氢酶(cat)是清除过氧化氢的主要抗氧化酶,检测发现实施例1配制获得生物刺激剂处理的番茄叶片中cat活性在3天内降低到11.99u·mg-1,,之后都波动于11.99u·mg-1至17.14u·mg-1之间。在对照组中cat活性却呈波动下降趋势,并且在13天时下降至1.76u·mg-1。以上结果表明,干旱胁迫条件下实施例1配制获得生物刺激剂能提高sod活性、pod活性和cat活性以快速清除过量积累的活性氧,最终提高番茄的耐旱能力。3)本申请的生物刺激剂对番茄的防病实验结果参上述第(1)部分第1段的表述,挑选取长势较为一致的番茄苗进行实验。实验组1-3:分别采用上述实施例1-3配制获得的生物刺激剂;阴性对照组:采用清水;每个组(实验组和阴性对照组)各24颗苗,在番茄4叶期时进行移栽,移栽当天每棵苗分别浇灌20ml样品(实验组1-5分别浇灌20ml实施例1-5配制获得生物刺激剂,阴性对照组浇灌20ml清水),同时接种20ml的青枯菌(活菌浓度为1.0×107cfu/ml),温室生长条件均为28℃,相对湿度30%,光周期16h/8h。每天观察,待阴性对照组开始发病时统计发病情况。参照kempe(1983)提出的青枯病病级标准(0级:没有青枯症状;1级:1~25%的叶片出现萎蔫症状;2级:26~50%的叶片出现萎蔫症状;3级:51~75%的叶片出现萎蔫症状;4级:76~100%的叶片出现萎蔫症状。)当该阴性对照组有番茄苗表现青枯病“1级”症状时,开始统计各处理组病害的发生情况。在阴性对照组发病率在90%以上时停止统计。关于“病害严重程度”和“防治效果”的计算公式:病害严重度={∑(各级病株数×相对级数值)}/(调查总株数×最高级数);防治效果=(阴性对照组病害严重度-实验组病害严重度)/阴性对照组病害严重度;试验结果参见下表4。表4病害严重度(%)防治效果(%)实验组140.63±0.352.43±0.2实验组240.89±0.152.12±0.24实验组341.23±0.251.72±0.08阴性对照组85.41±0.12---从上述表4的针对番茄的防病实验结果显示,本发明的生物刺激剂对番茄的青枯病具有显著的防治效果(接种7天左右,对番茄青枯病的防治效果达50%以上,能显著提高番茄对于青枯菌的防病效果。4)本申请的生物刺激剂对番茄的促生实验结果参上述第(1)部分第1段的表述,挑选取长势较为一致的番茄苗进行实验。实验组1-3:分别采用上述实施例1-3配制获得的生物刺激剂;阴性对照组:采用清水;每个组(实验组和阴性对照组)各24颗苗,在番茄4叶期时进行移栽,移栽当天每棵苗分别浇灌20ml样品(实验组1-3分别浇灌20ml实施例1-3配制获得生物刺激剂,阴性对照组浇灌20ml清水),温室生长条件均为28℃,相对湿度30%,光周期16h/8h,30天后检测植物生长指标:株高、茎粗、叶绿素、地上鲜重、地下鲜重、地上干重和地下干重。结果参见下表5。表5从表5的结果可以看出,与对照组相比,实验组1-3的各项生物量(株高、茎粗、叶绿素、地上鲜重、地下鲜重、地上干重和地下干重)均有显著增加,且总生物量高出44.92%以上。因此,结果表明,本发明的生物刺激剂对于番茄的种植有促生作用。应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1