一种超低温脱除建兰花叶病毒和齿兰环斑病毒的方法与流程
本发明属于脱毒技术领域,具体地说,涉及一种超低温脱除建兰花叶病毒和齿兰环斑病毒的方法。
背景技术
目前已报道侵染蝴蝶兰的病毒有25种,其中建兰花叶病毒(cymbidiummosaicvirus,cymmv)和齿兰环斑病毒(odontoglossumringsopotvirus,orsv)发生最普遍、危害最严重。长期的无性繁殖导致蝴蝶兰体内病毒不断积累,缺乏有效防治两种病毒的侵染和传播方法使蝴蝶兰普遍感染病毒,这已成为影响蝴蝶兰种苗质量的瓶颈问题之一。世界多国包括我国各地均报道蝴蝶兰种苗感染两种病毒的情况及其普遍。建兰花叶病毒引起蝴蝶兰叶片和花瓣出现褪绿条纹或坏死斑点,抑制植物生长;齿兰环斑病毒引起蝴蝶兰植物叶片产生黄化条斑或黄绿斑驳的嵌纹、花瓣无法展开或色素不均、局部坏死。两种病毒常复合侵染,危害更甚,严重影响蝴蝶兰的生长状况,降低其市场价值。据报道,两种病毒造成的系列影响已对中国台湾省蝴蝶兰产业造成重创。国际上已经认识到这两种病毒的危害,多数国家现已推行了种苗检疫证书制度,严格规定进口蝴蝶兰不能携带这两种病毒,这导致了相当大数量的蝴蝶兰种苗出口受阻。
植株一旦感染病毒则无法根治,因此栽培无毒苗是目前生产上防治病毒的有效方式,生产脱毒苗是目前生产上防治病毒的有效方式,对蝴蝶兰产业至关重要。建兰花叶病毒和齿兰环斑病毒的脱毒研究目前均采用传统脱毒方法,其中广泛采用的方法是化学药剂结合分生组织培养。这种方法存在以下三点弊端:①化学药剂对植物具有毒害作用。研究结果表明,药剂浓度较低,处理时间较短,对植物毒害作用不大,但病毒脱除效率低;药剂浓度较高,处理时间较长,病毒脱毒效率高,但对植物产生很大的毒害作用甚至引起植物死亡。②化学药剂易引起种苗遗传变异。已有研究表明,在培养基中添加化学药剂易引起植物种苗发生遗传变异,而现实生产中又缺乏对于脱毒苗进行相关的遗传稳定性鉴定,导致脱毒存在很大风险,这对于产业来说将造成无可挽回的损失。③分生组织过小极易引起褐化。为了避免药剂对植株产生毒害,研究者常降低化学药剂的浓度,而剥取较小的分生组织。众所周知,分生组织的大小与再生率成正相关,而与脱毒率成负相关。对于蝴蝶兰而言,面临所取分生组织过小极易引起褐化的难题,分生组织小于1mm以下褐化率和死亡率均为100%。
超低温脱毒技术是在超低温保存技术上延伸出来、目前发展迅猛的一种新型脱毒技术,指将感染病原体(病毒、植原体、细菌)的材料经液氮短暂处理后脱除病原体。据国内外学者报道,超低温脱毒技术已在13种植物上有所应用,成功脱除了23种病毒、3种植原体和1种细菌。超低温脱毒技术只使用液氮作为处理手段,不使用任何化学药剂,避免了对植物的毒害问题,液氮保存作为一种常规的种质资源保存手段已被证实再生植株是遗传稳定的,而且与常规分生组织脱毒不同,超低温脱毒技术的脱毒效率与分生组织大小无关,因此不用取过小的分生组织。
目前超低温脱毒技术尚未应用于建兰花叶病毒和齿兰环斑病毒。
技术实现要素:
有鉴于此,本发明针对建兰花叶病毒和齿兰环斑病毒常用脱毒技术中剥取茎尖过小、易褐化、化学药剂对植株有毒害作用和易引起变异等弊端,以安全、有效的超低温疗法为技术核心,提供了一种脱除建兰花叶病毒和齿兰环斑病毒的方法。
为了解决上述技术问题,本发明公开了一种脱除建兰花叶病毒和齿兰环斑病毒的方法,包括以下步骤:
步骤1、以感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰组培苗为对象,在超净工作台的条件下,在体视显微镜下取1.0-1.5cm大小的茎尖;茎尖放入在预培养基进预培养;
步骤2、在室温条件下用加载液加载茎尖;
步骤3、0℃条件下用pvs2玻璃化溶液处理茎尖,处理完毕后,用移液枪吸取pvs2溶液在铝箔纸上制作小滴,再将茎尖逐个放进小滴,用镊子将携带茎尖的铝箔纸夹住,投入液氮中进行超低温处理;
步骤4、夹起超低温处理后的茎尖,放入卸载液进行卸载;处理完的茎尖放入再生培养基,暗培养7天,再转入正常光照下进行培养;3个月后,茎尖顺利成苗。
可选地,所述步骤1中的预培养基为bm培养基+0.6m蔗糖;所述的预培养的天数为1-3天,预培养为黑暗条件;蝴蝶兰组培苗的苗龄为6周。
可选地,所述步骤1中的每升所述的bm培养基包括以下组分:花宝1号3g、fe.na.edta10ml、有机物10ml、蛋白胨1.5g、蔗糖30g、琼脂7g,ph值为6.0。
可选地,所述步骤1中的fe.na.edta通过以下方法制备所得:3.67gfe.na.edta溶于1000ml蒸馏水,制备得到fe.na.edta溶液;有机物通过以下方法制备得到:将甘氨酸0.1-0.3g、硫胺素0.8-1.2g、盐酸吡哆醇0.05-0.15g、泛酸钙0.05-0.15g、肌醇8-12g混合溶解于1000ml,制备得到有机物。
可选地,所述步骤2中的加载液为bm+2m甘油+0.4m蔗糖;加载液用量为20-30ml,加载液加载茎尖的时间为20-30分钟。
可选地,所述步骤3中的pvs2玻璃化溶液为:ms+30%甘油+15%乙二醇+15%dmso+0.4m蔗糖;冰冻保护液处理茎尖的处理时间为40-50分钟;所述pvs2玻璃化溶液的用量为20-30ml。
可选地,所述步骤3中的茎尖处理温度为0℃,处理时间为60-90分钟。
可选地,所述步骤3中的超低温处理时间为25-35分钟。
可选地,所述步骤4中的卸载液为bm+1.2m蔗糖;卸载时间为25-35min。
可选地,所述步骤4中的再生培养基为bm+ga32.0mg/l。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明不需要剥取过小的茎尖,降低了操作的难度和褐化的风险。通过筛选预培养中的蔗糖浓度、预培养天数和pvs2处理时间三个关键因素,茎尖经超低温后得以成活再生。经观察,成活部位为茎尖分生组织周围的细胞。因此,不需要人为剥取过小的茎尖,液氮已起到类似‘手术刀’的作用,缩小了成活细胞的范围。
2)本发明不采用化学药剂,对植物组织没有毒害作用。本发明避开了使用病毒唑等脱除病毒的药剂,只使用超低温和组培所需试剂,后期对再生苗进行观察,再生苗生长正常,没有出现毒害现象。
3)在脱毒的同时,可进行植物的超低温保存。通过超低温疗法进行脱毒,必须先建立超低温体系,该体系可以同时应用于脱毒和保存,因此该技术也可用于蝴蝶兰的超低温保存研究。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
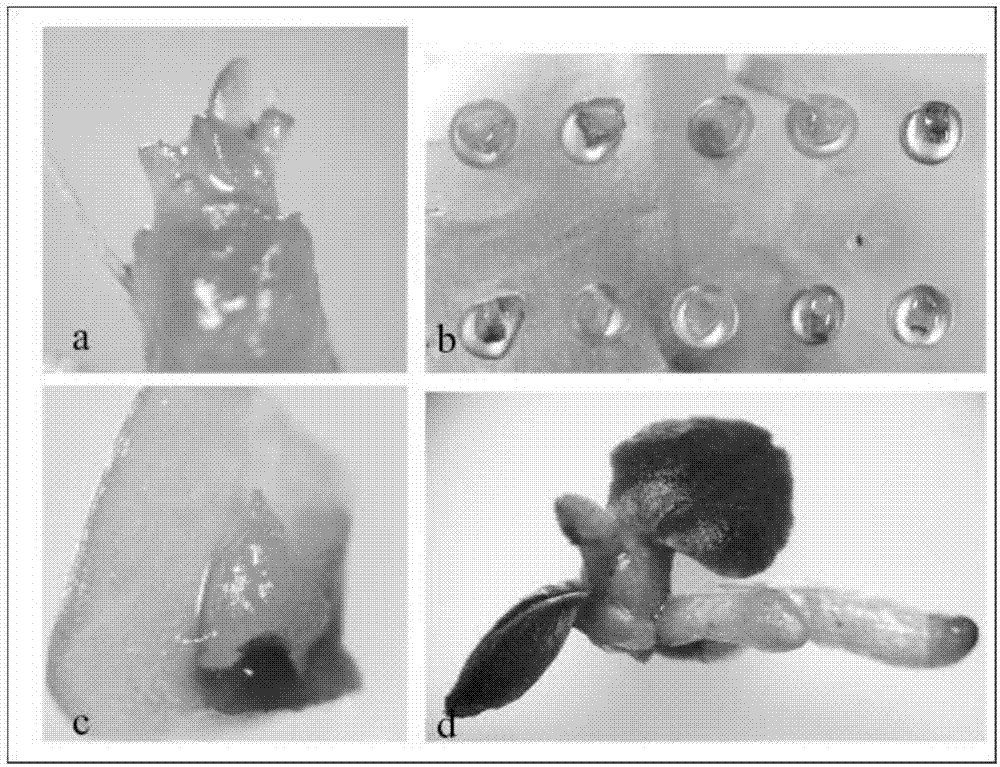
图1是本发明超低温技术脱除建兰花叶病毒和齿兰环斑病毒的过程图,其中,a为感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰茎尖(1.0-1.5mm),b为超低温过程中在铝箔条上制作小滴,每个小滴里包含一个茎尖,c为超低温过程后7天的茎尖,黑色部位死亡,绿色部位成活并生长,d为超低温处理3-4个月后,茎尖顺利萌发成苗;
图2是本发明rt-pcr对建兰花叶病毒和齿兰环斑病毒的检测情况,其中,a.未经处理的蝴蝶兰植株感染建兰花叶病毒的情况;b.超低温处理后茎尖再生植株感染建兰花叶病毒的情况;c.未经处理的蝴蝶兰植株感染齿兰环斑病毒的情况;d.超低温处理后茎尖再生植株感染齿兰环斑病毒的情况;m.marker,dl2000;p.阳性对照;n.阴性对照;1-8.检测样品数;
图3是本发明pvs2溶液处理时间对茎尖成活率的影响;
图4是本发明pvs2溶液处理时间对再生率的影响。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本发明公开了一种超低温脱除建兰花叶病毒和齿兰环斑病毒的方法,包括以下步骤:
步骤1、以感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰组培苗(苗龄:6周)为对象,在超净工作台的条件下,在体视显微镜下取1.0-1.5cm大小的茎尖;茎尖放入在预培养基(bm+0.6m蔗糖)进行1-3天预培养(黑暗条件);
其中,每升所述的bm培养基包括以下组分:花宝1号3g、fe.na.edta10ml、有机物10ml、蛋白胨1.5g、30g蔗糖、7g琼脂,ph值为6.0。
fe.na.edta通过以下方法制备所得:3.67gfe.na.edta溶于1000ml蒸馏水,制备得到100倍铁盐母液。
有机物通过以下方法制备得到:将甘氨酸0.2g、硫氨酸1g、盐酸吡哆醇0.1g、泛酸钙0.1g、肌醇10g混合溶解于1000ml蒸馏水,制备得到100倍有机物母液。
步骤2、在室温条件下用20-30ml加载液(bm+2m甘油+0.4m蔗糖)倒于直径为9cm的培养皿中,将茎尖逐个夹入加载液中处理20-30分钟;
步骤3、将4℃冰箱中保存的pvs2玻璃化溶液(ms+30%甘油+15%乙二醇+15%dmso+0.4m蔗糖)取出,取20-30ml的pvs2玻璃化溶液倒于直径为9cm的培养皿中,将茎尖逐个夹入pvs2溶液中,将培养皿放置于冰上,在0℃条件下处理茎尖60-90分钟;然后用移液枪吸取0℃的pvs2溶液,在铝箔条(2x0.8cm)上形成一个个小滴(小滴约为2.5ul),将茎尖逐个放入小滴中;用镊子将铝箔条夹住,投入液氮中进行超低温处理,时间为25-35分钟;
步骤4、夹起铝箔条,放入卸载液(bm+1.2m蔗糖)进行卸载,时间为25-35分钟;处理完的茎尖放入再生培养基(bm+ga32.0mg/l),暗培养7天,再转入正常光照下进行培养;3-4个月后,茎尖顺利成苗。
步骤5、再生植株的病毒检测:再生植株长到三片叶后,通过分子生物学方法对超低温再生苗进行建兰花叶病毒和齿兰环斑病毒的检测,阴性结果为脱除了病毒的样品,脱毒率=阴性结果的样品数/总样品数*100%;图2所示,8棵感染建兰花叶病毒(图2a)、6棵感染齿兰环斑病毒的‘黄边小飞象’植株(图2c)经过超低温疗法处理后,2棵再生植检测到建兰花叶病毒,6棵为阴性(图2b),建兰花叶病毒的脱毒率为75.0%,1棵再生植株检测到齿兰环斑病毒,5棵为阴性(图2d),齿兰环斑病毒的脱毒率为83.3%。另两个品种‘满天红’和‘钻石皇后’经超低温疗法处理后,建兰花叶病的脱毒率分别为62.5%和50.0%,齿兰环斑病毒脱毒率分别为66.7%和75%。超低温疗法对三个蝴蝶兰品种的建兰花叶病毒和齿兰环斑病毒的脱毒率分别为50.0-75.0%和66.7-83.3%。
感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰茎尖(1.0-1.5mm)如图1a所示,超低温过程中在铝箔条上制作小滴,每个小滴里包含一个茎尖如图1b所示,如图1c所示,超低温过程后7天的茎尖,黑色部位死亡,绿色部位成活并生长;如图1d所示,超低温处理3-4个月后,茎尖顺利萌发成苗。
在上述的方法中,蔗糖在预处理阶段、加载和卸载中都起到重要的作用:预处理可提高茎尖抗脱水和冷冻的能力,是超低温保存成功的关键步骤,蔗糖是预处理最常用的渗透性保护剂,茎尖在含有高浓度蔗糖的培养基上进行预培养可以有效减少细胞内自由水的含量,提高细胞抗低温胁迫的能力;加载液的处理能有效提高茎尖对玻璃化溶液的适应性,提高茎尖的成活率,蔗糖在加载液中的添加十分必要,有研究表明,加载液中如不添加蔗糖,超低温保存后的茎尖没有成活;卸载液的作用是除去在细胞内残留的玻璃化溶液,减少对茎尖的毒害,蔗糖是其中的主要成分。
甘油、乙二醇、二甲基亚砜和蔗糖是构成pvs2玻璃化溶液的主要成分,pvs2溶液在超低温保存中最常用,经pvs2溶液处理后,细胞里的自由水由液态直接转变成玻璃样无定形体,细胞粘性提高,避免冰晶形成,有效保护细胞免受冻害。
本方法关键的参数是预培养的蔗糖浓度、预培养时间、pvs2时间这三个。其取值范围分别是预培养蔗糖浓度为0.6m,预培养时间1-3天;pvs2时间为60-90分钟。在实验中,数据显示蔗糖浓度、预培养时间和pvs2的处理时间对蝴蝶兰茎尖的成活和再生具有显著的影响。预培养基中蔗糖浓度为0.6m时,茎尖的再生率为57%,显著高于蔗糖浓度为0.3m、0.8m和1.0m处理后的茎尖再生率;预培养天数1-3天时,超低温处理后茎尖的成活率(67-77%)和再生率(50-63%)没有显著差异,但显著高于预培养4天后茎尖的成活率(53%)和再生率(13%)、pvs2时间选择60-90min这两个范围的优点是能得到较高的成活率和再生率,从而获得较多的再生苗;pvs2处理时间为60-90min时,超低温处理后茎尖的成活率(73-80%)和再生率(57-63%)达到最高值,小于60min和大于90min,茎尖的成活率和再生率均显著下降。
实施例1
以感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰组培苗(苗龄:6周)为对象,在超净工作台的条件下,在体视显微镜下取1.0-1.5cm大小的茎尖;茎尖放入在预培养基(bm+0.6m蔗糖)进行2天预培养(黑暗条件);其中bm培养基(每升)成分为:花宝1号3g+fe.na.edta10ml(母液为3.67g溶于1000ml)+有机物10ml(母液为甘氨酸0.2g+硫胺素1.0g+盐酸吡哆醇0.1g+泛酸钙0.1g+肌醇10g混合溶液于1000ml)+蛋白胨1.5g;在室温条件下用加载液(bm+2m甘油+0.4m蔗糖)加载茎尖20分钟;0℃条件下用冰冻保护液(pvs2溶液)处理茎尖40-50分钟;用移液枪吸取pvs2溶液,在铝箔条(2x0.8cm)上形成一个个小滴(小滴大小约为2.5ul),将茎尖逐个放入小滴中;用镊子将铝箔条夹住,投入液氮中进行超低温处理,时间为30分钟;夹起铝箔条,放入卸载液(bm+1.2m蔗糖)进行卸载,时间为30分钟;处理完的茎尖放入再生培养基(bm+ga32.0mg/l),暗培养7天,再转入正常光照下进行培养;3个月后,茎尖顺利成苗。
实施例2
以感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰组培苗品种‘满天红’(苗龄:6周)为对象,在超净工作台的条件下,在体视显微镜下取1.5cm大小的茎尖;茎尖放入在预培养基(bm+0.6m蔗糖)进行1天预培养;其中bm培养基(每升)成分为:花宝1号3g+fe.na.edta10ml(100倍母液为3.67g溶于1000ml蒸馏水)+有机物10ml(100倍母液为甘氨酸0.2g+硫胺素1.0g+盐酸吡哆醇0.1g+泛酸钙0.1g+肌醇10g混合溶液于1000ml蒸馏水)+蛋白胨1.5g+蔗糖30g+琼脂7g,ph值为6.0;在室温条件下用加载液(bm+2m甘油+0.4m蔗糖)加载茎尖30分钟;将4℃冰箱中保存的pvs2玻璃化溶液(ms+30%甘油+15%乙二醇+15%dmso+0.4m蔗糖)取出,取20ml的pvs2溶液倒于直径为9cm的培养皿中,将茎尖逐个夹入pvs2溶液中,将培养皿放置于冰上,在0℃条件下处理茎尖90分钟;然后用移液枪吸取0℃的pvs2溶液,在铝箔条(2x0.8cm)上形成一个个小滴(小滴大小约为2.5ul),将茎尖逐个放入小滴中;用镊子夹住铝箔条,投入液氮中进行超低温处理,时间为35分钟;夹起铝箔条,放入卸载液(bm+1.2m蔗糖)进行卸载,时间为30分钟;处理完的茎尖放入再生培养基(bm+ga32.0mg/l),暗培养7天,再转入正常光照下进行培养;4个月后,茎尖顺利成苗;再生植株长到三片叶后,取叶片进行rt-pcr进行两种病毒的检测,建兰花叶病毒脱毒率为62.5%,齿兰环斑病毒脱毒率为83.3%。
实施例3
以感染建兰花叶病毒和齿兰环斑病毒的蝴蝶兰组培苗品种‘钻石皇后’(苗龄:6周)为对象,在超净工作台的条件下,在体视显微镜下取1.0cm大小的茎尖;茎尖放入在预培养基(bm+0.6m蔗糖)进行1天预培养;其中bm培养基(每升)成分为:花宝1号3g+fe.na.edta10ml(100倍母液为3.67g溶于1000ml蒸馏水)+有机物10ml(100倍母液为甘氨酸0.2g+硫胺素1.0g+盐酸吡哆醇0.1g+泛酸钙0.1g+肌醇10g混合溶液于1000ml蒸馏水)+蛋白胨1.5g+蔗糖30g+琼脂7g,ph值为6.0;在室温条件下用加载液(bm+2m甘油+0.4m蔗糖)加载茎尖25分钟;将4℃冰箱中保存的pvs2玻璃化溶液(ms+30%甘油+15%乙二醇+15%dmso+0.4m蔗糖)取出,取20ml的pvs2溶液倒于直径为9cm的培养皿中,将茎尖逐个夹入pvs2溶液中,将培养皿放置于冰上,在0℃条件下处理茎尖60分钟;然后用移液枪吸取0℃的pvs2溶液,在铝箔条(2x0.8cm)上形成一个个小滴(小滴大小约为2.5ul),将茎尖逐个放入小滴中;用镊子夹住铝箔条,投入液氮中进行超低温处理,时间为35分钟;夹起铝箔条,放入卸载液(bm+1.2m蔗糖)进行卸载,时间为30分钟;处理完的茎尖放入再生培养基(bm+ga32.0mg/l),暗培养7天,再转入正常光照下进行培养;3个月后,茎尖顺利成苗;再生植株长到三片叶后,取叶片进行rt-pcr进行两种病毒的检测,建兰花叶病毒脱毒率为50%,齿兰环斑病毒脱毒率为75%。
预处理的蔗糖浓度和预培养时间对茎尖成活率和再生率的影响见表1和表2;从表1和表2可以得出结论,蔗糖的浓度在0.6-0.8m时,茎尖经超低温疗法处理后成活率在67-77%,并无显著差异,但蔗糖浓度为0.8m时,茎尖再生率显著高于0.6m和1.0m,为57%,因此,0.8m蔗糖浓度为最佳预培养蔗糖浓度。茎尖经过1-3天的蔗糖预培养后,进行超低温疗法处理,成活率和再生率没有显著差异,但预培养到4天时,成活率和再生率均出现明显下降。
表1预培养的蔗糖浓度对茎尖成活率和再生率的影响
表2蔗糖预培养时间对茎尖成活率和再生率的影响
pvs2溶液处理时间对茎尖成活率和再生率的影响如图3和图4所示,pvs2溶液处理30-90min,茎尖成活率为67-80%,显著高于120min(成活率53%)和150min(成活率23%),茎尖再生率在pvs2溶液处理60min时达到最高,为63%,其次pvs2溶液处理90min,茎尖再生率为57%,二者无显著差异,其他处理时间的再生率均显著低于60min和90min。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!