转基因无脊椎动物阿尔茨海默病模型及其利用的制作方法
本发明涉及一种转基因无脊椎动物(transgenicinvertebrate)阿尔茨海默病模型、以及使用该模型筛选阿尔茨海默病的治疗药物的方法。
背景技术:
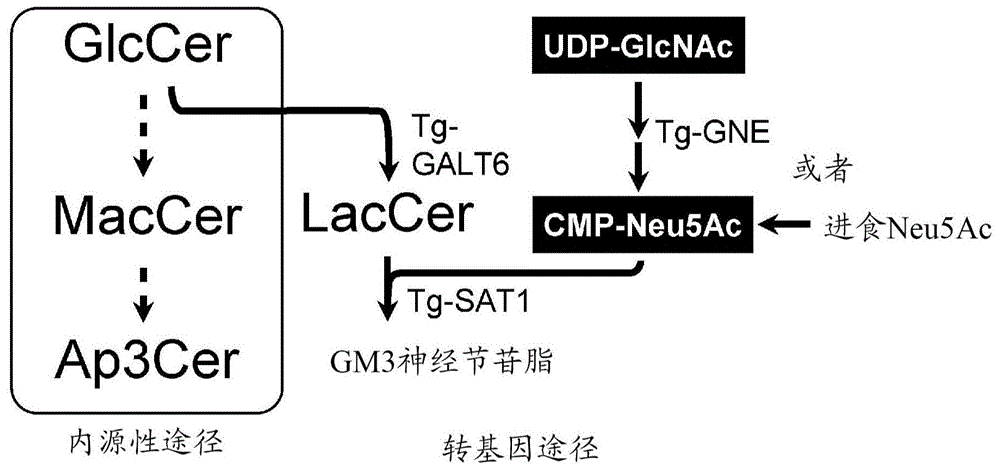
:目前,日本人口的老龄化正在以前所未有的速度发展,与此同时,以阿尔茨海默病为主的痴呆症患者的数量也在不断增加。痴呆症患者的护理在经济上也是一项沉重的负担,因此,尽早建立有效的治疗方法是当务之急。目前,作为阿尔茨海默型痴呆症的治疗在实施对症疗法,即使用胆碱酯酶抑制剂及nmda抑制剂等来暂时改善痴呆症的症状,但其效果非常有限,强烈期望建立一种抑制阿尔茨海默病的发病及发展的根治疗法。为了建立阿尔茨海默病的根治疗法,需要阐明阿尔茨海默病的发病机理。作为阿尔茨海默病患者中共同的病理特征,已知有以下三种:(1)大脑萎缩;(2)形成斑片状的淀粉样蛋白积聚物(老年斑);以及(3)神经细胞内形成纤维状的块体(神经原纤维缠结:neurofibrillarytangle(nft))。我们知道老年斑的形成是由β-淀粉样蛋白(aβ)的凝集及积聚而引起的,淀粉样蛋白假说作为特别有影响的假说得到广泛认可,即,aβ的凝集是阿尔茨海默病发病的开端。获得了aβ的凝集是从aβ键合于构成神经细胞膜的gm1神经节苷脂(gm1)并形成复合体(gm1键合型aβ:gaβ)而开始的这一认识(非专利文献1),并获得了大量支持gaβ作为“种子(seed)”促进aβ凝集这一假说的研究结果(非专利文献2、3)。为了进一步阐明阿尔茨海默病的发病机理以及开发用于阿尔茨海默病的根治疗法的治疗药物,模型动物是非常有用的。迄今为止,制作了大量的阿尔茨海默病模型小鼠并已用于研究。但是,哺乳动物中内源性的神经节苷脂的大量存在成为抑制因素,导致难以分析与阿尔茨海默病的病理学相关的aβ与神经节苷脂的相互作用。而且,测试大量的治疗药物候选化合物需要大量的小鼠,因此需要耗费大量的时间及经济成本,这成为另一个问题。另一方面,昆虫及线虫等无脊椎动物中未见神经节苷脂的内源性表达。而且,与哺乳动物相比,无脊椎动物的生命周期短、廉价且容易饲养,有利于治疗药物候选化合物的大规模筛选。但是,至今尚没有报告成功制作产生神经节苷脂的无脊椎动物的先例。现有技术文献非专利文献非专利文献1:yanagisawa,k.etal.,nat.med.,vol.1,pp.1062-1066(1995)非专利文献2:hayashi,h.etal.,j.nuerosci.,vol.24,pp.4894-4902(2004)非专利文献3:yanagisawak.,glycoconj.j.,vol.32,pp.87-91(2015)技术实现要素:发明想要解决的课题本发明是为了解决现有技术的各种问题并提供重现人大脑内的生理条件下的aβ的凝集的无脊椎动物从而完成的发明。用于解决课题的手段本发明人等进行了潜心研究,结果首次成功制作了产生神经节苷脂的转基因无脊椎动物。本发明人等发现,通过使该产生神经节苷脂的转基因无脊椎动物进一步共表达β-淀粉样蛋白,能够重现人大脑内的生理条件下aβ的凝集。即,基于一种实施方式,本发明提供了一种转基因无脊椎动物,其被导入有针对参与产生神经节苷脂的酶进行编码的基因,并且表达神经节苷脂。优选地,所述参与产生神经节苷脂的酶是β1,4-半乳糖基转移酶以及α2,3-唾液酸转移酶,所述神经节苷脂是gm3神经节苷脂。优选地,所述转基因无脊椎动物还被导入有针对参与唾液酸合成的酶进行编码的基因。优选地,所述转基因无脊椎动物还被导入有针对β-淀粉样蛋白进行编码的基因,并且共表达神经节苷脂和β-淀粉样蛋白。优选地,所述β-淀粉样蛋白是荷兰型β-淀粉样蛋白突变体。优选地,所述无脊椎动物是昆虫或线虫。优选地,所述昆虫是果蝇。另外,基于一种实施方式,本发明提供了一种阿尔茨海默病的治疗药物的筛选方法,其包括下述步骤:(1)提供共表达上述神经节苷脂和β-淀粉样蛋白的转基因无脊椎动物;(2)给药候选化合物于所述转基因无脊椎动物;以及(3)分析所述(2)步骤中给药候选化合物后的转基因无脊椎动物。发明效果本发明中的转基因无脊椎动物中不存在内源性的神经节苷脂,因此,通过表达与人大脑内相同水平的神经节苷脂及aβ,能够重现人大脑内的生理条件下aβ的凝集。另外,通过将本发明中的转基因无脊椎动物用于阿尔茨海默病的治疗药物的筛选,能够快速且廉价地对大量的候选化合物进行高通量筛选。附图说明图1是表示转基因果蝇中的gm3神经节苷脂的合成路线的图;图2是通过免疫染色确认转基因果蝇的神经组织中的galt6、sat1、gne的表达的图;图3是表示关于从(a)表达galt6及sat1的转基因果蝇(进食neu5ac(-))和(b)表达galt6及sat1的转基因果蝇(进食neu5ac(+))的大脑神经组织所提取的脂质的质谱法的结果的图;图4是表示通过蛋白质印迹法检测表达galt6、sat1及dut40的转基因果蝇(进食neu5ac(+))的大脑神经组织中的凝集aβ而得到的结果的图;图5是将图4的结果量化的图表;图6是通过蛋白质印迹法检测仅表达dut40的转基因果蝇(进食neu5ac(-)或(+))的大脑神经组织中的凝集aβ而得到的结果的图;图7是表示使用本发明的一种实施方式提供的转基因无脊椎动物来筛选阿尔茨海默病的治疗药物的方法的原理的示意图。具体实施方式下面,详细地对本发明进行说明,但本发明不限定于本说明书中所说明的实施方式。基于第一实施方式,本发明提供一种转基因无脊椎动物,其被导入有针对参与产生神经节苷脂的酶进行编码的基因,并且表达神经节苷脂的转基因无脊椎动物。作为能够在本实施方式中使用的“无脊椎动物”,实质上不表达内源性的神经节苷脂,即只要是比棘皮动物更低等的无脊椎动物则可以是任意的动物。“实质上不表达”内源性的神经节苷脂表示通过通常所进行的检测方式(例如免疫化学方法等)不能检测到内源性的神经节苷脂。作为实质上不表达内源性的神经节苷脂的无脊椎动物,例如,可列举昆虫等节肢动物、线虫等线性动物、环节动物、软体动物。作为能够在本实施方式中使用的无脊椎动物优选是昆虫或线虫(caenorhabditiselegans)。作为优选的昆虫,例如,可列举果蝇等双翅目、蚕等鳞翅目、蜜蜂等膜翅目、赤拟谷盗等鞘翅目的昆虫。作为能够在本实施方式中使用的昆虫优选是果蝇属(drosophila)的苍蝇,特别优选为黑腹果蝇(drosophilamelanogaster)“神经节苷脂”是在神经酰胺上键合有糖的糖脂的鞘糖脂的一种,其在糖链部分上包含至少一个唾液酸。神经节苷脂根据糖链部分的结构的差异而分类为神经节类、乳糖类、红细胞类等,并进一步根据糖链部分所含的唾液酸的数量进行分类。例如,作为包含一个唾液酸的神经节类神经节苷脂,可列举gm1a、gm1b、gm2、gm3等;作为包含两个唾液酸的神经节类神经节苷脂,可列举gd1a、gd1b、gd2、gd3等;作为包含三个唾液酸的神经节类神经节苷脂,可列举gt1a、gt1b、gt1c、gt2、gt3等;作为包含四个唾液酸的神经节类神经节苷脂,可列举gq1b、gq1c等;作为包含五个唾液酸的神经节类神经节苷脂,可列举gp1c等。本实施方式中的神经节苷脂优选为gm1a、gm1b、gm2、gm3等单唾液酸神经节类神经节苷脂,特别优选为gm3。“参与产生神经节苷脂的酶”中包含糖基转移酶和糖苷水解酶。作为糖基转移酶,例如,可列举半乳糖基转移酶、唾液酸转移酶、岩藻糖转移酶、n-乙酰半乳糖胺转移酶等。作为糖苷水解酶,例如,可列举半乳糖苷酶、葡萄糖苷酶、n-乙酰氨基葡萄糖苷酶等。神经节苷脂的生物合成路线已经阐明,能够根据想要表达的神经节苷脂来选择适当的酶。例如,若是gm3,则能够通过表达β1,4-半乳糖基转移酶以及α2,3-唾液酸转移酶而产生。例如,若是gm2,则能够通过表达β1,4-n-乙酰半乳糖胺转移酶而产生。例如,若是gm1a,则能够通过表达β1,3-半乳糖基转移酶2而产生。本实施方式中的参与产生神经节苷脂的酶可以是来自任意的动物物种的酶,优选为来自小鼠、大鼠、兔子、狗、非人灵长类、人等哺乳动物的酶,特别优选来自人。针对参与产生神经节苷脂的酶进行编码的基因已经被克隆,其碱基序列信息能够从规定的数据库获得。例如,关于人β1,4-半乳糖基转移酶,可以利用genbank收录号bc069620.1;关于人α2,3-唾液酸转移酶,可以利用genbank收录号nm_003896及nm_001042437;关于人β1,4-n-乙酰半乳糖胺转移酶,可以利用genbank收录号nm_153446、nm_001159387.1及nm_001159388.1;关于人β1,3-半乳糖基转移酶2,可以利用genbank收录号af288390。本实施方式中的参与产生神经节苷脂的酶能够以保持酶活性为限度包含蛋白质,其中,该蛋白质由与如上所述的数据库中所注册的氨基酸序列具有80%以上、优选90%以上、更优选约95%以上的同源性的氨基酸序列构成。氨基酸序列的同源性能够使用序列分析软件或本领域中常用的程序(fasta、blast等)来计算。另外,本实施方式中的参与产生神经节苷脂的酶能够以保持酶活性为限度包含蛋白质,其中,该蛋白质由在数据库所注册的氨基酸序列中取代、缺失、插入及/或添加1~数个氨基酸而成的氨基酸序列构成。在此,“1~数个”为例如“1~30个”,优选为“1~10个”,特别优选为“1~5个”。能够使用本领域中公知的方法来向无脊椎动物导入上述针对参与产生神经节苷脂的酶进行编码的基因。例如,能够与启动子等转录调控序列一起向质粒、病毒、转座子等公知的载体中整合入想要导入的基因序列,并将其导入目标无脊椎动物。特别是对于昆虫已经充分建立了使用转座子的转基因技术,例如,若是果蝇则能够使用本领域中充分建立的gal4-uas表达系统来制备。具体而言,通过使表达转录因子的gal4的果蝇品系与在作为gal4的目标序列的uas的下游导入了整合有针对参与产生神经节苷脂的酶进行编码的基因的载体而成的果蝇品系进行交配,能够制备表达神经节苷脂的转基因果蝇。在uas的下游导入了整合有针对参与产生神经节苷脂的酶进行编码的基因的载体而成的果蝇品系,能够通过现有公知的方法向例如puast等转化载体中整合编码目标酶的基因后将其导入果蝇的胚胎而制备。作为表达gal4的果蝇品系,可以获取并使用已经存在的品系,也可以通过现有公知的方法在启动子/增强子的下游导入整合有gal4基因的载体来制备。在本实施方式中,能够优选使用神经细胞特异性启动子/增强子,并且没有特别限定,能够使用elav、appl、r57c10等,能够优选使用elav。另外,作为神经细胞特异性表达gal4的果蝇品系,当使用已经存在的品系时,例如,能够使用作为神经细胞特异性表达gal4的品系的elavc155-gal4品系(lin,d.m.etal.,neuron,13:507-523(1994))、或者作为大脑蘑菇体的神经细胞特异性表达gal4的品系的mb247-gal4品系(schulz,ra.etal.,oncogene,12:1827-1831(1996))等。上述的果蝇品系能够从例如日本京都工艺纤维大学果蝇遗传资源中心(http://www.dgrc.kit.ac.jp/)或布卢明顿果蝇库存中心(http://flystocks.bio.indiana.edu/)等国内外的公共库存中心获得。为了使本实施方式的转基因无脊椎动物能够充分产生神经节苷脂,优选充分提供用于供应作为神经节苷脂的构成成分的唾液酸的唾液酸供体底物。唾液酸供体底物可以通过添加在饵料中供应,也可以通过向转基因无脊椎动物进一步导入编码参与唾液酸供体底物合成的酶的基因以补充唾液酸供体底物的生物合成。即,除针对参与产生神经节苷脂的酶进行编码的基因以外,本实施方式的转基因无脊椎动物可以进一步导入编码参与唾液酸供体底物合成的酶的基因。作为编码参与唾液酸供体底物合成的酶的基因,例如,可列举:人udp-n-乙酰葡萄糖胺2-表异构酶/n-乙酰甘露糖胺激酶(genbank收录号ng_008246.1)等。优选本实施方式的转基因无脊椎动物进一步导入针对β-淀粉样蛋白进行编码的基因,并且共表达神经节苷脂和β-淀粉样蛋白。β-淀粉样蛋白(下面,在本说明书中记作“aβ”)是淀粉样蛋白前体蛋白质片段(app)被β分泌酶及γ分泌酶切割而生成的肽,根据app上的切割点的差异,包含氨基酸数量不同的aβ40及aβ42等。除由ncbi的refseq数据库(http://www.ncbi.nlm.nih.gov/refseq/)中作为refseq收录号np_001129601.1、np_001129602.1、np_958817.1、np_001191231.1、np_958816.1、np_001191230.1、np_000475.1、np_001129488.1、np_001129603.1所注册的氨基酸序列构成的人app亚型以外,“app”中还包含具有在家族性阿尔茨海默病中发现的公知的突变的亚型。另外,“app”中能够以被β分泌酶及γ分泌酶切割而生成aβ的物质为限度来包含蛋白质,其中该蛋白质由与上述氨基酸序列具有80%以上、优选90%以上、更优选约95%以上的同源性的氨基酸序列构成。氨基酸序列的同源性能够使用序列分析软件或使用本领域中惯用的程序(fasta、blast等)来计算。另外,“app”中能够包含蛋白质,但以app为被β分泌酶及γ分泌酶切割而生成aβ的物质为限度,其中,该蛋白质由在上述氨基酸序列中取代、缺失、插入及/或添加1~数个氨基酸而成的氨基酸序列构成。在此,“1~数个”为例如“1~30个”,优选为“1~10个”,特别优选为“1~5个”。即,本实施方式中的aβ可以是例如野生型、荷兰型突变体(e22q)、北极型突变体(e22g)、意大利型突变体(e22k)、佛兰德型突变体(a21g)、爱荷华州型突变体(d23n)的aβ40或aβ42等,但不限定于此。本实施方式中的aβ优选为荷兰型突变体的aβ40或aβ42。本实施方式的转基因无脊椎动物能够用作分析神经节苷脂所参与的神经功能等各种生理功能的模型动物。另外,本实施方式的转基因无脊椎动物通过共表达与人大脑内相同程度的低水平的aβ而能够重现人大脑内的生理条件下aβ的凝集,因此,可以用作阿尔茨海默病的模型动物。基于第二实施方式,本发明提供一种阿尔茨海默病的治疗药物的筛选方法,其包括下述步骤:(1)提供共表达上述神经节苷脂和β-淀粉样蛋白的转基因无脊椎动物;(2)给药候选化合物于所述转基因无脊椎动物;以及(3)分析所述(2)步骤中给药候选化合物后的转基因无脊椎动物。本实施方式的筛选方法能够获得可以抑制aβ和神经节苷脂的相互作用的化合物而作为用于根治或预防阿尔茨海默病的aβ凝集抑制剂。本实施方式中的“无脊椎动物”、“神经节苷脂”及“β-淀粉样蛋白(aβ)”与第一实施方式中的定义相同。本实施方式的筛选方法使用共表达神经节苷脂和aβ的转基因无脊椎动物。本实施方式中的共表达神经节苷脂和aβ的转基因无脊椎动物能够如以上所记载的那样来制备。接着,向共表达神经节苷脂和aβ的转基因无脊椎动物给药候选化合物。作为候选化合物,可列举合成化合物、肽类化合物、核酸、抗体等,这些候选化合物可以是新型物质,也可以是公知的物质。为了给药候选化合物于转基因无脊椎动物,将各种浓度的候选化合物添加在饵料中使其摄取即可。添加在饵料中的候选化合物的浓度根据化合物的种类而不同,例如,能够在0.1~100mm的范围内适当选择。候选化合物能够在例如7~30天内给药。接着,通过分析给药候选化合物后的转基因无脊椎动物来评价候选化合物的aβ凝集抑制效果。能够通过公知的流程并使用例如抗aβ抗体进行生化或病理性分析大脑组织来检测及定量凝集aβ的积聚。另外,由于本实施方式中的转基因无脊椎动物的运动功能或学习记忆能力与凝集aβ的积聚相关地降低,因此,也可以通过测定运动功能或学习记忆能力来评价大脑组织中凝集aβ的积聚程度。运动功能或学习记忆能力的测定方法已经充分建立,能够适当地选择现有公知的方法。例如,若使用果蝇作为无脊椎动物,则运动功能的测定能够通过利用本领域中充分建立的方法即爬行测试评价负向趋地性(负趋地性)来进行,学习记忆能力的测定能够通过味觉厌恶学习来进行,味觉厌恶学习组合了味觉和电击。为了判断给药候选化合物后的转基因无脊椎动物中凝集aβ的积聚是否减少,可以同时进行未给药候选化合物后的转基因无脊椎动物的分析以进行比较,也可以与过去针对未给药候选化合物后的转基因无脊椎动物所实施的分析结果进行比较。在本实施方式的筛选方法中,当通过给药候选化合物,与未给药候选化合物后的转基因无脊椎动物相比凝集aβ的积聚量显著减少时,则能够评价该候选化合物具有作为用于根治或预防阿尔茨海默病的aβ凝集抑制剂的潜力。另一方面,当通过给药候选化合物,与未给药候选化合物后的转基因无脊椎动物相比凝集aβ的积聚量无变化或增加时,则能够评价该候选化合物不具有作为用于根治治疗或预防阿尔茨海默病的aβ凝集抑制剂的潜力。本实施方式的方法的概要示于图7。由于无脊椎动物中不存在内源性的神经节苷脂,因此能够仅在目标位点(例如神经组织)特异性产生神经节苷脂,从而能够检测与人大脑内相同程度的低水平的aβ表达时凝集aβ的积聚。因此,本实施方式的方法能够在与人大脑内的生理条件相同的条件来评价候选化合物的aβ凝集抑制效果,可以用于阿尔茨海默病的治疗药物的筛选。实施例下面例举实施例进一步对本发明进行说明。需要指出,这些说明对本发明不构成任何限定。<1.转基因果蝇的制备及饲养>通过下面的流程来制备转基因果蝇,该转基因果蝇表达作为在哺乳类动物中参与gm3神经节苷脂合成路线的酶的β1,4-半乳糖基转移酶(公式缩写:b4galt6;下面记作“galt6”)、α2,3-唾液酸转移酶(公式缩写:st3gal5;下面记作“sat1”)、以及udp-n-乙酰葡萄糖胺2-表异构酶/n-乙酰甘露糖胺激酶(公式缩写:gne)。本实施例中所制备的转基因果蝇中的gm3神经节苷脂的合成路线示于图1。在本实施例中所制备的转基因果蝇中,通过导入基因galt6(tg-galt6)由萄糖神经酰胺((glccer)来合成乳糖神经酰胺(laccer),通过导入基因sat1(tg-sat1)由laccer来合成gm3神经节苷脂。另外,通过导入基因gne(tg-gne)来合成cmp-neu5ac,该cmp-neu5ac为用于合成gm3神经节苷脂的唾液酸供体底物。以人大脑cdna文库(编码号9503、takara-bio公司制)为模板,通过使用下面引物组进行pcr扩增,从而获得人galt6、人sat1及人gne的编码序列。(i)galt6正向(forward):5′atgtctgtgctcaggcggat3′(序列号1)反向(reverse):5′cttgccacgacagccacttc3′(序列号2)(ii)sat1正向(forward):5′cattagtatgcggacgaagg3′(序列号3)反向(reverse):5′gctctcagagttagagttgc3′(序列号4)(iii)gne正向(forward):5′catggagaagaatggaaataaccga3′(序列号5)反向(reverse):5′ctagtagatcctgcgtgttg3′(序列号6)将pcr产物克隆至pcr-blunt-iitopo载体(thermofisherscientific公司制造),接着,亚克隆至puast载体(brandandperrimon,development,1993)的ecori位点。将puast载体注入yw品系的果蝇胚胎,使得到的成体进一步与w1118品系的果蝇交配,从而得到转基因果蝇uas-galt6、uas-sat1及uas-gne。另外,通过以下步骤制备表达荷兰型突变(e22q)aβ40(下面记作“dut40”)的转基因果蝇。利用pcr扩增hela细胞的cdna,从而使人aβ的编码序列与大鼠脑啡肽原a的分泌信号肽序列进行融合(finellietal.,mol.cell.neurosci.,2004)。再使用下面引物组通过pcr导入荷兰型突变(e22q)。将得到的pcr产物亚克隆至puast载体的bglii位点,与上述相同的方式得到转基因果蝇uas-dut40。(iv)dut40(下划线表示突变导入位点)正向(forward):5′gtgttctttgcacaagatgtgggttcaa3′(序列号7)反向(reverse):5′ttgaacccacatcttgtgcaaagaacac3′(序列号8)通过使上述uas品系与gal4品系杂交,制备表达上述导入基因的果蝇。作为神经细胞特异性表达gal4的果蝇品系,使用elavc155-gal4品系(从布卢明顿果蝇库存中心获得)。通过使表达上述导入基因的果蝇进一步杂交,制备表达galt6及sat1的转基因果蝇;表达galt6、sat1及gne的转基因果蝇;以及表达galt6、sat1及dut40的转基因果蝇。通过免疫染色确认到galt6、sat1及gne的表达结果示于图2。免疫染色是使用抗galt6抗体(20148-1-ap、proteintech公司制造)、抗sat1抗体(ab107534、abcam公司制造)、抗gne抗体(25079-1-ap、proteintech公司制造)并通过常规的程序进行(yamasakietal.,genescells.,2011)。由该结果确认galt6、sat1及gne得到神经组织特异性表达。在温度25℃、12小时明暗循环的环境下,使用普通虾-玉米面-蔗糖-琼脂培养基饲养所得到的果蝇。另外,当进食作为唾液酸供体底物的neu5ac时,将10mmneu5ac/150mm蔗糖溶液浸入滤纸中,每隔1天分别使其自由进食24小时,持续1~2周。<2.转基因果蝇中的gm3神经节苷脂的产生>为了确认所制备的转基因果蝇中是否产生了gm3神经节苷脂,通过液相色谱-质谱法(lc-ms)进行分析。分析针对下面的果蝇进行:(1)野生型(进食neu5ac(-))(阴性对照)、(2)仅表达galt6的转基因果蝇(进食neu5ac(-))、(3)表达galt6及sat1的转基因果蝇(进食neu5ac(-))、(4)表达galt6及sat1的转基因果蝇(进食neu5ac(+))、(5)仅表达sat1的转基因果蝇(进食neu5ac(+))、(6)表达galt6、sat1及gne的转基因果蝇(进食neu5ac(-))。针对各个转基因果蝇采集200~1000只成虫的头部,添加tbs缓冲液(50mm的tris-hcl(ph7.6)、150mm的nacl),均质化之后使其干燥。将得到的颗粒悬浮于氯仿:甲醇混合液(v/v=2:1),回收脂质提取液,再将颗粒重新悬浮于氯仿:甲醇:水混合液(v/v/v=2:1:0.8),回收脂质提取液。将回收的脂质提取液在氮气中、42℃下干燥,得到脂质提取物。将脂质提取物溶解于0.1n的naoh/甲醇,在40℃下处理2小时之后,利用0.1ml的2n乙酸进行中和,并在氮气中蒸发浓缩,通过c18bondelut300mg柱(agilenttechnologies公司制造)脱盐。然后,将脂质提取物溶解于甲醇,制得lc-ms用样品。作为lc-ms,使用液相色谱-质谱仪lcms-8050(日本岛津制作所)。结果示于图3及表1。在表达galt6及sat1的转基因果蝇中,当未进食唾液酸供体底物neu5ac时,未见产生gm3神经节苷脂(图3(a)),从而确认通过进食唾液酸供体底物neu5ac而产生了gm3神经节苷脂(图3(b))。另外,在除galt6及sat1以外还表达gne的转基因果蝇中,确认产生了gm3神经节苷脂(表1)。表1.转基因果蝇中的laccer及gm3的产生表1基因型进食neu5aclaccergm3野生型-ndndgalt6-+ndgalt6、sat1-+ndgalt6、sat1+++sat1+ndndgalt6、sat1、gne-++nd:未检测出<3.转基因果蝇中的gm3神经节苷脂依赖性aβ凝集>为了确认在共表达gm3神经节苷脂和dut40的转基因果蝇中是否可见凝集aβ依赖于gm3神经节苷脂的积聚,对于从表达galt6、sat1及dut40的转基因果蝇的大脑组织中所制备的样品进行蛋白质印迹。针对表达galt6、sat1及dut40的转基因果蝇(进食neu5ac(-))和表达galt6、sat1及dut40的转基因果蝇(进食neu5ac(+))分别采集100只以上成虫的头部,并在tbs缓冲液中均质化。将其超速离心(100000g、1小时、4℃),回收上清(tbs可溶性组分)。另一方面,将剩余的沉淀物在100%甲酸中再次均质化,通过离心除去多余成分(14000rpm、20分钟、25℃),回收上清并使其干燥(tbs不溶性组分)。aβ在未凝集的状态下被分离为tbs可溶性组分,在凝集且不溶化的状态下被分离为tbs不溶性组分。将对各组分通过laemmli缓冲液来配制得到的样品与合成aβ肽(对照)提供给4-20%tris-tricine凝胶(cosmobio公司制造),在通过sds-page进行电泳之后,转录至硝酸纤维素膜(nitrobind、msi公司制造)。然后,在psb中煮沸硝酸纤维素膜5分钟,并利用5%脱脂奶及0.1%tween20/pbs溶液进行封闭,使用抗aβ单克隆抗体(克隆82e1、免疫生物研究所制造)(1:100稀释)作为一抗,使用hrp标记山羊抗小鼠igg(cellsignaling公司制造)(1:3000稀释)作为二抗来进行蛋白质印迹。通过ecl蛋白质印迹检测系统(gehelthcarelifesciences公司制造)检测条带。通过图像分析软件(imagej、美国国立卫生研究院制造)将检测到的条带数值化,并将各组的aβ量比较并定量。结果示于图4。与由表达galt6、sat1及dut40的转基因果蝇(进食neu5ac(-))所制备的样品1及2(各3条泳道)相比,在由表达galt6、sat1及dut40的转基因果蝇(进食neu5ac(+))所制备的样品3及4(各3条泳道)中,显示出dut40的凝集增加。将图4的结果量化的图表示于图5。由该结果显示,dut40的凝集依赖于gm3神经节苷脂而显著增加。为了确认dut40的凝集不依赖于进食neu5ac,针对表达dut40的转基因果蝇(进食neu5ac(-)或(+)),与上述相同地制备样品,并进行蛋白质印迹。结果示于图6。从而确认neu5ac的进食并不影响dut40的凝集。由上面的结果表明,在共表达神经节苷脂和aβ的转基因果蝇中,能够重现凝集aβ依赖于人大脑中的神经节苷脂的积聚。序列表<110>日本国立研究开发法人国立长寿医疗研究中心(nationalcenterforgeriatricsandgerontology)<120>转基因无脊椎动物阿尔茨海默病模型及其利用(atransgenicinvertebrateanimalmodelforalzheimer'sdisease,andusethereof)<130>2967-pct<150>jp2017-099855<151>2017-05-19<160>8<170>patentinversion3.5<210>1<211>20<212>dna<213>人工序列(artificialsequence)<220><223>galt6正向引物<400>1atgtctgtgctcaggcggat20<210>2<211>20<212>dna<213>人工序列(artificialsequence)<220><223>galt6反向引物<400>2cttgccacgacagccacttc20<210>3<211>20<212>dna<213>人工序列(artificialsequence)<220><223>sat1正向引物<400>3cattagtatgcggacgaagg20<210>4<211>20<212>dna<213>人工序列(artificialsequence)<220><223>sat1反向引物<400>4gctctcagagttagagttgc20<210>5<211>25<212>dna<213>人工序列(artificialsequence)<220><223>gne正向引物<400>5catggagaagaatggaaataaccga25<210>6<211>20<212>dna<213>人工序列(artificialsequence)<220><223>gne反向引物<400>6ctagtagatcctgcgtgttg20<210>7<211>28<212>dna<213>人工序列(artificialsequence)<220><223>dut40正向引物<400>7gtgttctttgcacaagatgtgggttcaa28<210>8<211>28<212>dna<213>人工序列(artificialsequence)<220><223>dut40反向引物<400>8ttgaacccacatcttgtgcaaagaacac28当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1