一种极细链格孢PeaT1植物免疫蛋白可溶性粉剂的制备工艺的制作方法
本发明属于粉剂生产领域,具体涉及一种极细链格孢peat1植物免疫蛋白可溶性粉剂的制备工艺。
背景技术:
peat1是从极细链格孢菌(alternariatenuissma)中分离纯化得到的一种具有热稳定性的酸性蛋白,国内外尚无相关报道,peat1作为我国独创的新功能微生物蛋白,其编码基因已被克隆(genbank登录号:ch445335)(龙松华,张宁,邱德文,等.gateway(r)技术构建交链孢菌jh505cdna文库[j].微生物学报,2005,45(6):963-965;赵明治,杨秀芬,张明,等.一种促进植物根系生长的极细链格孢菌蛋白质分离、纯化和生物功能[j].中国生物防治学报,2007,23(2):170-173)。peat1能够激发烟草产生系统获得抗性(maoj,liuq,yangx,etal.purificationandexpressionofaproteinelicitorfromalternariatenuissimaandelicitor-mediateddefenceresponsesintobacco[j].annalsofappliedbiology,2010,156(3):411–420.),提高作物体内pod、sod等保护酶的活性,促进作物生长,提高产量和品质(张志刚,邱德文,官春云,等.链格孢菌蛋白激发子对棉花主要性状及相关酶变化的研究[j].棉花学报,2008,20(3):186-191)。除烟草之外,蛋白激发子peat1还能提高西红柿、水稻、棉花等作物的产量,促进拟南芥的生长(李丽,邱德文,刘峥,等.植物激活蛋白对番茄抗病性的诱导作用[j].中国生物防治学报,2005,21(4):265-268.;左斌,邱德文,罗宽.植物激活蛋白对水稻秧苗生长及相关酶活性的影响[j].科学技术与工程,2005,5(17):1260-1262.;张志刚,梅正鼎,杨晓萍,等.真菌激活蛋白对棉株主要产量性状及纤维品质性状影响的研究[c],2006)。peat1具备开发为生物农药的条件,但未对其进行大规模生产的相关研究。中国农科院植保所廊坊农药中试厂率先对其进行了农药登记,与氨基寡糖素配伍,配制成了6%寡糖•链蛋白可湿性粉剂(商品名:阿泰灵),并于2017年8月取得了农药正式登记证(登记证号:pd20171725)。
可湿性粉剂是用农药原药、惰性填料和一定量的助剂,按比例经充分混合粉碎后,达到一定粉粒细度的剂型。从形状上看,与粉剂无区别,但是由于加入了湿润剂、分散剂等助剂,加到水中后能被水湿润、分散、形成悬浮液,可喷洒施用。
可溶性粉剂是指全可溶于水的粉剂和农药。是农药的一种加工剂型。由水溶性较大的农药原药,或水溶性较差的原药附加了亲水基,与水溶性无机盐和吸附剂等混合磨细后制成。粉粒细度要求98%通过80目筛。本剂型用水稀释可迅速溶于水中并分散悬浮于水中,喷雾时不堵塞喷头。本剂型防治效果比可湿性粉剂高,使用方便,便于包装运输。
可溶性粉剂在水中可以形成真溶液,不产生沉淀或久置不沉淀。可适用高浓度液的喷施使用,用于飞机喷雾防治、滴灌使用不堵塞喷头。而可湿性粉剂悬浮性能差,使用时沉淀多,有粉尘污染,并且对于一般生产技术不过硬的厂家,润湿时间长,悬浮率差,久置产生沉淀,用于飞机喷雾和滴灌容易堵塞喷头,造成药害或者效果差,是一个将被淘汰的剂型。
技术实现要素:
本发明要解决的技术问题是提供一种极细链格孢peat1植物免疫蛋白可溶性粉剂的制备工艺,通过优化发酵工艺,对培养基配方的改良和改进提取工艺使其规模化生产成本显著降低,产品收率显著提高,并通过高压均质破碎、200目筛过滤残渣的新工艺,改变添加的填料成分制成一种新的可溶性粉剂剂型,可使产品溶解性、悬浮率及润湿性显著提高,不产生沉淀,可广泛应用于飞机喷施、滴灌等现代农业使用场景,从而使产品市场面更广。
为解决上述技术问题,本发明采用的技术方案是:一种极细链格孢peat1植物免疫蛋白可溶性粉剂的制备工艺,其特征在于,包括以下步骤,
步骤a、将菌丝接种到培养基平板上并放入恒温培养箱中培养至少72h;
步骤b、从所述培养基平板上挑取少量菌体接种到摇瓶液体培养基中进行种子发酵和振荡培养;
步骤c、将种子摇瓶接入发酵罐进行至少2级发酵;
步骤d、发酵完成后加入0.5mtrishcl缓冲液保护蛋白,然后进行破壁;
步骤e、对菌丝体细胞破壁的粗蛋白液通过200目筛网过滤,去除发酵培养基残渣、菌丝体细胞壁组织,保留粗蛋白液,然后添加载体填料助剂并干燥得到可溶性粉剂。
本发明的有益技术效果是:
1、通过优化发酵工艺和参数,对培养基配方的改良,降低了发酵原料的成本;缩短发酵时间到74h,减小了发酵污染机率和降低了发酵能耗成本并提高菌丝产量到54g/l;
2、改进了提取工艺,使产品收率显著提高:通过高压均质破碎后细胞破壁率达到95%以上,使蛋白的产率达到3.3g/l,间接使以后生产相同浓度的蛋白产品成本大幅度降低;
3、添加高压均质破碎细胞和200目筛网过滤工艺,去除了杂质。使产品的物理性状提高,水不溶物大幅减少;并保留了发酵液,保留的发酵清液里含有发酵未利用的可溶性多糖等营养物质和菌发酵的代谢产物,对产品效果也有一定提升;
4、制定了用分光光度计测定植物免疫蛋白peat1的检测方法;
5、研究出载体填料助剂的配方,制成植物免疫蛋白peat1可溶性粉剂剂型,使其产品性状比可湿性粉剂性状在溶解度、悬浮率、润湿性及水不溶物指标上有显著提高,植物免疫蛋白peat1可溶性粉剂是全新的剂型,为以后推广现代农业市场如(飞防、滴灌)创造有利条件。
下面结合附图对本发明进行详细说明。
附图说明
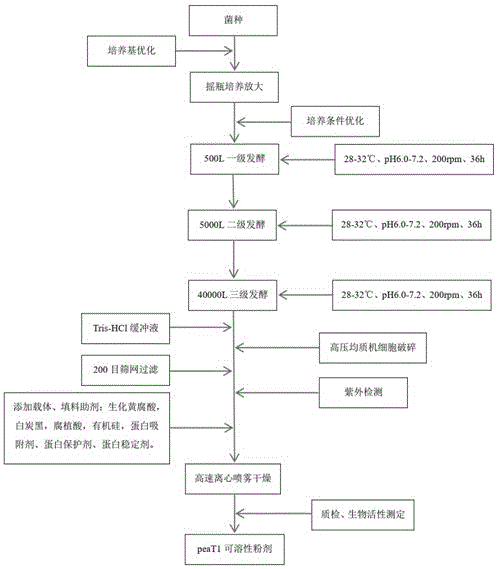
图1是本发明极细链格孢peat1植物免疫蛋白可溶性粉剂的制备工艺的流程图;
图2是peat1标准曲线;
图3是小麦根活力标准曲线;
图4是根系活力对照图。
具体实施方式
参见附图1,本发明提供了一种极细链格孢peat1植物免疫蛋白可溶性粉剂的制备工艺,包括以下步骤。
步骤a、将菌丝接种到培养基平板上并放入恒温培养箱中培养至少72h。
具体地,接种有菌丝的培养基平板在28-32℃的恒温培养箱中培养至少72h。培养基平板为土豆琼脂培养基平板,培养基的配方包括土豆200g、糖20g、水1l和琼脂粉18g。
步骤b、从上述培养基平板上挑取少量菌体接种到摇瓶液体培养基中进行种子发酵和振荡培养。
具体地,摇瓶液体培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,其余为水。振荡培养条件为在180rpm~200rpm、28-32℃的条件下振荡培养至少40h。
步骤c、将种子摇瓶接入发酵罐进行至少2级发酵。
具体地,本步骤中可以进行2级或3级发酵。
实施例一:
当进行2级发酵时,1级发酵包括以下步骤:将种子摇瓶接入500l发酵罐进行发酵,其中,培养基装液量为65%,灭菌温度121℃,30min,发酵培养温度为28-32℃,ph为6.0-7.2,发酵时间36h;2级发酵包括以下步骤:菌种经过500l发酵罐发酵后接入5000l发酵罐进行发酵,其中,培养基装液量70%,灭菌温度121℃,30min,发酵培养温度为28-32℃,ph为6.0-7.2,发酵时间为20h。
详细地,1级发酵时培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,余量为水;2级发酵时培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,余量为水。
实施例二:
当进行3级发酵时,1级发酵包括以下步骤:将种子摇瓶接入500l发酵罐进行发酵,其中,培养基装液量为65%,灭菌温度为121℃,30min,发酵培养温度为28-32℃,ph为6.0-7.2,发酵时间为36h;2级发酵包括以下步骤:菌种经过500l发酵罐发酵后接入5000l发酵罐进行发酵,其中,培养基装液量为70%,灭菌温度为121℃,30min,发酵培养温度为28-32℃,ph为6.0-7.2,发酵时间为20h;3级发酵包括以下步骤:菌种经过5000l发酵罐发酵后接入40000l发酵罐进行3级发酵,其中,培养基装液量为75%,灭菌温度为121℃,30min,发酵培养温度为28-32℃,ph为6.0-7.2,发酵时间为18h。
详细的,1级发酵时,培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,余量为水;2级发酵时,培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,余量为水;3级发酵时,培养基的配方以质量百分比计包括玉米淀粉3.0-5.5%,豆粕粉1.0-4.5%,糖0.1-1.0%,硫酸铵0.01-1.00%,蛋白质产生诱导剂0.01-1.00%,蛋白质激活剂i0.01-0.50%,蛋白质激活剂ii0.01-0.50%,余量为水。
由于真菌发酵过程中存在的发酵周期长,发酵过程容易污染等问题,通过对极细链格孢菌(alterneriatenuissima)在工厂和实验室进行了大量的发酵小试和中试实验,经过优化后的发酵培养基配方去除了价格昂贵的蛋白胨,土豆淀粉和黄豆粉;提高了培养基中几种微量元素的用量,并选用玉米淀粉和大豆粕粉,其为农副产品,大豆粕是大豆提取油料之后的剩余物,价格便宜,大规模就近购买方便,大大节约了规模化生产的原料成本和采购成本;培养基配方的优化,使发酵完成得到的菌丝体干重明显提升,达到了54g/l。通过对其发酵温度、ph、通气量、发酵罐培养基装液量的调整试验,获得了最优的发酵生产参数和工艺。大大缩短了发酵时间,使菌种进罐的发酵时间从原来的86小时缩短到现在的74小时,大大降低了工厂规模化生产的发酵成本和染菌风险。
步骤d、发酵完成后加入0.5mtrishcl缓冲液保护蛋白,然后进行破壁。
菌液加入trishcl缓冲液进入高压均质机进行菌丝体细胞破壁,均质机破碎压力80mpa,破碎1min。高压均质机利用物料在特制的柱塞作用下进入可调节压力大小的阀组中,经过特定宽度的限流缝隙后,瞬间失压的物料以极高的流速(1000-1500m/s)喷出,碰撞在碰撞阀组件之一的冲击环上,产生三种效应:空穴效应、撞击效应、剪切效应。经过这三种效应处理过后,物料粒径可均匀细化到100nm以下,细胞破壁率大于95%。peat1是极细链格孢菌(alternariatenuissima)表达的一种胞内蛋白,但其胞内蛋白的特性对提取和制剂工艺有相当的要求,通过摒弃了以前传统工艺使用胶体磨细胞破碎,选用高压均质机,相比使用胶体磨进行菌丝体研磨的细胞壁破壁率,从以前的50%左右提高到现在的95%以上,细胞破壁率提高后使得蛋白产率也得到显著提高,蛋白产率达到3.3g/l。均质后使产品的细度更细更均匀,产品的物理性状提高。此步骤大大降低了生产成本,显著提高了产品的质量和产品收率。
步骤e、对菌丝体细胞破壁的粗蛋白液通过200目筛网过滤,去除发酵培养基残渣、菌丝体细胞壁组织,保留粗蛋白液,然后添加载体填料助剂并干燥得到可溶性粉剂。
传统工艺在发酵完成后进行板框过滤,去除上清液保留菌丝体进行细胞破碎;经过改进后的工艺:在细胞破壁后进行200目筛过滤,去除菌丝体细胞壁和发酵培养基残渣,并保留了发酵清液;这些残渣的去除可使后期产品质量和物理指标得到明显提升:产品的水不溶物大幅减少、可溶性更好、杂质少、制剂悬浮性和润湿性显著提高,可使产品用于飞机喷洒使用的超细雾化喷头喷施,保障其不堵喷头,应用市场面更广;保留的发酵清液里含有发酵未利用的可溶性多糖等营养物质和菌发酵的代谢产物,对产品效果也有一定提升。
上述载体填料助剂以质量百分比计包括生化黄腐酸30-40%,白炭黑10-15%,腐植酸25-40%,有机硅3-9%,蛋白吸附剂4-9%、蛋白保护剂3-6%和蛋白稳定剂2-7%。
上述步骤中,蛋白质产生诱导剂可以是iptg、乳糖、丙酮酸等,也可以是其中的一种或几种的组合。
蛋白质激活剂i和蛋白质激活剂ii可以是钾离子、镁离子、钙离子等金属离子;溴离子、氢离子等阴离子、谷胱甘肽、乙二胺四乙酸等有机化合物,也可以是其中的一种或几种的组合。
蛋白吸附剂可以是活性炭、硅胶、离子交换树脂等,也可以是其中的一种或几种的组合。
蛋白保护剂可以是甘氨酸—盐酸缓冲液、邻苯二甲酸—盐酸缓冲液、磷酸氢二钠—柠檬酸缓冲液等,也可以是其中的一种或几种的组合。
蛋白稳定剂可以是透明质酸—海藻糖、蔗糖—甘油—氯化钠、明胶—甘油—氯化钠、edta—甘油—明胶—氯化钠等,也可以是其中的一种或几种的组合。
下面以步骤c中具有3级发酵为实施例详细介绍本发明。
步骤a、先从极细链格孢菌(alterneriatenuissima)的种管(菌种为腐烂白菜病叶筛选分离提纯)中挑取少量菌丝接种到固体土豆琼脂培养基平板上(培养基配方:土豆200g,糖20g,水1l,琼脂粉18g),在28℃的恒温培养箱中培养至少72h。
步骤b、从所述固体培养基上挑取少量菌体接种到121℃,30min灭菌的摇瓶液体培养基(培养基配方以质量百分比计:玉米淀粉3.0%,豆粕粉2%,糖0.5%,硫酸铵0.3%,蛋白质产生诱导剂(本实施例采用乳糖)0.5%,蛋白质激活剂i(本实施例采用乙二胺四乙酸)0.04%,蛋白质激活剂ii(本实施例采用谷胱甘肽)0.04%,余量为水)中进行种子发酵,在180rpm~200rpm、30℃的条件下振荡培养至少40h。
步骤c、将种子摇瓶接入发酵罐进行3级发酵。
1级发酵:种子摇瓶经过40h培养后,接入500l发酵罐进行1级发酵,(培养基配方以质量百分比计:玉米淀粉3.0%,豆粕粉2%,糖0.5%,硫酸铵0.3%,蛋白质产生诱导剂(本实施例采用乳糖)0.5%,蛋白质激活剂i(本实施例采用乙二胺四乙酸)0.04%,蛋白质激活剂ii(本实施例采用谷胱甘肽)0.04%,余量为水),培养基装液量65%,灭菌温度121℃,30min,发酵培养温度30℃±1℃,ph为6.8,发酵时间为36h。
2级发酵:菌种经过500l发酵罐发酵36h后接入5000l发酵罐进行2级发酵,(培养基配方以质量百分比计:玉米淀粉3%,豆粕粉2%,糖0.5%,硫酸铵0.3%,蛋白质产生诱导剂(本实施例采用乳糖)0.5%,蛋白质激活剂i(本实施例采用乙二胺四乙酸)0.04%,蛋白质激活剂ii(本实施例采用谷胱甘肽)0.04%,余量为水),培养基装液量70%,灭菌温度121℃,30min,发酵培养温度30℃±1℃,ph为6.8,发酵时间为20h。
3级发酵:菌种经过5000l发酵罐发酵20h后接入40000l发酵罐进行3级发酵,(培养基配方以质量百分比计:玉米淀粉3%,豆粕粉2%,糖0.5%,硫酸铵0.3%,蛋白质产生诱导剂(本实施例采用乳糖)0.5%,蛋白质激活剂i(本实施例采用乙二胺四乙酸)0.04%,蛋白质激活剂ii(本实施例采用谷胱甘肽)0.04%,余量为水),培养基装液量为75%,灭菌温度121℃,30min,发酵培养温度30℃±1℃,ph为6.8,发酵时间为18h。
步骤d、发酵完成后加入0.5mtrishcl缓冲液保护蛋白,然后进行破壁。
步骤e、对菌丝体细胞破壁的粗蛋白液通过200目筛网过滤。去除发酵培养基残渣、菌丝体细胞壁组织,保留粗蛋白液,然后添加载体填料助剂并干燥得到可溶性粉剂。
对粗蛋白液进行含量测定:利用考马斯亮蓝g-250染料在酸性溶液中与蛋白质的碱性氨基酸和芳香族氨基酸残基结合,导致游离染料的最大吸收峰由465nm变为595nm,而且此蛋白质-染料复合物在595nm下的吸光值与蛋白质浓度呈正比的特点,使用考马斯亮蓝染色法对粗蛋白液进行含量检测。
取具塞试管按下加样表加样,反应2min后在分光光度计上比色测定并记录595nm处的光密度值,并绘制标准曲线;通过计算粗蛋白液在标准曲线上的光密度值确定其浓度后用以计算添加载体和填料用量。
标准曲线绘制加样表:
批次检测结果:
测得样品在595nm波长下的吸光值平均数为0.143,通过peat1标准曲线(见附图2)计算得出反应液中蛋白含量为5.1614µg/ml;由于加入染色液后稀释倍数为6,待测溶液总体积为100ml,待测样品取样量为500mg,可计算出粗蛋白液中蛋白含量为0.62%,因此对于30t发酵液,载体和填料总质量在5t左右可以保证最终产品质量合格。
添加载体填料助剂,其以质量百分比计包括生化黄腐酸40%,白炭黑10%,腐植酸30%,有机硅5%,蛋白吸附剂(具体采用活性炭)6%、蛋白保护剂(具体采用邻苯二甲酸—盐酸缓冲液)6%和蛋白稳定剂(具体采用透明质酸—海藻糖)3%。
干燥:蛋白液加入载体和填料后进入离心式喷雾干燥器干燥,物料进口温度:180-200℃,出口温度:70-80℃。利用高速离心式雾化器使物料分散成雾状,与热空气充分接触,使其水分瞬间蒸发完成干燥,形成细度100目-200目粉状成品。
对产品进行室内生物活性测定:使用产品和清水浸种处理小麦和玉米种子,对比产品和清水对种子萌发率及根活力的影响,利用计数法测定种子萌发率;利用2,3,5-三苯基氯化四氮唑(ttc)可被氢还原成不溶性的红色三苯甲月替(ttf)的特点,如果根系具有生命力,其中的脱氢酶可以将ttc作为受氢体使之成为ttf而呈红色,而且其还原量与根系活力呈正比,使用ttc法测定根系活力。
取0.4%的ttc溶液0.2ml加入烧杯中,加少许na2s2o4粉摇匀后立即产生红色的ttf。再用乙酸乙酯定容至10ml,摇匀。然后分别取此液0.25ml、0.50ml、1.00ml、1.50ml、2.00ml置10ml容量瓶中,用乙酸乙酯定容至刻度,即得到含ttf25µg、50µg、100µg、150µg、200µg的标准比色液,以空白作参比,在485nm波长下测定吸光度,并绘制小麦根活力标准曲线(见附图3)。
批次检测结果:
测得对照组样品在485nm波长下的吸光值平均数为0.331,通过标准曲线计算得出对照组样品的根活力为0.213mg/g/h;处理组样品在485nm波长下的吸光值平均数为0.523,通过标准曲线计算得出处理组样品的根活力为0.319mg/g/h,所以可以得出处理组的根系活力比对照组提高了50%。
参见附图4,经计数法得出180颗小麦种子,对照组发芽数为156,发芽率86.7%;处理组发芽数为175,发芽率为97.2%;处理组相较于对照组的发芽增长率为12.2%。
最后应当说明的是:以上实施例仅用以说明本发明的技术方案而非对其限制;尽管参照较佳实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解:依然可以对本发明的具体实施方式进行修改或者对部分技术特征进行等同替换;而不脱离本发明技术方案的精神,其均应涵盖在本发明请求保护的技术方案范围当中。
- 还没有人留言评论。精彩留言会获得点赞!