一种药物特异质肝损伤模型及其构建方法和应用与流程
本申请涉及药物筛选领域,尤其但不限于涉及一种药物特异质肝损伤模型及其构建方法和应用。
背景技术:
药物性肝损伤是指由药物或其代谢产物导致的肝脏损伤,是药物研发失败或撤市的重要原因之一。药物肝损伤可分为固有型和特异质型,固有型肝损伤研究较为普遍,是由药物或其代谢产物的直接毒性所致,其具有可预测性及药物剂量依赖性。而特异质型药物性肝损伤(idili)的发生率极低且具有不可预测性,其与药物剂量、时间等缺乏明确的对应关系,但往往与基因多态性、免疫炎症等机体病证状态密切相关。正是由于特异质型药物性肝损伤具有偶发性且尚没有有效的评价标准,导致某些药物上市前难以发现肝损伤风险,给临床用药带来了极大的风险。由于idili的发生与机体病证状态密切相关,具有很大的个体差异性,导致现阶段还没有特别适合的idili评价模型。目前,基于idili的发生机制研究已经取得了长足进展,并已经形成了多种idili的机制假说,包括线粒体损伤假说,炎症应激损伤假说等,针对部分假说已经建立了病证模型用于idili评价,这些动物模型虽在一定程度上阐释了某些药物特异质肝损伤的病证基础和机制,但还存在评价不稳定等问题。
技术实现要素:
以下是对本文详细描述的主题的概述。本概述并非是为了限制权利要求的保护范围。
nlrp3炎症小体是由细胞内固有免疫受体蛋白nlrp3及下游的接头蛋白凋亡相关斑点样蛋白(apoptosisassociatedspecklikeprotein,asc)和半胱氨酸天冬氨酸特异蛋白酶1(cysteinylaspartatespecificproteinase,caspase-1)作为核心组成的多蛋白复合物,其活化需要两条信号通路协同完成:tlrs受体(toll-likereceptor)与脂多糖(lipopolysaccharides,lps)等配体结合,诱导nf-κb信号通路活化,从而介导nlrp3、pro-il-1β等nlrp3炎症小体表达,另外,在atp等损伤相关分子模式和病原相关分子模式作用下,nlrp3蛋白与asc形成多聚化复合体,从而诱导pro-caspase-1自我剪切活化,活化的caspase-1一方面可以诱导细胞焦亡,另一方面则可诱导pro-il-1β和pro-il-18剪切活化形成il-1β和il-18,招募免疫细胞,从而参与人类众多疾病的发生发展。现阶段,已经有大量研究发现,nlrp3炎症小体在多种免疫相关疾病中发挥重要作用,特别是有文献报道nlrp3炎症小体在阿莫地喹等药物诱导的特异质肝损伤过程中发挥了重要作用。然而,中药小分子化合物是否可以利用nlrp3炎症小体激活模型来进行毒性评价尚未见报道。近年来研究发现药物性肝损伤与机体免疫密切相关尤其是与nlrp3激活关系十分密切,在药物性肝损伤,特别是免疫特异质肝损伤中起着重要作用。调控nlrp3激活,减轻肝脏炎症反应和病理损伤程度,被认为是极具前景的药物特异质肝损伤治疗的新途径。而对nlrp3相关的药物特异质肝损伤发病机制的探讨和潜在治疗药物的筛选及评价,在很大程度上依赖于疾病相关的体内外模型的建立及应用。但至今仍缺乏稳定、可靠的动物模型可用,给药物特异质肝损伤治疗策略的拓展和新药研发造成了极大的困难。
已有的特异质肝损伤研究多基于传统毒理学评价模式,尚未以机体状态作为核心考量因素。本研究方法,基于特异质肝损伤免疫反应特点及nlrp3炎症小体在特异质肝损伤中发挥的重要作用,建立一种药物特异质肝损伤模型,并探讨其应用。本发明要解决的技术问题是提供一种用肝毒物配方诱导,适用于常规实验动物,简单易行,使nlrp3激活的动物模型,而且耗费人力财力少,实验周期短,成模率高,适用于药物特异质肝损伤发病机制的研究和特异质肝损伤药物的评价,为药物特异质肝损伤治疗策略的拓展和新药研发提供了一种稳定、可靠的动物模型。
具体地,本申请提供一种免疫特异质肝损伤的评价模型,所述评价模型包括nlrp3炎症小体以及促进nlrp3炎症小体活化的成分,其中,促进nlrp3炎症小体活化的成分为淫羊藿次苷i。
在本申请中,所述评价模型使用nlrp3炎症小体以及促进nlrp3炎症小体活化的成分进行构建。在本申请中,所述评价模型还可以使用nlrp3炎症小体以及促进nlrp3炎症小体活化的成分作为标记物进行构建。
本申请还提供所述评价模型的构建方法,所述构建方法包括:
s100.细胞水平评价;
s101.淫羊藿次苷i溶液的制备;
s102.制备小鼠原代骨髓巨噬细胞,并加入lps进行刺激;
s103.将步骤s101中制备的溶液加入小鼠原代骨髓巨噬细胞进行刺激;
s104.加入atp进行刺激;
s105.westernblot检测nlrp3炎症小体相关蛋白的表达,elisa检测细胞上清中il-1β、tnf-α的含量,以及caspase-1活性测定,并进行统计学分析。
在本申请中,所述方法还可以包括cck-8细胞毒性实验,cck-8细胞毒性实验包括:
取ibmdm和l02细胞,接种ibmdm和l02的细胞悬浮液,在培养箱中预培养,加入cck-8溶液,于培养箱内孵育,测定在450nm处的吸光度,并计算最大无毒剂量及ic50值。
在本申请中,淫羊藿次苷的最大无毒剂量可以为10μmol-20μmol,ic50为120μmol-200μmol。
在本申请中,所述构建方法包括:
s100.细胞水平评价;
s101.淫羊藿次苷i溶液的制备;
s102.制备小鼠原代骨髓巨噬细胞,并加入lps进行刺激;
s103.将步骤s101中制备的溶液加入小鼠原代骨髓巨噬细胞进行刺激;
s104.加入atp进行刺激;
s105.westernblot检测nlrp3炎症小体相关蛋白的表达,elisa检测细胞上清中il-1β、tnf-α的含量,以及caspase-1活性测定,并进行统计学分析;
s200.动物水平评价;
s201.小鼠尾静脉注射lps;
s202.腹腔注射促进nlrp3炎症小体活化的成分的溶液;
s203.测定血清中alt、asti、l-1β、tnf-α的含量,并进行tunnel染色。
在本申请中,所述淫羊藿次苷i的给药剂量可以为25mg/kg-100mg/kg,优选地50mg/kg。
在本申请中mg/kg指的是每kg动物体重的以mg计的给药量。
在本申请中,所述淫羊藿次苷i的给药时间可以为在脂多糖注射之后1小时-3小时,优选地2小时。
在本申请中,脂多糖的给药剂量可以为0.5mg/kg-3mg/kg,优选地2mg/kg。
在本申请中,在步骤s105中,nlrp3炎症小体相关蛋白可以包括il-1βp17、caspase-1p20、nlrp3、asc、pro-caspase-1以及pro-il-1β中的任一种或更多种。
本申请还提供淫羊藿次苷i在评价药物特异质肝损伤中的用途。
在本申请中,淫羊藿次苷i的给药剂量可以为25mg/kg-100mg/kg,优选地50mg/kg。
本申请还提供mcc950、脂多糖和淫羊藿次苷i的组合在评价药物特异质肝损伤中的用途。
在本申请中,mcc950的给药剂量可以为50mg/kg-80mg/kg,脂多糖的给药剂量可以为0.5mg/kg-3mg/kg,淫羊藿次苷i的给药剂量可以为25mg/kg-100mg/kg。
本发明申请提供的脂多糖/淫羊藿次苷i(lps/icarisidi)特异质肝损伤评价模型,可以从不同角度,准确灵敏地评价中药小分子化合物是否具有特异质肝损伤属性。mcc950可特异性地抑制nlrp3炎症小体活化。mcc950/lps/icarisidi针对药物特异质肝损伤筛选保肝药物的评价模型,可以从不同角度,准确灵敏地评价中药小分子化合物是否具有抑制药物特异质肝损伤的属性,为中药或中药小分子化合物肝毒性评价模型的构建、科学机制的研究、中药或组分中药的临床安全合理开发应用提供重要依据。
本申请的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本申请而了解。本申请的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
附图说明
附图用来提供对本申请技术方案的进一步理解,并且构成说明书的一部分,与本申请的实施例一起用于解释本申请的技术方案,并不构成对本申请技术方案的限制。
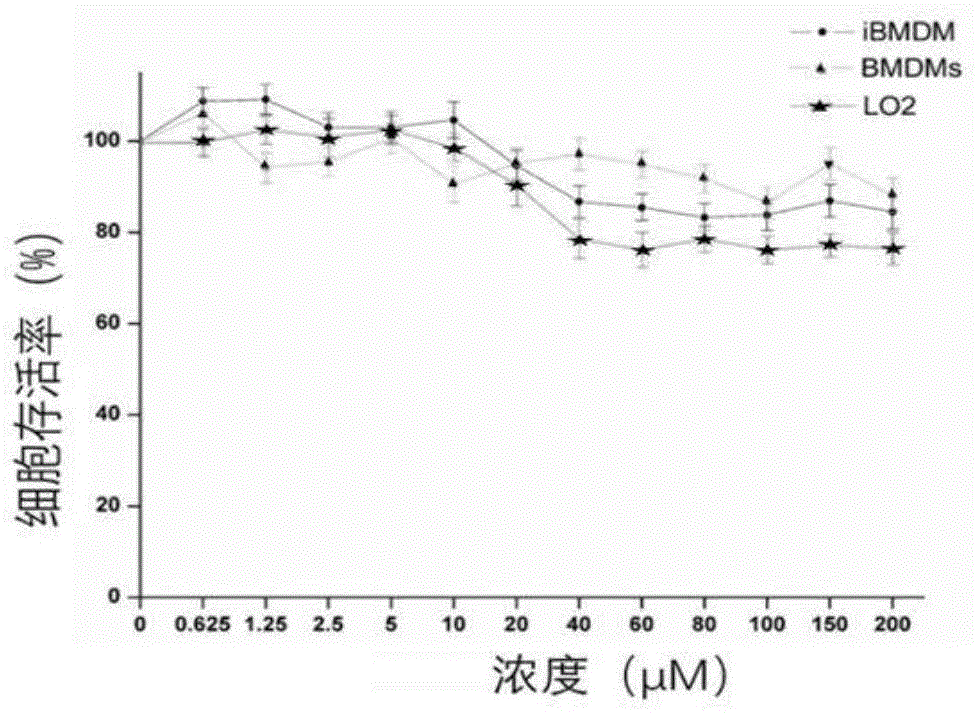
图1是淫羊藿次苷i的cck-8毒性实验。
图2示出淫羊藿次苷i在atp及尼日利亚菌素(nigericin)刺激下激活nlrp3炎症小体。
图3示出lps/淫羊藿次苷i构建特异质肝损伤模型,其中con为对照组,mod为模型组,ica指的淫羊藿次苷i。
图4示出lps/淫羊藿次苷i导致肝脏损伤,其中con为对照组,mod为模型组。
图5是基于lps/淫羊藿次苷i的特异质肝损伤模型,可筛选靶向nlrp3炎症小体的保肝模式药物(mcc950),其中con为对照组,mod为模型组,ica指的淫羊藿次苷i,mcc指的是mcc950。
图6示出mcc950缓解lps/淫羊藿次苷i所致的肝脏损伤,其中con为对照组,mod为模型组。
具体实施方式
为使本申请的目的、技术方案和优点更加清楚明白,下文中将结合附图对本申请的实施例进行详细说明。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互任意组合。
药物:
中药淫羊藿单体成分(淫羊藿次苷i)购自targetmol公司,制成10mmol/l的储存浓度,溶于dmso,储存于-20℃,备用。最终给药浓度:10μmol/l,由opti-mem培养基稀释所得。
动物实验所需淫羊藿次苷i,购自成都普非德生物技术有限公司,临用前用含10%吐温80的pbs缓冲液溶解,分别配成25、50、100mg/kg。
动物实验所需lps:购自美国sigmaaldrich公司,临用前用pbs缓冲液配置成2mg/kg。
试剂、材料:
dmem培养基、胎牛血清(美国hyclone公司);opti-mem无血清培养基(美国gibco公司);胰蛋白酶、双抗(青霉素-链霉素溶液)(迈晨科技北京有限公司);三磷酸腺苷(atp)、尼日利亚菌素(nigericin)、脂多糖(lps)、二甲基亚砜(dmso)(美国sigmaaldrich公司);mcc950购自targetmol公司;nlrp3、asc、caspase-1、pro-caspase-1、pro-il1β、gapdh抗体(美国cellsignalingtechnology公司);cck-8试剂盒(mce);caspase-1活性测定试剂盒(美国promega公司);tnf-α、il-1βelisa检测试剂盒(北京达科为生物技术有限公司);5×sds蛋白电泳上样缓冲液、pm2510三色预染蛋白marker(北京鼎国昌胜生物技术有限公司);电泳液、转印液、10×tbst缓冲液、考马斯亮蓝(北京博迈德基因技术有限公司);甲醇、乙酸(北京化工厂);ripa裂解液(上海碧云天生物技术有限公司);a、b显影液、pvdf膜(美国millipore公司)。
仪器:
二氧化碳培养箱(美国thermoscientific公司);酶标仪(美国promega公司);低温高速离心机(美国sigma公司);电泳槽、转印槽、凝胶电泳分析系统(美国bio-rad公司);细胞培养板振荡仪(德国ika公司)。
产品制备实施例:
1.淫羊藿次苷i激活nlrp3炎症小体情况
1.1淫羊藿次苷i用dmso溶解成10mm。-20℃储存,备用;
1.2小鼠原代骨髓巨噬细胞(bmdms)的制备:取10周龄c57bl/6雌性小鼠,分离肱骨和股骨,用dmem培养基(10%胎牛血清、)反复抽取骨髓细胞并按1∶4000加入小鼠集落刺激因子(mcsf)分化5天后,消化细胞并按9×105/ml种板(24孔板,0.5ml/well),过夜贴壁后进行下一步实验。
1.3lps刺激:采取换液的方式,以50ng/ml的浓度(0.4ml/well)加入到bmdms并刺激4h。
1.4给药:将淫羊藿次苷i用opti-mem培养基稀释成10μm,吸走lps,以换液的方式加入到bmdms(0.4ml/well),刺激1h。
1.5nlrp3刺激因子刺激:采取补液的方式,分别加入终浓度为5mmatp(0.02ml/well)刺激1h,10μm的nigericin(0.02ml/well)刺激0.5h。
1.6收样:细胞收样,直接加入1×ripaloading裂解(120μl/孔),迅速晃匀,使loading覆盖所有细胞,5mins后再如此,反复3次,将loading吸入ep管中。细胞上清样品处理:室温4000rpm离心5mins,收上清,加入1/4体积三氯乙酸(tca),4℃静置1h以上后,4℃,12000rpm离心15mins;弃上清,加入冰丙酮(500μl/孔)上下颠倒混匀,4℃,12000rmp离心15mins,弃上清,95℃金属浴挥干丙酮,待丙酮挥发后加1×ripaloading35μl振荡混匀,水浴煮沸,冷却后作为上清样品。
1.7westernblot:检测上清中il-1βp17、caspase-1p20蛋白表达水平,检测细胞裂解液中nlrp3、asc、pro-caspase-1,pro-il-1β蛋白水平。细胞上清蛋白样品采用12%浓度的sds-聚丙烯酰胺凝胶电泳,细胞裂解液样品采用10%浓度的sds-聚丙烯酰胺凝胶电泳,接通电源,设定恒定电压80v,45mins后电压改为135v,溴酚蓝到达分离胶底部时,结束电泳,安装转印装置。细胞上清结束电泳后,沿maker60kd位置裁胶,60kd以上采用考马斯亮蓝染色30mins,脱色液(水∶甲醇∶乙酸=5∶4∶1),至背景蓝色脱透明;转移槽的阴极铺4层滤纸,将60kd以下剩余凝胶平铺于滤纸上,并在胶上铺pvdf膜,将5层滤纸铺在膜的上方。接通电源,设定恒定电流,450ma,3h。转膜后,5%脱脂奶室温封闭1h,不同一抗(1∶1000)溶液4℃孵育过夜,pvdf膜经1%tbs-t溶液间隔5mins洗膜3次,再与相应标记的二抗(1∶5000)溶液进行反应1h,弃二抗,用1%tbs-t溶液间隔5mins洗膜3次,将显影液a和b两种试剂等体积混合后,立即加到膜上,暗室采用x光胶片压片曝光方式显影。
1.8caspase-1活性测定:按照caspase-1活性测定试剂盒说明书进行操作。先室温平衡
1.9elisa检测:测定细胞上清液中il-1β、tnf-α的含量,操作步骤按说明书进行。在450nm波长读取od值,根据标准曲线计算样品浓度。
1.10统计学方法:数据采用graphpadprism6.0(graphpad,sandiego,ca)统计软件进行处理,组间差异分析选用one-wayanova方法进行。p<0.05被认为存在统计学差异。
2.淫羊藿次苷icck-8细胞毒性实验
取培养至的80~90%丰度的ibmdm和l02细胞,于96孔板中接种细胞悬液(100μl/孔),密度2.5×105cells/ml。ibmdm和l02细胞分为正常组、0.1%dmso组、不同浓度的给药组,每组设3个复孔,将培养板放在培养箱中预培养24h,向每孔加入10μl的cck-8溶液,培养板置于培养箱内孵育15min后,用酶标仪测定在450nm处的吸光度,根据吸光度值计算单体成分的最大无毒剂量及ic50值。
3.基于lps模型,明确lps/icarisidi可导致严重的特异质肝脏损伤
3.1利用c57bl/6雌性小鼠确定lps给药时间
3.1.16-8周c57bl/6雌性小鼠尾静脉注射lps(2mg/kg)
3.1.21h、2h、3h后腹腔注射淫羊藿次苷i(50mg/kg)
3.1.36h后小鼠眼眶取血,3500rpm/min离心,测血清中alt、ast的含量。
3.2lps联合淫羊藿次苷i导致肝损伤的lps给药剂量确定
3.2.16-8周c57bl/6雌性小鼠尾静脉注射lps(0.5mg/kg、1mg/kg、2mg/kg、3mg/kg)
3.2.22h后腹腔注射淫羊藿次苷i(50mg/kg)
3.2.36h后小鼠眼眶取血,3500rpm/min离心,测血清中alt、ast的含量。
3.3基于lps模型评价淫羊藿次苷i致特异质肝损伤的客观属性
3.3.16-8周c57bl/6雌性小鼠尾静脉注射lps(2mg/kg)
3.3.22h后腹腔注射淫羊藿次苷i(25、50、100mg/kg)
3.3.36h后,小鼠眼眶取血,3500rpm/min离心,测血清中il-1β、tnf-α、alt、ast的含量;解剖小鼠,肝大叶放入5%福尔马林,he染色检测肝细胞损伤,tunnel染色检测肝细胞凋亡。
3.4mcc950可作为一种靶向nlrp3炎症小体的保肝模式药物。
3.4.16-8周c57bl/6雌性小鼠腹腔注射mcc950(50mg/kg);
3.4.22h后尾静脉注射lps(2mg/kg);
3.4.32h后腹腔注射淫羊藿次苷i(50mg/kg);
3.4.56h后,小鼠眼眶取血,3500rpm/min离心,测血清中il-1β、tnf-α、alt、ast的含量;解剖小鼠,肝大叶放入5%福尔马林,he染色检测肝细胞损伤,tunnel染色检测肝细胞凋亡。
结果
1.淫羊藿次苷icck-8毒性实验
从cck-8实验结果中可以看出,在l02细胞、ibmdms、bmdm细胞中,ic50值都大于120μmol/l。因此,在下一步探讨淫羊藿次苷i对nlrp3炎症小体激活作用时,在无毒剂量下,即浓度为40μmol/l以下时进行实验。2.基于bmdms细胞,淫羊藿次苷i在lps和atp、lps和nigericin共同刺激下,研究其对nlrp3炎症小体的激活情况
选择淫羊藿次苷i以下浓度研究其对nlrp3炎症小的激活情况:5、10、20、40μmol/l。先用lps(50ng/ml)处理细胞4h,然后将培养基换成无血清opti-mem配制而成的不同浓度的淫羊藿次苷i,处理1h,进而补加atp(5mm)或nigericin(10μm),1h后收取细胞上清及裂解液进行相关指标检测。从图2可以看出在lps及atp(nigericin)共同刺激作用下,westernblot结果显示bmdms细胞上清中,caspase-1p20及il-1βp17的蛋白表达量随着淫羊藿次苷i浓度的增加而梯度递增;caspase-1活性测定结果表明bmdms细胞上清中caspase-1的量随着淫羊藿次苷i浓度增加呈剂量依赖性增加;elisa结果表明细胞上清中il-1β的含量随着淫羊藿次苷i浓度增加呈剂量依赖性增加,而对非nlrp3炎症小体依赖的tnf-α的含量无影响。以上研究结果表明,淫羊藿次苷i在lps和atp(nigericin)刺激下,caspase-1进一步剪切活化,进而促进nlrp3炎症小体激活,导致炎症因子il-1β大量增加,从而导致更加严重的免疫炎症反应,加重特异质肝损伤。
3.基于lps模型评价淫羊藿次苷i致特异质肝损伤的客观属性
6-8周龄雌性c57bl/6小鼠经lps(2mg/kg)尾静脉注射2h后,给予不同浓度的淫羊藿次苷i(25、50、100mg/kg)处理6h,眼眶取血,3500rpm/min离心,测血清中tnf-α、alt、ast的含量;小鼠肝大叶放入10%中性福尔马林固定液,he染色检测肝细胞损伤,tunnel染色检测肝细胞凋亡。实验结果显示,与对照组相比,lps组血清tnf-α显著升高。而单独给药组(25、50、100mg/kg)与对照组相比tnf-α、alt、ast的含量无显著性差异,提示淫羊藿次苷i并不能直接导致肝脏损伤。而与lps组相比,lps+给药组(25、50、100mg/kg)血清alt、ast、tnf-α显著升高,提示在lps诱导的特异质肝损伤模型中,淫羊藿次苷i会导致肝脏损伤,且损伤程度与炎症因子tnf-α密切相关,表明lps/icarisidi确实可导致特异质肝损伤。
4.mcc950可作为一种靶向nlrp3炎症小体的保肝模式药物。
6-8周龄雌性c57bl/6小鼠腹腔注射mcc950(50mg/kg),2h后,经lps(2mg/kg)尾静脉注射,2h后,给予淫羊藿次苷i(i)(50mg/kg)处理6h,眼眶取血,3500rpm/min离心,测血清中il1β、tnf-α、alt、ast的含量;小鼠肝大叶放入10%中性福尔马林固定液,he染色检测肝细胞损伤,tunnel染色检测肝细胞凋亡。实验结果显示,与对照组相比,lps组血清il1β、tnf-α显著升高。而单独给药组(50mg/kg)与对照组相比无显著性差异,提示淫羊藿次苷i、mcc950并不能直接导致肝脏损伤。与lps组相比,lps+mcc950(lm)、lps+mcc950+淫羊藿次苷i(lim),血清中il1β、tnf-α、alt、ast的含量并未明显变化,提示mcc950很好的模拟了nlrp3-/-敲除状态,在此基础上给予淫羊藿次苷i并不能导致肝脏损伤。而与lps组相比,lps+淫羊藿次苷i(li),血清中il1β、tnf-α、alt、ast的含量显著增加,本实验表明,lps/icarisidi可导致免疫特异质肝损伤,而对于依赖激活nlrp3的特异质肝损伤药物,mcc950又具有效果显著的保肝作用。
虽然本申请所揭露的实施方式如上,但所述的内容仅为便于理解本申请而采用的实施方式,并非用以限定本申请。任何本申请所属领域内的技术人员,在不脱离本申请所揭露的精神和范围的前提下,可以在实施的形式及细节上进行任何的修改与变化,但本申请的专利保护范围,仍须以所附的权利要求书所界定的范围为准。
- 还没有人留言评论。精彩留言会获得点赞!