一种Nrf2基因缺失斑马鱼突变体的制备及其应用的制作方法
本发明涉及生物技术技术领域,更具体地,涉及一种nrf2基因缺失斑马鱼突变体的制备及其应用。
背景技术:
拟除虫菊酯类农药是模拟天然除虫菊素由人工合成的一类杀虫剂,有效成分是天然菊素。主要用于防治农业害虫。拟除虫菊酯类农药的大量使用,也会使多种害虫产生抗药性,而带来严重的环境污染的同时严重的危害了人类和其他动物的安全。随着拟除虫菊酯类农药在农业上广泛的使用,随着水体的循环,不可避免的在湖泊河流中广泛存在并积累。虽然拟除虫菊酯类农药对哺乳动物毒性较低,但是有数据显示对水体动物的毒性是哺乳动物的1000多倍,因此拟除虫菊酯类农药水体内的生物造成了严重的毒害作用,但是目前尚无一种灵敏的检测水体内的拟除虫菊酯类农药的生物学手段。
crispr/cas系统具有编辑dna的功能,是近年来得到快速发展的一项用于基因编辑的工具,有着比传统基因编辑技术zfns(zinc-fingernucleases)和talens(transcriptionactivator-likeeffectors)更便利,应用更广的优点。ⅱ型crispr/cas系统(thetypeⅱclusteredregularlyinterspacedshortpalindromicrepeatssystem/crispr-associated)来自于streptococcuspyogenes,是属于原核生物适应性免疫的一部分,保护细菌和古生菌避免入侵性病毒和质粒的伤害。cas9是ⅱ型crispr/cas系统的一部分,能够在grna的引导下对外源性dna进行剪切(congetal2013)。在斑马鱼胚胎中,使用cas9/grnasystem可有效的进行特异性位点的切割,导致非同源末端连接介导的插入或缺失,或通过hdr机制在基因组中引入一小段外源dna。本实验参考jing-weixiong等的方法,在斑马鱼胚胎中进行基因的敲除(changetal2013)。
转录因子nuclearfactorerythroid2(nf-e2)-relatedfactor2(nrf2)是一个氧化还原反应的关键调控因子,同时还与药物/异生物质代谢、dna修复、线粒体功能以及多种物质代谢包括铁、脂质和碳水化合物代谢相关,此外,还参与到蛋白稳态和增殖活动中,总体而言,nrf2可能对细胞存活有重要作用。在斑马鱼中,nrf2由5个外显子编码。
斑马鱼作为一种典型的模型生物,具有个体小,生长周期短,繁殖快等优点。斑马鱼在性成熟后可长至3到4厘米,和其它鱼类相比,个体较小,适合在实验室条件下进行饲养。而且在实验室条件下,斑马鱼的繁殖已经非常成熟可控以及便利,一尾性成熟的雌性斑马鱼一次能产数百颗卵,而且产卵频率为一周一次,在获取实验材料上非常便捷。另,斑马鱼的基因组测序早已完成,遗传背景清晰,在进行基因编辑上有很大的便利和优势。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供一种nrf2基因缺失斑马鱼突变体的制备及其应用。
本发明的第一个目的是提供nrf2基因缺失的斑马鱼在监测水体拟除虫菊脂农药污染和/或拟除虫菊脂农药毒理研究中的应用。
本发明的第二个目的是提供一个用于构建nrf2基因缺失的斑马鱼的靶位点。
本发明的第三个目的是提供所述靶位点在构建nrf2基因缺失的斑马鱼中的应用。
本发明的第四个目的是提供一种拟除虫菊脂敏感型斑马鱼的制备方法。
本发明的第五个目的是提供所述的带有nrf2靶点序列的grna在构建nrf2基因缺失的斑马鱼中的应用。
本发明的第六个目的是提供nrf2基因作为敲除的靶点在构建拟除虫菊脂敏感型斑马鱼和/或拟除虫菊脂农药毒理研究中的应用。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
设计nrf2特异性的靶点序列,接入grnascaffold中,并通过体外转录得到相应的nrf2-grna;通过体外转录得到cas9mrna;将nrf2-grna和cas9mrna混合为注射敲除体系并显微注射到斑马鱼的一细胞期受精卵中;将注射处理的胚胎养育至性成熟(f0代成鱼)后,剪取斑马鱼的尾鳍并提取dna,筛选有突变的个体,并与野生型斑马鱼交配产生f1代;f1养育至性成熟后,再次通过剪去取尾鳍,提取dna并且克隆nrf2片段测序,筛选出突变的个体并确定突变的类型,共筛选出4种类型;比较不同的突变类型,从中选取可能有效的突变型,将拥有相同突变型的f1代的雌性和雄性进行交配得到f2代的胚胎;从f2代中筛选出nrf2缺失的纯合体。结果显示,nrf2缺失的纯合体对水体拟除虫菊酯类农药残留更为敏感,可以用于水体的拟除虫菊酯类农药的检测或监测。
因此本发明要求保护nrf2基因缺失的斑马鱼在监测水体拟除虫菊脂农药污染和/或拟除虫菊脂农药毒理研究中的应用。
进一步要求保护一个用于构建nrf2基因缺失的斑马鱼的小鼠的靶位点,其核苷酸序列如seqidno:1所示。
以及,所述靶位点在构建nrf2基因缺失的斑马鱼中的应用。
一种拟除虫菊脂敏感型斑马鱼的制备方法,敲除或降低nrf2基因的表达。
优选地,利用crispr/cas9技术和所述靶位点,进行nrf2基因敲除。
更优选地,包括以下步骤:
s1.以所述的靶点为靶点,得到结构为t7启动子-靶点序列-grnascaffold的dna片段,其核苷酸序列如seqidno:2所示,通过体外转录的方式得到带有nrf2靶点序列的grna;
s2.通过体外转录得到cas9mrna
s3.将带有nrf2靶点序列的grna和cas9mrna等体积混合,显微注射到斑马鱼的一细胞期的受精卵中;
s4.受精卵培养至成鱼,得到f0代斑马鱼,鉴定f0代nrf2基因缺失的斑马鱼;
s5.将得到的f0代nrf2基因缺失的斑马鱼与野生型斑马鱼交配的得到f1代斑马鱼,并鉴定f1代nrf2基因缺失的斑马鱼;
s6.将得到的f1代nrf2基因缺失的斑马鱼自交得到f2代斑马鱼,并鉴定纯合的f2代nrf2基因缺失的斑马鱼。
优选地,步骤s1中,得到结构为t7启动子-靶点序列-grnascaffold的dna片段的具体方法为:以seqidno:5~6所示引物,对grnascaffold进行扩增,得到核苷酸序列如seqidno:2所示dna片段。
优选地,所述带有nrf2靶点序列的grna其核苷酸序列如seqidno:2所示。
更优选地,步骤s3中,带有nrf2靶点序列的grna的浓度为100ng/μl。
更优选地,步骤s3中,cas9mrna的浓度为300ng/μl。
优选的,使用核苷酸序列如seqidno:3~4所示引物进行nrf2基因缺失的斑马鱼的鉴定。
以上任一所述制备方法制备得到的斑马鱼在监测水体拟除虫菊脂农药污染的应用。
所述的带有nrf2靶点序列的grna在构建nrf2基因缺失的斑马鱼中的应用。
同时还要求保护nrf2基因作为敲除的靶点在构建拟除虫菊脂敏感型斑马鱼和/或拟除虫菊脂农药毒理研究中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明利用nrf2基因,成功构建了一种nrf2基因缺失的斑马鱼,nrf2基因缺失的斑马鱼对于除虫菊脂高度敏感,可以作为用于监测水体拟除虫菊脂农药污染,以及拟除虫菊脂农药毒理研究。本发明构建的nrf2基因缺失的斑马鱼具有很好的应用前景,值得大力推广。
附图说明
图1为nrf2基因靶点2grna琼脂糖凝胶电泳图。
图2为cas9mrna琼脂糖凝胶电泳图。
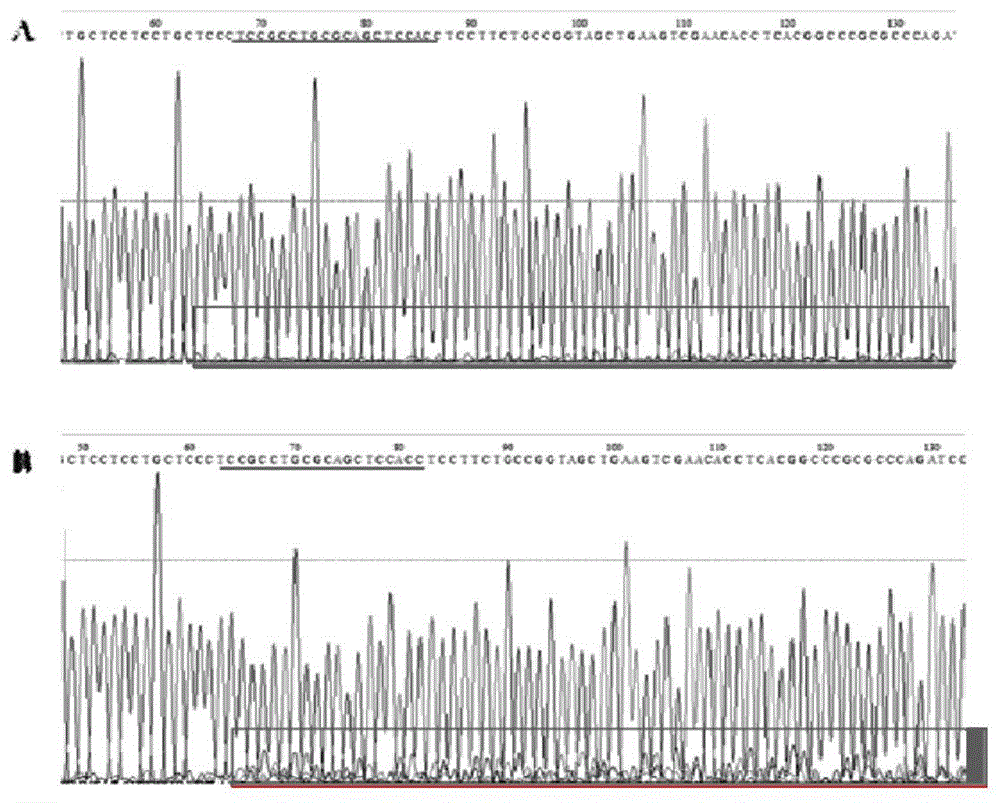
图3为nrf2基因的测序峰图;a是野生型tu系斑马鱼的nrf2基因片段测序峰图;b是注射了cas9/nrf2-grna敲除体系的斑马鱼的nrf2基因片段测序峰图。
图4为nrf2敲除个体中筛选得到的不同类型突变,其中a为筛选得到的突变类型,b为野生型和nrf2基因敲除斑马鱼的nrf2基因序列比对。
图5为nrf2的核苷酸序列及氨基酸序列,灰底标注为突变位点,黑框标注为nrf2的neh2domain,*表示终止密码子。
图6为nrf2突变后序列,红字表示和原序列不同的片段,*表示终止密码子。
图7为不同浓度fen处理对野生型和敲除型斑马鱼胚胎死亡率孵化率的影响。
图8为fen处理对斑马鱼胚胎形态发育的影响。
图9为fen暴露对斑马鱼幼鱼氧化应激指标的影响。a是sod活性结果。b是mda含量变化结果。c是cat活性结果。
图10为fen暴露对野生型和nrf2基因敲除型斑马鱼幼鱼氧化应激相关基因表达水平的影响。
图11为fen暴露对野生型和nrf2基因敲除型斑马鱼幼鱼细胞凋亡相关基因表达水平的影响。
图12为fen暴露96小时后野生型和nrf2基因敲除型斑马鱼的lc3蛋白表达量。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1cas9mrna和grna合成
一、crispr/cas9基因敲除靶点设计
1、实验方法
在ncbi网站(https://www.ncbi.nlm.nih.gov/)上查找斑马鱼nrf2基因的基因组dna序列。根据crispr/cas9的设计原理,设计针对斑马鱼nrf2基因的靶点序列。所设计的nrf2基因靶点序列为ggtggagctgcgcaggcgga(核苷酸序列如seqidno:1所示)。
设计扩增nrf2基因靶点的pcr引物,引物序列为:tggcggcaggatgtggatct(核苷酸序列如seqidno:3所示)和ggcaggaactctccggtct(核苷酸序列如seqidno:4所示),从斑马鱼基因组dna中通过pcr扩增获得nrf2基因的部分片段,确定靶点序列的正确性。
2、实验结果
利用核苷酸序列如seqidno:3~4所示扩增nrf2基因靶点的pcr引物对nrf2基因靶点进行扩增并测序,测序结果与ncbi上提供的序列抑制,所设靶点序列正确。
二、nrf2-grna合成
1、实验方法
设计grnascaffold的上下游引物,
上游引物:taatacgactcactataggtggagctgcgcaggcggattttagagctagaaatagc(核苷酸序列如seqidno:5所示)
下游引物:agcaccgactcggtgccact(核苷酸序列如seqidno:6所示)。
使用核苷酸序列如seqidno:5~6所示引物,通过pcr扩增从插入了grnascaffold的pmd19-tvector获得带有nrf2敲除靶点的grnascaffold,其序列为:
taatacgactcactataggtggagctgcgcaggcggattttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct(核苷酸序列如seqidno:2所示),
并利用体外转录试剂盒转录得到nrf2-grna。
2、实验结果
如图1所示,用体外转录试剂盒转录得到nrf2-grna。
三、cas9mrna合成
1、实验方法
使用限制性内切酶xbaⅰ对pxt7-cas9vector进行酶切,得到线性化质粒。使用体外转录试剂盒,以线性化的pxt7-cas9vector为模板合成cas9mrna(图1)。
2、实验结果
以线性化的pxt7-cas9vector为模板合成cas9mrna,如图2所示。
实施例2斑马鱼胚胎的显微注射和nrf2基因敲除体系的有效性验证
一、实验方法
将实施例1制备得到的nrf2-grna(100ng/μl)和cas9mrna(300ng/μl)等体积混合,配制为注射体系,获取斑马鱼一细胞期(又称单细胞期,即受精后未开始分裂的受精卵,此处用了罗马数字表示)的受精卵,进行显微注射。注射3天后,挑取部分正常发育的胚胎,提取基因组dna,并以此为模板,使用引物核苷酸序列如seqidno:3~4所示扩增nrf2基因片段。
反应条件为94℃3min;94℃15s,56℃15s,72℃20s,35个循环;72℃5min;4℃∞。将pcr所得产物送测序公司进行测序,根据测序峰图判断敲除的有效性。
二、实验结果
图3为注射敲除体系的斑马鱼nrf2基因的测序图与野生型斑马鱼的比较。结果显示:注射了敲除体系的斑马鱼的nrf2基因片段的测序图中呈现出重叠峰,说明当中的nrf2片段有不同的类型,从而验证了该敲除体系能对斑马鱼的nrf2基因进行编辑。
实施例3nrf2基因敲除斑马鱼的制备
一、nrf2基因敲除斑马鱼f0代的制备
在实施例2的验证,是在幼鱼时期初步验证所注射的敲除体系是否有效,但是没法确保每个个体都被有效编辑,所以需要在长大后对个体进行逐一的验证筛选。
1、实验方法
将实施例3中获得的显微注射后的斑马鱼养殖至成鱼,剪去尾鳍并提取基因组dna,按照步骤4扩增每个个体的nrf2基因片段,并按照实施例2的方法进行测序。
2、实验结果
进行测序后,确定有突变的个体为f0代。
二、nrf2基因敲除斑马鱼f1代的制备
1、实验方法
将上一步筛选得到的f0代斑马鱼与野生型斑马鱼进行交配,获得受精卵,培养至成鱼,即可得到f1代,再分别剪取尾鳍,测序鉴定f1代的突变类型。
2、实验结果
结果如图4所示,共筛选出4种类型(图4-a)突变,比较不同的突变类型,从中选取可能有效的突变型(图4-b):外显子2缺失了8个碱基,产生了移码突变的nrf2突变体f1代,和nrf2基因原序列(图5)相比,发生移码突变后nrf2基因预测的氨基酸序列缩短,功能区不被翻译(图6)。
三、nrf2基因敲除斑马鱼f2代的制备
从上一步筛选得到的f1代突变体中挑选出雌性和雄性个体,进行交配,获得f2代,并对其进行筛选,通过对nrf2基因的克隆和测序,挑选出nrf2双缺失的纯合个体(nrf2-/-),即为可以稳定遗传的nrf2突变体f2代。
实施例4斑马鱼胚胎在氰戊菊脂(fenvalerate,fen)中的暴露实验
一、实验方法
将野生型和nrf2-/-型斑马鱼胚胎暴露于不同浓度的fen溶液中(0、50、100、200和500nm)。
二、实验结果
结果显示nrf2-/-型斑马鱼胚胎暴露于不同浓度fen溶液中的死亡率都显著高于野生型组(图7),并存在有一定的剂量依存关系,高浓度fen200nm组的死亡率达到最高,暴露于fen溶液的斑马鱼胚胎出现发育畸形(图8)。与对照组及低浓度组相比,高浓度fen暴露组(200nm、500nm)sod活性升高(图9-a)。相同fen暴露条件下,nrf2敲除型各组cat活性显著高于野生型各组(图9-c)。在转录水平上,cat在一定浓度范围内表达水平显著升高,而mn-sod和gpx基因显著下调(图10);野生型胚胎中除高浓度暴露组(200nm、500nm)的casp3a表达量与空白对照组相比显著降低(图11)。野生型和敲除型高浓度组(200nm)lc3蛋白表达量低于自身对照组(图12)。
结果说明:nrf2-/-斑马鱼对fen的敏感性比野生型斑马鱼高,fen在nrf2-/-个体中引起的生理变化和野生型有显著差异,证明nrf2敲除型的斑马鱼可以用于fen的毒理研究。
序列表
<120>一种nrf2基因缺失斑马鱼突变体的制备及其应用
<160>6
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggtggagctgcgcaggcgga20
<210>2
<211>113
<212>dna
<213>人工序列(artificialsequence)
<400>2
taatacgactcactataggtggagctgcgcaggcggattttagagctagaaatagcaagt60
taaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgct113
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
tggcggcaggatgtggatct20
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggcaggaactctccggtct19
<210>5
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>5
taatacgactcactataggtggagctgcgcaggcggattttagagctagaaatagc56
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
agcaccgactcggtgccact20
- 还没有人留言评论。精彩留言会获得点赞!