髓母细胞瘤动物模型及其建立与应用的制作方法
1.本发明涉及生物医药领域,具体地,涉及髓母细胞瘤动物模型及其建立与应用。
背景技术:
2.髓母细胞瘤发生于小脑,是最常见、恶性程度最高的神经系统肿瘤之一。儿童发病率较高,占髓母细胞瘤总发病率的70%以上。儿童发病率约占儿童脑肿瘤的18.2%。髓母细胞瘤肿瘤生长快,体积大,病情发展迅速,导致死亡率与发病率几乎相等。
3.髓母细胞瘤的发病机理尚不清楚,导致临床治疗上的困难。发展新型髓母细胞瘤动物模型,为阐明其机制和研发新药提供新的思路和手段,具有重要的科学和社会意义。
4.然而,目前本领域尚缺乏髓母细胞瘤发病率高、遗传稳定的非人哺乳动物模型。因此,本领域迫切需要开发一种有效而稳定的髓母细胞瘤的非人哺乳动物模型。
技术实现要素:
5.本发明的目的是提供一种有效而稳定地表现内源性髓母细胞瘤的非人哺乳动物模型。所述动物模型可有效而稳定地模拟临床的非人哺乳动物髓母细胞瘤,有望广泛应用于治疗髓母细胞瘤的治疗技术和药物的筛选与评价。
6.本发明的第一方面提供了一种髓母细胞瘤的非人哺乳动物模型,所述的动物模型的细胞中patched蛋白的表达或活性下降且trim32蛋白的表达或活性下降。
7.在另一优选例中,所述动物模型具有选自下组的基因型:patch
+/-/trim32
ko
、patched
+/-/trim32
+/-。
8.在另一优选例中,所述的动物模型为math1-gfp/dcx-dsred/patch
+/-/trim32
ko
。
9.在另一优选例中,所述的动物模型为啮齿动物。
10.在另一优选例中,所述的动物模型为小鼠、或大鼠。
11.在另一优选例中,所述的patched蛋白的表达或活性下降指:在所述动物模型中patched蛋白表达量b1与正常非人哺乳动物中的patched蛋白表达量b0之比b1/b0≤2/3,较佳地≤1/2,更佳地≤1/3,或为0;
12.或者在所述动物模型中patched蛋白的活性h1与正常非人哺乳动物中的patched蛋白活性h0之比h1/h0≤2/3,较佳地≤1/2,更佳地≤1/3,或为0。
13.在另一优选例中,所述的trim32蛋白的表达或活性下降指:在所述动物模型中trim32蛋白表达量e1与正常非人哺乳动物中的trim32蛋白表达量e0之比e1/e0≤1/2,较佳地≤1/3,更佳地≤1/4,或为0;
14.或者,在所述动物模型中trim32蛋白活性a1与正常非人哺乳动物中的trim32蛋白活性a0之比a1/a0≤1/2,较佳地≤1/3,更佳地≤1/4,或为0。
15.在另一优选例中,所述的蛋白表达量或活性为体细胞中的蛋白表达量或活性。
16.在另一优选例中,所述的蛋白表达量或活性为神经系统细胞中的蛋白表达量或活性。
17.在另一优选例中,所述的细胞选自下组:神经上皮细胞、髓母细胞、髓母细胞瘤细胞、或其组合。
18.在另一优选例中,trim32蛋白是不表达和/或无活性的。
19.在另一优选例中,所述动物模型中patched是杂合突变的,即patched
+/-。
20.在另一优选例中,所述的髓母细胞瘤包括小脑的髓母细胞瘤。
21.在另一优选例中,所述的髓母细胞瘤的非人哺乳动物模型是用本发明第二方面或第五方面中所述的方法制备的。
22.本发明的第二方面提供了一种髓母细胞瘤的非人哺乳动物模型的制备方法,包括步骤:
23.(a)将patch
+/-杂合子非人哺乳动物与同物种的trim32敲除的(即trim32
ko
)非人哺乳动物进行杂交,从而得到patched
+/-/trim32
+/-双杂合子的非人哺乳动物;
24.(b)用patched
+/-/trim32
+/-双杂合子的非人哺乳动物与同物种的trim32敲除的(即trim32
ko
)非人哺乳动物进行杂交,从而获得patched
+/-/trim32-/-基因型的非人哺乳动物,即为髓母细胞瘤的非人哺乳动物模型。
25.在另一优选例中,所述方法还包括通过杂交方式使转基因小鼠中的基因表达稳定。
26.在另一优选例中,所述方法还包括:
27.(c)将patched
+/-/trim32-/-基因型的非人哺乳动物与trim32
ko
基因型非人哺乳动物自交3代以上,从而得到基因型稳定的patched
+/-/trim32-/-基因型的非人哺乳动物。
28.在另一优选例中,所述的非人哺乳动物模型为啮齿动物。
29.在另一优选例中,所述的非人哺乳动物模型型为小鼠、或大鼠。
30.在另一优选例中,在步骤(a)中,将patch
+/-杂合子雄性小鼠与trim32
ko
雌性小鼠进行杂交,得到patched
+/-/trim32
+/-双杂合子小鼠;
31.并且在步骤(b)中,将patched
+/-/trim32
+/-双杂合子小鼠与trim32
ko
小鼠回交,从而获得基因型为patched
+/-/trim32-/-小鼠子代。
32.在另一优选例中,在步骤(c)中,将patched
+/-/trim32
ko
小鼠子代与trim32
ko
小鼠自交3代以上,从而得到基因型稳定的patched
+/-/trim32-/-小鼠。
33.在另一优选例中,所述的trim32敲除的非人哺乳动物是通过基因编辑、或体细胞克隆方法制备的。
34.在另一优选例中,所述的trim32敲除的非人哺乳动物是用包括以下步骤的方法制备的:
35.(1)提供非人哺乳动物的体细胞,所述细胞trim32基因是失活的;
36.(2)利用步骤(1)中所述体细胞,制备得到trim32基因失活的非人哺乳动物。
37.在另一优选例中,所述方法还包括:对基因型为patched
+/-/trim32-/-的非人哺乳动物,进行髓母细胞瘤的检测。
38.在另一优选例中,所述的髓母细胞瘤的检测选自下组:
39.(m1)通过基因鉴定,对patched
+/-/trim32-/-基因型进行确认,
40.(m2)在6周龄至40周龄期间,定期观察非人哺乳动物的生物学行为;
41.(m3)症状检测:在饲养起见,观察非人哺乳动物是否出现髓母细胞瘤的表征。
42.(m4)经组织学分析及荧光检测。
43.在另一优选例中,所述的组织学分析及荧光检测中,表达大量math1-gfp+细胞则提示小脑组织存在髓母细胞瘤。
44.在另一优选例中,所述的髓母细胞瘤的表征选自下组:头部隆起、弯腰驼背、偏向一侧、体重严重下降、瘫痪、或缺乏活动。
45.本发明的第三方面提供了一种分离的可用作髓母细胞瘤模型的细胞,patched蛋白的表达或活性下降;并且trim32蛋白的表达或活性下降。
46.在另一优选例中,所述的细胞包括体细胞,较佳地神经系统的细胞。
47.在另一优选例中,所述细胞选自下组:成纤维细胞、神经元细胞、神经上皮细胞、神经胶质细胞、神经干细胞、髓母细胞、髓母细胞瘤细胞、或其组合。
48.在另一优选例中,所述细胞来自于人、非人哺乳动物、果蝇、斑马鱼、和/或线虫。
49.在另一优选例中,所述patched和trim32蛋白同时失活是指细胞中patched和trim32基因表达或活性抑制。
50.在另一优选例中,所述的细胞是经基因工程化的体细胞。
51.在另一优选例中,所述的细胞是经基因编辑或基因重组的细胞。
52.在另一优选例中,所述的细胞分离自本发明第一方面中所述的髓母细胞瘤的非人哺乳动物模型。
53.在另一优选例中,所述基因失活包括基因剔除、基因中断或基因插入。
54.在另一优选例中,所述非人哺乳动物为啮齿动物或灵长目动物,较佳地包括小鼠、大鼠、猴。
55.本发明的第四方面,提供了一种本发明第一方面中所述非人哺乳动物模型的用途,该模型被用于治疗髓母细胞瘤的治疗技术和药物的筛选与评价。
56.在另一优选例中,该模型还用于研究人或动物中patched和trim32基因的生物学功能。
57.本发明的第五方面,提供了一种同时携带小脑前体细胞标记物和早期分化细胞标记物的髓母细胞瘤的非人哺乳动物模型的制备方法,所述的方法包括以下步骤:
58.(1)提供一种非人哺乳动物的体细胞,所述体细胞含有外源的小脑前体细胞标记物基因、外源的早期分化细胞标记物基因,并且所述体细胞中patched蛋白的表达或活性下降且trim32蛋白的表达或活性下降;
59.(2)利用步骤(1)中的所述体细胞,制备得到非人哺乳动物,即为同时携带小脑前体细胞标记物和早期分化细胞标记物的髓母细胞瘤的非人哺乳动物模型。
60.在另一优选例中,所述的方法还包括:
61.(3):对步骤(2)中获得的非人哺乳动物,通过回交和自交得到稳定表达非人哺乳动物。
62.在另一优选例中,所述小脑前体细胞标记物基因选自下组:math1,pax6,mycn、zic1或其组合。
63.在另一优选例中,所述小脑前体细胞标记物基因包括math1。
64.在另一优选例中,所述早期分化细胞标记物基因选自下组:neun、dcx、p27、neurod、或其组合。
65.在另一优选例中,所述早期分化细胞标记物基因包括neun。
66.在另一优选例中,所述基因失活包括基因剔除、基因中断或基因插入。
67.在另一优选例中,所述非人哺乳动物为啮齿动物或灵长目动物,较佳地包括小鼠、大鼠、猴。
68.在另一优选例中,所述的动物模型为啮齿动物。
69.在另一优选例中,所述的动物模型为小鼠、或大鼠。
70.在另一优选例中,所述的动物模型的基因型为math1-gfp/dcx-dsred/patched
+/-/trim32
ko
。
71.本发明的第六方面,提供了一种同时携带小脑前体细胞标记物和早期分化细胞标记物的髓母细胞瘤的非人哺乳动物模型的用途,将该模型用于治疗髓母细胞瘤的治疗技术和药物的筛选与评价。
72.在另一优选例中,所述方法制备的非人哺乳动物模型的用途,该模型可以配合实时荧光监测技术,实时监测髓母细胞瘤中细胞分裂模式和细胞增殖分化的过程。
73.本发明的第七方面,提供了一种筛选或鉴定治疗或缓解髓母细胞瘤的潜在治疗剂的方法,包括以下步骤:
74.a.将候选物质施用于本发明第一方面的非人哺乳动物模型;和
75.b.对所述动物模型的髓母细胞瘤表征及生存期进行追踪,并与对照组进行比较;
76.其中,与对照相比,如果施用了候选物质的动物模型中髓母细胞瘤表征及生存期得到改善,则表明该候选物质是髓母细胞瘤的潜在治疗剂。
77.在另一优选例中,所述动物模型具有选自下组的基因型:patch
+/-/trim32
ko
、patched
+/-/trim32
+/-。
78.在另一优选例中,所述的动物模型为math1-gfp/dcx-dsred/patch
+/-/trim32
ko
。
79.本发明的第八方面,提供了一种trim32激动剂的用途,用于制备shh信号通路的协同抑制剂。
80.在另一优选例中,所述trim32激动剂协同抑制髓母细胞瘤中异常激活的shh信号通路。
81.在另一优选例中,所述trim32激动剂选自下组:小分子化合物、核酸、蛋白质、抗体、或其组合。
82.在另一优选例中,所述trim32激动剂具有以下功能:在基因组、翻译、转录水平上扩增trim32、增强trim32与配体结合的能力、和/或升高trim32的活性。
83.在另一优选例中,所述trim32激动剂用于协同抑制shh信号通路异常激活的肿瘤的发生和发展。
84.在另一优选例中,所述trim32激动剂用于抑制髓母细胞瘤的发展。
85.本发明的第九方面提供了一种药物组合物,所述的药物组合物含有:
86.第一活性成分,所述的第一活性成分选自下组:trim32蛋白、用于表达trim32蛋白的核苷酸序列或载体、trim32激动剂、或其组合;
87.第二活性成分,所述的第一活性成分选自下组:patched蛋白、用于表达patched蛋白的核苷酸序列或载体、patched激动剂、或其组合;
88.以及药学上可接受的载体。
89.本发明的第十方面提供了一种活性成分的制药用途,被用于制备用于治疗髓母细胞瘤的药物,
90.其中,所述的活性成分包括:
91.第一活性成分,所述的第一活性成分选自下组:trim32蛋白、用于表达trim32蛋白的核苷酸序列或载体、trim32激动剂、或其组合;和
92.第二活性成分,所述的第一活性成分选自下组:patched蛋白、用于表达patched蛋白的核苷酸序列或载体、patched激动剂、或其组合。
93.本发明的第十一方面提供了一种治疗治疗髓母细胞瘤的方法,包括步骤:给需要的对象施用第九方面所述的药物组合物或第十方面中所述的活性成分。
94.在另一优选例中,所述的第一活性成分和第二活性成分可以先后、依次、间隔、或同时给予。
95.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
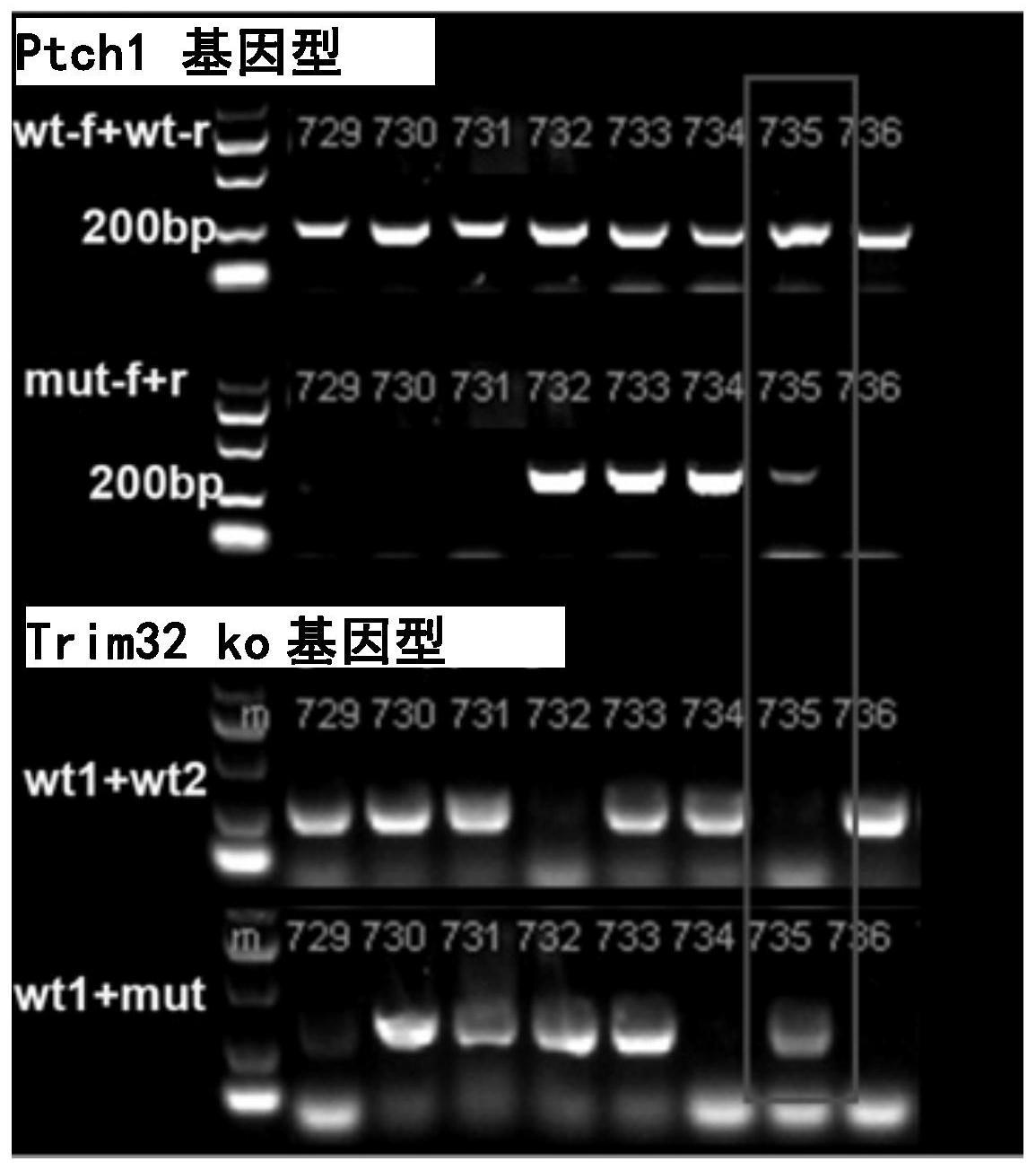
96.图1:ptch1
+/-和trim32
ko
转基因小鼠基因鉴定。取3周龄转基因小鼠子代进行编号,并剪鼠尾提取小鼠基因组,后加特定鉴定引物进行pcr扩增,扩增产物通过电泳、拍照记录,如图示,编号#735小鼠经鉴定基因型为patched
+/-/trim32
ko
。
97.图2:math1-gfp;dcx-dsred;ptch1
+/-;trim32
ko
四杂交小鼠基因鉴定。(a)通过提取鼠尾基因组、pcr扩增、电泳、显像拍照,编号#6的p7小鼠经基因鉴定为patched
+/-;trim32
ko
基因型;(b)经荧光检测分析,编号#6的p7小鼠小脑切片为math1-gfp;dcx-dsred双阳性。
98.图3:math1-gfp;dcx-dsred背景下的转基因小鼠,可直接观察小脑前体细胞和小脑分化细胞,形成了一个很好的研究小脑发育和肿瘤的动物模型体系。
99.图4:trim32
ko
;ptch1
+/-小鼠比ptch1
+/-小鼠更容易发生肿瘤。trim32
ko
即trim32
kt
,ptch1
+/-即patched
+/-。kaplan meier分析63个ptch1
+/-/trim32
wt
小鼠(灰色线)与17个ptch1
+/-/trim32
ko
小鼠(黑线)的mb发病率。通过至少三代杂交获得ptch1
+/-/trim32
wt
小鼠和ptch1
+/-/trim32
ko
小鼠,然后监测髓母细胞瘤的发生(***表明p<0.001,logrank检验)。
100.图5:trim32的表达水平在shh激活的mb组织中显著下调。(a-b)通过qpcr和western blot分析,与相邻的正常小脑组织相比,小鼠shh激活的mb组织在mrna和蛋白质水平上呈现降低的trim32表达。(c)通过分析来自northcott脑样本库的临床shh mb样本,本发明人发现trim32和gli1水平之间存在很强的反相关(p=0.036,r2=0.09)。
101.图6:ptch1+/-/trim32
ko
小鼠mb的分子特性。mb组织中shh通路靶基因gli1、gli2、ccnd1、ccnd2和mycn显著上调。trim32敲除导致ptch1
+/-/trim32
ko mb中颗粒神经元细胞分化标记物neun和tuj1的表达降低。trim32基因敲除通过增强shh通路活性和抑制gnp分化来增加ptch1
+/-小鼠模型中mb的恶性度。
102.图7:ptch1
+/-组与ptch1
+/-;trim32
ko
组小鼠发病时间比较。追踪观察ptch1+/-组与ptch1+/-;trim32ko组小鼠生物性行为,一旦出现髓母细胞瘤表征(如头部隆起、弯腰驼背、偏向一侧、瘫痪、或缺乏活动),即认定小鼠发病,此时即为发病时间,随后通过组织学确认
小鼠发病,计算小鼠发病时间并统计分析。
103.图8:ptch1
+/-组与ptch1
+/-;trim32
ko
组小鼠发病后体重下降比较。追踪观察ptch1+/-组与ptch1+/-;trim32ko组小鼠生物性行为并定期测量体重,一旦出现髓母细胞瘤表征(如头部隆起、弯腰驼背、偏向一侧、瘫痪、或缺乏活动),即认定小鼠发病,计算小鼠体重减轻量并统计分析。
104.图9:trim32基因敲除促进出生后小脑gnp增殖。(a)math1-gfp蛋白(gfp,绿色)在来自math1-gfp/trim32wt小鼠和math1-gfp/trim32ko小鼠的p7小鼠小脑切片中的表达。用dapi(蓝色)对细胞核进行复染。(b-c)免疫荧光染色分析早期分化神经元标记物neun(红色,b)和细胞增殖标志物ki67(红色,c)在来自math1-gfp/trim32wt小鼠和math1-gfp/trim32ko小鼠的p7小鼠小脑切片上的表达情况。用dapi(蓝色)对细胞核进行复染。(c)中的图表示ki67阳性细胞到egl边缘。oegl:外颗粒层的外层,iegl:外颗粒层的内层,ml:分子层,igl:内颗粒层。(d)对p7和p18小脑中矢状面切片进行dapi染色,以显示trim32wt小鼠和trim32ko小鼠小脑的整体形态。
105.图10:trim32拮抗shh信号传导活性。(a)来自trim32
wt
小鼠和trim32
ko
小鼠的出生后第七天,即p7,小脑颗粒神经元祖细胞(cgnps)的trim32、颗粒神经元祖细胞标记物math1和shh靶基因的rt-qpcr分析。(b)trim32、gli1、ccnd2、myc-n在来自trim32
wt
小鼠和trim32
ko
小鼠的p7小鼠小脑中的免疫印迹分析。(c-d)通过rt-pcr分析shh靶基因gli1和myc-n在过表达trim32-gfp或gfp对照的hek293t细胞中mrna的表达。(e-f)转染所述载体后,人髓母细胞瘤细胞系d283(e)和hek293t细胞(f)的gli-re-荧光素酶活性变化,并以renilla活性作为内参对照。
106.图11:trim32与gli1相互作用。(a)体内检测trim32和gli1之间的结合。将编码trim32-gfp和gli1-flag的表达载体转染至hek293t细胞。分别用抗trim32或抗flag抗体进行免疫共沉淀全细胞裂解物,其产物用抗trim32和抗gli1抗体进行蛋白免疫印迹分析。
具体实施方式
107.本发明人经过广泛而深入的研究,首次开发了一种可稳定遗传且髓母细胞瘤(mb)发病率高的非人动物模型。本发明的动物模型细胞中patched蛋白的表达或活性下降且trim32蛋白的表达或活性下降。本发明人意外地发现,trim32
kt
转基因小鼠自身不会发生髓母细胞瘤,但trim32被敲除后可协同激活sonic hedgehog信号转导通路,从而使得mb发病率显著升高。实验表明,patched蛋白和trim32蛋白的两者的表达或活性均下降时,mb发病率大幅提高。因此,本发明的非人哺乳动物是一个更有效的髓母细胞瘤(mb)模型,可以作为优秀的筛药和实验研究的动物模型。在此基础上,发明人完成了本发明。
108.术语说明
109.除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
110.如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
111.如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换
言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
112.如本文所用,术语“trim32
ko”、“trim32-/
-”、“trim32基因敲除的”可互换使用,指trim32基因被敲除和/或trim32蛋白被失活。
113.髓母细胞瘤和shh信号通路
114.髓母细胞瘤发生于小脑,是最常见、恶性程度最高的神经系统肿瘤之一。
115.目前对髓母细胞瘤的机理研究,涉及特异信号转导通路(包括shh信号通路、wnt信号通路)、基因突变、翻译后组蛋白修饰等等。
116.多条小脑发育相关信号转导通路在髓母细胞瘤中存在异常。新近研究证据甚至根据信号转导通路对髓母细胞瘤进行分子分型,包含shh亚型、wnt亚型、亚型3和亚型4。
117.sonic hedgehog(shh)信号转导通路的异常激活在肿瘤发生发展中起着重要作用。研究表明,shh信号通路被激活导致肿瘤发生。
118.shh信号通路包括其关键因子shh、patched、gli等在小脑发育和肿瘤中起重要作用。大约25%的髓母细胞瘤的shh信号通路组分发生突变。shh通路激活后可通过转录因子gli上调促细胞增殖因子如myc的表达,伴随肿瘤的发生。shh由浦肯野细胞分泌,作用于patched蛋白。
119.patched基因及蛋白
120.如本文所用,术语“patched”、“ptch”可互换使用,指patched蛋白或基因。
121.patched蛋白在shh信号通路中起拮抗作用,patched突变小鼠中,shh信号通路被激活,突变小鼠可产生髓母细胞瘤。
122.patched突变纯合小鼠因神经系统、心脏和其他器官缺陷在胚胎发育期即死亡。patched突变杂合小鼠在出生后3至6个月,产生髓母细胞瘤。
123.patched
+/-小鼠模型(转基因小鼠)是髓母细胞瘤的一个重要模型,然而该小鼠动物模型有其局限性,只有14-20%的小鼠产生髓母细胞瘤。
124.在本发明中,patched包括patched1、patched2或其组合。除非特别说明,在本公开内容中,patched为patched1。
125.基因失活
126.对于功能未知基因的研究可采用许多方法,例如使有待研究的基因失活,分析所得的遗传修饰的表型变化,进而获得该基因的功能信息。这一研究方法的另一优点是可以将基因功能和疾病进行关联,从而在获得基因功能的同时也能获得该基因作为潜在药物或者药物靶点所能治疗的疾病信息和疾病动物模型。基因失活的方法可通过基因剔除、基因中断或基因插入的方式来完成。其中,基因剔除技术是研究人类基因在整体中的功能的非常强有力的手段。
127.如本文所用,术语“基因失活”、“基因敲除”可互换使用,指通过对某一目的基因进行中断、敲除等遗传操作,从而使得该目的基因的表达和/或活性大幅下降甚至完全丧失。
128.trim32基因及蛋白
129.trim(tripartite motif)家族参加一系列生物学过程,包括转录调节、细胞生长、凋亡、发育等。
130.trim32蛋白(tripartite motif protein 32)是一种e3泛素连接酶(e3ubiquitin ligases),属于trim(c-vii)亚家族成员,包含六个重复的nhl区域。trim家族在人和小鼠中
含有70多个成员。
131.之前的研究表明,trim32的遗传性缺失导致基因敲除小鼠表现出自闭症症状样行为(例如,社交障碍和重复刻板举止)。
132.小鼠的trim32蛋白具有655个氨基酸,accession登录号为np_444314.2gi:239937489。
133.大鼠的trim32蛋白具有655个氨基酸,accession登录号为:edm10507.1,gi:149059569。
134.在啮齿动物中,trim32蛋白的高度同源的。
135.trim32作为抑癌基因的研究多集中于其同源基因brat、mei-p26在果蝇等低等动物上的作用研究。有研究报导,trim32调节蛋白降解和mirna活性,控制神经前体细胞两个子代的平衡。
136.本发明的研究表明,单纯敲除trim32基因所形成的trim32
kt
转基因小鼠,其自身不会发生髓母细胞瘤(与正常小鼠相比)。然而,出乎意料的是,当trim32被敲除或可协同sonic hedgehog信号转导通路激活,发病率显著升高,促进肿瘤发生。
137.报告基因工具小鼠
138.math1-gfp转基因小鼠种系,dcx-dsred转基因小鼠种系,patched
+/-/trim32
kt
双杂交小鼠,math1-gfp/dcx-dsred/patched
+/-/trim32
kt
四杂交转基因小鼠
139.小脑前体细胞标记物基因包括:math1、pax6、mycn和zic1,其中以math1-gfp转基因小鼠为例,math1是小脑前体细胞标记物,math1-gfp转基因动物可以以绿色荧光报告小脑前体细胞。
140.早期分化细胞标记物基因包括:neun、dcx、p27和neurod,其中以dcx-dsred转基因小鼠为例,dcx是小脑早期分化细胞标记物,dcx-dsred转基因小鼠可以以红色荧光报告小脑分化细胞。
141.本发明将math1-gfp转基因小鼠、dcx-dsred转基因小鼠、patched
+/-转基因小鼠和trim32
kt
转基因小鼠进行双杂交、三杂交和四杂交,产生了math1-gfp;dcx-dsred转基因小鼠,math1-gfp;dcx-dsred;patched
+/-转基因小鼠,patched
+/-;trim32
kt
转基因小鼠和math1-gfp;dcx-dsred;patched
+/-;trim32
kt
转基因小鼠,形成了一个很好的研究小脑发育和肿瘤的动物模型体系。
142.本发明的主要优点包括:
143.1.patched和trim32基因同时失活的非人哺乳动物是一个新的更有效的髓母细胞瘤模型,其发病率较现有经典模型大大提高,可以作为优秀的筛药和实验研究模型。
144.2.构建同时存在小脑前体细胞标记物基因math1-gfp、早期分化细胞标记物基因dcx-dsred、patched基因失活、和trim32基因失活的非人哺乳动物,可直接观察小脑前体细胞和小脑分化细胞,形成了一个很好的研究小脑发育和肿瘤的动物模型体系。也可以利用荧光成像技术,实时记录髓母细胞瘤中trim32对细胞分裂模式和细胞增殖分化的调控。全过程操作简单,效果一目了然,并且能与其他成像技术结合,实现三维重构髓母细胞瘤发病的全过程。
145.3.首次公开trim32抑制shh信号通路的机制,而shh信号通路异常是多种癌症的共同特征,因此提升体内trim32可以为临床肿瘤研究和治疗提供新的思路和靶标。
146.下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
147.实施例1杂交获得patched
+/-/trim32
ko
转基因小鼠
148.首先将patch
+/-杂合子雄性小鼠(ptched
+/-小鼠模型(#003081)购自jackson laboratory)与trim32
ko
雌性小鼠进行杂交,得到patched
+/-/trim32
+/-双杂合子小鼠;然后用双杂合子小鼠与trim32
ko
小鼠回交,选其子代patched
+/-/trim32
ko
小鼠,与trim32
ko
小鼠两种基因型小鼠不断自交3代以上,得到基因型稳定的patched
+/-/trim32
ko
。
149.patched
+/-和trim32
ko
小鼠分别使用以下引物对子代小鼠进行基因分型。
150.patched
+/-小鼠基因型的鉴定:
151.名称序列编号wt-f5'-ctaggccacagaattgaaagatct-3'1wt-r5'-gtaggtggaaattctagcatcatcc-3'2mut-f5'-gatgatctcgtcgtgacccat-3'3mut-r5'-gtaggtactctgttctcaccc-3'4
152.trim32
ko
小鼠基因型的鉴定:
153.名称序列编号wt 15'-ggagagacactatttcctaagtca-3'5wt 25'-gttcaggtgagaagctgctgca-3'6mut5'-gggacaggataagtatgacatca-3'7
154.注:wt:wt1+wt2 250bp,mutant:wt1+mut 300bp
155.结果:
156.如图1所示,基因鉴定结果可以看出,杂交获得了patched基因杂合而trim32敲除的转基因小鼠,如电泳图中红框所示编号#735。
157.实施例2杂交获得math1-gfp/dcx-dsred/patched
+/-/trim32
ko
转基因小鼠
158.math1-gfp转基因小鼠与dcx-dsred转基因小鼠杂交产生了math1-gfp/dcx-dsred转基因小鼠。
159.用math1-gfp/dcx-dsred转基因小鼠与patched
+/-杂合子进行杂交,并取其子代连续自交3代以上,得到math1-gfp/dcx-dsred转基因小鼠和math1-gfp/dcx-dsred/patched
+/-转基因小鼠。
160.用math1-gfp/dcx-dsred转基因小鼠与patched
+/-/trim32
ko
进行杂交,并取其子代连续自交3代以上,得到math1-gfp/dcx-dsred/patched
+/-/trim32
ko
转基因小鼠。
161.math1-gfp及dcx-dsred转基因小鼠用绿色荧光或红色荧光证实,而patched
+/-和trim32
ko
小鼠分别使用上述引物对子代小鼠进行基因分型。
162.结果:
163.如图2所示,通过基因鉴定和小脑区域的免疫荧光成像结果可以证明,所选编号#6的p7小鼠,其中a图所示经基因鉴定为patched
+/-/trim32
ko
基因型,b图所示荧光显示为
math1-gfp/dcx-dsred双阳性。
164.如图3所示,math1-gfp;dcx-dsred背景下的转基因小鼠,可直接观察小脑前体细胞和小脑分化细胞,形成了一个很好的研究小脑发育和肿瘤的动物模型体系。
165.实施例3新型髓母细胞瘤模型的确立
166.1.mb的发病率
167.通过实施例1中的方法获得patched
+/-/trim32
ko
转基因小鼠及patched
+/-/trim32
wt
、trim32
ko
、wt(即patched
wt
/trim32
wt
)四种基因型小鼠,在6周龄至40周龄期间定期观察各小鼠的生物学行为变化,一旦出现髓母细胞瘤的表征(比如头部隆起、弯腰驼背、偏向一侧、体重严重下降、瘫痪、或缺乏活动),就将其杀死并进行尸检。经组织学分析证实其小脑组织为髓母细胞瘤。同时统计分析40周内ptch1
+/-小鼠中mb的发病率,以及由ptch1
+/-和trim32敲除小鼠杂交产生的子代ptch1
+/-/trim32
ko
的mb发病率。
168.结果:
169.如图4所示,令人意外地发现,trim32基因敲除在ptch1+/-小鼠的背景下使mb的发生率从25.4%增加到52.9%。25.4%的ptch1
+/-/trim32
wt
小鼠(16/63)和52.9%的ptch1
+/-/trim32
ko
小鼠(9/17)发生小脑髓母细胞瘤,50只野生型小鼠和30只ptch1
+/+
/trim32
ko
小鼠未发生mb,表明trim32基因敲除导致mb发病率显著升高(p<0.001)。
170.2.mb组织在mrna和蛋白质水平trim32表达
171.2.1通过定量聚合酶链反应实验与蛋白免疫印迹实验,比较正常小脑组织和mb组织trim32表达的情况。
172.结果:
173.如图5a和5b所示,与相邻的正常小脑组织相比,小鼠shh激活的mb组织在mrna(a)和蛋白质(b)水平上呈现降低的trim32表达。trim32的表达水平在shh激活的mb组织中显著下调。接下来,
174.2.2通过分析来自northcott脑样本库的临床shh mb样本,以研究低trim32水平和高gli1水平是否与人shh mbs呈负相关。
175.结果如图5c所示,发现trim32和gli1水平之间存在很强的反相关(p=0.036,r2=0.09)。
176.3.mb的恶性度
177.将math1-gfp小鼠与ptch1
+/-/trim32
wt
小鼠杂交和将math1-gfp小鼠与ptch1
+/-/trim32
ko
小鼠杂交。通过脑组织切片、定量聚合酶链反应,检测小鼠脑内math1-gfp阳性细胞的数量和颗粒神经元细胞分化标记物的表达情况;取小脑组织提取mrna及蛋白,进一步测量正常小脑组织和来自两个基因型的mb中shh通路组分的表达水平。
178.结果:
179.如图6a所示,两种基因型的mb均含有大量的math1-gfp阳性细胞,表明这两种基因型的mb均来源于gnp的恶性转化。
180.如图6b所示,在mrna水平上,与正常小脑组织相比,mb组织中shh通路靶基因gli1、gli2、ccnd1、ccnd2和mycn显著上调。出乎意料的是,gli1、ccnd1、ccnd2和mycn基因,在ptch1
+/-/trim32
ko
比ptch1
+/-/trim32
wt
的mb区域中普遍表达更高。如图6e所示,此结果在免疫印迹实验也得到证实。
181.如图6d所示,通过免疫印迹实验证实,与ptch1
+/-/trim32
ko mb相比,trim32敲除导致ptch1
+/-/trim32
ko mb中颗粒神经元细胞分化标记物neun和tuj1的表达降低,尽管gnp标记物math1的表达没有显著差异。
182.因此,trim32基因敲除通过增强shh通路活性和抑制gnp分化来增加ptch1
+/-小鼠模型中mb的恶性度。
183.4.mb的发病情况
184.按照本领域技术人员已知的实验操作,髓母细胞瘤小鼠模型一般使用40周龄内的成年转基因小鼠。因此,从转基因小鼠出生后6周起(小鼠成年),对ptch1
+/-小鼠和ptch1
+/-/trim32
wt
小鼠进行长达40周的发病情况监测。
185.结果:
186.如图7所示,本发明提供的ptch1
+/-/trim32
ko
组小鼠mb肿瘤平均发病时间比传统的ptch1+/-组有提前的趋势。
187.如图8所示,ptch1
+/-/trim32
ko
组发病后体重下降较ptch1
+/-组更明显,提示前者的生长发育更受影响,也提示了本发明提供的ptch1
+/-/trim32
ko
组小鼠模型病情更严重。
188.实施例4trim32基因敲除破坏了小脑gnp分化和增殖的平衡
189.将math1-gfp小鼠与trim32
wt
和trim32
ko
小鼠杂交,通过脑组织切片、免疫荧光染色,观察并分析小鼠脑内math1-gfp阳性细胞的数量和颗粒神经元细胞分化标记物及细胞增殖标记物的表达情况。
190.结果:
191.如图9a所示,来自math1-gfp;trim32
kt
小鼠小脑的gnp表达了比math-1-gfp;trim32
wt
小鼠更高的math1水平,也就是说,小脑神经颗粒前体细胞gnp明显增殖。
192.如图9b所示,trim32敲除即trim32
kt
小鼠p7,即出生后第7天时,分化的神经元neun+阳性细胞数量减少。
193.如图9c所示,对代表增殖细胞的ki67
+
细胞的定量分析表明,在trim32
kt
小鼠小脑中,在egl(外颗粒层)中发现更多的ki67阳性细胞;而图9d所示,trim32敲除影响小脑分叶发育异常;这些表明,trim32基因的敲除可导致gnp的过度增殖和对gnp分化的干扰。
194.在本发明中,本发明人发现trim32基因敲除破坏了小脑gnp分化和增殖的平衡,增加了ptch1+/-小鼠mb的发生率。
195.实施例5trim32过表达拮抗shh信号转导。
196.取基因型为trim32
wt
和trim32
ko
的p7小鼠小脑组织,通过定量聚合酶链反应实验与蛋白免疫印迹实验,分析来自两个基因型的组织中shh通路组分的表达水平;另在hek293细胞中加入外源性shh分子激活其下游靶基因表达上调,通过定量聚合酶链反应实验,检测trim32过表达对shh诱导上调的靶基因的抑制作用;通过荧光素酶实验,检测在髓母细胞瘤细胞株d283及hek293细胞株中,过表达trim32对gli1诱导的shh信号转导活性的抑制作用。
197.结果:
198.如图10所示,在trim32
kt
小鼠中,shh靶基因中与gnp增殖相关的基因表达升高,包括mcyn,ccnd1,ccnd2,和gli1等,这同时体现在基因表达水平(a)和蛋白表达水平(b)上。反之,trim32过表达抑制shh信号转导活性(c-f)。
199.本领域技术人员已知,shh能激活mcyn和gli1的表达,如图10所示,trim32过表达
可以显著性地降低shh激活的mcyn(c)和gli1(d)的表达升高。
200.以上实验数据表明,trim32过表达可以拮抗shh信号转导。
201.实施例6 trim32与shh信号通路关键因子gli1相互作用
202.通过蛋白免疫共沉淀实验,检测trim32与gli1之间是否存在相互作用。
203.结果:
204.如图11所示,在hek293t细胞中外源性标记表达的gli1和trim32-gfp,证明trim32和gli1可以相互共沉淀。
205.讨论
206.在小脑中,sonic hedgehog信号转导通路起着非常重要的作用,该通路的异常激活可导致小脑髓母细胞瘤,patched
+/-转基因小鼠是髓母细胞瘤的一个重要模型。
207.在本发明中,本发明人意外地发现,trim32
kt
转基因小鼠自身不会发生髓母细胞瘤,但trim32被敲除或可协同sonic hedgehog信号转导通路激活,发病率显著升高,促进肿瘤发生。
208.本发明的研究表明,patched和trim32基因同时失活的转基因非哺乳动物的髓母细胞瘤发生率发生协同性的显著升高,这提示,trim32基因可作为patched基因的协同基因,参与和影响了髓母细胞瘤的进程和恶化。
209.本发明中,首次确立了patched
+/-trim32
kt
小鼠是一个新型髓母细胞瘤模型。同时,阐明了patched
+/-trim32
kt
髓母细胞瘤模型的机理:trim32基因敲除增强小脑神经颗粒前体细胞gnp增殖;sonic hedgehog信号转导通路的异常激活是导致小脑髓母细胞瘤的重要原因,trim32过表达拮抗shh信号转导通路的异常激活。换言之,trim32敲除协同shh信号转导通路的异常激活;gli1是shh信号通路的关键因子,trim32与gli1相互作用,从而完成其拮抗shh信号转导通路的异常激活的作用。trim32或许可独立或协同成为髓母细胞瘤治疗的新靶点候选。
210.具体地,本发明人发现:trim32基因敲除在patch
+/-小鼠的背景下使mb的发生率从25.4%增加到52.9%。这些数据支持trim32可能是肿瘤抑制基因的概念。
211.基因表达分析表明,与patch
+/-/trim32
wt mb组织相比,在patch
+/-/trim32
ko mb组织中shh靶基因的表达水平较高,在trim32
ko gnp中shh靶基因的表达水平也高于trim32
wt gnp。因此表明trim32的缺失与patch
+
突变存在协同作用,可进一步增强shh通路的异常激活,导致mb的形成。
212.同时,在临床shh mb样本中,本发明人发现trim32与gli1水平呈负相关。所有这些数据都强调了trim32在小鼠或人shh mb形成中的意义。
213.本发明人从组织病理学和遗传学上证实了细胞命运决定因子trim32在有丝分裂gnp的细胞质中非对称地分布,并且trim32在小鼠小脑中的遗传缺失导致gnps。重要的是,trim32基因敲除使gnp处于增殖状态,阻止它们分化,并导致patch
+/-小鼠中mb发病率增加。在生化水平上,trim32抑制shh信号转导的活性,从而促进gnp的分化。这些发现说明trim32是调控gnp增殖和分化的新分子,提示trim32基因突变或丢失可能是mb形成的另一个原因。
214.有趣的是,越来越多的证据表明,细胞分裂过程中trim32的不对称分布诱导小鼠新皮层神经干细胞/祖细胞的分化。和这种情况一致,本发明人发现trim32在有丝分裂颗粒神经前体细胞中的不对称分布和其在小脑发育和肿瘤发生中的生物学功能。shh信号在小
脑神经发生过程中通过维持对称和不对称细胞分裂之间的平衡来决定gnp的命运。在本发明中,本发明人进一步发现,trim32负调控shh信号,调节小脑内gnp的分化和增殖的平衡,以起到至关重要的细胞命运决定作用。
215.本发明的一个重要发现是鉴定trim32抑制shh信号通路的机制,shh信号通路是小脑发育和mb形成的主要调节因子,gli1是shh信号通路的关键因子,本发明人证明trim32与gli1结合,以抑制shh信号通路活性。
216.总之,本发明确立了patched
+/-trim32
kt
小鼠是一个新型髓母细胞瘤模型,并阐明了patched
+/-trim32
kt
髓母细胞瘤模型的机理。
217.在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1