使用屋尘螨蛋白和SEB诱导小鼠皮肤瘙痒症模型的方法与流程
使用屋尘螨蛋白和seb诱导小鼠皮肤瘙痒症模型的方法
技术领域
1.本发明属于动物实验模型构建技术领域,涉及使用屋尘螨蛋白和seb诱导小鼠皮肤瘙痒症模型的方法。
背景技术:
2.皮肤瘙痒症(特应性皮炎)是一种无原发性皮肤损害的慢性皮肤病。可由某些疾病、药物、寒冷、过敏源刺激而发生,属于神经功能障碍性皮肤病,目前仍属于难治性皮肤病。临床上患者自觉剧痒,无原发性皮肤损害,发生部位不固定可全身泛发,亦可局限一定部位如:头颈、躯干、四肢、二阴,瘙痒后可引发抓痕、丘疹、血痂、皮肤增厚及苔藓样改变,病人奇痒难忍,痛苦不堪。
3.当前特应性皮炎的常见模型动物包括家兔,大鼠,小鼠,豚鼠,犬等,其中小鼠以成本低,模型易建立且便于基因操作等优势备受青睐。这些动物模型可分为3类:自发动物模型,致敏剂诱导模型,基因方法建立模型。
4.自发动物模型包括nc/nga小鼠,特点是普通环境下会出现严重的红斑,瘙痒,皮肤干燥,皮肤屏障功能障碍等症状,且病理表现接近人类特应性皮炎临床表现,缺点是价格昂贵,限制了其广泛应用。基因编辑模型小鼠同样因为价格昂贵,操作不便限制了其广泛应用。
5.致敏剂诱导模型是目前科研人员常用的得到特应性皮炎动物模型,卵清蛋白(ova)可诱导包括balb/c和c57bl/6在内的5个品系小鼠的特应性皮炎,表现为致敏小鼠皮肤增厚,真皮层cd4
+
t淋巴细胞浸润,嗜酸性粒细胞和th2型细胞因子il
‑
4,il
‑
5及il
‑
13表达的上调,但是ifn
‑
γ水平变化很小或者无变化。尘螨是目前已发现最强的过敏源之一,其引起的过敏性疾病包括:过敏性皮炎、过敏性哮喘、过敏性鼻炎和过敏性湿疹,利用粉尘螨提取物在nc/nga小鼠背部和耳后诱导7周后小鼠出现特应性皮炎样皮肤炎性反应,亦有使用重组螨变应原der p8致敏balb/c小鼠产生具有表皮增生和水肿特征的皮炎,皮肤cd4
+
和cd8
+
t淋巴细胞浸润,免疫学特点以th2型免疫为主。葡萄球菌肠毒素b(seb)是常见的超抗原,能够以极低浓度即可激活大量t细胞的活化,能加重小鼠皮炎的严重程度。这些致敏原导致的模型都需要反复致敏,找到一种缩短造模周期,且价格便宜的特应性造模方法对药物发现和疗效验证具有重要意义。
技术实现要素:
6.针对上述技术问题,本发明的目的在于提供使用屋尘螨蛋白和seb诱导小鼠皮肤瘙痒症模型的方法。
7.为了实现上述目的,本发明采用的技术方案为:
8.本发明提供了使用屋尘螨蛋白和seb诱导小鼠皮肤瘙痒症模型的方法,包括:
9.1)小鼠适应性喂养7天,异氟烷麻醉后,背部剃毛,然后涂抹脱毛膏,10min后刮去脱毛膏及毛发,形成3
‑
5cm2的脱毛区域,并在除毛后的皮肤上轻刮造成皮损。
10.2)用生理盐水为小鼠清洗背部,并用消毒棉签轻擦干背部。
11.3)将化妆棉剪为1.5cm*1.5cm大小的化妆棉块,将100μl屋尘螨蛋白溶液及50μl seb溶液滴于化妆棉上,将化妆棉使用胶布固定于小鼠脱毛区域,并使用胶布将其缠在小鼠腰腹位置。
12.4)模型制备共包含3或4轮造模处理,每轮造模处理包括两次给药,每次给药中间间隔1天,每一轮造模处理周期为9天,动物休养6天后再开始下轮造模处理,在造模处理的第40天进行模型验证。
13.优选地,步骤1)中,小鼠采用8w龄c57b/6n小鼠,雌雄不限。
14.优选地,步骤3)中,所述屋尘螨蛋白溶液的质量体积浓度为100μg/ml,所述seb溶液的质量体积浓度为10μg/ml。
15.更优选地,所述屋尘螨蛋白溶液通过以下方法制备:将含蛋白4.51mg的屋尘螨提取物加入4.51ml的pbs,至尘螨完全溶解,配制成1mg/ml的母液,每次使用时,用pbs稀释成100μg/ml的屋尘螨蛋白溶液。所述seb溶液通过以下方法制备:将1mg葡萄球菌肠毒素b加入10ml的pbs,配制成100μg/ml的母液,每次使用时,用pbs稀释成10μg/ml的seb溶液。
16.优选地,步骤4)具体包括:
[0017]4‑
1)第一次给药后第4天(day 4),将给药装置解除,休养1天后再给药一次,持续4天,此时距第一次给药9天(day 9),这样的两次给药为一轮造模给药处理,周期为9天,即4天给药+1天休养+4天给药。在day10解除给药装置。
[0018]4‑
2)动物于第一轮造模处理结束后休养6天后进行第二轮造模处理。
[0019]4‑
3)动物于第二轮造模处理结束后休养6天后进行第三轮造模处理。
[0020]4‑
4)于第三轮造模处理结束后一天进行模型验证,如果造模效果不佳,则于第三轮造模结束后休养处理2天开始第四轮造模。
[0021]
更优选地,步骤4
‑
1)中,第一次给药后,若皮损不严重或毛发再生,则在再次给药前再用脱毛膏进行一次皮损。
[0022]
更优选地,所述模型验证包括皮损评分及搔抓实验:对小鼠背部造模区域的四个参数:发红,出血,喷发和脱屑进行评价,评级按以下严重性等级:0
‑
无症状,1
‑
轻度,2
‑
中级,3
‑
严重;造模第40天时,对小鼠背部特定部位进行屋尘螨蛋白和seb混合溶液的喷施,喷施剂量与造模剂量相同,并进行为期30min的行为学观察,主要观察指标为小鼠在造模及喷施部位的抓挠次数和总抓挠时长,小鼠抓挠身上除头面外其他部位为有效,以小鼠开始抓挠到抓挠用爪重新触地或舔舐抓挠用爪计为一次;造模第40天,评分大于等于5分的为造模成功小鼠。
[0023]
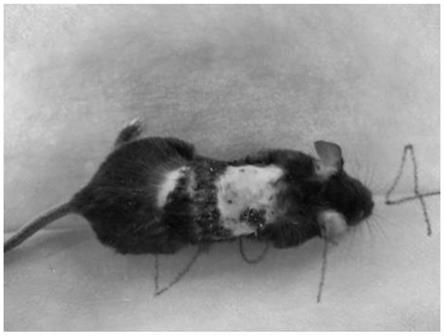
本发明还提供了上述方法获得的皮肤瘙痒症模型在治疗皮炎和瘙痒症药物的研发中的应用。
[0024]
优选地,上述应用包括:构建皮肤瘙痒症模型后,根据分组对动物执行治疗方案,待治疗方案周期结束后,通过包括病理、生化检测在内的相关检测来确认治疗药物是否有效。
[0025]
更优选地,所述分组包括模型组、正常对照组、阳性药物组和阴性药物组。
[0026]
本发明相对于传统方法,有如下优点:
[0027]
1、使用小鼠品系为普通c57bl/6小鼠,价格较低,且成模率为70%以上。
[0028]
2、采用混合过敏原致敏小鼠局部皮肤,成模加初步验证时间共计40天,比单过敏原致敏7周造模周期更短,且造模严重程度更深。
附图说明
[0029]
图1显示本发明实施例中给小鼠背部刮毛并造成皮损。
[0030]
图2显示将屋尘螨蛋白溶液和seb溶液滴到化妆棉上。
[0031]
图3显示将图2的化妆棉置于小鼠脱毛区域。
[0032]
图4显示将胶布置于小鼠腰腹位置。
[0033]
图5显示将化妆棉使用胶布固定于小鼠脱毛区域。
[0034]
图6显示本发明实施例造模成功的一只小鼠。
[0035]
图7显示图6小鼠病理特征的he染色结果。
[0036]
图8显示图6小鼠病理特征的甲苯胺蓝染色结果。
具体实施方式
[0037]
为了更清楚地说明本发明,下面结合实施例并对照附图对本发明作进一步详细说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0038]
实施例
[0039]
一、实验准备
[0040]
动物:8w龄c57b/6n小鼠,雌雄不限。
[0041]
试剂与耗材:屋尘螨提取物(lot:361863,greer),seb(lot:92815b,toxin technology),pbs(lot:m61218,transgen biotech),化妆棉,粘性胶布。
[0042]
屋尘螨蛋白溶液的配制:取一瓶屋尘螨提取物(含蛋白4.51mg),加入4.51ml的pbs的尘螨完全溶解,配制成1mg/ml的母液,每次用pbs稀释成100μg/ml的屋尘螨蛋白(derf)溶液。
[0043]
seb的配制:取一瓶seb,加入10ml的pbs,配制成100μg/ml的母液,每次用pbs稀释成10μg/ml的seb。
[0044]
在进行以下造模操作前,小鼠适应性喂养7天。
[0045]
二、造模操作方法
[0046]
1.异氟烷麻醉后,背部剃毛,然后涂抹脱毛膏,10min后稍微用力刮去脱毛膏及毛发,形成3
‑
5cm2的脱毛区域,并在除毛后的皮肤上轻刮造成皮损,如图1所示。
[0047]
2.用生理盐水为小鼠清洗背部,并用消毒棉签轻擦干背部。
[0048]
3.将化妆棉剪为1.5cm*1.5cm大小的化妆棉块,将100μl derf(100μg/ml)及50μl seb(10μg/ml)滴于化妆棉上,如图2所示。将化妆棉使用胶布固定于小鼠脱毛区域,并使用胶布将其缠在小鼠腰腹位置,如图3
‑
5所示。
[0049]
4.模型制备共包含3或4轮造模处理,每轮造模处理包括两次给药,每次给药中间间隔1天,因此每一轮造模处理周期为9天。动物休养6天后再开始下轮给药,在第三轮造模处理结束后进行模型验证。如3轮造模处理效果不佳,则在第三轮造模处理结束2天后开始第四轮造模。即前三轮造模周期为9+(6)+9+(6)+9,共39天,在第40天进行模型验证,通常前
三轮造模(39天造模+1天验证)已经能达到预期效果。如效果不佳,则在休养2天后继续第四轮造模处理,4轮造模加1天检测,共需51天(39+2+9+1)。具体包括:
[0050]4‑
1)第一轮造模给药后第4天,将给药装置(即步骤3用胶布固定的化妆棉)解除,休息1天后再重复给药一次(若皮损不严重或毛发再生,则在再次给药前再用脱毛膏进行一次皮损)。第一次给药后第9天,解除给药装置。两次给药为一轮给药,此为第一轮给药。
[0051]4‑
2)休养6天后再进行第二轮共两次给药,给药方法步骤同1
‑
3。
[0052]4‑
3)于第二轮两次给药结束休息6天后进行第三轮造模处理,步骤同1
‑
3。
[0053]4‑
4)造模给药结束后进行模型验证,确定模型是否达到要求,否则继续第四轮造模处理。
[0054]
三、模型验证方法
[0055]
1、皮损评分及搔抓实验:对小鼠背部造模区域的四个参数:发红,出血,喷发和脱屑进行评价,评级按以下严重性等级:0
‑
无症状,1
‑
轻度,2
‑
中级,3
‑
严重。造模第40天时,对小鼠背部特定部位(自拟定并标记)进行derf和seb混合溶液的喷施,喷施剂量与造模剂量相同,并进行为期30min的行为学观察,主要观察指标为小鼠在造模及喷施部位的抓挠次数和总抓挠时长,小鼠抓挠身上除头面外其他部位为有效,以小鼠开始抓挠到抓挠用爪重新触地或舔舐抓挠用爪计为一次。行为学观察的部分结果见表1。
[0056]
表1.小鼠抓挠行为学观察结果
[0057][0058][0059]
表1数据表明,造模后动物的抓挠次数和总的抓挠时间都显著高于对照组。
[0060]
2、模型验证:造模第40天,评分大于等于5分的为造模成功小鼠(如图6所示),取正常组和模型组小鼠各3只,样本固定和石蜡包埋后切片行he染色及甲苯胺蓝染色进行病理特征判断验证模型制备成功性,结果如图7和8所示,与正常组相比,模型组有不同程度的角化过度或角化不全现象,真皮层出现增厚,结构紊乱,有大量炎症细胞浸润,毛囊受损及数量减少。
[0061]
通过屋尘螨蛋白和seb对小鼠皮肤的反复致敏,可高效诱发小鼠出现局部皮肤炎症,伴有血清ige水平增高,临床表现及免疫学改变类似于人类的特应性皮炎,且该方法可以应用于多个小鼠品系的模型建立。
[0062]
四、应用前景
[0063]
特应性皮炎小鼠模型可以应用于治疗皮炎和瘙痒症药物的研发。
[0064]
如药物研发公司制备了某种药物,则可以通过设计不同分组,最后检测出该药物是否有效。
[0065]
分组设计为:
[0066]
i.正常对照组(纯同步饲养)
[0067]
ii.假手术组(和造模组有通用的基本操作,但不涉及到导致病症的操作)
[0068]
iii.模型组(特应性皮炎造模)
[0069]
iv.阳性药物组(参比药物,能有效治疗)
[0070]
v.阴性药物组(通常认为无治疗效果的给药)
[0071]
vi.溶媒、赋型剂组(此组无治疗效果或有部分治疗效果)
[0072]
vii.待测药物的低剂量组
[0073]
viii.待测药物的中剂量组
[0074]
ix.待测药物的高剂量组
[0075]
其中,假手术组、阴性对照组和溶媒组可以根据客户的具体要求和模型的特性,有些组可以删减。
[0076]
按本发明构建特应性皮炎动物模型后,即可根据分组对动物执行治疗方案,待治疗方案周期结束后,通过病理、生化和其他相关检测来确认治疗药物是否有效。
[0077]
显然,本发明的上述实施例仅仅是为更清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动,这里无法对所有的实施方法予以穷举,凡是属于本发明的技术方案所引申出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1