一种增强胰岛功能的双歧杆菌及其应用的制作方法
本发明涉及一种增强胰岛功能的双歧杆菌及其应用。
背景技术:
糖尿病(diabetes)是一种与胰岛素的产生和作用异常相关、以高血糖症为主要特征的内分泌代谢疾病,主要包括I型和II型糖尿病。我国糖尿病人群以II型糖尿病为主,占糖尿病患者总数的90%以上。以胰岛素相对缺乏和胰岛素抵抗为主的II型糖尿病最终会导致高血糖,长期的高血糖症状会引起一系列的慢性并发症,如足病(足部溃疡、感染和坏疽)、肾病(肾功能衰竭、尿毒症)、眼病(视网膜病变、模糊不清、失明)、脑病(脑血管病变)、心脏病、皮肤病、性病等。II型糖尿病是一种缓慢进展性疾病,其发病的中心环节是胰岛素抵抗和胰岛β细胞功能缺陷。目前,我国的II型糖尿病的患病人数居世界首位,所以发展II型糖尿病的预防和治疗措施刻不容缓。许多研究发现益生菌对改善II型糖尿病具有良好生物学作用,但是关于其作用机理并未阐述明确,并且许多功能性益生菌的菌株、发酵剂以及核心技术都被国外垄断。
技术实现要素:
本发明的目的是提供一种增强胰岛功能的双歧杆菌及其应用。
本发明提供了动物双歧杆菌的应用,为如下(a1)和/或(a2):
(a1)制备用于预防和/或治疗糖尿病的产品;
(a2)预防和/或治疗糖尿病。
本发明还保护动物双歧杆菌的应用,为如下(b1)-(b12)中的至少一种:
(b1)制备用于保护胰岛的结构和功能的产品;
(b2)制备用于保护胰腺的结构和功能的产品;
(b3)制备用于促进胰岛损伤后结构和功能恢复的产品;
(b4)制备用于促进胰腺损伤后结构和功能恢复的产品;
(b5)制备用于促进糖尿病患者胰岛结构和功能恢复的产品;
(b6)制备用于促进糖尿病患者胰腺结构和功能恢复的产品;
(b7)保护胰岛的结构和功能;
(b8)保护胰腺的结构和功能;
(b9)促进胰岛损伤后结构和功能恢复;
(b10)促进胰腺损伤后结构和功能恢复;
(b11)促进糖尿病患者胰岛结构和功能恢复;
(b12)促进糖尿病患者胰腺结构和功能恢复。
本发明还保护动物双歧杆菌的应用,为如下(c1)-(c6)中的至少一种:
(c1)制备用于促进胰岛素分泌的产品;
(c2)制备用于促进糖尿病患者胰岛素分泌的产品;
(c3)制备用于促进胰岛细胞胰岛素分泌的产品;
(c4)促进胰岛素分泌;
(c5)促进糖尿病患者胰岛素分泌;
(c6)促进胰岛细胞胰岛素分泌。
本发明还保护动物双歧杆菌的应用,为如下(d1)-(d4)中的至少一种:
(d1)制备用于增加机体葡萄糖耐量的产品;
(d2)制备用于增加糖尿病患者葡萄糖耐量的产品;
(d3)增加机体葡萄糖耐量;
(d4)增加糖尿病患者葡萄糖耐量。
本发明还保护一种产品,其活性成分为动物双歧杆菌;所述产品的用途为所述产品的用途为预防和/或治疗糖尿病。
本发明还保护一种产品,其活性成分为动物双歧杆菌;所述产品的用途为如下(e1)-(e6)中的至少一种:
(e1)保护胰岛的结构和功能;
(e2)保护胰腺的结构和功能;
(e3)促进胰岛损伤后结构和功能恢复;
(e4)促进胰腺损伤后结构和功能恢复;
(e5)促进糖尿病患者胰岛结构和功能恢复;
(e6)促进糖尿病患者胰腺结构和功能恢复。
本发明还保护一种产品,其活性成分为动物双歧杆菌;所述产品的用途为如下(f1)-(f3)中的至少一种:
(f1)促进胰岛素分泌;
(f2)促进糖尿病患者胰岛素分泌;
(f3)促进胰岛细胞胰岛素分泌。
本发明还保护一种产品,其活性成分为动物双歧杆菌;所述产品的用途为如下(g1)和/或(g2):
(g1)增加机体葡萄糖耐量;
(g2)增加糖尿病患者葡萄糖耐量。
以上任一所述动物双歧杆菌具体可为动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)。
以上任一所述动物双歧杆菌具体可为动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)A6。
动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)A6,已于2014年06月05日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC;地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;邮编:100101),保藏编号为CGMCC No.9273。动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)A6简称为双歧杆菌A6。
以上任一所述糖尿病具体可为II型糖尿病。
以上任一所述双歧杆菌A6具体可为双歧杆菌A6活菌。
以上任一所述双歧杆菌A6具体可为双歧杆菌A6灭活菌。
以上任一所述产品具体可为食品、药品或保健品。
本发明通过实验证明,双歧杆菌A6对胰岛结构具有明显保护作用。在给予糖尿病大鼠4周双歧杆菌A6后,糖尿病大鼠的胰岛数目增多,空泡变性程度得到明显改善,同时细胞实验证实了双歧杆菌A6对STZ诱导的β胰岛素瘤细胞RIN-m5F具有明显保护作用,并能促进其分泌胰岛素。本发明通过研究双歧杆菌A6对II型糖尿病的表观特征以及病情的发生发展具有延缓及其他良性的生物学作用,为糖尿病相关实验研究提供一定的理论基础。
附图说明
图1为造模成功后各组大鼠口服葡萄糖耐量试验结果。
图2为处死前各组大鼠口服葡萄糖耐量试验结果。
图3为动物实验第6周和第10周检测大鼠空腹胰岛素统计结果。
图4为为正常组大鼠胰腺HE切片观察结果。
图5为模型组大鼠胰腺HE切片观察结果。
图6为A6低剂量组大鼠胰腺HE切片观察结果。
图7为A6中剂量组大鼠胰腺HE切片观察结果。
图8为A6高剂量组大鼠胰腺HE切片观察结果。
图9为巨噬细胞光学显微镜观察结果。
图10为A6活菌悬液和A6灭菌悬液对巨噬细胞存活率影响统计结果。
图11为A6菌上清液对巨噬细胞存活率影响统计结果。
图12为β胰岛素瘤细胞RIN-m5F存活率结果。
图13为β胰岛素瘤细胞RIN-m5F分泌胰岛素ELISA检测结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)A6:已于2014年06月05日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC;地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;邮编:100101),保藏编号为CGMCC No.9273。动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactis)A6简称为双歧杆菌A6。
基础饲料配方如表1所示。基础饲料蛋白质、脂肪、碳水化合物的供能比分别为22.47%、12.11%和65.42%,能量为14.31kJ/g。
表1基础饲料配方
高脂饲料配方如表2所示。高脂饲料供能比为17.77%、40.92%和41.31%,能量为19.45kJ/g。
表2高脂饲料配方
RPMI-1640基础培养基:Gibco公司。
RPMI-1640完全培养基:RPMI-1640完全培养基+10mL/100mL FBS+青霉素100U/mL+链霉素100μg/mL。
β胰岛素瘤细胞RIN-m5F:中国医学科学院基础医学研究所基础医学细胞中心。
胰岛素检测ELISA试剂盒:Mercodia公司。
STZ溶液:STZ溶液由链脲佐菌素和pH 4.2的0.1mmol/L柠檬酸缓冲液组成;在STZ溶液中,链脲佐菌素的质量百分含量为1%。
链脲佐菌素:Sigma公司。
实施例1、双歧杆菌A6菌悬液的制备
1、将已活化的双歧杆菌A6接种到MRS液体培养基中,37℃厌氧培养12h,培养结束后将培养体系4000g离心15min收集菌体。PBS洗涤菌体两次,然后采用生理盐水重悬菌体,获得A6活菌悬液。
2、将已活化的双歧杆菌A6接种到MRS液体培养基中,37℃厌氧培养12h,培养结束后将培养体系4000g离心15min收集菌体。PBS洗涤菌体两次,然后采用RPMI-1640完全培养基重悬菌体,获得A6活菌悬液。
3、将已活化的双歧杆菌A6接种到MRS液体培养基中,37℃厌氧培养12h,培养结束后将培养体系置于72℃水浴10min,然后冷却至室温(吸取100μL菌体悬液接种于MRS固体培养基上,37℃厌氧培养48h后检验灭活效果,无菌生长代表完全灭活),4000g离心15min收集菌体,然后用RPMI-1640完全培养基配制成A6灭活菌悬液。
4、将已活化的双歧杆菌A6接种到MRS液体培养基中,37℃厌氧培养18h,培养结束后将培养体系4000g离心15min后取上清,调整pH值为7.0,然后经0.22μm滤膜过滤,得到菌上清液。
实施例2、II型糖尿病大鼠模型的建立及动物实验
实验大鼠:60只健康6-8周龄的雄性SD大鼠(240±10g)。大鼠在不锈钢干养式实验笼架中喂养,以防止食粪癖。动物实验房温度保持在22±2℃,湿度维持在55%±5%,严格遵循12h光照/12h黑暗循环。
1、将实验大鼠随机分为2组(正常组、模型组),正常组10只,模型组50只。正常组大鼠饲喂基础饲料,模型组大鼠饲喂高脂饲料,持续4周(第1-4周)。
2、完成步骤1后,所有大鼠禁食不进水饲养12h,然后测定大鼠体重,正常组大鼠按35mg/kg的剂量腹腔注射pH值4.2的0.1mmol/L柠檬酸缓冲液,模型组按35mg/kg的剂量腹腔注射STZ溶液。
3、完成步骤2后,继续饲养大鼠2周(第4-6周),饲养期间各组大鼠正常进水,正常组大鼠饲喂基础饲料,模型组大鼠饲喂高脂饲料,第6周取模型组大鼠测定大鼠空腹血糖,检测前大鼠禁食不禁水12h,以血糖仪测定尾静脉血糖值,以空腹血糖≥11.0mmol/L为造模成功。将造模成功的大鼠随机分为四组(模型组、A6低剂量组、A6中剂量组和A6高剂量组),每组10只。
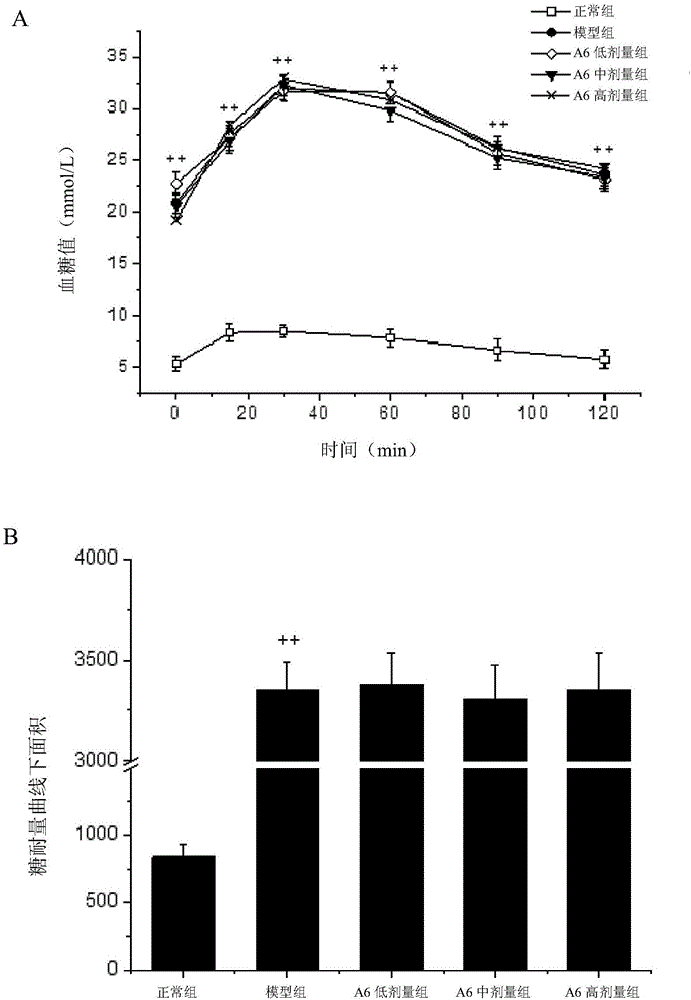
造模成功后,对各组大鼠进行口服葡萄糖耐量试验(Oral Glucose Tolerance Test,OGTT),实验方法具体为:各组大鼠禁食不禁水12h,按2g/kg体重灌胃50%(质量百分比)的葡萄糖水溶液,并分别测定第0min、第15min、第30min、第60min、第90min和第120min鼠尾静脉血糖值。绘制血糖变化曲线,并计算糖耐量曲线下面积(Area Under Curve,AUC)。
结果如图1所示。图1A为口服葡萄糖糖耐量曲线。图1B为糖耐量曲线线下面积。
结果表明,在灌胃葡萄糖后的15-30min内,各组大鼠血糖均呈上升趋势,正常组大鼠表现出正常的耐糖现象,正常组大鼠的血糖在0~30min内上升幅度平缓,在30min后逐渐降低,2h后回到空腹水平;其余各组大鼠的血糖在30min内显著上升(p<0.01),均在30min时达到最高峰,血糖在30min后逐渐降低,2h后血糖水平依然较高。此外,曲线下面积统计结果显示,模型组和A6各剂量组AUC显著高于正常组(p<0.01),说明造模组大鼠均出现严重糖耐量受损的情况(p<0.01),符合II型糖尿病糖耐量降低的特征。同时,模型组和A6各剂量组大鼠糖耐量曲线变化趋势相同,组间无显著性差异(p>0.05)。表明造模成功时,所有大鼠发病程度相当。
4、完成步骤3后,继续饲养大鼠4周(第6-10周),饲养期间各组大鼠正常进水,正常组大鼠饲喂基础饲料,其余各组大鼠饲喂高脂饲料。饲养过程中正常组和模型组大鼠采用灭菌生理盐水灌胃(1次/天),A6低剂量组采用实施例1步骤1制备的A6活菌悬液灌胃(5.0×106CFU菌/kg体重/天),A6中剂量组采用实施例1步骤1制备的A6活菌悬液灌胃(5.0×108CFU菌/kg体重/天),A6高剂量组采用实施例1步骤1制备的A6菌悬液灌胃(5.0×1010CFU菌/kg体重/天)。
分别于第6周(造模成功后)和第10周检测各组大鼠空腹胰岛素,将各组大鼠禁食不禁水12h,内眦静脉取血,分离血浆后用胰岛素检测ELISA试剂盒检测血浆胰岛素含量。
结果如图3所示。在STZ诱导成模后,由于低剂量STZ对大鼠胰岛β细胞的部分破坏作用,故模型组和A6各剂量组在第6周空腹胰岛素水平低于正常组(p>0.05),而模型组和A6各剂量组间空腹胰岛素水平无明显差异,说明造模成功后,大鼠发病程度无差别。第10周空腹胰岛素水平数据显示,与模型组相比,A6低、中、高剂量治疗组的空腹血浆胰岛素逐渐升高且存在组间剂量效应。其中A6高剂量组胰岛素水平显著高于模型组(p<0.01)。本实验结果表明,双歧杆菌A6有促进II型糖尿病大鼠分泌胰岛素的功能。
第10周再一次对各组大鼠进行口服葡萄糖耐量试验(Oral Glucose Tolerance Test,OGTT)实验方法具体为:各组大鼠禁食不禁水12h,按2g/kg体重灌胃50%(w/v)的葡萄糖溶液,并分别测定第0min、第15min、第30min、第60min、第90min和第120min鼠尾静脉血糖值。绘制血糖变化曲线,并计算糖耐量曲线下面积(Area Under Curve,AUC)。
结果如图2所示。图2A为口服葡萄糖糖耐量曲线。图2B为糖耐量曲线线下面积。
结果表明,模型组和A6各剂量组口服糖耐量曲线峰值(30min)均显著高于正常组,表明仍存在明显的糖耐量受损。A6低、中剂量组与模型组口服糖耐量曲线峰值(30min)差异不显著。A6高剂量组口服糖耐量曲线峰值(30min)为31.5±1.0mmol/L,低于模型组32.7±1.1mmol/L,但无显著性差异。A6高剂量组口服糖耐量曲线90min和120min的血糖值显著低于模型组(p<0.05)。曲线下面积统计结果显示,模型组AUC显著大于正常组AUC(p<0.01),A6低、中剂量组AUC与模型组AUC差异不显著(p>0.05),A6高剂量组AUC显著低于模型组AUC(p<0.01)。
5、完成步骤4后,将各组大鼠椎脱臼处死,取新鲜胰腺组织,制作石蜡切片并进行HE染色。
结果如图4-图8所示。图4为正常组大鼠胰腺HE切片。图5为模型组大鼠胰腺HE切片。图6为A6低剂量组大鼠胰腺HE切片。图7为A6中剂量组大鼠胰腺HE切片。图8为A6高剂量组大鼠胰腺HE切片。
正常组(图4):胰腺表面覆盖着疏松的结缔组织,这些结缔组织深入胰腺内,将胰腺分隔成许多胰腺小叶,胰腺的导管、血管、淋巴管和神经纤维等均行走于小叶间的结缔组织中。胰腺主要由腺泡细胞、腺管和胰岛细胞构成。胰腺泡和腺管组成胰腺的外分泌腺,内分泌腺则由大小不同的胰岛细胞团所组成。胰腺外分泌腺为浆液型腺体,胞浆丰富;胰岛细胞呈团状,分布在腺泡细胞中,胰岛细胞核呈圆形,蓝色着染,内分泌胰与外分泌腺小叶清晰可辩。
模型组(图5):镜下可见胰岛毛细血管扩张、充血。部分腺泡细胞胞浆减少,结构混乱。小叶结构破坏,叶间隙增宽,胰腺损伤显著。胰岛数目减少,且不能维持圆形结构,形状变得不规则,胰腺滤泡与胰岛交错生长。有些胰岛结构萎缩,崩解,与周围组织混合,部分胰岛细胞内发生空泡变性(黑色箭头所指处)。
A6低剂量组(图6):与模型组相比胰腺形态学没有明显改变。
A6中剂量组(图7):胰岛数目与模型组相比有所增多,胰岛组织与周围组织界限比较清楚。
A6高剂量组(图8):胰岛数目略少于正常组,但较于低、中剂量组明显增多。胰岛细胞空泡变性程度明显减轻,腺泡结构较稳定。
胰腺损伤可能是由于STZ的毒性和糖脂代谢紊乱引起的糖毒性与脂毒性引起的。从上述结果中可以看出,摄入双歧杆菌A6可以保持腺泡细胞的完整,增加胰岛细胞数目,减轻空泡变性程度,较大程度的恢复胰腺结构。
实施例3、双歧杆菌A6对β胰岛素瘤细胞RIN-m5F的作用检测
一、巨噬细胞制备
将雄性SD大鼠椎脱臼处死,依次进行如下操作:
(1)将大鼠在75%(体积百分比)乙醇水溶液中浸泡30s,腹部朝上置于超净台中。
(2)小心剪去腹部毛皮,露出腹膜,用无菌注射器向腹腔注射10mL预冷的含有3%(体积百分比)胎牛血清的PBS缓冲液。
(3)轻轻揉动腹部,用注射器吸出腹腔液,置于干净的离心管中。
(4)将腹腔液300g离心5min,收集细胞,37℃预热的PBS缓冲液洗涤两次,用RPMI-1640完全培养基重悬。
(5)用手持式细胞计数器计数,按1.0×105个细胞/mL接种于6孔细胞培养板,于37℃培养2h使巨噬细胞贴壁。
(6)贴壁2h后,用PBS缓冲液洗去悬浮细胞,加入0.25%胰蛋白酶消化贴壁巨噬细胞1min,用RPMI-1640完全培养基终止消化。
(7)鉴定:取细胞悬液滴加于洁净载玻片上,制备涂片,室温自然干燥。将细胞涂片置于瑞氏染液中染色3min,流水冲洗,干燥后置光学显微镜下观察。
结果如图9所示。图9中可观察到贴壁细胞多呈圆形或椭圆形,细胞体积较大。在瑞氏染色后,在显微镜下可见细胞多呈椭圆形或肾形,胞浆丰富且着色浅,富含颗粒及少许空泡。多为单核,且细胞核大多偏于一侧,着色深。瑞氏染色结果显示,从腹腔分离出来的巨噬细胞的纯度>98%,可以用于后续实验。
二、双歧杆菌A6对巨噬细胞的作用检测
1、将实施例1步骤2制备的A6活菌悬液采用RPMI-1640完全培养基稀释为不同浓度的A6活菌悬液(106CFU/mL、107CFU/mL、108CFU/mL、109CFU/mL和1010CFU/mL)。
2、将实施例1步骤3制备的A6灭活菌悬液采用RPMI-1640完全培养基稀释为不同浓度的A6灭活菌悬液(106CFU/mL、107CFU/mL、108CFU/mL、109CFU/mL和1010CFU/mL)。
3、将实施例1步骤3制备的A6菌上清液采用RPMI-1640完全培养基分别进行不同稀释比例稀释(1∶2、1∶4、1∶8、1∶16、1∶32和1∶64倍稀释),得到不同稀释比例的A6菌上清液。
4、将步骤一中分离得到的巨噬细胞接种于96孔板中(每孔1.0×104个细胞),使用RPMI-1640完全培养基,37℃、5%CO2温箱中培养,待细胞贴壁后,分别加入100μL步骤1制备的各浓度A6活菌悬液、100μL步骤2制备的各浓度A6灭活菌悬液和100μL步骤3制备的各稀释比例的菌上清液,静置90min后,采用CCK8法测定巨噬细胞存活率。
结果如图10和图11所示。图10为加入A6活菌悬液和A6灭菌悬液后的存活率统计结果。图10中,横坐标为菌悬液浓度(CFU/mL)。图11为加入菌上清液后的存活率统计结果。图11中,横坐标为不同稀释比例。结果表明,A6活菌悬液和灭活菌悬液的最大无毒剂量均为108CFU/mL;A6菌上清液最大无毒剂量为1∶4的稀释液。由于107CFU/mL的A6活菌悬液,107CFU/mL的A6灭活菌悬液和1∶16的A6菌上清液稀释液促进巨噬细胞增殖能力最强,巨噬细胞增殖引起的细胞因子水平的变化会影响巨噬细胞的极化,巨噬细胞的不同极化类型会对胰岛结构与功能产生不同的影响,故在后续实验中选用这三个剂量。
三、双歧杆菌A6对β胰岛素瘤细胞RIN-m5F的作用检测
1、将步骤一中分离得到的巨噬细胞接种与96孔板中(每孔1.0×104个细胞),使用RPMI-1640完全培养基,37℃、5%CO2温箱中培养,待细胞贴壁后,分别加入100μL步骤二制备的107CFU/mL A6活菌悬液、100μL步骤二制备的107CFU/mL灭活菌悬液、100μLMRS液体培养基和100μL步骤二制备的1∶16稀释的菌上清液,静置90min后,将培养体系离心取上清液,用于后续实验。
2、将β胰岛素瘤细胞RIN-m5F接种于96孔板中(每孔1.0×105个细胞),使用RPMI-1640完全培养基,37℃、5%CO2温箱中培养,待细胞贴壁后,每孔培养基中加入终浓度为10mM的STZ溶液刺激24h。
3、完成步骤2后,取所述96孔板,按照表4的设置进行分组并进行操作,采用CCK8法测定3h和6h后的β胰岛素瘤细胞RIN-m5F存活率、用ELISA试剂盒检测6h后β胰岛素瘤细胞RIN-m5F分泌胰岛素含量。
β胰岛素瘤细胞RIN-m5F存活率结果如图12所示。由图12可知,巨噬细胞不同处理组的上清液与STZ诱导后的β胰岛素瘤细胞RIN-m5F共培养3h后,A6活菌组的细胞存活率最高,依次是灭活菌组、菌上清和MRS培养基组。培养6h后的细胞存活率趋势与3h的相同。其中A6活菌组的细胞存活率高于对照组,但差异不显著。
表4分组及实验操作
使用胰岛素检测ELISA试剂盒检测β胰岛素瘤细胞RIN-m5F分泌胰岛素含量结果如图13所示。结果表明,巨噬细胞不同处理组的上清液与STZ诱导后的RIN-m5F细胞共培养3h后,A6活菌组、灭活菌组的胰岛素分泌量显著高于对照组(p<0.01,p<0.05)。
上述结果表明,A6活菌或灭活菌可以对巨噬细胞产生刺激,促使巨噬细胞分泌细胞因子,可以对被STZ诱导后的β胰岛素瘤细胞RIN-m5F产生保护作用。
- 还没有人留言评论。精彩留言会获得点赞!