一种淀粉湿法保藏方法与流程
本发明涉及淀粉保藏技术领域,特别是涉及一种淀粉湿法保藏方法。
背景技术:
淀粉是人类食物的重要组成部分,广泛存在于谷物种子、根茎中。将淀粉从原料中提取分离出来,可应用于食品、医药和化工中。在提取的淀粉储藏中,一般是干法储藏,将制得的淀粉烘干或让其自然干燥,使得其水分降低至20%以下,以便于包装、运输和储藏,在储藏过程中还要注意防潮和防异味。但对于薯类淀粉,其多用于粉丝加工,若将制得的湿淀粉烘干再在生产过程中加水,就增加了不必要的能耗。因此,在许多薯类淀粉生产企业,甘薯制成淀粉、淀粉储藏、淀粉制品生产各个生产过程都在同一个地点,不需要远距离运输,企业多采用湿淀粉保藏。
传统的淀粉湿法贮藏是将生产出的湿淀粉置于一个大池中,在表面加入一层水密封,通过不断地更换密封水来保持淀粉的品质,秋冬季节温度较低时4-5天更换一次,夏天温度较高时2-3天更换一次,这种方法在储藏过程中会使用大量的水,增加了淀粉储藏保鲜的成本,造成了一定程度的水资源浪费。在储藏后期,由于淀粉散发出的强烈酸味,引来各种飞虫掉入池中,增加了池中微生物的数量和种类,从而加速了淀粉品质的劣变。因此,开发出一种储藏效果好、经济节能的淀粉湿法储藏新技术在实际应用中具有重要意义。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种淀粉湿法保藏方法,用于解决现有技术中淀粉保藏用水量大、成本高、淀粉品质易劣变等问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种淀粉湿法保藏方法,包括如下步骤:
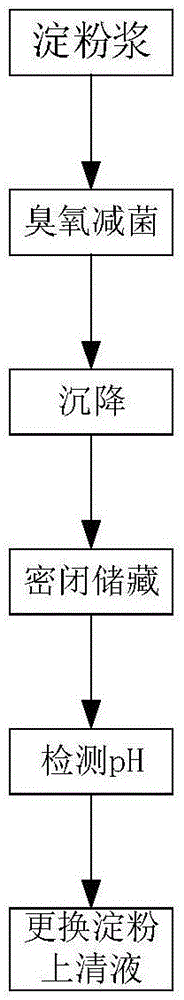
1)淀粉浆减菌处理:将淀粉与水混合,调浆,通入臭氧,结束后密封储藏,淀粉浆自然沉淀;
2)湿淀粉管理储藏:检测上层减菌水和淀粉层的ph值,当ph值低于要求值时,更换减菌水,如此循环。
在本发明的一些实施例中,所述步骤1)中,淀粉浆的质量浓度为20~50%。
在本发明的一些实施例中,所述步骤1)中,臭氧通入量为100~1000mg/kg淀粉浆,臭氧处理时间为30~200min。
在本发明的一些实施例中,所述步骤2)中,每隔3天检测上层减菌水和淀粉层的ph值。
在本发明的一些实施例中,所述步骤2)中,检测淀粉层0.5m厚处的ph值。
在本发明的一些实施例中,所述步骤2)中,当ph值低于4.5时,更换减菌水。
在本发明的一些实施例中,所述步骤2)中,更换减菌水时,排出原减菌水,再补入臭氧灭菌水。
在本发明的一些实施例中,所述步骤2)中,更换减菌水时,补入的减菌水中臭氧浓度为0.30-0.95mg/l。
在本发明的一些实施例中,所述步骤2)中,更换减菌水时,臭氧对水的处理时间为10min。
本发明第二方面提供上述方法制得的淀粉。
如上所述,本发明的一种淀粉湿法保藏方法,具有以下有益效果:本发明结合臭氧水的强杀菌能力,开发出了一种能保持淀粉基本品质,增加淀粉白度,淀粉品质优,保质期长,保鲜效果好,用水量少,经济节能的淀粉湿法储藏新方法。
附图说明
图1显示为本发明实施例的工艺流程图。
图2显示为本发明实施例的臭氧与淀粉反应装置示意图。
图3显示为不同臭氧处理时间的甘薯淀粉扫描电子显微镜(sem)图(600×),a为0min(control,下同),b为0.4min,c为0.8min,d为1.6min。
图4显示为不同臭氧处理时间的甘薯淀粉粒径分布图。
图5显示为不同臭氧处理时间的甘薯淀粉的偏光显微镜图,a为0min,b为0.4min,c为0.8min,d为1.6min。
图6显示为不同臭氧处理时间的甘薯淀粉x-衍射图谱。
图7显示为不同臭氧处理时间的甘薯淀粉凝沉性质参数。
图8显示为不同臭氧处理时间的甘薯淀粉红外光谱图。
图9显示为不同臭氧处理时间的甘薯淀粉羧基含量变化情况,a、b、c等不同字母表示各组间存在显著性差异(p<0.05)。
图10显示为淀粉分子量与时间关系gpc-ri-mals色谱图。
图11(a)显示为37℃条件下储藏ph变化情况图。
图11(b)显示为室温条件下储藏ph变化情况图。
图12(a)显示为37℃条件下储藏菌落总数变化情况图。
图12(b)显示为室温条件下储藏菌落总数变化情况图。
图13显示为37℃条件下储藏90天后甘薯淀粉扫描电子显微镜(sem)图(600×):a为2d(control,下同)、b为4d、c为6d、d为8d、e为10d。
图14(a)显示为37℃条件下储藏90天后甘薯淀粉x-衍射图谱。
图14(b)显示为室温条件下储藏90天后甘薯淀粉x-衍射图谱。
图15(a)显示为37℃条件下储藏90天后甘薯淀粉红外光谱图。
图15(b)显示为室温条件下储藏90天后甘薯淀粉红外光谱图。
图16显示为淀粉分子量与时间关系gpc-ri-mals色谱图(a为对照组,b为处理组)。
图17显示为本发明实施例的湿淀粉大池储藏设施布局示意图(红管为臭氧灭菌水;绿管为淀粉池中的酸变水)。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
薯类淀粉多用于粉条生产,因此,许多企业为了降低加工成本,提取的湿淀粉采用湿法大池保藏,但易腐败变质。为了提高湿淀粉储藏期限和储藏品质,本发明以新鲜甘薯湿淀粉为原料,在传统湿淀粉储藏方法的基础上,结合臭氧水的强杀菌能力,先使用臭氧水对原淀粉进行杀菌,储藏时换入经臭氧处理的臭氧水,研究湿淀粉储藏新方法,并研究了臭氧处理对淀粉品质可能产生的影响。
本发明结合臭氧水的强杀菌能力,以期研究出一种淀粉品质优、保鲜效果好、换水时间间隔长、用水量少、经济节能的淀粉湿法储藏新方法。
臭氧灭菌为溶菌级方法,其具有杀菌彻底、杀菌速度快、广谱杀菌、无残留等特点。与传统化学杀菌消毒剂相比凸显出的优越性包括:高效性,臭氧气体消毒是以空气为媒介,不需要额外添加其他物质,在相对密封的环境下,可全方位快速高效的消毒杀菌,克服了紫外线杀菌时存在多处死角的缺陷;高洁净性无残留,次氯酸钠和过氧化氢是近年来研究最多的化学氧化剂。但是,二者均存在的一个问题是使用次氯酸钠和过氧化氢氧化后会产生废水,而且可能会在食品中留下不良残留物,臭氧氧化是一种清洁技术。臭氧不稳定,能自行快速地分解成为氧气,不会造成任何残留的优点与在杀菌、消毒过程中无法克服环境污染问题的传统化学杀菌消毒剂相比,显示出了其巨大的优越性;并且方便经济,臭氧发生器价格低廉,设置好发生器的运行时间后可自动运行,操作方便。
臭氧杀菌浓度低,不会对食品品质产生不良影响,又因其易分解,在食品表面也不产生残留污染。安全使用臭氧完全可以保证人的健康不受危害,相反,在呼吸0.1mg/l以下浓度臭氧时,对人体会有保健作用,因此,有人把臭氧比作美酒,臭氧应用一百多年来,至今世界上无一例因臭氧中毒死亡事故发生。
图1显示为本发明的工艺流程图。
以下实验中,原材料来自重庆市彭水市晶丝苕粉厂的甘薯淀粉。数据处理分析:采用spss18.0软件进行方差分析,在0.05显著水平下进行多重比较;采用origin8.0软件作图。
主要仪器与试剂:溴化钾(色谱纯);盐酸、碘化钾、碘、氢氧化钠、无水乙醇、酚酞、硝酸银等试剂均为分析纯,购于成都科龙化工试剂厂;直链、支链标准品,购于美国sigma公司。hh-6d数显恒温水浴磁力搅拌器,惠州市宏业仪器有限公司;fa2004a电子天平,上海精天电子仪器有限公司;centrifuge5810型台式高速离心机,德国eppendorf公司;uv-2450紫外分光光度计,日本岛津公司;shz-ii型循环水真空泵,上海亚荣生化仪器厂;shz-ii型循环水真空泵,上海亚荣生化仪器厂;utrascanpro型测色仪,上海一恒科技有限公司;jsm-6510lv型钨灯丝扫描电子显微镜,日本电子株式会社;feili803a型臭氧发生器(3g/h),飞利有限公司;spectrum100型傅里叶变换红外仪,美国铂金埃尔默股份有限公司;d8型x-射线衍射仪,德国布鲁克公司。
臭氧处理时间对湿淀粉品质的影响
如图2所示,在无菌操作台中,取200g甘薯淀粉置于玻璃反应器中,加入等质量自来水,使用磁力搅拌器将淀粉悬浊液搅拌均匀,开启臭氧发生器,待流速稳定后接入反应器中并开始计时,臭氧处理时间分别为0、80、160、240、320min(对应每克淀粉处理时间为0、0.4、0.8、1.2和1.6min)处理完后立即用封口膜密封,转移至烘箱中,45℃、48h条件下烘干,研钵研碎,过100目筛,置于干燥器中备用。
1、淀粉色泽测定:不同臭氧处理时间的甘薯淀粉色泽测定结果如表1所示。l*、a*、b*和de*是反映色泽的参数,其中,白度和总色差是反应淀粉色泽的主要指标。淀粉的色泽是影响淀粉制品品质的一个指标,特别是粉丝和粉条等淀粉制品。由表1可知,未经臭氧处理的甘薯淀粉白度和总色差均最低,且与经臭氧处理的各组间存在显著性差异(p<0.05)。随着臭氧处理时间的增加,甘薯淀粉的白度及总色差增大。由此可知,臭氧处理会增加甘薯淀粉的白度,对甘薯淀粉的色泽具有积极的影响。
表1不同臭氧处理时间的甘薯淀粉色泽参数
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
2、淀粉颗粒形貌测定
使用扫描电镜观察未经臭氧处理的甘薯淀粉和经臭氧处理后的甘薯淀粉颗粒,结果如图3所示,红圈中为不规则塌陷的淀粉颗粒。由图3可知,未经臭氧处理的甘薯淀粉颗粒大多数呈球形、铃铛形,存在少量不规则形状。经臭氧处理后,部分甘薯淀粉颗粒表面变得凹凸不平,且随着臭氧处理时间的增加不规则塌陷淀粉颗粒数量呈增加的趋势。淀粉颗粒的结构被描述为具有无定形区和结晶区的半结晶,在氧化淀粉中观察到的结果可能是由于氧化首先破坏了非结晶区从而导致颗粒塌陷。
3、淀粉颗粒粒径测定
使用粒度仪测定未经臭氧处理的甘薯淀粉和经臭氧处理后的甘薯淀粉颗粒,结果如表2和图4所示。由表2可知,未经臭氧处理的甘薯淀粉比表面积最大,表面积平均粒径、体积平均粒径、中位径d(0.5)均最小,且均与臭氧处理组存在显著性差异(p<0.05)。随着臭氧处理时间的增加,甘薯淀粉颗粒比表面积呈减小趋势,表面积平均粒径、体积平均粒径、中位径d(0.5)呈增大的趋势。由图4可知,与未经臭氧处理的甘薯淀粉相比,经臭氧处理后的甘薯淀粉粒径分布图向右偏移。
表2不同臭氧处理时间的甘薯淀粉粒径分析数据
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
4、淀粉颗粒光学性质测定
使用偏光显微镜观察未经臭氧处理的甘薯淀粉和经臭氧处理后的甘薯淀粉颗粒,结果如图5所示。由图5可知,未经臭氧处理和经臭氧处理的甘薯淀粉颗粒均被黑色的十字分为四个白色的区域,甘薯淀粉颗粒上的黑色十字称为偏光十字,十字交叉点为颗粒的粒心。由此可知,本实验臭氧处理对甘薯淀粉的十字偏光性没有影响。
5、淀粉结晶类型测定
使用x-射线衍射仪测定未经臭氧处理的甘薯淀粉和经臭氧处理0.8min及1.6min后的甘薯淀粉,衍射图谱如图6所示。使用配套jade软件分析计算淀粉结晶度及峰值分析报告,对应的峰值分析报告如表3、表4、表5所示。由图6及表3、表4、表5可知,甘薯淀粉的衍射图谱分别在15°和23°(2θ)处存在两个宽的单峰,在17-18°(2θ)处有存在一个双重峰,可知甘薯淀粉都是典型的“a”型淀粉,说明臭氧处理过程中,淀粉的结晶型保持不变。未经臭氧处理的甘薯淀粉结晶度为37.9%,臭氧处理时间为0.8min及1.6min的甘薯淀粉结晶度为38.5%和32.1%,由此可知,随着臭氧处理时间的增加,臭氧处理时间较短时,淀粉结晶度呈现增加的趋势,当臭氧处理时间持续增加结晶度呈现减小的趋势。由此说明,臭氧处理甘薯淀粉,在短时间内先作用于淀粉的无定型区,随着臭氧处理时间的增加,再作用于淀粉的结晶区。
表3未经臭氧处理(0min)的甘薯淀粉峰值分析表
表4臭氧处理时间为0.8min的甘薯淀粉峰值分析表
表5臭氧处理时间为1.6min的甘薯淀粉峰值分析表
6、淀粉黏度特性测定
使用rva测定甘薯淀粉黏度特性,结果如表6所示。崩解黏度为峰值黏度与最低黏度的差值,代表淀粉糊的稳定性;回生黏度为最终黏度与最低黏度的差值,代表淀粉糊的回生特性。由表6可知,未经臭氧处理的淀粉峰值黏度、最低黏度、崩解黏度、最终黏度、回生黏度均最大,与经臭氧处理的淀粉相比,差异显著(p<0.05),随着臭氧处理时间的增加,以上黏度指标呈现减小的趋势。说明,臭氧处理降低了淀粉黏度,增加了淀粉糊稳定性和回生性。淀粉的峰值时间(糊化时间,下同)及糊化温度各组淀粉之间不存在显著性差异,说明臭氧处理对淀粉分子的主体结构影响不大,且对以此淀粉为原料生产的制品蒸煮特性没有影响。由此可知,臭氧处理会降低淀粉峰值黏度、最低黏度、最终黏度,但是对淀粉峰值时间及糊化温度没有影响。
表6不同臭氧处理时间的甘薯淀粉黏度特性参数
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
7、淀粉凝沉性质测定
不同臭氧处理时间的甘薯淀粉凝沉性质测定结果如图7所示。稀淀粉糊经过一段时间后会逐渐变浑浊分层沉淀,出现上方清液下方沉淀物的现象(即凝沉)。清液体积越大其凝沉性越强。凝沉值大小是代表淀粉老化难易的一个指标,凝沉值越大说明淀粉糊在放置过程中析出的上清液越多,淀粉糊越易老化。说明:由于1.2min组和1.6min组透明度较高,未观察分层情况,所以只列出了0min、0.4min和0.8min组。由图7可知,淀粉糊在放置过程中随着时间的延长,凝沉值逐渐增大。在0-8h内,淀粉糊的上清液体积增加速度最迅速,24h后淀粉糊的上清液体积增加速度减缓。淀粉糊上清液不在增加后,未经臭氧处理组的淀粉糊凝沉值最小,低于臭氧处理组,但差异不显著。由此可知,臭氧处理会增加甘薯淀粉凝沉性但是未出现显著性差异。
8、淀粉溶解度、膨润力测定
甘薯淀粉溶解度、膨润力测定结果如表7所示。淀粉的溶解度和膨润力是淀粉颗粒与水分子相互作用特性的表观反应,膨润度越大,持水能力越强,淀粉分子颗粒间强度越低。通常直链淀粉含量越高,膨润度就越小,反之越大。由表7可知,未经臭氧处理的淀粉溶解度最小,随着臭氧处理时间的增加,淀粉的溶解度不断增大,臭氧处理时间为0.8min时与未经臭氧处理组之间出现显著性差异(p<0.05)。未经臭氧处理的淀粉膨润力最大,随着臭氧处理时间的增加,淀粉的膨润力不断减小,臭氧处理时间为1.2min时与未经臭氧处理组之间出现显著性差异(p<0.05)。由此可知,臭氧处理会增加甘薯淀粉的溶解度,减小甘薯淀粉的的膨润力。这可能是由于氧化后淀粉颗粒的结构被分解以及直链淀粉的浸出和扩散导致。
表7甘薯淀粉溶解度、膨润力、透明度、冻融稳定性
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
9、淀粉糊透明度测定
甘薯淀粉透明度测定结果如表7、图8所示。淀粉糊透明度由淀粉糊透光率来表示,显示其与水结合能力的强弱。淀粉中支、直链淀粉含量不同,透明度也不同,一般认为,直链淀粉含量越高,光线穿过时,由于直链淀粉间彼此缔合而使淀粉糊产生回生现象,减弱了光的透射,从而使得淀粉糊的透明度降低。由表7可知,未经臭氧处理的淀粉透明度最小,随着臭氧处理时间的增加,淀粉的透明度不断增大,且实验各组间存在显著性差异(p<0.05)。由此可知,臭氧处理会增加淀粉糊透明度。
10、淀粉冻融稳定性测定
甘薯淀粉冻融稳定性测定结果如表7所示。淀粉糊的冻融脱水作用与淀粉的回生性相关,根据淀粉糊脱水量的多少来衡量淀粉的回生程度,一般而言,脱水量越高,淀粉的回生程度越高。由表7可知,未经臭氧处理的淀粉冻融稳定值最小,且显著小于臭氧处理各组(p<0.05),随着臭氧处理时间的增加,淀粉的冻融稳定值不断增大。由此可知,未经臭氧处理的淀粉冻融稳定性最好,臭氧处理后的淀粉冻融稳定性降低,说明臭氧处理会降低甘薯淀粉糊的冻融稳定性。
11、淀粉红外光谱分析
使用红外光谱扫描甘薯淀粉,未经臭氧处理及经臭氧处理各组的ft-ir光谱图如图8所示。由图可以看出,3387cm-1处的吸收峰是葡萄糖单元上-oh的伸缩震动峰;2930cm-1处的吸收峰是c-h键的伸缩震动峰,1642cm-1处是典型的水峰或淀粉衍生物的吸收峰,各组淀粉峰型相似,但是3600-3400cm-1之间有差异,未经臭氧处理的甘薯淀粉峰型最宽,随着臭氧处理时间的增加峰型逐渐变尖。3600-3400cm-1之间为较宽峰,是由o-h的伸缩振动引起的,与淀粉分子中葡萄糖苷链间或者链分子内氢键的连接有关,包括自由羟基基团和形成氢键的羟基基团;宽峰型反映淀粉分子间羟基团的复杂伸缩振动,尖锐峰型反映分子内羟基基团和自由羟基基团的伸缩运动。由此可知,随着臭氧处理时间的增加,甘薯淀粉形成了较多的分子内羟基基团和自由羟基基团,使得淀粉分子内氢键作用力减弱,颗粒内部稳定性降低。
12、淀粉羧基含量测定
不同臭氧处理时间的甘薯淀粉羧基含量测定结果如图9所示,由图可知,随臭氧处理时间的增加,淀粉中羧基含量也随之增加,且各组间增加趋势具有显著性差异(p<0.05)。由此可知,臭氧与其他氧化剂一样,作用于淀粉分子中葡萄糖单元上的羟基,而且随臭氧处理时间的延长,淀粉分子中葡萄糖单元上的羟基被持续氧化为羧基。
13、直、支链淀粉含量的测定
甘薯淀粉的直、支链淀粉含量如表8所示,由表8可知,未经臭氧处理的淀粉直链淀粉含量最高,显著高于臭氧处理后的各组淀粉(p<0.05),随着臭氧处理时间的增加,直链淀粉含量呈显著降低的趋势(p<0.05);未经臭氧处理的淀粉支链淀粉含量最低,显著低于臭氧处理后的淀粉(p<0.05),随着臭氧处理时间的增加,支链淀粉含量呈先上升后下降的趋势。由此可知,臭氧处理会使得淀粉的直链淀粉含量减少,支链淀粉含量先上升后下降。
表8甘薯淀粉的直、支链淀粉含量
注:矫正方法为将直链淀粉和支链淀粉的含量之和调整为100%。a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
14、淀粉分子量及其分布的测定
使用凝胶色谱-示差-多角度激光散射(gpc-ri-mals)的方法测定0min组、0.8min组和1.6min组淀粉的分子量分布,结果如图10和表9。支链淀粉分子量较大先出峰对应的保留时间较短,直链淀粉分子量较小后出峰对应的保留时间较长。根据淀粉分子量与时间关系曲线的斜率,可将曲线分为三段,每一段分别代表这一段时间内淀粉分子量的变化情况,将淀粉分为高分子量、中分子量和低分子量三部分。由图表可知,原淀粉的数均分子量(mn)、重均分子量(mw)均最大,随着臭氧处理时间的增加,淀粉分子量呈减小的趋势。数均分子量(mn)高分子量部分,与原淀粉(3.808×107)相比,臭氧处理0.8min后淀粉(3.173×107)与原淀粉稍有下降但相差不大,臭氧处理1.6分钟后下降到1.197×107,但还是处在同一数量级;中分子量部分,原淀粉与0.8min组稍有下降但相差不大,但是1.6min组却下降到3.755×106,下降了一个数量级;低分子量分布部分,随着臭氧处理时间的增加逐渐下降,各组分别处在依次减小的数量级。重均分子量(mw)与数均分子量结果类似。原淀粉的分散系数最低,说明其分布窄,而臭氧处理后的淀粉分散系数增加说明经过臭氧的处理,淀粉成为分散度高,分布较宽的聚合物。这一现象也可以通过图的纵坐标范围来判断。淀粉的分散度差异主要分布在高分子量部分,原淀粉的分散度为1.117,0.8min组增加到1.226,1.6min组持续增加到1.417,再加上低分子量部分聚合度由原淀粉的1.014增大到1.282,由此可以推测,臭氧处理使得支链淀粉发生了解聚。
表9gpc-ri-mals测量淀粉的分子量及其分布结果
研究结果表明,未经臭氧处理的甘薯淀粉颗粒大多数呈球形、铃铛形,存在少量不规则形状。经臭氧处理后,部分甘薯淀粉颗粒表面变得凹凸不平,且随着臭氧处理时间的增加不规则塌陷淀粉颗粒数量呈增加的趋势;臭氧处理后淀粉的结晶型保持不变,臭氧处理时间较短时,淀粉结晶度呈现增加的趋势,当臭氧处理时间持续增加结晶度呈现减小的趋势;各组淀粉红外色谱图中峰型相似;经臭氧处理后的甘薯淀粉粒径变大,白度增加,羧基含量也增加,凝沉性稍微增加但是未出现显著性差异,淀粉糊冻融稳定值、透明度增加;臭氧处理会降低淀粉峰值黏度、最低黏度、最终黏度,但是对淀粉峰值时间及糊化温度没有影响;会增加甘薯淀粉的溶解度,减小甘薯淀粉的的膨润力;会使得淀粉的直链淀粉含量减少,支链淀粉含量先上升后下降;会使得淀粉数均分子量(mn)、重均分子量(mw)变小,分散度变大。
臭氧处理对湿淀粉储藏品质的影响
实验处理方法:如图2所示,在无菌操作台中,取200g甘薯淀粉置于玻璃反应器中,加入等质量自来水,使用磁力搅拌器将淀粉悬浊液搅拌均匀,开启臭氧发生器,待流速稳定后接入反应器中并开始计时,臭氧处理时间分别为80min(对应每克淀粉处理时间为0.4min),处理完后用立即用封口膜密封,外加一层保鲜膜。对照组用磁力搅拌器将淀粉悬浮液搅拌均匀后用封口膜密封。选择室温及37℃为试验储藏温度。在37℃恒温箱及室温下分别放置12组经臭氧处理后的湿淀粉,3组未经臭氧处理的湿淀粉。传统储藏方法高温时一般2-3d换水一次,温度较低时一般4-5d换水一次,结合传统储藏方法的换水时间确定各个温度下换水时间如下:
37℃,对照组:2d换水一次,换入新鲜自来水;处理组1:4d换水一次,换入臭氧处理后的水(测得臭氧浓度为0.54mg/l,下同);处理组2:6d换水一次,换入臭氧处理后的水;处理组3:8d换水一次,换入臭氧处理后的水;处理组4:10d换水一次,换入臭氧处理后的水。
室温(25℃,下同),对照组:4d换水一次,换入新鲜自来水;处理组1:8d换水一次,换入臭氧处理后的水(测得臭氧浓度为0.54mg/l,下同);处理组2:12d换水一次,换入臭氧处理后的水;处理组3:16d换水一次,换入臭氧处理后的水。其中对照组换新鲜的自来水,处理组换经臭氧处理后的水,测得臭氧浓度为0.54mg/l。每次换水时测定淀粉液上层水的ph。每隔30d取三个平行样对37℃和室温条件下储藏的淀粉进行各个指标的测定。
1、淀粉水层ph测定:根据37℃及室温条件下每组淀粉的换水时间,每次换水时使用ph计测定淀粉储藏初期淀粉水层ph值,结果如图11(a)、图11(b)。由图可知,随着储藏时间的延长,各组淀粉水层ph值不断下降后趋于平缓。臭氧处理使得淀粉储藏体系初始ph值(5.20左右)低于对照组(6.90左右),在储藏过程中处理组的ph值也低于对照组,趋于平缓后37℃的6d、8d组和室温的12d组与对照组ph值较接近。由此可知,储藏过程中,淀粉水层ph不断下降后趋于平缓。
2、淀粉菌落总数测定:使用平板计数法测定甘薯淀粉菌落总数,结果如图12(a)和图12(b)所示,37℃条件下储藏的结果如图12(a)所示,室温条件下储藏的结果如图12(b)所示。由图可知,37℃条件下,菌落总数从大到小的顺序依次为:对照组>10d组>4d组>6d组>8d组。室温条件下,菌落总数从大到小的顺序依次为:对照组>16d组>12d组>8d组。由此可知,室温及37℃条件下储藏的淀粉,臭氧处理组菌落总数均低于对照组,说明臭氧的杀菌效果良好。
3、淀粉色泽测定:甘薯淀粉储藏90天后的色泽测定结果如表10所示。由表10可知,37℃条件下储藏的甘薯淀粉白度值从大到小依次为:8d组>6d组>4d组>10组>对照组,对照组总色差显著低于各处理组(p<0.05);室温条件下储藏的甘薯淀粉白度值为对照组和16d组显著低于8d组和12d组(p<0.05)。由此可知,处理组经储藏后,依然保持较高的白度,说明此储藏方法对甘薯淀粉的白度的提高具有积极的影响。
表10储藏90天后甘薯淀粉色泽变化情况
4、淀粉颗粒形貌测定:
使用扫描电镜观察37℃条件下储藏90天后的甘薯淀粉颗粒,结果如图13所示。由图13可以明显的看到,对照组、6d组(换水时间,下同)、8天组的甘薯淀粉颗粒观察到的球形、铃铛状数量较多,不规则形状较少,而4d组及10d组,存在的不规则形状数量较多,且部分淀粉聚集在一起。说明,对照组、6d组和8天组能较好的保持淀粉颗粒原有的外貌形态。图13中红色箭头是指出现差异变化的淀粉颗粒。
5、淀粉结晶类型测定
使用xrd测定储藏90天后的甘薯淀粉x-衍射图谱如图14(a)和图14(b)所示。37℃条件下储藏的对照组、8d组甘薯淀粉颗粒结果如图14(a)所示,对应的峰值分析报告如表11(a)、表11(b)所示;室温条件下储藏的对照组、12d组甘薯淀粉颗粒结果如图14(b)所示,对应的峰值分析报告如表11(c)、表11(d)。由图14(a)、图14(b)及表11(a)、表11(b)、表11(c)、表11(d)可知,甘薯淀粉的衍射图谱分别在15°和23°(2θ)处存在两个宽的单峰,在17-18°(2θ)处有存在一个双重峰,可知甘薯淀粉均为“a”型淀粉,说明储藏对淀粉的结晶型没有影响。37℃条件下储藏的甘薯淀粉对照组结晶度为33.0%,8d组的结晶度为34.9%;室温条件下储藏的甘薯淀粉对照组结晶度为36.50%,12d组的结晶度为37.3%。由此可知,不同温度和不同换水时间条件下储藏90d后,甘薯淀粉的结晶类型没有受到影响;室温储藏的各组淀粉结晶度高于37℃储藏的淀粉,说明温度是影响淀粉储藏品质的因素之一。不同温度下,对照组结晶度均稍低于处理组,且低于原淀粉(未经臭氧处理的淀粉),说明对照组结晶结构受破坏程度高于处理组。
表11(a)37℃对照组(2d)储藏90天后甘薯淀粉峰值分析表
表11(b)37℃处理组(8d)组储藏90天后甘薯淀粉峰值分析表
表11(c)室温对照组(4d)储藏90天后甘薯淀粉峰值分析表
表11(d)室温处理组(12d)组储藏90天后甘薯淀粉峰值分析表
6、淀粉黏度特性测定:
使用rva测定甘薯淀粉黏度特性,结果如表12(a)、表12(b)所示,37℃条件下储藏的结果如表12(a)所示;室温条件下储藏的结果如表12(b)所示。
由表12(a)可知,37℃条件下储藏30d后,对照组的峰值黏度、最低黏度和最终黏度与6d组和8d组之间无显著性差异,但显著高于4d组和10天组(p<0.05)。对照组崩解黏度低于6d组和8d组高于10d组,回生黏度低于6d组,与8d组无显著性差异,高于10d组。各组的峰值时间及糊化温度没有显著性差异;储藏60d后,对照组各个黏度指标均与6d组和8d组之间无显著性差异,但峰值黏度显著高于4d组和10天组(p<0.05);储藏90d后,对照组各个黏度指标均与6d组和8d组之间无显著性差异。对照组峰值黏度、崩解黏度、回生黏度均与4d组间无显著性差异,而与10d组间差异显著(p<0.05)。
由表12(b)可知,室温条件下储藏30d后,对照组黏度指标与12d组间均无显著性差异,峰值时间和糊化温度高于12d组,对照组峰值黏度显著高于8d组和16d组,最低黏度、崩解黏度最终黏度均显著高于16d组(p<0.05);储藏60d后,对照组黏度特性指标均与12d组无显著性差异,峰值黏度、最低黏度、最终黏度与8d组无显著性差异但与16d组差异显著(p<0.05);储藏90d后对照组黏度特性各个指标与12d组均无显著性差异,峰值黏度显著高于8d组和16d组,最低黏度、崩解黏度、最终黏度、回生黏度均与8d组无显著差异,但显著高于16d组。
由此可知,随着储藏时间的延长,淀粉的黏度呈下降的趋势,但对淀粉峰值时间及糊化温度没有影响;37℃条件下储藏的对照组淀粉黏度特性与6d组和8d组之间无显著性差异,室温条件下储藏的对照组淀粉黏度特性与12d组间无显著性差异;随着储藏时间的延长,可以推测,在储藏过程中,微生物对淀粉黏度性质的影响可能大于臭氧的影响。
表12(a)37度条件下不同换水时间对淀粉黏度的影响
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
表12(b)室温条件下不同换水时间对淀粉黏度的影响
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
7、淀粉凝沉性测定
储藏90d后甘薯淀粉凝沉性质测定结果如表13所示,由表13可知,各组淀粉糊在放置过程中随着凝沉时间的延长,凝沉值逐渐增大。在0-8h内,淀粉糊的上清液体积增加速度最快,24h后淀粉糊的上清液体积增加速度减缓。37℃条件下储藏的甘薯淀粉,48h后凝沉值最大的是10d组,且显著高于其余各组,其次是4d组、对照组和6d组,最小的是8d组而且显著低于对照组(p<0.05);室温条件下储藏的甘薯淀粉,48h后凝沉值各组间无显著性差异。由此可知,室温条件下储藏温度较低时,各组淀粉的凝沉值未见显著差异;37℃条件下储藏的甘薯淀粉8d组凝沉值最小,显著低于对照组,说明其最不容易老化。
表13储藏90天后淀粉凝沉值、透明度
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
8、淀粉透明度测定
储藏90d后的甘薯淀粉透明度测定结果如表13所示,37℃条件下储藏的甘薯淀粉,对照组透明度与8d组无显著性差异,高于6d组、10d组但低于4d组;室温条件下储藏的甘薯淀粉,透明度大小依次为8d组>对照组>16d组>12d组。由此可知,温度较低时,影响淀粉透明度的主要原因是相同时间内换水的次数,所以呈现出表中的结果,37℃和室温条件下储藏的淀粉换水最频繁组(4d和8d组)透明度均是对应条件下最高的。
9、淀粉溶解度、膨润力测定
储藏后的淀粉溶解度及膨润力测定结果如表14所示。由表14可知,储藏后的淀粉溶解度和膨润力均呈现出下降的趋势。37℃条件下储藏的甘薯淀粉,不同储藏时间和不同换水时间对淀粉的溶解度影响未见显著性差异;储藏90d后,对照组和10d组膨润力显著低于4d组、6d组和8d组。室温条件下储藏的甘薯淀粉,30d后,淀粉的溶解度和膨润力均未见显著变化;90d后,对照组溶解度与12d组未出现显著性差异,8d组溶解度显著高于对照组和12d组,这与第三章得出的臭氧处理时间越长淀粉溶解度也随之越大的结果一致,8d组换水次数最频繁,其淀粉与臭氧接触的时间最久,8d组的溶解度最大。由此可知,随着储藏时间的延长,淀粉溶解度和膨润力均呈现出下降的趋势,37℃条件下,4d组、6d组和8d组能较好的保持原有的膨润力;室温条件下,对照组溶解度与12d组未出现显著性差异。
表14不同储藏时间对淀粉溶解度、膨润力、冻融稳定性的影响
注:a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
10、淀粉冻融稳定性测定
储藏后的淀粉冻融稳定性测定结果如表14所示。由表14可知,不同温度、不同储藏时间下,储藏后的淀粉冻融值均呈现出上升的趋势。不同储藏温度下,换水时间间隔最长组即37℃度10d组、室温16d组的冻融值一直最高,显著高于同一温度下的其余各组(p<0.05)。室温下,处理组冻融值从大到小依次为:16d组>12d组>8d组;37℃度下,处理组冻融值从大到小依次为:10d组>4d组>6d组>8d组。由此可知,室温室温条件下,储藏温度较低时,处理组随着换水时间的增加,冻融值增加,而37℃度储藏时,并不依照此规律,而是要在合适的换水时间下才能保持较好的冻融稳定性。
11、淀粉红外光谱分析:
使用红外光谱扫描储藏90d后的甘薯淀粉,ft-ir光谱图如图15(a)、图15(b)所示。37℃条件下储藏的结果如图15(a),室温条件下储藏的结果如图15(b)。由图可看出,3390cm-1处和3388cm-1处的吸收峰是葡萄糖单元上-oh的伸缩震动峰;2930cm-1处和2929cm-1处的吸收峰是c-h键的伸缩震动峰,1643cm-1处和1641cm-1处是典型的水峰或淀粉衍生物的吸收峰,不同温度下各组淀粉峰型相似,未见明显差异。此外,相关文献表明,1738cm-1处若存在吸收峰则为c=o引发的伸缩振动峰,但各组淀粉的红外图谱均没有此吸收峰的存在,由此说明储藏过程未对淀粉发生高度氧化。
12、淀粉支、直链淀粉含量测定
储藏90d后的甘薯淀粉支、直链淀粉含量测定结果表15。由表15可知,37℃条件下,对照组直链淀粉含量显著低于6d组和8d组,显著高于4d组和10d组(p<0.05)。对照组支链淀粉含量显著低于6d组和8d组,与4d组无显著性差异,显著高于10d组(p<0.05);室温条件下,对照组直链淀粉含量显著高于其余各组,12d组又显著高于8d组和16d组(p<0.05)。对照组支链淀粉含量显著低于显著低于12d组,与16d组无显著性差异,显著高于8d组(p<0.05)。说明,淀粉低温储藏时,对照组和12d组能较好的保持淀粉原有的直支链淀粉含量,而温度较高时处理组中6d组和8d组能较好的保持淀粉原有的直支链淀粉含量。
表15储藏90天后淀粉支、直链淀粉含量
注:矫正方法为将直链淀粉和支链淀粉的含量之和调整为100%。a、b、c等不同字母表示各组间存在显著性差异,(p<0.05)。
13、淀粉分子量及其分布的测定
使用凝胶色谱-示差-多角度激光光散射(gpc-ri-mals)的方法测定37℃条件下储藏的对照组和换水时间为8d组(处理组)淀粉的分子量分布,结果如图16和表16。由图和表可知,对照组的数均分子量(mn)、重均分子量(mw)均小于处理组,而处理组的数均分子量(mn)、重均分子量(mw)及分散系数更接近与原淀粉(第三章中对照组淀粉)。数均分子量(mn)高分子量部分,中分子量部分对照组均稍大于处理组,但是低分子量部分,对照组为7.926×106处理组为1.034×107相差了一个数量级。重均分子量(mw)类似于数据分子量,与对照组相比,处理组高分子量部分和中分子量部分稍高,但低分子量部分高出了一个数量级,处理组为8.254×106,对照组为1.071×107。对照组和处理组的分散度高、中、低分子量部分均差异不大。由此可以说明,处理组经储藏后分子量及其分布情况稍优于对照组更接近原淀粉。
表16gpc-ri-mals测量淀粉的分子量及其分布结果
通过本发明保藏湿淀粉,在最佳处理条件下,可将传统湿淀粉保藏更换减菌水的时间从高温(37℃)条件下2天更换一次延长到8天换水1次,在室温(25℃以下)条件下湿淀粉减菌水更换时间从传统的4天延长到12天更换1次。本发明不仅能有效延长湿淀粉的储藏时间,降低换水频率,减少储藏用水量,节约储藏成本,减少废水排放对环境的污染;同时可以提高淀粉的白度,提高淀粉的冻融稳定性。
本发明研究了不同温度下储藏,不同换水时间对淀粉的影响,研究发现,储藏后37℃条件下,6d组和8d组的ph值、淀粉颗粒形态与对照组相差不大;6d组和8d组菌落总数显著低于对照组;甘薯淀粉的结晶类型相同,对照组结晶结构受破坏程度高于8d组;对照组淀粉黏度特性与6d组和8d组之间无显著性差异;与对照组相比,处理组经储藏后,依然保持较高的白度;甘薯淀粉8d组凝沉值最小,显著低于对照组;对照组透明度与8d组无显著性差异;6d组和8d组能较好的保持原有的膨润力;处理组中6d组和8d组能较好的保持淀粉原有的直支链淀粉含量;对照组的数均分子量(mn)、重均分子量(mw)均小于处理组,且处理组的数均分子量(mn)、重均分子量(mw)及分散系数更接近与原淀粉,即处理组经储藏后分子量及其分布情况稍优于对照组更接近原淀粉。室温条件下储藏时,12d组的ph值、淀粉颗粒形态与对照组相差不大;12d组菌落总数显著低于对照组;甘薯淀粉的结晶类型相同,对照组结晶结构受破坏程度高于12d组;对照组淀粉黏度特性、凝沉值、溶解度与12d组间无显著性差异;处理组经储藏后,依然保持较高的白度;透明度12d组低于对照组;12d组冻融性优于对照组;对照组和12d组能较好的保持淀粉原有的直支链淀粉含量。实验发现,37℃条件下8d组淀粉,室温条件下12d组淀粉品质最佳。37℃储藏由传统储藏的2d换水一次延长到8d换水一次;室温储藏由传统储藏的4d换水一次延长到12d换水一次。
图17显示为本发明实际应用时,采用的湿淀粉大池储藏设施布局示意图,淀粉池中设有用于引入减菌水的减菌水水管以及用于排出酸变水的吸水软管,淀粉池附近设有水减菌池,用于预先对自来水进行减菌处理,减菌池通过气体管道连通有臭氧机,臭氧机中的臭氧通入减菌池中进行减菌处理。
采用图17所示系统进行淀粉储藏时,具体包括如下步骤:
s1、淀粉浆减菌处理:将精制淀粉加入洁净水(通常为自来水)调浆,将鲜淀粉调节成浓度20~50%的淀粉浆,使用搅拌器将淀粉悬浊液搅拌均匀,开启臭氧发生器,待流速稳定后接入反应器中并开始计时,臭氧通入量为100~1000mg/kg淀粉浆,臭氧处理时间为30~200min,处理完后转入大池中,加盖密封,淀粉浆自然沉淀,密闭储藏。
s2、湿淀粉管理储藏:每隔3天检测上层减菌水和淀粉层0.5米厚处淀粉的ph值,当ph值低于4.5时,开始换水。
s3、减菌水的置换:开启池边的排水口,让淀粉上层水进入排水管道中,排水时注意控制水流速度,减少因水流过快引起的上层淀粉振动随水排除量。控制排除废水中淀粉含量不超过3wt%。当上层减菌水基本排出后,用泵将减菌池中经过臭氧灭菌的净水送入淀粉大池,用细长布袋包裹进水口,该布袋用于缓冲水对池中上层淀粉的冲击。换水频率取决于室温,若室温在25℃以下,换水时间为6~12天一次,若气温高于25℃,则5~10天更换一次。
s4、减菌水处理:减菌池中净水通入臭氧,控制臭氧水中臭氧浓度为1mg/l,开启臭氧发生器,将臭氧通入容器的水中,让臭氧溶解在水中,制备臭氧水,控制水中臭氧浓度为0.30~0.95mg/l,处理时间10min,处理完的臭氧水泵入淀粉池中。
综上所述,本发明有效减少了淀粉储藏过程中的用水量,从而降低了淀粉储藏的成本,并且,储藏后的淀粉品质更接近于原淀粉,具有较高的应用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!