精氨基琥珀酸合成酶缺乏症的MRNA疗法的制作方法
本专利申请要求2013年10月22日提交的美国临时申请No.61/894,294的优先权,其公开内容据此以引用方式并入。
背景技术:
精氨基琥珀酸合成酶缺乏症(ASD)是一种常染色体隐性代谢遗传性障碍,其特征在于精氨基琥珀酸合成酶(ASS1)的基因中发生突变,从而影响其结合到瓜氨酸、天冬氨酸盐和其它分子的能力。ASS蛋白中的缺陷破坏尿素循环并阻止肝脏将多余的氮适当地处理成尿素。尿素循环中累积的氨和其它副产物(诸如瓜氨酸)是毒性的,并且当出现在生命的早期时,可导致诸如精神不振(嗜睡)、食欲不振、呕吐、痉挛和意识丧失的症状。目前,对于这种疾病没有治愈方法,并且护理标准是通过饮食管理,将含大量蛋白质的食物降至最小程度,以及精氨酸和乙酸苯酯的膳食补充剂。
技术实现要素:
本发明除了其它方面以外提供了基于mRNA疗法治疗精氨基琥珀酸合成酶缺乏症(ASD)的改进的方法和组合物。本发明涵盖以下观察结果:施用包封在脂质体内的编码人ASS1蛋白的mRNA导致高效持久的体内蛋白生成以及临床相关的疾病标志物血浆氨水平成功降低。
在一个方面,本发明提供了治疗ASD的方法,包括以有效剂量和施用间隔给需要治疗的受试者施用包含编码精氨基琥珀酸合成酶(ASS1)的mRNA的组合物,使得ASD的至少一种症状或特征在强度、严重程度或频率上降低或延缓发作。在一些实施例中,mRNA包封在脂质体内。
在另一方面,本发明提供了用于治疗ASD的组合物,其包含以有效剂量包封在脂质体内的编码ASS1的mRNA。
在一些实施例中,合适的脂质体包含一种或多种阳离子脂质、一种或多种非阳离子脂质、一种或多种基于胆固醇的脂质以及一种或多种PEG改性脂质。
在一些实施例中,一种或多种阳离子脂质选自C12-200、MC3、DLinDMA、DLinkC2DMA、cKK-E12、ICE(基于咪唑的)、HGT5000、HGT5001、DODAC、DDAB、DMRIE、DOSPA、DOGS、DODAP、DODMA和DMDMA、DODAC、DLenDMA、DMRIE、CLinDMA、CpLinDMA、DMOBA、DOcarbDAP、DLinDAP、DLincarbDAP、DLinCDAP、KLin-K-DMA、DLin-K-XTC2-DMA、HGT4003以及它们的组合。
在一些实施例中,一种或多种阳离子脂质包括式I-c1-a的化合物:
或其药学上可接受的盐,其中:
每个R2独立地为氢或C1-3烷基;
每个q独立地为2至6;
每个R'独立地为氢或C1-3烷基;
并且每个RL独立地为C8-12烷基。
在一些实施例中,一种或多种阳离子脂质包括cKK-E12:
在一些实施例中,适用于本发明的一种或多种非阳离子脂质选自DSPC(1,2-二硬脂酰基-sn-甘油-3-磷酰胆碱)、DPPC(1,2-二棕榈酰基-sn-甘油-3-磷酰胆碱)、DOPE(1,2-二油烯基-sn-甘油-3-磷酰乙醇胺)、DOPC(1,2-二油烯基-sn-甘油-3-磷脂酰胆碱)、DPPE(1,2-二棕榈酰基-sn-甘油-3-磷酰乙醇胺)、DMPE(1,2-二肉豆蔻酰基-sn-甘油-3-磷酰乙醇胺)、DOPG(,2-二油酰基-sn-甘油-3-磷酰-(1'-rac-甘油))以及它们的组合。
在一些实施例中,一种或多种基于胆固醇的脂质选自胆固醇、PEG化胆固醇和DC-Chol(N,N-二甲基-N-乙基酰胺基胆固醇)、1,4-二(3-N-油烯基氨基-丙基)哌嗪。
在一些实施例中,脂质体还包含一种或多种PEG改性脂质。在一些实施例中,一种或多种PEG改性脂质包含长度为至多5kDa的聚乙二醇链,该聚乙二醇链共价附接到具有C6-C20长度烷基链的脂质。在一些实施例中,PEG改性脂质是衍生化神经酰胺,诸如N-辛酰基-鞘氨醇-1-[琥珀酰基(甲氧基聚乙二醇)-2000]。在一些实施例中,PEG改性或PEG化脂质为PEG化胆固醇或二肉豆蔻酰基甘油(DMG)-PEG-2K。
在一些实施例中,合适的脂质体包含选自以下的组合:cKK-E12、DOPE、胆固醇和DMG-PEG2K;C12-200、DOPE、胆固醇和DMG-PEG2K;HGT4003、DOPE、胆固醇和DMG-PEG2K;或ICE、DOPE、胆固醇和DMG-PEG2K。
在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)占脂质体的约30-60摩尔%(例如,约30-55摩尔%、约30-50摩尔%、约30-45摩尔%、约30-40摩尔%、约35-50摩尔%、约35-45摩尔%或约35-40摩尔%)。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)占脂质体的约30摩尔%、约35摩尔%、约40摩尔%、约45摩尔%、约50摩尔%、约55摩尔%或约60摩尔%)。
在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)比非阳离子脂质(例如,DOPE)比基于胆固醇的脂质(例如,胆固醇)比PEG化脂质(例如,DMG-PEG2K)的比率可分别在约30-60:25-35:20-30:1-15之间。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)比非阳离子脂质(例如,DOPE)比基于胆固醇的脂质(例如,胆固醇)比PEG化脂质(例如,DMG-PEG2K)的比率分别为大约40:30:20:10。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)比非阳离子脂质(例如,DOPE)比基于胆固醇的脂质(例如,胆固醇)比PEG化脂质(例如,DMG-PEG2K)的比率分别为大约40:30:25:5。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)比非阳离子脂质(例如,DOPE)比基于胆固醇的脂质(例如,胆固醇)比PEG化脂质(例如,DMG-PEG2K)的比率分别为大约40:32:25:3。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)比非阳离子脂质(例如,DOPE)比基于胆固醇的脂质(例如,胆固醇)比PEG化脂质(例如,DMG-PEG2K)的比率分别为大约50:25:20:5。
在一些实施例中,通过脂质体颗粒的最大直径的长度确定脂质体的尺寸。在一些实施例中,合适的脂质体的尺寸小于约500nm、400nm、300nm、250nm、200nm、150nm、100nm、75nm或50nm。在一些实施例中,合适的脂质体的尺寸小于约100nm、90nm、80nm、70nm或60nm。
在一些实施例中,以约0.1–5.0mg/kg体重范围内的剂量施用mRNA,例如约0.1–4.5、0.1–4.0、0.1–3.5、0.1–3.0、0.1–2.5、0.1–2.0、0.1–1.5、0.1–1.0、0.1-0.5、0.1-0.3、0.3–5.0、0.3-4.5、0.3–4.0、0.3–3.5、0.3–3.0、0.3–2.5、0.3–2.0、0.3–1.5、0.3–1.0、0.3-0.5、0.5–5.0、0.5-4.5、0.5–4.0、0.5–3.5、0.5–3.0、0.5–2.5、0.5–2.0、0.5–1.5或0.5–1.0mg/kg体重。在一些实施例中,以等于或小于约5.0、4.5、4.0、3.5、3.0、2.5、2.0、1.5、1.0、0.8、0.6、0.5、0.4、0.3、0.2或0.1mg/kg体重的剂量施用mRNA。
在一些实施例中,经静脉内施用所提供的组合物。在一些实施例中,通过肺部递送施用所提供的组合物。在某些实施例中,通过气溶胶化、吸入、雾化或滴注执行肺部递送。在一些实施例中,所提供的组合物被配制成可呼吸颗粒、可雾化脂质或可吸入干粉形式。
在一些实施例中,所提供的组合物每日施用一次、每周施用一次、每月施用两次、每月施用一次。在一些实施例中,所提供的组合物每7天施用一次、每10天施用一次、每14天施用一次、每28天施用一次或每30天施用一次。
在一些实施例中,ASS1蛋白在肝脏中表达。在一些实施例中,施用所提供的组合物导致ASS1蛋白的表达水平处于或高于约100ng/mg(例如,处于或高于约200ng/mg、400ng/mg、500ng/mg、1000ng/mg、2000ng/mg或3000ng/mg)肝脏中总蛋白。
在一些实施例中,施用组合物导致血清ASS1蛋白水平升高。在一些实施例中,施用组合物导致血清ASS1蛋白水平相比于治疗前的基线血清ASS1蛋白水平升高至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍或5倍。
在一些实施例中,施用组合物导致受试者的瓜氨酸水平相比于治疗前的基线瓜氨酸水平降低。在一些实施例中,施用组合物导致血浆瓜氨酸水平相比于治疗前的基线血浆瓜氨酸水平降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。在一些实施例中,施用组合物导致血浆瓜氨酸水平降低至小于约2000μM、1500μM、1000μM、750μM、500μM、250μM、100μM、90μM、80μM、70μM、60μM、50μM、40μM或30μM。
在一些实施例中,施用组合物导致受试者的氨水平相比于治疗前的基线氨水平降低。在一些实施例中,施用所提供的组合物导致血浆或血清中的氨水平降低至约3000μmol/L或更低、约2750μmol/L或更低、约2500μmol/L或更低、约2250μmol/L或更低、约2000μmol/L或更低、约1750μmol/L或更低、约1500μmol/L或更低、约1250μmol/L或更低、约1000μmol/L或更低、约750μmol/L或更低、约500μmol/L或更低、约250μmol/L或更低、约100μmol/L或更低或约50μmol/L或更低。在特定实施例中,施用所提供的组合物导致血浆或血清中的氨水平降低至约50μmol/L或更低。
在一些实施例中,施用所提供的组合物导致生物样品中的氨水平相比于治疗前的基线氨水平降低至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。合适的生物样品可为全血、血清、血浆或尿液。
在一些实施例中,mRNA为密码子优化的。在一些实施例中,密码子优化的mRNA包含SEQ ID NO:3、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15(对应于密码子优化的人ASS1mRNA序列)。在一些实施例中,mRNA包含SEQ ID NO:4的5’UTR序列(对应于5’UTR序列X)。在一些实施例中,mRNA包含SEQ ID NO:5的3’UTR序列(对应于3’UTR序列Y)。在一些实施例中,mRNA包含SEQ ID NO:6的3’UTR序列(对应于3’UTR序列Y)。在一些实施例中,密码子优化的mRNA包含SEQ ID NO:7或SEQ ID NO:8(对应于密码子优化的具有5’UTR和3’UTR序列的人ASS1mRNA序列)。
在一些实施例中,mRNA包括一种或多种修饰核苷酸。在一些实施例中,一种或多种修饰核苷酸包括假尿苷、N-1-甲基假尿苷、2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、C-5-丙炔基胞苷、C-5-丙炔基尿苷、2-氨基腺苷、C5-溴代尿苷、C5-氟代尿苷、C5-碘代尿苷、C5-丙炔基尿苷、C5-丙炔基胞苷、C5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、O(6)-甲基鸟嘌呤和/或2-硫代胞苷。在一些实施例中,mRNA为未修饰的。
在特定实施例中,本发明提供了用于治疗ASD的组合物,其包含以有效剂量包封在脂质体内的编码精氨基琥珀酸合成酶(ASS1)的mRNA,其中该mRNA包含SEQ ID NO:3、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15,并且另外其中脂质体包含阳离子或非阳离子脂质、基于胆固醇的脂质和PEG改性脂质。
在特定实施例中,本发明提供了用于治疗ASD的组合物,其包含以有效剂量包封在脂质体内的编码精氨基琥珀酸合成酶(ASS1)的mRNA,其中该mRNA包含SEQ ID NO:7或SEQ ID NO:8,并且另外其中脂质体包含阳离子或非阳离子脂质、基于胆固醇的脂质和PEG改性脂质。
本发明的其它特征、目的和优点在下面的具体实施方式、附图和权利要求中显而易见。然而应当理解,指示本发明的实施例的具体实施方式、附图和权利要求仅以举例方式给出,并非限制。本发明的范围之内的各种变化和修改将对本领域的技术人员显而易见。
附图说明
附图仅用于示例目的,并非限制。
图1示出了在用多个剂量的加载有人ASS1mRNA的基于cKK-E12的脂质纳米颗粒处理后,通过ELISA检测到的示例性ASS1蛋白水平。
图2A-2D示出了在经静脉内施用单剂量的包封有人ASS1mRNA的脂质纳米颗粒后的示例性Western印迹,其中将肝脏中的人ASS1蛋白水平比作剂量的函数。在施用后24小时处死CD1小鼠并取出肝脏,并且如上所述进行分析。利用2H8小鼠单克隆抗体检测人ASS1蛋白。将50微克总肝脏蛋白加载到每个孔。将重组人ASS1蛋白加载到每个凝胶上作为阳性对照(R5对照)。
图3示出了如通过ELISA测量的累积的人精氨基琥珀酸合成酶(ASS1)蛋白水平的示意图。所检测到的蛋白是通过单剂量脂质纳米颗粒(1.0mg/kg包封的ASS1mRNA)静脉递送的ASS1mRNA随时间推移的产量的结果。
图4A-4E示出了在经静脉内施用单剂量的包封有人ASS1mRNA的脂质纳米颗粒(1.0mg/kg剂量)后随时间推移的肝脏中的人ASS1蛋白水平的示例性Western印记。
图5A-5I示出了通过原位杂交检测经处理的小鼠肝脏中的人ASS1信使RNA。外源mRNA对于施用单剂量(1.0mg/kg)的加载有ASS1mRNA的基于cKK-E12的脂质纳米颗粒后至少7天可被观察到。人ASS1mRNA可在肝窦细胞以及肝细胞中被检测到。
图6A-6I示出了在施用1mg/kg含ASS1mRNA的cKK-E12脂质纳米颗粒后多个时间点处的小鼠肝脏中的ASS1蛋白水平的示例性免疫组织化学染色。人ASS1蛋白可在肝窦细胞以及肝细胞中被检测到。人ASS1蛋白对于施用单剂量的加载有ASS1mRNA的脂质纳米颗粒后至少一周可被检测到。
图7A-7B示出了在施用1mg/kg含ASS1mRNA的cKK-E12脂质体后24小时小鼠肝脏中的ASS1蛋白水平的低放大率(4x)免疫组织化学染色。未经处理的小鼠肝脏的比较结果(左)显示了人ASS1蛋白在整个肝脏中的广泛分布。
图8示出了如通过ELISA测量的人精氨基琥珀酸合成酶(ASS1)蛋白水平的示例图。所检测到的蛋白是通过单剂量的多种脂质纳米颗粒静脉内递送的ASS1mRNA的产量的结果。
图9示出了相比于稳定表达的阳性AS1细胞系(SK(+),克隆体#5),在将ASS1mRNA转染到ASS1KO细胞系(SK(-))中后结合到蛋白质中的14C精氨酸。对照物代表仅用脂质体处理的SK(-)细胞。
图10示出了在施用加载有ASS1mRNA的脂质纳米颗粒后24小时大鼠肝脏中的人ASS1蛋白水平。
图11示出了施用1.0mg/kg加载有ASS1mRNA的脂质纳米颗粒(按每14天一次施用30天)的AAS1基因敲除小鼠的血浆氨水平。
定义
为了使本发明更易于理解,首先对某些术语定义如下。以下术语和其它术语的另外的定义在本说明书通篇中示出。本文引用的描述发明背景以及提供关于其实践的另外的细节的公布和其它参考材料据此以引用方式并入。
烷基:如本文所用,“烷基”是指具有1至15个碳原子(“C1-15烷基”)的直链或支链的饱和烃基的自由基。在一些实施例中,烷基基团具有1至3个碳原子(“C1-3烷基”)。C1-3烷基基团的例子包括甲基(C1)、乙基(C2)、正丙基(C3)和异丙基(C3)。在一些实施例中,烷基基团具有8至12个碳原子(“C8-12烷基”)。C8-12烷基基团的例子包括但不限于正辛基(C8)、正壬基(C9)、正癸基(C10)、正十一烷基(C11)、正十二烷基(C12)等。前缀“n-”(正)是指无支链的烷基基团。例如,n-C8烷基是指-(CH2)7CH3,n-C10烷基是指-(CH2)9CH3等。
氨基酸:如本文所用,术语“氨基酸”最广义地讲是指任何可结合到多肽链的化合物和/或物质。在一些实施例中,氨基酸具有通式结构H2N–C(H)(R)–COOH。在一些实施例中,氨基酸是天然存在的氨基酸。在一些实施例中,氨基酸是合成氨基酸;在一些实施例中,氨基酸是d-氨基酸;在一些实施例中,氨基酸是l-氨基酸。“标准氨基酸”是指天然存在的肽中常见的20种标准l-氨基酸中的任何一者。“非标准氨基酸”是指除标准氨基酸之外的任何氨基酸,无论其是通过合成制备或是从天然来源获得。如本文所用,“合成氨基酸”包括化学改性的氨基酸,包括但不限于盐、氨基酸衍生物(诸如酰胺)和/或替代品。氨基酸(包括肽中的羧基末端氨基酸和/或氨基末端氨基酸)可通过如下方式改性:甲基化、酰胺化、乙酰化、保护基团和/或替换为可改变肽的循环半衰期而不会对其活性造成不利影响的其它化学基团。氨基酸可参与二硫键。氨基酸可以包括一种或翻译后修饰,诸如与一个或多个化学实体(例如,甲基、乙酸基团、乙酰基、磷酸基团、甲酰基部分、类异戊二烯基团、硫酸基团、聚乙二醇部分、脂质部分、烃部分、生物素部分等)缔合。术语“氨基酸”可与“氨基酸残基”互换使用,并且可指游离氨基酸和/或指肽的氨基酸残基。从使用该术语的上下文将显而易见的是,该术语是指游离氨基酸或是肽的残基。
动物:如本文所用,术语“动物”是指动物界里的任何成员。在一些实施例中,“动物”是指处于任何发育阶段的人。在一些实施例中,“动物”是指处于任何发育阶段的非人类动物。在某些实施例中,非人类动物是哺乳动物(例如,啮齿动物、小鼠、大鼠、兔子、猴子、狗、猫、羊、牛、灵长类动物和/或猪)。在一些实施例中,动物包括但不限于哺乳动物、鸟类、爬行动物、两栖动物、鱼、昆虫和/或蠕虫。在一些实施例中,动物可以是转基因动物、基因工程改造的动物和/或克隆体。
大约或约:如本文所用,术语“大约”或“约”如用于一个或多个所关注的值是指类似于指定参考值的值。在某些实施例中,除非另外指定或另外从上下文显而易见,否则术语“大约”或“约”是指在指定参考值的两个方向上(大于或小于)落入25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的一系列值(除了此类数值将超过可能值的100%的情况)。
生物活性:如本文所用,术语“生物活性”是指在生物系统中尤其是在生物体中具有活性的任何试剂的特征。例如,在施用给生物体时对该生物体具有生物效应的试剂被认为具有生物活性。
递送:如本文所用,术语“递送”包括局部递送和全身递送两者。例如,递送mRNA包括其中将mRNA递送到靶组织并且所编码的蛋白质在靶组织中表达并保持在靶组织内的情况(也称为“局部分布”或“局部递送”),以及其中将mRNA递送到靶组织并且所编码的蛋白质表达并分泌到患者的循环系统中(例如血清)并且全身分布并且被其它组织摄取的情况(也称为“全身分布”或“全身递送”)。
表达:如本文所用,核酸序列的“表达”是指mRNA翻译成多肽,将多个多肽组装成完整蛋白(例如酶)和/或多肽或完全组装蛋白(例如酶)的翻译后修饰。在本专利申请中,术语“表达”和“生成”以及等同的语法表达可互换使用。
官能化:如本文所用,“官能化”生物分子是具有表现出特征性属性和/或活性的形式的生物分子。
半衰期:如本文所用,术语“半衰期”是诸如核酸或蛋白浓度或活性的量降至如在某时间段开始时测量的值的一半所需的时间。
提高、升高或降低:如本文所用,术语“提高”、“升高”或“降低”以及等同的语法表达指示相对于基线测量值(诸如在开始本文所述治疗之前相同个体的测量值或不进行本文所述治疗的对照受试者(或多个对照受试者)的测量值)的值。“对照受试者”是患有与接收治疗的受试者相同形式的疾病的受试者,该受试者与接收治疗的受试者年龄大致相同。
体外:如本文所用,术语“体外”是指发生在人工环境中(例如,在试管或反应容器中,在细胞培养物中等)而不是在多细胞生物体内的事件。
体内:如本文所用,术语“体内”是指发生在诸如人和非人类动物的多细胞生物体内的事件。在基于细胞的系统的情况下,该术语可用于指发生在活细胞(与例如体外系统相对)内的事件。
分离的:如本文所用,术语“分离的”是指(1)与最初产生时(不管在自然中和/或在实验环境中)与其缔和的组分中的至少一些分离的和/或(2)通过人工产生、制备和/或制造的物质和/或实体。分离的物质和/或实体可与它们最初缔和的其它组分中的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或超过约99%分离。在一些实施例中,分离的试剂纯度为约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或超过约99%。如本文所用,如果某物质基本上不含其它组分,那么它是“纯”的。如本文所用,分离的物质和/或实体的纯度百分比的计算不应包括赋形剂(例如,缓冲剂、溶剂、水等)。
局部分布或递送:如本文所用,术语“局部分布”、“局部递送”或等同的语法表达是指组织特异性递送或分布。通常,局部分布或递送需要由mRNA编码的蛋白质(例如酶)在细胞内翻译并表达或者有限分泌以避免进入患者的循环系统。
信使RNA(mRNA):如本文所用,术语“信使RNA(mRNA)”是指编码至少一种多肽的多核苷酸。如本文所用的mRNA包括修饰RNA和未修饰RNA两者。mRNA可以包含一个或多个编码区和非编码区。mRNA可从天然来源纯化,利用重组表达系统产生并任选地纯化,化学合成等。如果适当的话,例如,就化学合成的分子而言,mRNA可包含核苷类似物,诸如具有化学改性的碱基或糖、主链修饰等的类似物。除非另外指明,否则mRNA序列以5’至3’方向呈现。在一些实施例中,mRNA为或包含天然核苷(例如,腺苷、鸟苷、胞苷、尿苷);核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、C-5-丙炔基胞苷、C-5-丙炔基尿苷、2-氨基腺苷、C5-溴代尿苷、C5-氟代尿苷、C5-碘代尿苷、C5-丙炔基尿苷、C5-丙炔基胞苷、C5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、O(6)-甲基鸟嘌呤和2-硫代胞苷);化学改性的碱基;生物改性的碱基(例如,甲基化碱基);嵌入性碱基;改性的糖(例如,2’-氟核糖、核糖、2’-脱氧核糖、阿拉伯糖和己糖);和/或改性的磷酸基团(例如,硫代磷酸酯和5’-N-亚磷酰胺键)。
核酸:如本文所用,术语“核酸”最广义地讲是指结合或可结合到多核苷酸链的任何化合物和/或物质。在一些实施例中,核酸是通过磷酸二酯键结合到或可结合到多核苷酸链中的化合物和/或物质。在一些实施例中,“核酸”是指单独的核酸残基(例如,核苷酸和/或核苷)。在一些实施例中,“核酸”是指包含单独的核酸残基的多核苷酸链。在一些实施例中,“核酸”包括RNA以及单链和/或双链DNA和/或cDNA。
患者:如本文所用,术语“患者”或“受试者”是指可例如出于实验、诊断、预防、美容和/或治疗目的对其施用所提供的组合物的任何生物体。典型的患者包括动物(例如,哺乳动物,诸如小鼠、大鼠、兔子、非人类灵长动物和/或人)。在一些实施例中,患者是人。人包括出生前和出生后形式。
药学上可接受的:如本文所用,术语“药学上可接受的”是指在合理的医学判断范围内适用于与人类和动物的组织接触而无过度的毒性、刺激性、变应性反应或其它问题或并发症,与合理效险比相称的物质。
药学上可接受的盐:药学上可接受的盐是本领域熟知的。例如,S.M.Berge等人在J.Pharmaceutical Sciences(1977)66:1-19中详细描述了药学上可接受的盐。本发明化合物的药学上可接受的盐包括那些衍生自合适的无机和有机酸和碱的盐。药学上可接受的无毒酸加成盐的例子为与诸如盐酸、氢溴酸、磷酸、硫酸和高氯酸的无机酸或与诸如醋酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸的有机酸或通过使用本领域中所使用的其它方法诸如离子交换而形成的氨基的盐。其它药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、延胡索酸盐、葡庚糖酸盐、甘油磷酸盐、葡萄糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐等。衍生自适当的碱的盐包括碱金属盐、碱土金属盐、铵盐和N+(C1-4烷基)4盐。代表性的碱盐或碱土金属盐包括钠盐、锂盐、钾盐、钙盐、镁盐等。适当时,另外的药学上可接受的盐包括使用抗衡离子例如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、磺酸根和芳基磺酸根形成的无毒铵、季铵和胺阳离子。另外的药学上可接受的盐包括由胺的季铵化作用形成的盐,其中使用适当的亲电体(例如烷基卤化物)以形成季铵化烷基化氨基盐。
全身分布或递送:如本文所用,术语“全身分布”、“全身递送”或等同的语法表达是指影响整个身体或整个生物体的递送或分布机制。通常,通过身体的循环系统(例如血流)完成全身分布或递送。与“局部分布或递送”的定义进行比较。
受试者:如本文所用,术语“受试者”是指人或任何非人类动物(例如,小鼠、大鼠、兔子、狗、猫、牛、猪、羊、马或灵长类动物)。人包括出生前和出生后形式。在许多实施例中,受试者为人类。受试者可为患者,是指让医疗服务提供者进行疾病诊断或治疗的人。术语“受试者”在本文中可与“个体”或“患者”互换使用。受试者可患有或易患病害或障碍,但可以或可以不表现该疾病或障碍的症状。
基本上:如本文所用,术语“基本上”是指表现出所关注的特征或特性的全部或几乎全部范围或程度的定性条件。生物领域的普通技术人员将理解到,生物和化学现象很少(如果有的话)进行完全和/或进行完整或者实现或避免绝对结果。因此,本文使用术语“基本上”涵盖许多生物和化学现象中固有的潜在完整性不足。
靶组织:如本文所用,术语“靶组织”是指受待治疗的疾病影响的任何组织。在一些实施例中,靶组织包括显示病害相关的病变的那些组织。
治疗有效量:如本文所用,治疗剂的术语“治疗有效量”意指当施用给患有或易患疾病、障碍和/或病症的受试者时,足以治疗、诊断、预防和/或延缓所述疾病、障碍和/或病症的一个或多个症状发作的量。本领域的普通技术人员将认识到,通常通过包括至少一个单位剂量的给药方案施用治疗有效量。
治疗:如本文所用,术语“治疗”、“疗法”或“处理”是指用于部分或完全缓解、改善、减轻、抑制、预防、延缓特定病害、障碍和/或病症的一个或多个症状或特征发作,降低特定病害、障碍和/或病症的一个或多个症状或特征的严重程度和/或降低发病率的任何方法。可以对未表现出疾病标志和/或仅表现出早期疾病标志的受试者进行治疗,以减小与疾病相关的病变发展的风险。
具体实施方式
除了其它方面,本发明提供了基于mRNA疗法治疗精氨基琥珀酸合成酶缺乏症(ASD)的方法和组合物。具体地讲,本发明提供了通过如下方式治疗ASD的方法:以有效剂量和施用间隔给需要治疗的受试者施用包含编码精氨基琥珀酸合成酶(ASS)的mRNA的组合物,使得ASD的至少一种症状或特征在强度、严重程度或频率上降低或延缓发作。在一些实施例中,mRNA包封在一种或多种脂质体内。如本文所用,术语“脂质体”是指任何层状、多层或固体纳米颗粒囊泡。通常,如本文所用的脂质体可通过混合一种或多种脂质或通过混合一种或多种脂质和聚合物来形成。因此,如本文所用的术语“脂质体”包括基于脂质的纳米颗粒和基于聚合物的纳米颗粒两者。在一些实施例中,适用于本发明的脂质体包含阳离子或非阳离子脂质、基于胆固醇的脂质和PEG改性脂质。
精氨基琥珀酸合成酶缺乏症(ASD)
本发明可用于治疗患有或易患精氨基琥珀酸合成酶缺乏症(ASD)的受试者。ASD是一种常染色体隐性代谢遗传性障碍,其特征在于精氨基琥珀酸合成酶(ASS1)的基因中发生突变。在ASS1基因中已识别到至少50个导致I型ASD的突变。这些突变中的大多数涉及单个氨基酸取代。ASS1基因中的许多突变很可能影响所得蛋白质的结构及其结合到瓜氨酸、天冬氨酸盐和其它分子的能力。ASS1基因中的一些突变导致异常短型酶的产生,这种酶不能在尿素循环中有效发挥其作用。
ASS1蛋白中的缺陷破坏尿素循环并阻止肝脏将使用蛋白质提供能量时生成的多余的氮适当地处理成尿素。尿素循环中累积的氨和其它副产物(诸如瓜氨酸)是毒性的,并且当出现在生命的早期时,可导致诸如精神不振(嗜睡)、食欲不振、呕吐、痉挛和意识丧失的症状。这些医学问题在许多情况下可危及生命。
本文所述的组合物和方法可用于治疗ASD的至少一种症状或特征。
精氨基琥珀酸合成酶(ASS1)
在一些实施例中,本发明提供了将编码ASS1的mRNA递送到受试者以治疗精氨基琥珀酸合成酶缺乏症(ASD)的方法和组合物。合适的ASS1mRNA编码ASS1蛋白的任何全长、片段或部分,其可替代天然存在的ASS1蛋白活性和/或降低与ASD相关的一种或多种症状的强度、严重程度和/或频率。
在一些实施例中,合适的mRNA序列为编码人ASS1蛋白的mRNA序列。天然存在的人ASS1mRNA序列和对应的氨基酸序列示于表1中:
表1.人ASS1
在一些实施例中,合适的mRNA为序列(SEQ ID NO:1)的野生型hASS1mRNA。在一些实施例中,合适的mRNA可为密码子优化的hASS1序列,诸如下面所示序列:
AUGAGCAGCAAGGGCAGCGUGGUGCUGGCCUACAGCGGCGGCCUGGACACCAGCUGCAUCCUGGUGUGGCUGAAGGAGCAGGGCUACGACGUGAUCGCCUACCUGGCCAACAUCGGCCAGAAGGAGGACUUCGAGGAGGCCCGCAAGAAGGCCCUGAAGCUGGGCGCCAAGAAGGUGUUCAUCGAGGACGUGAGCCGCGAGUUCGUGGAGGAGUUCAUCUGGCCCGCCAUCCAGAGCAGCGCCCUGUACGAGGACCGCUACCUGCUGGGCACCAGCCUGGCCCGCCCCUGCAUCGCCCGCAAGCAGGUGGAGAUCGCCCAGCGCGAGGGCGCCAAGUACGUGAGCCACGGCGCCACCGGCAAGGGCAACGACCAGGUGCGCUUCGAGCUGAGCUGCUACAGCCUGGCCCCCCAGAUCAAGGUGAUCGCCCCCUGGCGCAUGCCCGAGUUCUACAACCGCUUCAAGGGCCGCAACGACCUGAUGGAGUACGCCAAGCAGCACGGCAUCCCCAUCCCCGUGACCCCCAAGAACCCCUGGAGCAUGGACGAGAACCUGAUGCACAUCAGCUACGAGGCCGGCAUCCUGGAGAACCCCAAGAACCAGGCCCCCCCCGGCCUGUACACCAAGACCCAGGACCCCGCCAAGGCCCCCAACACCCCCGACAUCCUGGAGAUCGAGUUCAAGAAGGGCGUGCCCGUGAAGGUGACCAACGUGAAGGACGGCACCACCCACCAGACCAGCCUGGAGCUGUUCAUGUACCUGAACGAGGUGGCCGGCAAGCACGGCGUGGGCCGCAUCGACAUCGUGGAGAACCGCUUCAUCGGCAUGAAGAGCCGCGGCAUCUACGAGACCCCCGCCGGCACCAUCCUGUACCACGCCCACCUGGACAUCGAGGCCUUCACCAUGGACCGCGAGGUGCGCAAGAUCAAGCAGGGCCUGGGCCUGAAGUUCGCCGAGCUGGUGUACACCGGCUUCUGGCACAGCCCCGA
GUGCGAGUUCGUGCGCCACUGCAUCGCCAAGAGCCAGGAGCGCGUGGAGGGCAAGGUGCAGGUGAGCGUGCUGAAGGGCCAGGUGUACAUCCUGGGCCGCGAGAGCCCCCUGAGCCUGUACAACGAGGAGCUGGUGAGCAUGAACGUGCAGGGCGACUACGAGCCCACCGACGCCACCGGCUUCAUCAACAUCAACAGCCUGCGCCUGAAGGAGUACCACCGCCUGCAGAGCAAGGUGACCGCCAAGUGA(SEQ ID NO:3)
另外的示例性mRNA序列在下面实例部分中有所描述,例如SEQ ID NO:7和SEQ ID NO:8,这两者均包含构造密码子优化的编码ASS1的mRNA的5’和3’未翻译区。
在一些实施例中,合适的mRNA序列可为人ASS1蛋白的同系物或类似物的mRNA序列。例如,人ASS1蛋白的同系物或类似物可为相比于野生型或天然存在的人ASS1蛋白包含一个或多个氨基酸取代、缺失和/或插入同时保持基本的ASS1蛋白活性的修饰人ASS1蛋白。在一些实施例中,适用于本发明的mRNA编码与SEQ ID NO:2具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大同源性的氨基酸序列。在一些实施例中,适用于本发明的mRNA编码与人ASS1蛋白基本上相同的蛋白质。在一些实施例中,适用于本发明的mRNA编码与SEQ ID NO:2至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多相同的氨基酸序列。在一些实施例中,适用于本发明的mRNA编码人ASS1蛋白的片段或部分。在一些实施例中,适用于本发明的mRNA编码人ASS1蛋白的片段或部分,其中该蛋白的片段或部分仍保持类似于野生型蛋白的ASS1活性。在一些实施例中,适用于本发明的mRNA具有与SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多相同的核苷酸序列。
在一些实施例中,合适的mRNA编码融合蛋白,该融合蛋白包含融合到另一个蛋白(例如,N或C末端融合)的ASS1蛋白的全长、片段或部分。在一些实施例中,融合到编码ASS1蛋白的全长、片段或部分的mRNA的蛋白质编码信号序列或细胞靶向序列。
递送载体
根据本发明,可将如本文所述的编码ASS1蛋白(例如,ASS1蛋白的全长、片段或部分)的mRNA以裸RNA(未包装)形式递送或通过递送载体递送。如本文所用,术语“递送载体”、“转移载体”、“纳米颗粒”或等同的语法表达可互换使用。
在一些实施例中,可通过单个递送载体递送编码ASS1蛋白的mRNA。在一些实施例中,可通过各自具有不同组成的一种或多种递送载体递送编码ASS1蛋白的mRNA。根据多个实施例,合适的递送载体包括但不限于基于聚合物的载体,诸如聚乙烯亚胺(PEI)、脂质纳米颗粒和脂质体、纳米脂质体、含神经酰胺的纳米脂质体、蛋白脂质体、天然外泌体和合成外泌体、天然、合成和半合成板层体、纳米颗粒、硅酸钙荧光体纳米颗粒、磷酸钙纳米颗粒、二氧化硅纳米颗粒、纳米晶体颗粒、半导体纳米颗粒、聚(D-精氨酸)、溶胶凝胶、纳米树形分子、基于淀粉的递送系统、胶束、乳液、类脂质体、多结构域嵌段聚合物(乙烯基聚合物、聚丙基丙烯酸聚合物、动态聚共轭体)、干粉制剂、质粒、病毒、磷酸钙核苷酸、核酸适配体、肽以及其它带菌体标记。
脂质体递送载体
在一些实施例中,合适的递送载体为脂质体递送载体,例如脂质纳米颗粒。如本文所用,脂质体递送载体(例如脂质纳米颗粒)通常以微囊泡形式为特征,该微囊泡具有通过具有一个或多个双分子层的膜与外部介质隔绝的内部溶液空间。脂质体的双分子层膜通常由两亲性分子形成,诸如包含空间分隔的亲水性和疏水性结构域的合成或天然来源的脂质(Lasic,Trends Biotechnol.,16:307-321,1998)。脂质体的双分子层膜还可由两亲性聚合物和表面活性剂(例如,聚合物囊泡、类脂质体等)形成。在本发明的上下文中,脂质体递送载体通常用于将所需的mRNA运送至靶细胞或靶组织。
阳离子脂质
在一些实施例中,脂质体可包含一种或多种阳离子脂质。如本文所用,术语“阳离子脂质”是指在所选择的pH(诸如生理pH)下具有净正电荷的多个脂质种类中的任何一者。若干阳离子脂质在文献中已有描述,其中许多是可商购获得的。供本发明的组合物和方法使用的特别合适的阳离子脂质包括国际专利公布WO 2010/053572(具体地讲,在段落[00225]中描述的CI 2-200)和WO 2012/170930中描述的那些,所述专利均以引用方式并入本文。在某些实施例中,本发明的组合物和方法采用脂质纳米颗粒,其包含2012年3月29日提交的美国临时专利申请61/617,468(以引用方式并入本文)中描述的可离子化阳离子脂质,诸如(15Z,18Z)-N,N-二甲基-6-(9Z,12Z)-十八烷-9,12-二烯-1-基)二十四烷-15,18-二烯-1-胺(HGT5000)、(15Z,18Z)-N,N-二甲基-6-((9Z,12Z)-十八烷-9,12-二烯-1-基)二十四烷-4,15,18-三烯-1-胺(HGT5001)和(15Z,18Z)-N,N-二甲基-6-((9Z,12Z)-十八烷-9,12-二烯-1-基)二十四烷-5,15,18-三烯-1-胺(HGT5002)。
在一些实施例中,所提供的脂质体包含WO 2013063468和与本申请同一天提交的标题为“Lipid Formulations for Delivery of Messernger RNA”的美国临时申请中所述的阳离子脂质,所述专利均以引用方式并入本文。
在一些实施例中,阳离子脂质包括式I-c1-a的化合物:
或其药学上可接受的盐,其中:
每个R2独立地为氢或C1-3烷基;
每个q独立地为2至6;
每个R'独立地为氢或C1-3烷基;
并且每个RL独立地为C8-12烷基。
在一些实施例中,每个R2独立地为氢、甲基或乙基。在一些实施例中,每个R2独立地为氢或甲基。在一些实施例中,每个R2为氢。
在一些实施例中,每个q独立地为3至6。在一些实施例中,每个q独立地为3至5。在一些实施例中,每个q为4。
在一些实施例中,每个R'独立地为氢、甲基或乙基。在一些实施例中,每个R'独立地为氢或甲基。在一些实施例中,每个R'独立地为氢。
在一些实施例中,每个RL独立地为C8-12烷基。在一些实施例中,每个RL独立地为n-C8-12烷基。在一些实施例中,每个RL独立地为C9-11烷基。在一些实施例中,每个RL独立地为n-C9-11烷基。在一些实施例中,每个RL独立地为C10烷基。在一些实施例中,每个RL独立地为n-C10烷基。
在一些实施例中,每个R2独立地为氢或甲基;每个q独立地为3至5;每个R'独立地为氢或甲基;并且每个RL独立地为C8-12烷基。
在一些实施例中,每个R2为氢;每个q独立地为3至5;每个R'为氢;并且每个RL独立地为C8-12烷基。
在一些实施例中,每个R2为氢;每个q为4;每个R'为氢;并且每个RL独立地为C8-12烷基。
在一些实施例中,阳离子脂质包括式I-g的化合物:
或其药学上可接受的盐,其中每个RL独立地为C8-12烷基。在一些实施例中,每个RL独立地为n-C8-12烷基。在一些实施例中,每个RL独立地为C9-11烷基。在一些实施例中,每个RL独立地为n-C9-11烷基。在一些实施例中,每个RL独立地为C10烷基。在一些实施例中,每个RL为n-C10烷基。
在特定实施例中,所提供的脂质体包含阳离子脂质cKK-E12或(3,6-二(4-(二(2-羟基月桂基)氨基)丁基)哌嗪-2,5-二酮)。cKK-E12的结构在下面示出:
在一些实施例中,一种或多种阳离子脂质可以是N-[1-(2,3-二油烯氧基)丙基]-N,N,N-三甲基氯化铵或“DOTMA”。(Feigner等人,Proc.Nat'l Acad.Sci.84,7413(1987);美国专利No.4,897,355)。可将DOTMA单独或与中性脂质、二油酰基磷脂酰乙醇胺或“DOPE”或其它阳离子或非阳离子脂质组合配制成脂质体转移载体或脂质纳米颗粒,并且此类脂质体可用于提高核酸到靶细胞的递送。其它合适的阳离子脂质包括例如5-羧基精胺基甘油二硬脂酰胺或“DOGS”、2,3-二油烯氧基-N-[2(精胺-羧酰氨基)乙基]-N,N-二甲基-1-丙烷铵或“DOSPA”(Behr等人,Proc.Nat.'l Acad.Sci.86,6982(1989);美国专利No.5,171,678;美国专利No.5,334,761)、1,2-二油酰基-3-二甲基铵-丙烷或“DODAP”、1,2-二油酰基-3-三甲基铵-丙烷或“DOTAP”。
另外的示例性阳离子脂质还包括1,2-二硬脂酰氧基-N,N-二甲基-3-氨基丙烷或“DSDMA”、1,2-二油烯氧基-N,N-二甲基-3-氨基丙烷或“DODMA”、1,2-二亚油醇基氧-N,N-二甲基-3-氨基丙烷或“DLinDMA”、1,2-二亚油醇基氧-N,N-二甲基-3-氨基丙烷或“DLenDMA”、N-二油烯基-N,N-二甲基氯化铵或“DODAC”、N,N-二硬脂基-N,N-二甲基溴化铵或“DDAB”、N-(1,2-二肉豆蔻基氧丙烷-3-基)-N,N-二甲基-N-羟乙基溴化铵或“DMRIE”、3-二甲基氨基-2-(胆甾-5-烯-3-β-氧丁烷-4-氧)-1-(顺,顺-9,12-十八烷二烯氧)丙烷或“CLinDMA”、2-[5'-(胆甾-5-烯-3-β-氧)-3'-氧杂五氧代)-3-二甲基1-1-(顺,顺-9',1-2'-十八烷二烯氧)丙烷或“CpLinDMA”、N,N-二甲基-3,4-二油烯基氧苄胺或“DMOBA”、1,2-N,N'-二油烯基氨基甲酰基-3-二甲基氨基丙烷或“DOcarbDAP”、2,3-二亚油酰氧基-Ν,Ν-二甲基丙胺或“DLinDAP”、1,2-N,N'-二亚油醇基氨基甲酰基-3-二甲基氨基丙烷或“DLincarbDAP”、1,2-二亚油酰基氨基甲酰基-3-二甲基氨基丙烷或“DLinCDAP”、2,2-二亚油醇基-4-二甲基氨甲基-[1,3]-二氧戊环或“DLin--DMA”、2,2-二亚油醇基-4-二甲基氨乙基-[1,3]-二氧戊环或“DLin-K-XTC2-DMA”以及2-(2,2-二((9Z,12Z)-十八烷-9,12-二烯-1-基)-1,3-二氧戊环-4-基)-N,N-二甲基乙胺(DLin-KC2-DMA))(参见WO 2010/042877;Semple等人,Nature Biotech.28:172-176(2010)),或它们的混合物。(Heyes,J.等人,J Controlled Release 107:276-287(2005);Morrissey,DV.等人,Nat.Biotechnol.23(8):1003-1007(2005);PCT公布WO2005/121348A1)。在一些实施例中,阳离子脂质中的一者或多者包括咪唑、二烷基氨基或胍鎓部分中的至少一者。
在一些实施例中,一种或多种阳离子脂质可选自XTC(2,2-二亚油醇基-4-二甲基氨乙基-[1,3]-二氧戊环)、MC3(((6Z,9Z,28Z,31Z)-三十七烷-6,9,28,31-四烯-19-基4-(二甲基氨基)丁酸酯)、ALNY-100((3aR,5s,6aS)-N,N-二甲基-2,2-二((9Z,12Z)-十八烷-9,12-二烯基)四氢-3aH-环戊烷[d][1,3]二氧杂环戊烯-5-胺))、NC98-5(4,7,13-三(3-氧代-3-(十一烷基氨基)丙基)-N1,N16-双十一基-4,7,10,13-四氮杂十六烷-1,16-二酰胺)、DODAP(1,2-二油烯基-3-二甲基铵丙烷)、HGT4003(WO 2012/170889,其教导内容全文以引用方式并入本文中)、ICE(WO 2011/068810,其教导内容全文以引用方式并入本文中)、HGT5000(美国临时专利申请No.61/617,468,其教导内容全文以引用方式并入本文中)或HGT5001(顺式或反式)(临时专利申请No.61/617,468)、氨基醇类脂质(诸如WO2010/053572中所公开的那些)、DOTAP(1,2-二油烯基-3-三甲基铵丙烷)、DOTMA(1,2-二-O-十八烷基-3-三甲基铵丙烷)、DLinDMA(Heyes,J.;Palmer,L.;Bremner,K.;MacLachlan,I.“Cationic lipid saturation influences intracellular delivery of encapsulated nucleic acids”J.Contr.Rel.2005,107,276-287)、DLin-KC2-DMA(Semple,S.C.等人,“Rational Design of Cationic Lipids for siRNA Delivery”Nature Biotech.2010,28,172-176)、C12-200(Love,K.T.等人,“Lipid-like materials for low-dose in vivo gene silencing”PNAS 2010,107,1864-1869)。
在一些实施例中,阳离子脂质在脂质体中的百分比可大于10%、大于20%、大于30%、大于40%、大于50%、大于60%或大于70%。在一些实施例中,阳离子脂质占脂质体的约30-50重量%(例如,约30-45重量%、约30-40重量%、约35-50重量%、约35-45重量%或约35-40重量%)。在一些实施例中,阳离子脂质(例如,cKK-E12)占脂质体的约30摩尔%、约35摩尔%、约40摩尔%、约45摩尔%或约50摩尔%。
非阳离子/辅助脂质
在一些实施例中,所提供的脂质体包含一种或多种非阳离子(“辅助”)脂质。如本文所用,术语“非阳离子脂质”是指任何中性、两性离子或阴离子脂质。如本文所用,术语“阴离子脂质”是指在所选择的H(诸如生理pH)下带有净负电荷的多个脂质种类中的任何一者。非阳离子脂质包括但不限于二硬脂酰卵磷脂(DSPC)、二油酰卵磷脂(DOPC)、二棕榈酰卵磷脂(DPPC)、二油酰磷脂酰甘油(DOPG)、二棕榈酰磷脂酰甘油(DPPG)、二油酰磷脂酰乙醇胺(DOPE)、棕榈酰油酰卵磷脂(POPC)、棕榈酰油酰-磷脂酰乙醇胺(POPE)、二油酰基-磷脂酰乙醇胺4-(N-马来酰亚胺甲基)-环己烷-1-羧酸酯(DOPE-mal)、二棕榈酰基磷脂酰乙醇胺(DPPE)、二肉豆蔻酰基磷酰乙醇胺(DMPE)、二硬脂酰基-磷脂酰乙醇胺(DSPE)、16-O-一甲基PE、16-O-二甲基PE、18-1-反式PE、1-硬脂酰-2-油酰基-磷脂酰乙醇胺(SOPE)或它们的混合物。
在一些实施例中,可以单独使用此类非阳离子脂质,但优选地与其它赋形剂(例如阳离子脂质)联合使用。在一些实施例中,非阳离子脂质可占脂质体中存在的总脂质的约5%至约90%或约10%至约70%的摩尔比。在一些实施例中,非阳离子脂质是中性脂质,即,在配制和/或施用组合物的条件下不带有净电荷的脂质。在一些实施例中,非阳离子脂质在脂质体中的百分比可大于5%、大于10%、大于20%、大于30%或大于40%。
基于胆固醇的脂质
在一些实施例中,所提供的脂质体包含一种或多种基于胆固醇的脂质。例如,合适的基于胆固醇的阳离子脂质包括例如DC-Choi(N,N-二甲基-N-乙基酰胺基胆固醇)、1,4-二(3-N-油烯基氨基-丙基)哌嗪(Gao等人,Biochem.Biophys.Res.Comm.179,280(1991);Wolf等人,BioTechniques 23,139(1997);美国专利No.5,744,335)或ICE。在一些实施例中,基于胆固醇的脂质可占脂质体中存在的总脂质的约2%至约30%或约5%至约20%的摩尔比。在一些实施例中,基于胆固醇的脂质在脂质纳米颗粒中的百分比可大于5%、10%、大于20%、大于30%或大于40%。
PEG化脂质
在一些实施例中,所提供的脂质体包含一种或多种PEG化脂质。例如,通过本发明还设想到将聚乙二醇(PEG)-改性的磷脂和衍生化脂质(诸如衍生化神经酰胺(PEG-CER),包括N-辛酰基-鞘氨醇-1-[琥珀酰基(甲氧基聚乙二醇)-2000](C8PEG-2000神经酰胺))与阳离子脂质中的一者或多者联合使用,以及在一些实施例中,与包含该脂质体的其它脂质一起使用。设想到的PEG改性脂质包括但不限于长度为至多5kDa的聚乙二醇链,该聚乙二醇链共价附接到具有C6-C20长度烷基链的脂质。在一些实施例中,PEG改性脂质或PEG化脂质为PEG化胆固醇或PEG-2K。添加此类组分可以阻止络合物聚集并且还可以提供增加循环寿命以及增加脂质-核酸组合物向靶细胞的递送的方法(Klibanov等人,(1990)FEBS Letters,268(1):235-237),或者它们被选择用于在体内快速替换到制剂外(参见美国专利No.5,885,613)。
在一些实施例中,特别有用的可替换脂质为具有较短酰基链(例如,C14或C18)的PEG-神经酰胺。本发明的PEG改性磷脂和衍生化脂质可占脂质体中存在的总脂质的约0%至约15%、约0.5%至约15%、约1%至约15%、约4%至约10%或约2%的摩尔比。
根据多个实施例,基于所选择的脂质的特性、预期靶细胞的性质、待递送的mRNA的特性选择包含脂质纳米颗粒的阳离子脂质、非阳离子脂质和/或PEG改性脂质以及此类脂质对于彼此的相对摩尔比。另外的考虑因素包括例如烷基链的饱和度,以及所选择的脂质的尺寸、电荷、pH、pKa、融合性和毒性。因此可以对摩尔比进行调节。
聚合物
在一些实施例中,利用聚合物单独或与其它载体(包括本文所述的多个脂质)组合作为载体,配制合适的递送载体。因此,在一些实施例中,如本文所用的脂质体递送载体还包括含聚合物的纳米颗粒。合适的聚合物可包括例如聚丙烯酸酯、聚氰基丙烯酸烷基酯、聚交酯、聚交酯-聚乙交酯共聚物、聚己内酯、葡聚糖、白蛋白、明胶、藻酸酯、胶原、脱乙酰壳多糖、环糊精、鱼精蛋白、PEG化鱼精蛋白、PLL、PEG化PLL和聚乙烯亚胺(PEI)。当PEI存在时,其可为分子量在10至40kDa范围内的支链PEI,例如25kDa支链PEI(Sigma#408727)。
用于本发明的合适的脂质体可以多个比率包含本文所述的阳离子脂质、非阳离子脂质、胆固醇脂质、PEG化脂质和/或聚合物中的任何一者或多者。作为非限制性例子,合适的脂质体制剂可以包括选自以下的组合:cKK-E12、DOPE、胆固醇和DMG-PEG2K;C12-200、DOPE、胆固醇和DMG-PEG2K;HGT4003、DOPE、胆固醇和DMG-PEG2K;或ICE、DOPE、胆固醇和DMG-PEG2K。
在多个实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)占脂质体的约30-60摩尔%(例如,约30-55摩尔%、约30-50摩尔%、约30-45摩尔%、约30-40摩尔%、约35-50摩尔%、约35-45摩尔%或约35-40摩尔%)。在一些实施例中,阳离子脂质(例如,cKK-E12、C12-200、ICE和/或HGT4003)在脂质体中的百分比为或大于约30摩尔%、约35摩尔%、约40摩尔%、约45摩尔%、约50摩尔%、约55摩尔%或约60摩尔%。
在一些实施例中,阳离子脂质比非阳离子脂质比基于胆固醇的脂质比PEG化脂质的比率可分别在约30-60:25-35:20-30:1-15之间。在一些实施例中,阳离子脂质比非阳离子脂质比基于胆固醇的脂质比PEG化脂质的比率可分别为大约40:30:20:10。在一些实施例中,阳离子脂质比非阳离子脂质比基于胆固醇的脂质比PEG化脂质的比率可分别为大约40:30:25:5。在一些实施例中,阳离子脂质比非阳离子脂质比基于胆固醇的脂质比PEG化脂质的比率可分别为大约40:32:25:3。在一些实施例中,阳离子脂质比非阳离子脂质比基于胆固醇的脂质比PEG化脂质的比率可分别为大约50:25:20:5。
mRNA的合成
可以根据多个已知方法中的任一者合成根据本发明的mRNA。例如,可以通过体外转录(IVT)合成根据本发明的mRNA。简而言之,通常用线性或环状DNA模板执行IVT,该模板包含启动子、许多核糖核苷三磷酸、缓冲系统(其可包括DTT和镁离子),以及适当的RNA聚合酶(例如,T3、T7或SP6RNA聚合酶)、DNA酶I、焦磷酸酶和/或RNA酶抑制剂。精确的条件将根据具体应用而变化。
在一些实施例中,为了制备根据本发明的mRNA,在体外转录DNA模板。合适的DNA模板通常具有用于体外转录的启动子,例如T3、T7或SP6启动子,后接所需的mRNA的所需的核苷酸序列以及终止信号。
可以使用标准方法确定根据本发明的所需的mRNA序列并将其结合到DNA模板。例如,从所需的氨基酸序列(例如,酶序列)开始,根据简并遗传密码进行实质逆向翻译。然后可以使用优化算法选择合适的密码子。通常,可优化G/C含量,从而一方面实现最大可能的G/C含量,另一方面根据密码子使用最大可能地充分考虑tRNA的频率。可例如借助适当的显示装置确定和显示优化的RNA序列,并与初始(野生型)序列进行比较。还可对二次结构进行分析,以分别计算RNA的各区域的稳定特性和不稳定特性。
修饰的mRNA
在一些实施例中,可以未修饰或修饰mRNA的形式合成根据本发明的mRNA。通常,mRNA为修饰的以提高稳定性。mRNA的修饰可包括例如RNA的核苷酸的修饰。根据本发明的修饰mRNA可因此包括例如主链修饰、糖修饰或碱基修饰。在一些实施例中,mRNA可由天然存在的核苷酸和/或核苷酸类似物(修饰核苷酸)合成,包括但不限于嘌呤(腺嘌呤(A)、鸟嘌呤(G))或嘧啶(胸腺嘧啶(T)、胞嘧啶(C)、尿嘧啶(U)),以及嘌呤和嘧啶的修饰核苷酸类似物或衍生物,诸如1-甲基腺嘌呤、2-甲基腺嘌呤、2-甲硫基-N-6-异戊烯基腺嘌呤、N6-甲基腺嘌呤、N6-异戊烯基腺嘌呤、2-硫代胞嘧啶、3-甲基胞嘧啶、4-乙酰基胞嘧啶、5-甲基胞嘧啶、2,6-二氨基嘌呤、1-甲基鸟嘌呤、2-甲基鸟嘌呤、2,2-二甲基鸟嘌呤、7-甲基鸟嘌呤、肌苷、1-甲基肌苷、假尿嘧啶(5-尿嘧啶)、二氢尿嘧啶、2-硫代尿嘧啶、4-硫代尿嘧啶、5-羧甲基氨甲基-2-硫代尿嘧啶、5-(羧基羟甲基)-尿嘧啶、5-氟代尿嘧啶、5-溴代尿嘧啶、5-羧甲基氨甲基尿嘧啶、5-甲基-2-硫代尿嘧啶、5-甲基尿嘧啶、N-尿嘧啶-5-氧乙酸甲酯、5-甲基氨甲基尿嘧啶、5-甲氧基氨甲基-2-硫代尿嘧啶、5'-甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、尿嘧啶-5-氧乙酸甲酯、尿嘧啶-5-氧乙酸(v)、1-甲基假尿嘧啶、Q核苷(queosine)、β-D-甘露糖基-Q核苷(.beta.-D-mannosyl-queosine)、怀丁氧苷(wybutoxosine)以及氨基磷酸酯、硫代磷酸酯、肽核苷酸、甲基磷酸酯、7-脱氮鸟苷、5-甲基胞嘧啶和肌苷。此类类似物的制备是本领域的技术人员已知的,例如,通过美国专利No.4,373,071、美国专利No.4,401,796、美国专利No.4,415,732、美国专利No.4,458,066、美国专利No.4,500,707、美国专利No.4,668,777、美国专利No.4,973,679、美国专利No.5,047,524、美国专利No.5,132,418、美国专利No.5,153,319、美国专利No.5,262,530和No.5,700,642已知,这些专利的公开内容全文以引用方式并入。
在一些实施例中,mRNA(例如编码ASS1的mRNA)可包含RNA主链修饰。通常,主链修饰为其中包含于RNA中的核苷酸的主链的磷酸酯被化学改性的修饰。示例性主链修饰通常包括但不限于选自甲基磷酸酯、甲基氨基磷酸酯、氨基磷酸酯、硫代磷酸酯(例如胞苷5'-O-(1-硫代磷酸酯))、硼磷酸酯、带正电的胍基等的修饰,这意味着将磷酸二酯键替换为其它阴离子、阳离子或中性基团。
在一些实施例中,mRNA(例如编码ASS1的mRNA)可包含糖修饰。典型的糖修饰为其包含的核苷酸的糖的化学改性,包括但不限于选自2'-脱氧-2'-氟代-寡核糖核苷酸(2'-氟代-2'-脱氧胞苷5'-三磷酸、2'-氟代-2'-脱氧尿苷5'-三磷酸)、2'-脱氧-2'-二胺-寡核糖核苷酸(2'-氨基-2'-脱氧胞苷5'-三磷酸、2'-氨基-2'-脱氧尿苷5'-三磷酸)、2'-O-烷基寡核糖核苷酸、2'-脱氧-2'-C-烷基寡核糖核苷酸(2'-O-甲基胞苷5'-三磷酸、2'-甲基尿苷5'-三磷酸)、2'-C-烷基寡核糖核苷酸以及它们的异构体(2'-阿糖胞苷5'-三磷酸、2'-阿糖尿苷5'-三磷酸)或叠氮磷酸酯(2'-叠氮-2'-脱氧胞苷5'-三磷酸、2'-叠氮-2'-脱氧尿苷5'-三磷酸)的糖修饰。
在一些实施例中,mRNA(例如编码ASS1的mRNA)可包含核苷酸的碱基的修饰(碱基修饰)。包含碱基修饰的修饰核苷酸也称为碱基修饰核苷酸。此类碱基修饰核苷酸的例子包括但不限于2-氨基-6-氯嘌呤核糖核苷5'-三磷酸、2-氨基腺苷5'-三磷酸、2-硫代胞苷5'-三磷酸、2-硫代尿苷5'-三磷酸、4-硫代尿苷5'-三磷酸、5-氨基烯丙基胞苷5'-三磷酸、5-氨基烯丙基尿苷5'-三磷酸、5-溴胞苷5'-三磷酸、5-溴代尿苷5'-三磷酸、5-碘胞苷5'-三磷酸、5-碘代尿苷5'-三磷酸、5-甲基胞苷5'-三磷酸、5-甲基尿苷5'-三磷酸、6-氮杂胞苷5'-三磷酸、6-氮杂尿苷5'-三磷酸、6-氯嘌呤核糖核苷5'-三磷酸、7-脱氮腺苷5'-三磷酸、7-脱氮鸟苷5'-三磷酸、8-氮杂腺苷5'-三磷酸、8-叠氮腺苷5'-三磷酸、苯并咪唑核糖核苷5'-三磷酸、N1-甲基腺苷5'-三磷酸、N1-甲基鸟苷5'-三磷酸、N6-甲基腺苷5'-三磷酸、O6-甲基鸟苷5'-三磷酸、假尿苷5'-三磷酸、嘌呤霉素5'-三磷酸或黄嘌呤核苷5'-三磷酸。
通常,mRNA合成包括在N-末端(5’)上添加“帽”,以及在C-末端(3’)上添加“尾”。帽的存在提供对存在于大多数真核细胞中的核酸酶的抗性方面是重要的。“尾”的存在用于保护mRNA免受核酸外切酶降解。
因此,在一些实施例中,mRNA(例如编码ASS1的mRNA)包括5’帽结构。通常按如下方式添加5’帽:首先,RNA末端磷酸酶将末端磷酸基中的一个从5’核苷酸去除,剩下两个末端磷酸;然后通过鸟苷酰基转移酶将鸟苷三磷酸(GTP)添加到末端磷酸,从而生成5’5’5三磷酸键;然后通过甲基转移酶将鸟嘌呤的7-氮甲基化。帽结构的例子包括但不限于m7G(5')ppp(5'(A,G(5')ppp(5')A和G(5')ppp(5')G。
在一些实施例中,mRNA(例如编码ASS1的mRNA)包括3’聚(A)尾结构。mRNA的3'端上的聚-A尾通常包括约10至300个腺苷核苷酸(SEQ ID NO:9)(例如,约10至200个腺苷核苷酸、约10至150个腺苷核苷酸、约10至100个腺苷核苷酸、约20至70个腺苷核苷酸或约20至60个腺苷核苷酸)。在一些实施例中,mRNA包括3’聚(C)尾结构。mRNA的3'末端上的合适的聚-C尾通常包括约10至200个胞嘧啶核苷酸(SEQ ID NO:10)(例如,约10至150个胞嘧啶核苷酸、约10至100个胞嘧啶核苷酸、约20至70个胞嘧啶核苷酸、约20至60个胞嘧啶核苷酸或约10至40个胞嘧啶核苷酸)。可以将聚-C尾添加到聚-A尾或者可以替代聚-A尾。
在一些实施例中,mRNA包括5’和/或3’未翻译区。在一些实施例中,5’未翻译区包括一个或多个影响mRNA的稳定性或翻译的元件,例如,铁反应元件。在一些实施例中,5’未翻译区的长度可在约50和500个核苷酸之间。
在一些实施例中,3’未翻译区包括聚腺苷酸化信号中的一个或多个,影响mRNA在细胞内的位置的稳定性的蛋白质的结合位点,或miRNA的一个或多个结合位点。在一些实施例中,3’未翻译区的长度可在50和500个核苷酸之间或更长。
帽结构
在一些实施例中,mRNA包括5’帽结构。通常按如下方式添加5’帽:首先,RNA末端磷酸酶将末端磷酸基中的一个从5’核苷酸去除,剩下两个末端磷酸;然后通过鸟苷酸转移酶将鸟苷三磷酸(GTP)添加到末端磷酸,从而生成5’5’5三磷酸键;然后通过甲基转移酶将鸟嘌呤的7-氮甲基化。帽结构的例子包括但不限于m7G(5')ppp(5'(A,G(5')ppp(5')A和G(5')ppp(5')G。
天然存在的帽结构包含7-甲基鸟苷,其通过三磷酸桥键连接到第一转录核苷酸的5'-端,从而产生m7G(5')ppp(5')N的二核苷酸帽,其中N为任何核苷。在体内通过酶促方法添加帽。在细胞核中添加帽并通过鸟苷酰基转移酶催化。在引发转录之后立即将帽添加到RNA的5'末端。末端核苷通常为鸟苷,并且与所有其它核苷酸的取向相反,即G(5')ppp(5')GpNpNp。
通过体外转录产生的用于mRNA的常见帽为m7G(5')ppp(5')G,其已被用作用T7或SP6RNA聚合酶进行的体外转录中的二核苷酸帽,以获得在5'-末端具有帽结构的RNA。用于体外合成加帽的mRNA的普遍方法采用具有m7G(5')ppp(5')G(“m7GpppG”)形式的预成形二核苷酸作为转录引发剂。
迄今为止,用于体外翻译实验的合成二核苷酸帽的常用形式为抗反向帽类似物(“ARCA”)或修饰ARCA,其通常为修饰的帽类似物,其中2'或3'OH基替换为-OCH3。
另外的帽类似物包括但不限于选自m7GpppG、m7GpppA、m7GpppC的化学结构;未甲基化帽类似物(例如GpppG);二甲基化帽类似物(例如m2,7GpppG)、三甲基化帽类似物(例如m2,2,7GpppG)、二甲基化对称帽类似物(例如m7Gpppm7G)或抗反向帽类似物(例如,ARCA;m7、2'OmeGpppG、m72'dGpppG、m7,3'OmeGpppG、m7,3'dGpppG以及它们的四磷酸酯衍生物)(参见例如Jemielity,J.等人,“Novel‘anti-reverse’cap analogs with superior translational properties”,RNA,9:1108-1122(2003))。
在一些实施例中,合适的帽为通过三磷酸桥键连接到第一转录核苷酸的5'-端的7-甲基鸟苷酸(“m7G”),从而产生m7G(5')ppp(5')N,其中N为任何核苷。用于本发明实施例的m7G帽的优选实施例为m7G(5')ppp(5')G。
在一些实施例中,帽为Cap0结构。Cap0结构不含附接到碱基1和2的核糖的2'-O-甲基残基。在一些实施例中,帽为Cap1结构。Cap1结构在碱基2处具有2'-O-甲基残基。在一些实施例中,帽为Cap2结构。Cap2结构具有附接到碱基2和3两者的2'-O-甲基残基。
多种m7G帽类似物是本领域已知的,它们中许多是可商购获得的。这些帽类似物包括上述m7GpppG以及ARCA 3'-OCH3和2'-OCH3帽类似物(Jemielity,J.等人,RNA,9:1108-1122(2003))。用于本发明实施例的另外的帽类似物包括N7-苄基化二核苷四磷酸类似物(描述于Grudzien,E.等人,RNA,10:1479-1487(2004)中)、硫代磷酸酯帽类似物(描述于Grudzien-Nogalska,E.,等人,RNA,13:1745-1755(2007)中),以及美国专利No.8,093,367和No.8,304,529中描述的帽类似物(包括生物素酰化帽类似物),所述专利以引用方式并入本文。
尾结构
通常,“尾”的存在用于保护mRNA免受核酸外切酶降解。聚A尾被认为用于稳定天然信使以及合成有义RNA。因此,在某些实施例中,可将较长的聚A尾添加到mRNA分子,从而使RNA更加稳定。可使用多种本领域公认的技术添加聚A尾。例如,可使用聚A聚合酶将较长的聚A尾添加到合成或体外转录RNA(Yokoe等人,Nature Biotechnology.1996;14:1252-1256)。转录载体也可编码较长的聚A尾。此外,可通过从PCR产物直接转录来添加聚A尾。聚A还可以连接到具有RNA连接酶的有义RNA的3'端(参见例如,Molecular Cloning A Laboratory Manual,第2版,Sambrook、Fritsch和Maniatis编辑(Cold Spring Harbor Laboratory Press:1991年版))。
在一些实施例中,mRNA包括3’聚(A)尾结构。通常,聚A尾的长度可为至少约10、50、100、200、300、400、至少500个核苷酸(SEQ ID NO:11)。在一些实施例中,mRNA的3'末端上的聚-A尾通常包括约10至300个腺苷核苷酸(SEQ ID NO:9)(例如,约10至200个腺苷核苷酸、约10至150个腺苷核苷酸、约10至100个腺苷核苷酸、约20至70个腺苷核苷酸或约20至60个腺苷核苷酸)。在一些实施例中,mRNA包括3’聚(C)尾结构。mRNA的3'端上的合适的聚-C尾通常包括约10至200个胞嘧啶核苷酸(SEQ ID NO:10)(例如,约10至150个胞嘧啶核苷酸、约10至100个胞嘧啶核苷酸、约20至70个胞嘧啶核苷酸、约20至60个胞嘧啶核苷酸或约10至40个胞嘧啶核苷酸)。可以将聚-C尾添加到聚-A尾或者可以替代聚-A尾。
在一些实施例中,调节聚A或聚C尾的长度以控制本发明的修饰有义mRNA分子的稳定性,从而控制蛋白转录的稳定性。例如,由于聚A尾的长度可影响有义mRNA分子的半衰期,因此可调节聚A尾的长度以修改mRNA对核酸酶的抗性水平,从而控制靶细胞中的多核苷酸表达和/或多肽产生的时间进程。
5’和3’未翻译区
在一些实施例中,mRNA包括5’和/或3’未翻译区。在一些实施例中,5’未翻译区包括一个或多个影响mRNA的稳定性或翻译的元件,例如,铁反应元件。在一些实施例中,5’未翻译区的长度可在约50和500个核苷酸之间。
在一些实施例中,3’未翻译区包括聚腺苷酸化信号中的一个或多个,影响mRNA在细胞内的位置的稳定性的蛋白质的结合位点,或miRNA的一个或多个结合位点。在一些实施例中,3’未翻译区的长度可在50和500个核苷酸之间或更长。
示例性3'和/或5'UTR序列可衍生自mRNA分子,该mRNA分子为稳定的(例如,球蛋白、肌动蛋白、GAPDH、微管蛋白、组蛋白或柠檬酸循环酶)以增大有义mRNA分子的稳定性。例如,5’UTR序列可以包括CMV前早期1(IE1)基因的部分序列或其片段,以提高核酸酶抗性和/或增加多核苷酸的半衰期。还可以想到将编码人类生长激素(hGH)的序列或其片段添加到多核苷酸(例如mRNA)的3’端或未翻译区以进一步稳定多核苷酸。一般来讲,这些修饰相对于多核苷酸的未修饰的对应物改善了多核苷酸的稳定性和/或药动学特性(例如半衰期),并且包括例如为提高此类多核苷酸对体内核酸酶消化的抗性而做出的修饰。
脂质体的形成
可通过本领域目前已知的各种技术制备用于本发明组合物的脂质体转移载体。可通过本领域目前已知的各种技术制备用于所提供的组合物的脂质体。例如,可以根据常规技术制备多层囊泡(MLV),诸如通过将脂质溶于适当溶剂来将所选择的脂质沉积到合适的容器或器皿内壁,然后蒸发溶剂以在器皿内部留下薄膜或通过喷雾干燥。然后可以用涡旋运动将水相添加到器皿,这导致形成MLV。然后可通过均化、超声处理或挤出多层囊泡来形成单层囊泡(ULV)。此外,可通过去污剂去除技术形成单层囊泡。
在某些实施例中,所提供的组合物包含脂质体,其中mRNA缔和在脂质体表面上并且包封在相同脂质体内。例如,在制备本发明组合物的过程中,阳离子脂质体可通过静电相互作用与mRNA缔和。例如,在制备本发明组合物的过程中,阳离子脂质体可通过静电相互作用与mRNA缔和。
在一些实施例中,本发明的组合物和方法包括包封在脂质体内的mRNA。在一些实施例中,可将一个或多个mRNA种类包封在相同脂质体内。在一些实施例中,可将一个或多个mRNA种类包封在不同脂质体内。在一些实施例中,将mRNA包封在一个或多个脂质体内,所述脂质体在脂质组成、脂质组分的摩尔比、尺寸、电荷(ζ电势)、靶向配体和/或它们的组合方面不同。在一些实施例中,一个或多个脂质体可具有不同组成的阳离子脂质、中性脂质、PEG改性脂质和/或它们的组合。在一些实施例中,一个或多个脂质体可具有不同摩尔比的用于形成脂质体的阳离子脂质、中性脂质、胆固醇和PEG改性脂质。
将所需的mRNA结合到脂质体内的过程通常称为“加载”。示例性方法在Lasic等人,FEBS Lett.,312:255-258,1992中有所描述,该文献以引用方式并入本文。脂质体结合的核酸可以完全或部分位于脂质体的内部空间中,位于脂质体的双分子层膜内,或与脂质体膜的外表面缔和。将核酸结合到脂质体内在本文中也称为“包封”,其中核酸完全包含于脂质体的内部空间中。将mRNA结合到转移载体(诸如脂质体)中的目的通常是保护核酸免受环境影响,这种环境包含降解核酸的酶或化学品和/或导致核酸快速排泄的系统或受体。因此,在一些实施例中,合适的递送载体能够提高包含于其中的mRNA的稳定性和/或促进mRNA递送到靶细胞或组织。
脂质体尺寸
可以按多种尺寸制备根据本发明的合适的脂质体。在一些实施例中,所提供的脂质体可以制成小于先前已知的包封mRNA的脂质体。在一些实施例中,减小的脂质体尺寸与更有效的mRNA递送相关。选择适当的脂质体尺寸可以顾及靶细胞或靶组织的位点以及在一定程度上顾及该脂质体的目的应用。
在一些实施例中,选择适当尺寸的脂质体以促进由mRNA编码的抗体的全身分布。在一些实施例中,可能有利的是限制mRNA转染到某些细胞或组织。例如,为了靶向肝细胞,可以将脂质体的尺寸设定成使得其大小小于肝脏中的内皮细胞层衬里肝窦的窗孔;在此类情况下脂质体可易于进入此类内皮细胞窗以达到目标肝细胞。
作为另外一种选择或除此之外,可以将脂质体的尺寸设定成使得脂质体的大小具有足够的直径,以限制或明确避免分布到某些细胞或组织内。例如,可以将脂质体的尺寸设定成使得其大小大于内皮细胞层衬里肝窦的窗孔,从而限制脂质体分布到肝细胞。
在一些实施例中,通过脂质体颗粒的最大直径的长度确定脂质体的尺寸。在一些实施例中,合适的脂质体的尺寸不大于约250nm(例如,不大于约225nm、200nm、175nm、150nm、125nm、100nm、75nm或50nm)。在一些实施例中,合适的脂质体的尺寸在约10-250nm范围内(例如,在约10–225nm、10–200nm、10–175nm、10–150nm、10–125nm、10–100nm、10–75nm或10–50nm范围内)。在一些实施例中,合适的脂质体的尺寸在约100-250nm范围内(例如,在约100–225nm、100–200nm、100–175nm、100–150nm范围内)。在一些实施例中,合适的脂质体的尺寸在约10-100nm范围内(例如,在约10–90nm、10–80nm、10–70nm、10–60nm或10–50nm范围内)。
本领域已知的多种替代方法可用于确定一组脂质体的尺寸。一种此类确定尺寸的方法在美国专利No.4,737,323(以引用方式并入本文)中有所描述。通过超声浴或超声探针中任一者对脂质体悬浮液进行超声处理,使得尺寸逐渐减小至直径小于约0.05微米的小ULV。均化是另一种方法,其依赖于剪切能量将大脂质体碎裂为较小的脂质体。在典型的均化程序中,通过标准乳液均化器使MLV再循环,直至观察到所选择的脂质体尺寸通常在约0.1和0.5微米之间。通过如Bloomfield,Ann.Rev.Biophys.Bioeng.,10:421-150(1981)中所述的准弹性光散射(QELS)确定脂质体的尺寸,该文献以引用方式并入本文。可以通过对形成的脂质体进行超声处理来减小平均脂质体直径。间歇超声处理循环可与QELS评估交替,以引导有效的脂质体合成。
药物组合物
为了促进mRNA的体内表达,可将诸如脂质体的递送载体与一种或多种另外的核酸、载体、靶向配体或稳定剂组合配制,或配制在药理组合物中,其中将脂质体与合适的赋形剂混合。用于配制和施用药物的技术可见于“Remington's Pharmaceutical Sciences”,Mack Publishing Co.,Easton,Pa.,最新版。
可以根据当前的医疗实践施用和给予所提供的脂质体包封或缔和的mRNA以及包含此类mRNA的组合物,所述医疗实践考虑了受试者的临床状况、施用位点和方法、施用时间表、受试者的年龄、性别、体重和与具有本领域普通技术的临床医生相关的其它因素。可以通过如实验临床研究、药理学、临床和医疗领域的普通技术人员已知的此类相关的考虑因素确定用于本文目的的“有效量”。在一些实施例中,施用的量能够有效地实现如本领域的技术人员选择作为疾病进展、回归或改善的适当量度的症状和其它指征的至少一些稳定、改善或消除。例如,合适的量和给药方案是导致至少瞬时蛋白(例如酶)生成的量和给药方案。
合适的施用途径包括例如经口、直肠、阴道、经粘膜、肺部(包括气管内或吸入)或肠道施用;肠胃外递送(包括真皮内、透皮(局部))、肌内、皮下、髓内注射,以及鞘内、直接心室内、静脉内、腹膜内或鼻内。
作为另外一种选择或除此之外,可以局部方式而非全身方式施用本发明的脂质体包封的mRNA和组合物,例如,将药物组合物直接注射到靶组织,优选地以缓释制剂形式施用。可根椐待靶向组织以多种方式影响局部递送。例如,可吸入包含本发明组合物的气溶胶(以供鼻腔、气管或支气管递送);可将本发明组合物注射到例如损伤、疾病表现或疼痛位点;可以锭剂形式提供组合物以供经口、气管或食道应用;可以液体、片剂或胶囊形式供应以供施用到胃或肠,可以栓剂形式供应以供直肠或阴道应用;或者可甚至利用乳剂、滴剂或甚至注射剂递送到眼睛。甚至可以在手术中施用包含所提供的用治疗剂分子或配体合成的组合物的制剂,例如与可允许组合物从植入位点扩散到周围细胞的聚合物或其它结构或物质缔和。或者,可在不使用聚合物或载体的情况下手术施用它们。
本发明所提供的方法设想出单次以及多次施用治疗有效量的本文所述治疗剂(例如,编码ASS1蛋白的mRNA)。可根据受试者的病症(例如ASD)的性质、严重程度和程度,每隔一定时间施用治疗剂。在一些实施例中,可将治疗有效量的本发明治疗剂(例如,编码ASS1蛋白的mRNA)每隔一定时间周期性地施用(例如,每年一次、每6个月一次、每5个月一次、每3个月一次、两月一次(每2个月一次)、每月一次(每1个月一次)、两周一次(每2周一次)、每30天一次、每28天一次、每14天一次、每10天一次、每7天一次、每周一次、每日一次或连续不断地)。
在一些实施例中,所提供的脂质体和/或组合物被配制成使得它们适用于包含于其中的mRNA的缓释。可将此类缓释组合物按较长的施用间隔施用给受试者。例如,在一个实施例中,将本发明的组合物按每日两次、每日一次或每隔一天施用给受试者。在一个优选的实施例中,将本发明的组合物按每周两次、每周一次、每7天一次、每10天一次、每14天一次、每28天一次、每30天一次、每两周一次、每三周一次或更优选地每四周一次、每月一次、每六周一次、每八周一次、每隔一月一次、每三个月一次、每四个月一次、每六个月一次、每八个月一次、每九个月一次或每年一次施用给受试者。还可以想到为持久性施用(例如,肌内、皮下、玻璃体内)而配制的用于在较长时间段内递送或释放mRNA的组合物和脂质体。优选地,所用的缓释方法与为提高稳定性对mRNA做出的修饰结合。
如本文所用,术语“治疗有效量”主要根据包含于本发明的药物组合物中的治疗剂的总量确定。一般来讲,治疗有效量足以对受试者实现有意义的有益效果(例如,治疗、调节、治愈、预防和/或改善ASD)。例如,治疗有效量可为足以实现所需的治疗和/或预防效果的量。一般来讲,施用给有需要的受试者的治疗剂(例如,编码ASS1蛋白的mRNA)的量将取决于受试者的特征。此类特征包括受试者的病症、病害严重程度、总体健康状态、年龄、性别和体重。本领域的普通技术人员将易于根椐这些和其它相关因素确定适当的剂量。此外,可以任选地采用客观和主观测定两者以确定最佳剂量范围。
通常在可包括多次单位剂量的给药方案中施用治疗有效量。就任何特定的治疗剂蛋白而言,治疗有效量(和/或有效给药方案中的适当单位剂量)可以例如根椐施用途径、与其它药剂的组合而变化。另外,对于任何特定患者的具体治疗有效量(和/或单位剂量)可以取决于多种因素,包括所治疗的障碍及该障碍的严重程度;所用的具体药剂的活性;所用的具体组合物;患者的年龄、体重、总体健康状态、性别及饮食;所用的具体蛋白的施用时间、施用途径和/或排泄率;治疗的持续时间;以及医药领域中熟知的类似因素。
在一些实施例中,治疗有效剂量在约0.005mg/kg体重至500mg/kg体重范围内,例如,约0.005mg/kg体重至400mg/kg体重、约0.005mg/kg体重至300mg/kg体重、约0.005mg/kg体重至200mg/kg体重、约0.005mg/kg体重至100mg/kg体重、约0.005mg/kg体重至90mg/kg体重、约0.005mg/kg体重至80mg/kg体重、约0.005mg/kg体重至70mg/kg体重、约0.005mg/kg体重至60mg/kg体重、约0.005mg/kg体重至50mg/kg体重、约0.005mg/kg体重至40mg/kg体重、约0.005mg/kg体重至30mg/kg体重、约0.005mg/kg体重至25mg/kg体重、约0.005mg/kg体重至20mg/kg体重、约0.005mg/kg体重至15mg/kg体重、约0.005mg/kg体重至10mg/kg体重。
在一些实施例中,治疗有效剂量大于约0.1mg/kg体重、大于约0.5mg/kg体重、大于约1.0mg/kg体重、大于约3mg/kg体重、大于约5mg/kg体重、大于约10mg/kg体重、大于约15mg/kg体重、大于约20mg/kg体重、大于约30mg/kg体重、大于约40mg/kg体重、大于约50mg/kg体重、大于约60mg/kg体重、大于约70mg/kg体重、大于约80mg/kg体重、大于约90mg/kg体重、大于约100mg/kg体重、大于约150mg/kg体重、大于约200mg/kg体重、大于约250mg/kg体重、大于约300mg/kg体重、大于约350mg/kg体重、大于约400mg/kg体重、大于约450mg/kg体重、大于约500mg/kg体重。
本文还可以想到包含本文所公开的脂质体中的一者或多者的冻干药物组合物以及使用此类组合物的相关方法,如例如2011年6月8日提交的美国临时申请No.61/494,882中所公开的,其教导内容全文以引用方式并入本文。例如,可以在施用前重构根据本发明的冻干药物组合物或者可在体内重构。例如,可将冻干药物组合物配制为适当剂型(例如,真皮内剂型,诸如盘、棒或膜)并施用,使得该剂型在体内随时间推移通过个体的体液再水化。
可以将所提供的脂质体和组合物施用到任何所需的组织。在一些实施例中,通过所提供的脂质体或组合物递送的mRNA在其中施用了该脂质体和/或组合物的组织中表达。在一些实施例中,所递送的mRNA在与其中施用了脂质体和/或组合物的组织不同的组织中表达。可以在其中递送和/或表达所递送的mRNA的示例性组织包括但不限于肝、肾、心、脾、血清、大脑、骨骼肌、淋巴结、皮肤和/或脑脊液。
根据本发明,当定期施用时,治疗有效剂量导致肝ASS1水平升高。在一些实施例中,当定期施用时,治疗有效剂量导致血清中的瓜氨酸水平相比于治疗前的基线瓜氨酸水平降低。在一些实施例中,当定期施用时,治疗有效剂量导致血清中的氨水平相比于治疗前的基线氨水平降低。
在一些实施例中,施用所提供的组合物导致ASS1蛋白在肝脏中的表达相比于治疗前的基线水平升高。在一些实施例中,施用所提供的组合物导致ASS1蛋白水平处于或高于约3000ng/mg、处于或高于约2000ng/mg、处于或高于约1000ng/mg、处于或高于约500ng/mg、处于或高于约400ng/mg、处于或高于约200ng/mg或处于或高于约100ng/mg肝脏中总蛋白。在特定实施例中,施用所提供的组合物导致ASS1蛋白水平处于或高于120ng/mg肝脏中总蛋白。
在一些实施例中,施用所提供的组合物导致血浆或血清中的ASS1蛋白水平相比于治疗前的基线水平升高。在一些实施例中,施用所提供的组合物导致血浆或血清中的ASS1蛋白水平相比于治疗前的基线水平升高至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。
在一些实施例中,施用组合物导致受试者的瓜氨酸和/或氨水平相比于治疗前的基线水平降低。通常,在治疗前即刻测量基线水平。通常,在生物样品中测量瓜氨酸和/或氨水平。合适的生物样品包括例如全血、血浆、血清、尿液或脑脊髓液。
在一些实施例中,施用组合物导致生物样品(例如,血清、血浆或尿液样品)中的瓜氨酸水平相比于治疗前即刻的基线瓜氨酸水平降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。在一些实施例中,施用组合物导致血浆瓜氨酸水平降低至小于约2000μM、1500μM、1000μM、750μM、500μM、250μM、100μM、90μM、80μM、70μM、60μM、50μM、40μM或30μM。
在一些实施例中,施用组合物导致生物样品(例如,血清、血浆或尿液样品)中的氨水平相比于治疗前即刻的基线水平降低至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。
在一些实施例中,施用所提供的组合物导致血浆或血清中的氨水平相比于治疗前即刻的基线氨水平降低。在一些实施例中,施用所提供的组合物导致血浆或血清中的氨水平相比于未接受治疗的受试者的氨水平降低。在一些实施例中,施用组合物导致血浆或血清中的氨水平降低至约3000μmol/L或更低、约2750μmol/L或更低、约2500μmol/L或更低、约2250μmol/L或更低、约2000μmol/L或更低、约1750μmol/L或更低、约1500μmol/L或更低、约1250μmol/L或更低、约1000μmol/L或更低、约750μmol/L或更低、约500μmol/L或更低、约250μmol/L或更低、约100μmol/L或更低或约50μmol/L或更低。在特定实施例中,施用组合物导致血浆或血清中的氨水平降低至约50μmol/L或更低。
根据多个实施例,可调节所递送的mRNA的表达时间,以适合特定的医疗需要。在一些实施例中,在施用所提供的脂质体和/或组合物后1小时、2小时、3小时、6小时、12小时、24小时、48小时、72小时和/或96小时,可检测到由所递送的mRNA编码的蛋白的表达。在一些实施例中,在施用后1周、2周和/或1个月,可检测到由所递送的mRNA编码的蛋白的表达。
实例
虽然本发明的某些化合物、组合物和方法已专门根据某些实施例进行了描述,但是以下实例仅用于阐述本发明的化合物而不旨在对其进行限制。
实例1.用于ASS1mRNA递送和表达的示例性脂质体制剂
该实例提供了用于体内有效递送和表达ASS1mRNA的示例性脂质体制剂。
脂质材料
本文所述的制剂包括具有不同比率的多组分脂质混合物,该混合物采用一种或多种被设计用于包封编码ASS1蛋白的mRNA的阳离子脂质、辅助脂质(例如,非阳离子脂质和/或基于胆固醇的脂质)和PEG化脂质。阳离子脂质可包括(但不限于)DOTAP(1,2-二油烯基-3-三甲基铵丙烷)、DODAP(1,2-二油烯基-3-二甲基铵丙烷)、DOTMA(1,2-二-O-十八烯基-3-三甲基铵丙烷)、DLinDMA(Heyes,J.;Palmer,L.;Bremner,K.;MacLachlan,I.“Cationic lipid saturation influences intracellular delivery of encapsulated nucleic acids”J.Contr.Rel.2005,107,276-287)、DLin-KC2-DMA(Semple,S.C.等人,“Rational Design of Cationic Lipids for siRNA Delivery”Nature Biotech.2010,28,172-176)、C12-200(Love,K.T.等人,“Lipid-like materials for low-dose in vivo gene silencing”PNAS 2010,107,1864-1869)、cKK-E12(3,6-二(4-(二(2-羟基月桂基)氨基)丁基)哌嗪-2,5-二酮)、HGT5000、HGT5001、HGT4003、ICE、基于二烷基氨基的脂质、基于咪唑的脂质、基于胍鎓的脂质等。辅助脂质可包括(但不限于)DSPC(1,2-二硬脂酰基-sn-甘油-3-磷酰胆碱)、DPPC(1,2-二棕榈酰基-sn-甘油-3-磷酰胆碱)、DOPE(1,2-二油烯基-sn-甘油-3-磷酰乙醇胺)、DOPC(1,2-二油烯基-sn-甘油-3-磷脂酰胆碱)、DPPE(1,2-二棕榈酰基-sn-甘油-3-磷酰乙醇胺)、DMPE(1,2-二肉豆蔻酰基-sn-甘油-3-磷酰乙醇胺)、DOPG(,2-二油酰基-sn-甘油-3-磷酰基-(1'-rac-甘油))、胆固醇等。PEG化脂质可包括(但不限于)长度为至多5kDa的共价附接到具有C6-C20长度烷基链的脂质的聚乙二醇链。
通过如下方式合成密码子优化的人精氨基琥珀酸合成酶(ASS1)信使RNA:从编码基因的质粒DNA模板体外转录,然后添加5’帽结构(帽1)(Fechter,P.;Brownlee,G.G.“Recognition of mRNA cap structures by viral and cellular proteins”J.Gen.Virology 2005,86,1239-1249)和如通过凝胶电泳确定的长度为大约250个核苷酸的3’聚(A)尾(SEQ ID NO:12)。存在于每个mRNA产物中的5’和3’未翻译区分别表示为X和Y,并且如本文所述定义(参见下文)。
示例性的密码子优化的人精氨基琥珀酸合成酶(ASS1)mRNA
构建体设计:
X-SEQ ID NO:3-Y;
X-SEQ ID NO:13-Y;
X-SEQ ID NO:14-Y;以及
X-SEQ ID NO:15-Y。
5’和3’UTR序列
X(5’UTR序列)=
GGACAGAUCGCCUGGAGACGCCAUCCACGCUGUUUUGACCUCCAUAGAAGACACCGGGACCGAUCCAGCCUCCGCGGCCGGGAACGGUGCAUUGGAACGCGGAUUCCCCGUGCCAAGAGUGACUCACCGUCCUUGACACG[SEQ ID NO.:4]
Y(3’UTR序列)=
CGGGUGGCAUCCCUGUGACCCCUCCCCAGUGCCUCUCCUGGCCCUGGAAGUUGCCACUCCAGUGCCCACCAGCCUUGUCCUAAUAAAAUUAAGUUGCAUCAAGCU[SEQ ID NO.:5]
或
GGGUGGCAUCCCUGUGACCCCUCCCCAGUGCCUCUCCUGGCCCUGGAAGUUGCCACUCCAGUGCCCACCAGCCUUGUCCUAAUAAAAUUAAGUUGCAUCAAAGCU(SEQ ID NO.:6)
示例性的密码子优化的人ASS1mRNA序列包括具体实施方式部分中所述的SEQ ID NO:3,以及下面的SEQ ID NO:13、SEQ ID NO:14和SEQ ID NO:15:
SEQ ID NO:13
AUGAGCUCAAAGGGAUCUGUGGUGCUGGCAUACUCGGGGGGAUUGGACACUUCAUGCAUACUUGUCUGGUUGAAGGAACAGGGCUACGACGUGAUCGCCUACCUGGCUAACAUCGGUCAAAAGGAGGACUUCGAGGAGGCCCGGAAGAAGGCCCUGAAGCUGGGCGCGAAGAAAGUGUUCAUCGAGGACGUGUCCCGGGAAUUUGUGGAAGAGUUCAUCUGGCCCGCCAUCCAAAGCAGCGCACUGUACGAGGAUAGAUACCUCCUCGGAACAUCCCUUGCCCGGCCAUGUAUUGCCAGGAAACAGGUGGAAAUCGCCCAGCGGGA
AGGAGCCAAAUACGUGUCCCACGGGGCGACCGGAAAGGGGAACGACCAAGUGCGCUUCGAGCUGUCGUGCUACUCCCUGGCACCGCAGAUUAAGGUCAUCGCGCCGUGGAGAAUGCCUGAAUUCUACAACCGCUUCAAGGGCCGCAACGAUCUGAUGGAAUACGCCAAGCAGCACGGCAUCCCGAUCCCCGUGACCCCUAAGAACCCUUGGUCAAUGGACGAGAAUCUGAUGCACAUCAGCUACGAAGCGGGCAUCCUGGAGAACCCCAAGAAUCAAGCUCCGCCCGGACUGUACACUAAGACUCAGGAUCCCGCUAAGGCGCCCAACACUCCUGAUAUUUUGGAAAUCGAAUUCAAGAAGGGUGUCCCAGUGAAGGUCACCAACGUGAAGGACGGCACUACCCACCAGACCUCGCUGGAACUGUUUAUGUAUCUGAACGAGGUGGCCGGCAAACAUGGAGUCGGCAGAAUCGAUAUUGUGGAGAACCGCUUUAUUGGCAUGAAGUCCAGGGGGAUCUAUGAAACCCCGGCCGGAACCAUCCUCUACCACGCCCAUCUCGACAUUGAAGCGUUCACCAUGGACCGCGAGGUCCGCAAGAUUAAGCAGGGCCUGGGACUCAAGUUCGCCGAGCUCGUGUACACCGGUUUCUGGCAUUCCCCGGAAUGCGAAUUCGUGCGACACUGCAUUGCCAAGAGCCAGGAGCGGGUGGAAGGAAAGGUCCAGGUGUCCGUGCUGAAGGGUCAAGUGUACAUCCUGGGGCGGGAGUCCCCUCUUUCCCUGUACAACGAAGAACUGGUGUCGAUGAACGUGCAGGGAGACUACGAGCCGACCGACGCCACGGGUUUCAUUAACAUCAAUUCCCUGAGACUGAAGGAGUACCACCGGCUCCAGUCCAAAGUCACCGCUAAGUGA(SEQ ID NO:13),SEQ ID NO:14
AUGAGCUCAAAAGGAUCGGUGGUGCUGGCAUACUCGGGAGGAUUGGACACUUCAUGUAUUCUUGUCUGGCUCAAGGAACAGGGCUACGACGUCAUUGCCUACCUGGCCAACAUCGGUCAGAAAGAGGACUUCGAGGAAGCCAGAAAGAAGGCCCUGAAGCUGGGAGCCAAGAAGGUGUUCAUCGAGGACGUGUCCCGCGAAUUUGUGGAAGAAUUCAUCUGGCCUGCCAUUCAAUCCUCCGCGCUCUACGAGGAUCGGUACCUUCUGGGAACUUCCUUGGCUCGCCCGUGCAUCGCCCGGAAACAAGUGGAGAUUGCACAGCGGGAAGGAGCUAAGUACGUGUCCCACGGGGCCACUGGAAAGGGCAACGAUCAAGUGCGCUUCGAGCUGUCCUGCUACUCCCUGGCGCCACAGAUCAAGGUCAUCGCGCCGUGGCGGAUGCCCGAGUUCUAUAACCGCUUCAAGGGACGGAACGAUCUGAUGGAGUACGCC
AAGCAGCACGGCAUUCCGAUACCCGUGACCCCCAAGAACCCUUGGAGCAUGGACGAGAACCUGAUGCAUAUCUCUUACGAAGCCGGGAUUCUCGAAAACCCUAAGAAUCAGGCGCCGCCUGGCCUGUACACCAAAACCCAGGACCCCGCCAAGGCGCCGAACACGCCCGACAUCCUCGAAAUCGAGUUCAAGAAGGGGGUGCCAGUGAAGGUCACCAACGUGAAGGACGGAACCACCCAUCAGACCUCACUGGAACUCUUCAUGUACCUCAACGAGGUCGCAGGGAAGCACGGCGUGGGGAGAAUCGACAUCGUGGAAAACAGGUUCAUCGGCAUGAAGUCCCGGGGAAUCUACGAAACACCCGCCGGGACUAUCCUCUACCACGCCCACCUGGACAUUGAGGCCUUCACCAUGGAUAGAGAAGUGCGCAAGAUUAAGCAGGGUCUGGGUCUGAAGUUCGCCGAGUUGGUCUACACCGGAUUCUGGCAUUCCCCUGAAUGCGAAUUCGUGCGCCACUGCAUUGCCAAGAGCCAGGAAAGAGUGGAGGGCAAAGUCCAAGUGUCGGUGCUGAAGGGCCAAGUGUACAUCCUGGGAAGGGAAAGCCCGCUCUCCCUGUACAACGAGGAACUGGUGUCGAUGAACGUCCAGGGCGAUUAUGAGCCGACUGACGCCACUGGUUUUAUCAAUAUCAACAGCCUGCGACUGAAGGAGUACCACCGGCUGCAGUCCAAGGUCACCGCUAAGUAG(SEQ ID NO:14),
SEQ ID NO:15
AUGAGCUCGAAAGGAUCCGUGGUUUUGGCAUACUCCGGUGGACUUGACACUUCAUGCAUUUUGGUUUGGCUCAAAGAACAGGGCUACGAUGUGAUCGCCUACCUGGCGAACAUCGGACAGAAAGAGGACUUUGAAGAGGCCCGCAAGAAGGCACUGAAGCUGGGUGCCAAGAAAGUGUUUAUCGAGGAUGUGUCGAGAGAAUUCGUGGAAGAAUUCAUUUGGCCAGCCAUUCAAAGCUCCGCGCUGUACGAGGACAGAUACCUCCUCGGCACCUCACUGGCCCGCCCUUGCAUCGCGCGCAAACAGGUCGAGAUCGCUCAAAGAGAAGGAGCUAAAUACGUGUCACACGGCGCCACCGGAAAGGGAAAUGACCAAGUCCGCUUCGAGCUGUCUUGCUACUCACUCGCUCCGCAAAUCAAGGUCAUCGCACCGUGGAGGAUGCCCGAGUUCUACAACCGGUUCAAGGGGCGGAACGACCUGAUGGAGUACGCGAAGCAGCACGGUAUCCCGAUCCCUGUCACCCCAAAGAACCCCUGGAGCAUGGACGAAAAUCUGAUGCACAUCAGCUACGAAGCAGGAAUCCUGGAGAACCCGAAAAAUCAAGCACCUCCUGGACUGUACACUAAGACCCAGGACCCAGCCAAGGCCCCGAAUA
CCCCGGACAUCUUGGAAAUCGAGUUCAAGAAGGGGGUGCCAGUGAAGGUUACCAAUGUCAAGGAUGGGACCACUCACCAAACUAGCCUGGAACUGUUCAUGUACCUGAACGAAGUGGCUGGAAAACAUGGCGUGGGAAGAAUCGAUAUCGUGGAGAACCGCUUCAUCGGCAUGAAGUCAAGGGGAAUCUACGAAACUCCGGCCGGGACGAUACUGUAUCAUGCGCAUCUCGACAUUGAAGCCUUUACUAUGGAUCGGGAAGUCCGAAAGAUCAAACAGGGCUUGGGCCUCAAGUUUGCCGAGCUGGUGUACACGGGAUUCUGGCACUCGCCGGAAUGCGAAUUCGUGCGCCACUGUAUUGCGAAGUCCCAGGAGCGCGUGGAAGGGAAGGUCCAAGUCUCCGUGCUCAAAGGACAGGUCUACAUCCUUGGACGGGAGUCGCCCCUGUCGCUCUACAACGAAGAACUGGUGUCGAUGAACGUGCAGGGAGACUAUGAACCAACGGAUGCUACUGGUUUCAUCAACAUCAAUUCGCUGCGGCUUAAGGAGUACCAUCGGCUGCAGUCCAAGGUCACCGCGAAGUAG(SEQ ID NO:15)。
示例性的全长密码子优化的人精氨基琥珀酸合成酶(ASS1)信使RNA序列在下面示出:
GGACAGAUCGCCUGGAGACGCCAUCCACGCUGUUUUGACCUCCAUAGAAGACACCGGGACCGAUCCAGCCUCCGCGGCCGGGAACGGUGCAUUGGAACGCGGAUUCCCCGUGCCAAGAGUGACUCACCGUCCUUGACACGAUGAGCAGCAAGGGCAGCGUGGUGCUGGCCUACAGCGGCGGCCUGGACACCAGCUGCAUCCUGGUGUGGCUGAAGGAGCAGGGCUACGACGUGAUCGCCUACCUGGCCAACAUCGGCCAGAAGGAGGACUUCGAGGAGGCCCGCAAGAAGGCCCUGAAGCUGGGCGCCAAGAAGGUGUUCAUCGAGGACGUGAGCCGCGAGUUCGUGGAGGAGUUCAUCUGGCCCGCCAUCCAGAGCAGCGCCCUGUACGAGGACCGCUACCUGCUGGGCACCAGCCUGGCCCGCCCCUGCAUCGCCCGCAAGCAGGUGGAGAUCGCCCAGCGCGAGGGCGCCAAGUACGUGAGCCACGGCGCCACCGGCAAGGGCAACGACCAGGUGCGCUUCGAGCUGAGCUGCUACAGCCUGGCCCCCCAGAUCAAGGUGAUCGCCCCCUGGCGCAUGCCCGAGUUCUACAACCGCUUCAAGGGCCGCAACGACCUGAUGGAGUACGCCAAGCAGCACGGCAUCCCCAUCCCCGUGACCCCCAAGAACCCCUGGAGCAUGGACGAGAACCUGAUGCACAUCAGCUACGAGGCCGGCAUCCUGGAGAACCCCAAGAACCAGGCCCCCCCCGGCCUGUACACCAAGACCCAGGACCCCGCCAAGGCCCCCAACACCCCCGACAUCCUGGAGAUCGAGUUCAAGA
AGGGCGUGCCCGUGAAGGUGACCAACGUGAAGGACGGCACCACCCACCAGACCAGCCUGGAGCUGUUCAUGUACCUGAACGAGGUGGCCGGCAAGCACGGCGUGGGCCGCAUCGACAUCGUGGAGAACCGCUUCAUCGGCAUGAAGAGCCGCGGCAUCUACGAGACCCCCGCCGGCACCAUCCUGUACCACGCCCACCUGGACAUCGAGGCCUUCACCAUGGACCGCGAGGUGCGCAAGAUCAAGCAGGGCCUGGGCCUGAAGUUCGCCGAGCUGGUGUACACCGGCUUCUGGCACAGCCCCGAGUGCGAGUUCGUGCGCCACUGCAUCGCCAAGAGCCAGGAGCGCGUGGAGGGCAAGGUGCAGGUGAGCGUGCUGAAGGGCCAGGUGUACAUCCUGGGCCGCGAGAGCCCCCUGAGCCUGUACAACGAGGAGCUGGUGAGCAUGAACGUGCAGGGCGACUACGAGCCCACCGACGCCACCGGCUUCAUCAACAUCAACAGCCUGCGCCUGAAGGAGUACCACCGCCUGCAGAGCAAGGUGACCGCCAAGUGACGGGUGGCAUCCCUGUGACCCCUCCCCAGUGCCUCUCCUGGCCCUGGAAGUUGCCACUCCAGUGCCCACCAGCCUUGUCCUAAUAAAAUUAAGUUGCAUCAAGCU(SEQ ID NO:7)。
在另一个例子中,全长密码子优化的人精氨基琥珀酸合成酶(ASS1)信使RNA序列在下面示出:
GGACAGAUCGCCUGGAGACGCCAUCCACGCUGUUUUGACCUCCAUAGAAGACACCGGGACCGAUCCAGCCUCCGCGGCCGGGAACGGUGCAUUGGAACGCGGAUUCCCCGUGCCAAGAGUGACUCACCGUCCUUGACACGAUGAGCAGCAAGGGCAGCGUGGUGCUGGCCUACAGCGGCGGCCUGGACACCAGCUGCAUCCUGGUGUGGCUGAAGGAGCAGGGCUACGACGUGAUCGCCUACCUGGCCAACAUCGGCCAGAAGGAGGACUUCGAGGAGGCCCGCAAGAAGGCCCUGAAGCUGGGCGCCAAGAAGGUGUUCAUCGAGGACGUGAGCCGCGAGUUCGUGGAGGAGUUCAUCUGGCCCGCCAUCCAGAGCAGCGCCCUGUACGAGGACCGCUACCUGCUGGGCACCAGCCUGGCCCGCCCCUGCAUCGCCCGCAAGCAGGUGGAGAUCGCCCAGCGCGAGGGCGCCAAGUACGUGAGCCACGGCGCCACCGGCAAGGGCAACGACCAGGUGCGCUUCGAGCUGAGCUGCUACAGCCUGGCCCCCCAGAUCAAGGUGAUCGCCCCCUGGCGCAUGCCCGAGUUCUACAACCGCUUCAAGGGCCGCAACGACCUGAUGGAGUACGCCAAGCAGCACGGCAUCCCCAUCCCCGUGACCCCCAAGAACCCCUGGAGCAUGGACGAGAACCUGAUGCACAUCAGCUACGAGGC
CGGCAUCCUGGAGAACCCCAAGAACCAGGCCCCCCCCGGCCUGUACACCAAGACCCAGGACCCCGCCAAGGCCCCCAACACCCCCGACAUCCUGGAGAUCGAGUUCAAGAAGGGCGUGCCCGUGAAGGUGACCAACGUGAAGGACGGCACCACCCACCAGACCAGCCUGGAGCUGUUCAUGUACCUGAACGAGGUGGCCGGCAAGCACGGCGUGGGCCGCAUCGACAUCGUGGAGAACCGCUUCAUCGGCAUGAAGAGCCGCGGCAUCUACGAGACCCCCGCCGGCACCAUCCUGUACCACGCCCACCUGGACAUCGAGGCCUUCACCAUGGACCGCGAGGUGCGCAAGAUCAAGCAGGGCCUGGGCCUGAAGUUCGCCGAGCUGGUGUACACCGGCUUCUGGCACAGCCCCGAGUGCGAGUUCGUGCGCCACUGCAUCGCCAAGAGCCAGGAGCGCGUGGAGGGCAAGGUGCAGGUGAGCGUGCUGAAGGGCCAGGUGUACAUCCUGGGCCGCGAGAGCCCCCUGAGCCUGUACAACGAGGAGCUGGUGAGCAUGAACGUGCAGGGCGACUACGAGCCCACCGACGCCACCGGCUUCAUCAACAUCAACAGCCUGCGCCUGAAGGAGUACCACCGCCUGCAGAGCAAGGUGACCGCCAAGUGAGGGUGGCAUCCCUGUGACCCCUCCCCAGUGCCUCUCCUGGCCCUGGAAGUUGCCACUCCAGUGCCCACCAGCCUUGUCCUAAUAAAAUUAAGUUGCAUCAAAGCU(SEQ ID NO:8)。
示例性制剂方案
A.cKK-E12
将cKK-E12、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1 mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.64mg/mL ASS1 mRNA(包封的)。Z平均=78nm(Dv(50))=46nm;Dv(90)=96nm)。
B.C12-200
将C12-200、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1 mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.82mg/mL ASS1 mRNA(包封的)。Z平均=86nm(Dv(50)=50nm;Dv(90)=101nm)。
C.HGT4003
将HGT4003、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.82mg/mL ASS1 mRNA(包封的)。Z平均=86nm(Dv(50)=50nm;Dv(90)=101nm)。
D.ICE
将ICE、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1 mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.91mg/mL ASS1 mRNA(包封的)。Z平均=81nm(Dv(50)=48nm;Dv(90)=96nm)。
E.HGT5001
将HGT5001、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1 mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.20mg/mL ASS1mRNA(包封的)。Z平均=87.0nm(Dv(50)=75nm;Dv(90)=103nm)。
F.HGT5000
将HGT5000、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.20mg/mL ASS1mRNA(包封的)。Z平均=81nm(Dv(50)=67nm;Dv(90)=97nm)。
G.DLinKC2DMA
将DLinKC2DMA、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.20mg/mL ASS1mRNA(包封的)。Z平均=78nm(Dv(50)=60nm;Dv(90)=92nm)。
H.DODAP
将DODAP、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.20mg/mL ASS1 mRNA(包封的)。Z平均=84nm(Dv(50)=62nm;Dv(90)=92nm)。
I.DODMA
将DODMA、DOPE、胆固醇和DMG-PEG2K的50mg/mL乙醇溶液的等分试样混合并用乙醇稀释至3mL最终体积。单独地,从1mg/mL原液制备ASS1 mRNA的水性缓冲液(10mM柠檬酸盐/150mM NaCl,pH 4.5)。将脂质溶液快速注射到水性mRNA溶液中并振摇,以产生20%乙醇中的最终悬浮液。将所得的纳米颗粒悬浮液过滤,用1x PBS(pH 7.4)透析过滤,浓缩并存储在2-8℃下。最终浓度=0.20mg/mL ASS1mRNA(包封的)。Z平均=86nm(Dv(50)=69nm;Dv(90)=98nm)。
实例2.施用加载有ASS1 mRNA的脂质体纳米颗粒
该实例示出了施用加载有ASS1mRNA的脂质体纳米颗粒的示例性方法以及用于分析在体内多个靶组织中表达的蛋白的方法。
在每个实验的开始利用大约6-8周龄的公CD-1小鼠进行所有研究。通过具有1.0mg/kg等效总剂量的(或以其它方式指定的)包封的ASS1 mRNA的单次尾静脉推注引入样品。在指定时间点处死小鼠并用盐水溶液灌注。
获取每个小鼠的诸如肝、脾、肾和心的组织,分成独立的部分,并且存储在10%中性缓冲福尔马林中或速冻存储在-80℃下以供分析。
在给药后指定时间点(±5%)通过CO2窒息处死全部动物,然后行胸廓切开术并进行终端心脏采血。通过对处死动物的心脏穿刺将全血(可获得的最大体积)采集到血清分离管中,使其在室温下凝结至少30分钟,在22℃±5℃下以9300g离心10分钟,然后提取血清。就临时采血而言,通过面静脉穿刺或剪尾采集大约40-50μL全血。使用从未处理动物采集的样品作为基线ASS1水平以供比较以研究动物。
酶联免疫吸附测定(ELISA)分析-人ASS1ELISA
按照标准ELISA程序,采用小鼠抗-ASS1 2D1-2E12 IgG作为捕集抗体,并用兔抗-ASS1#3285IgG作为第二(检测)抗体(Shire Human Genetic Therapies)。利用辣根过氧化物酶(HRP)-结合的山羊抗-兔IgG激活3,3',5,5'-四甲基对二氨基联苯(TMB)基质溶液。在20分钟后利用2N H2SO4使反应骤冷。在分子器件SpectraMax器械上通过吸光度(450nm)监测检测。分别使用未经处理的小鼠血清和器官以及人ASS1蛋白作为阴性对照和阳性对照。
实例3.有效的体内ASS1蛋白表达
该实例证实施用ASS1mRNA导致成功的体内蛋白质生成和临床功效。
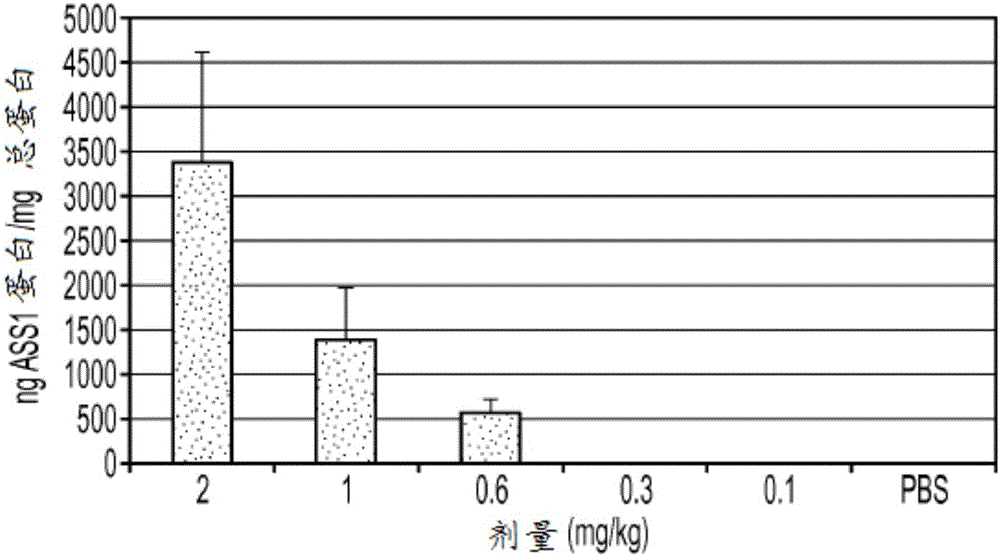
在CD-1小鼠中,以单次静脉推注,通过加载有密码子优化的hASS1mRNA的脂质纳米颗粒测试了人ASS1蛋白的产生情况。图1示出了在用多个剂量的加载有人ASS1mRNA的基于cKK-E12的脂质纳米颗粒处理小鼠时,通过ELISA检测到的人ASS1蛋白量。在注射后24小时处死小鼠并获取器官(如上所述)。
如图1所示,当测量人ASS1蛋白的肝脏水平时获得明显的剂量响应。剂量范围为0.10–2.0mg/kg包封的人ASS1mRNA。这些数据表明脂质纳米颗粒能够在肝脏内累积并释放mRNA有效载荷,以及肝脏能够通过翻译处理这种外源mRNA以产生人ASS1蛋白。如通过ELISA分析(如图1所示)测量的人ASS1蛋白的原始值示于下表1中。
表1
通过基于cKK-E12的脂质纳米颗粒递送密码子优化的人ASS1 mRNA。剂量基于包封的ASS1 mRNA。这些值以每毫克肝脏内总蛋白中人ASS1蛋白的纳克数描述。BLD=低于ELISA的检出限。
虽然ELISA的灵敏度在较低值时具有局限性,但western印迹分析允许在较低剂量(0.30mg/kg)下清楚地观察到人ASS1蛋白(图2A-2D)。
为进一步理解包封ASS1mRNA的脂质纳米颗粒促进mRNA递送到所选择的器官(肝脏)的能力,我们继续进行药动学研究,在一周时间段内监测肝脏中的人ASS1蛋白水平。图3示出了在施用加载有人ASS1的脂质纳米颗粒(cKK-E12)后的多个时间点在肝脏中检测到的人ASS1蛋白量。这是以经静脉内给予的单剂量(1.0mg/kg包封的mRNA)完成的。
在这种情况下,我们在施用后大约24-48小时观察到最大的人ASS1蛋白血清水平。在施用后1周仍可观察到可测量的蛋白质水平,如通过ELISA和western印迹(分别为图3和4A-4E)确定。
利用基于原位杂交(ISH)的方法实现直接检测经处理的小鼠的肝脏中的活性药物成分(ASS1 mRNA)。如图5A-5I中所示,在所测试的最早时间点(30分钟)可检测到处于较高水平的外源人ASS1信使RNA,并且在给药后48小时内信号保持较强。另外,在施用后7天仍可检测到人ASS1 mRNA。
除ISH之外,利用免疫组织化学(IHC)方法实现所得人ASS1蛋白的检测。利用小鼠单克隆抗体(02D2-2E12)进行特异性结合,我们易于在经处理的肝脏的肝细胞的细胞质中观察到目标人ASS1蛋白。在施用后30分钟内首先在经处理的肝脏中观察到微弱的信号,但在施用后3小时内观察到清晰的信号。图6A-6I示出了随施用后时间而变化的经处理的小鼠肝脏中的人ASS1蛋白的染色。
另外,可以观察到整个肝脏中的广泛分布,其中在肝窦细胞以及目标肝细胞两者中均检测到较强的人ASS1蛋白。图7A-7B示出了在施用后24小时人ASS1蛋白的阳性IHC染色的低放大率图示。
人ASS1 mRNA的递送和后续蛋白生成不限于单个脂质纳米颗粒系统。探索若干基于阳离子脂质的纳米颗粒系统递送mRNA和产生所需蛋白的能力。利用人ASS1 mRNA作为所选择的被分析物,研究10种不同阳离子脂质系统的筛选。每个制剂的阳离子脂质组分列于表2中以及示于图8中。施用单次静脉注射并在施用后24小时获取肝脏样品。
基于包封的mRNA,制剂的剂量均为1.0mg/kg。所述值基于施用后24小时的肝脏样品。
表2
如通过ELISA分析测量的多种基于阳离子脂质的纳米颗粒系统的人ASS1蛋白的原始值(如图9所示)。以1.0mg/kg经静脉内施用所有剂量。蛋白质的值以每毫克总肝脏蛋白中人ASS1蛋白的纳克数描述。cKK-E12(1)具有比cKK-E12(2)更低的PEG脂质百分比(3%比5%PEG脂质)。
虽然可检测到通过加载有mRNA的脂质纳米颗粒产生的蛋白,但我们进一步确定所得蛋白是否具有活性以及是否可适当发挥作用。为此,进行体外活性研究,其中通过14C瓜氨酸的添加量测量结合到细胞蛋白中的14C精氨酸。在存在活性ASS1蛋白的情况下,将放射性瓜氨酸转变成14C-精氨基琥珀酸,随后转变成14C-精氨酸。通过对人ASS1 mRNA转染细胞与未经处理的细胞进行比较,我们可测量相应的外源mRNA-衍生的ASS1蛋白的活性。图9示出了结合到细胞蛋白中的14C精氨酸的每分钟放射性计数。用暴露于贫化培养基(无精氨酸或亮氨酸)的人ASS1 mRNA进行的SK(-)细胞(ASS1蛋白基因敲除细胞系)的转染导致观察到的放射性相比于未经处理的SK(-)细胞增大。在这些转染细胞中测量的活性与稳定转染的阳性ASS1细胞系(SK(+))相当。
实例4.用加载有ASS1 mRNA的脂质纳米颗粒处理后的人ASS1蛋白水平[
该实例证实施用ASS1 mRNA导致肝脏中成功产生ASS1蛋白。
给雄性CD-1小鼠经静脉内施用单剂量的1.0mg/kg脂质纳米颗粒(加载有ASS1 mRNA的基于cKK-E12的脂质纳米颗粒),或未经处理(即对照物),如上面实例2中所述。在施用后24小时处死小鼠并采集器官。通过ELISA测量肝脏中的人精氨基琥珀酸合成酶(ASS1)蛋白水平。这些数据表明,检测到ASS1蛋白水平相对于对照物升高,并且所产生的蛋白由静脉内递送的ASS1mRNA得到(图10)。
实例5:用加载有ASS1 mRNA的脂质纳米颗粒处理后的血浆氨水平
该实例证实施用ASS1 mRNA导致血浆氨水平成功降低。
给ASS1基因敲除小鼠施用1.0mg/kg ASS1 mRNA脂质纳米颗粒(加载有ASS1 mRNA的基于cKK-E12的脂质纳米颗粒)或空脂质纳米颗粒,按每14天一次施用30天,如上面实例2中所述。施用了空脂质纳米颗粒的小鼠充当载体对照物。另外的对照物包括未经处理的野生型小鼠和未经处理的ASS1基因敲除小鼠。在第1天、第15天和第29天的每次给药之前,采集血浆样品(即给药前)。另外在第2天、第16天和第30天的每次给药后24小时内采集血浆样品。在第8天和第22天采集另外的血浆样品。在所有样品中量化血浆氨水平,并且显示在处理后至少24小时,血浆氨水平可再生地降低至接近在野生型小鼠中观察到的水平的水平。
等同方案
本领域的技术人员将认识到或能够确定仅使用例行实验、许多本文描述的本发明的具体实施例的等效内容。本发明的范围并非旨在意图限于上述“具体实施方式”,而是如以下权利要求中所述。
- 还没有人留言评论。精彩留言会获得点赞!