打印具有包埋的脉管系统的组织构建体的方法与流程
本专利文件根据35U.S.C.§119要求在2013年11月5日提交的美国临时专利申请序列号61/900029的优先权的权益,并且在此通过引用将所述美国临时专利申请整体并入本文。
下面的专利和专利申请公开文本也由此通过引用以整体并入本文:2012年6月29日提交的国际专利申请序号PCT/US2012/044794,题为“Multinozzle Deposition System for Direct Write Applications”;美国专利申请公开号2013/0084449,题为“Viscoelastic Ink for Direct Writing of Hydrogel Structures”,其于2011年3月22日被提交作为PCT/US2011/29429;和美国专利8101139,题为“Microcapillary Networks,”提交于2008年6月5日。
联邦政府资助的研究或开发
由国家科学基金会授予的合同号DMR 0820484通过政府支持而做出本发明。政府对本发明具有一定的权利。
技术领域
本公开内容一般性涉及组织工程,尤其涉及制造组织构建体包括经包埋的脉管系统。
背景技术:
按需创建三维(3D)脉管化组织可以实现在组织工程,药物筛选,毒理学,3D组织培养和器官修复中的科技进步。为了产生模仿天然组织并最终模仿器官的3D工程组织构建,几个关键组件-细胞,细胞外基质(ECM),和脉管系统-可能需要以复杂的排列来进行组装。这些组件中的每一个起着至关重要的作用:细胞是所有生命系统的基本单元,ECM提供结构支撑,和脉管网络提供有效的养分和废物的运输,温度调节,因子的递送和远程信号传导路径。每个细胞的几百微米之内没有可灌注的脉管系统的情况下,三维组织会快速地发展成坏死区。无法在组织构建体中包埋入脉管网络,阻碍了3D组织工程的进展几十年。
简述
包含一个或多个组织模型的打印的组织构建体,其中每个组织模型包含一种或多种预定的细胞类型的诸多活细胞。脉管通道的网络与一个或多个组织模型互相贯通(interpenetrate)。细胞外基质组合物至少部分地裹绕所述一个或多个组织模型和脉管通道的网络。
打印具有包埋的脉管系统的组织构建体的方法,其包括沉积一种或多种载有细胞的丝(cell-laden filaments)在基底(substrate)上,以形成一个或多个组织模型(tissue pattern)。所述一个或多个组织模型中的每一个包括一种或多种预定的细胞类型。一根或多根牺牲丝(sacrificial filament)(每根包含短时性墨水(fugitive ink))被沉积在基底上,以形成与一个或多个组织模型互相贯通的脉管模型。脉管模型和一个或多个组织模型至少部分地被细胞外基质组合物裹绕。然后短时性墨水被移除以在细胞外基质组合物中创建脉管通道,从而在组织构建体中形成互相贯通的脉管网络。
打印上皮组织构建体的方法需要在基底上沉积一根或多根牺牲丝以形成功能性通道模型。每根牺牲丝包含短时性墨水和多个上皮细胞。功能性通道模型至少部分地被细胞外基质组合物裹绕。然后短时性墨水被移除以创建在细胞外基质组合物中的一个或多个功能性通道。至少上皮细胞的一部分在移除短时性墨水后留在所述一个或多个功能性通道中,由此形成上皮组织构建体。
打印的上皮组织构建体包含一个或多个功能性通道,所述功能性通道包含在其上的上皮细胞层。细胞外基质组合物至少部分地裹绕所述一个或多个功能性通道。
附图的简要说明
图1A显示生物打印概念的图例,在所述生物打印概念中,脉管系统,细胞外基质,及细胞可以被组合打印。
图1B显示3D打印的异质组织构建体的示意图,异质组织构建体包括三维精确放置的脉管系统和多种细胞类型。
图2A是表示2D组织构建体(包含二种组织模型和互相贯通的脉管网络)的横截面示意图。
图2B显示3D组织构建体(其包含组织模型和互相贯通的脉管网络)的一个实例。
图2C显示包含二种组织模型和互相贯通的脉管网络的3D组织构建体的一个实例。
图3A和3B显示包含二种组织模型和互相贯通的脉管网络的3D组织构建的实例。
图4显示四个打印头(喷嘴)被安装到定制3D打印机之上,其中每个z轴被独立地控制。
图5A还显示四个打印头(喷嘴),以及图5B显示四层微结构,其中复合墨水模型被依次由四个喷嘴沉积以形成具有不同组分的四层的微观结构。
图5C显示沉积工艺的每一层的连续制造的图像,其中每个插图显示每一层的几何结构。
图6A显示普流罗尼克F127的溶胶-凝胶转变的示意图。
图6B显示40wt.%的普流罗尼克F127墨水的剪切模量(G’和G”)的温度依赖性。
图6C显示GelMA的螺旋到线圈的转变特性的示意图。
图6D显示GelMA剪切模量(shear moduli)的热依赖性。
图6E显示载有细胞的GelMA。
图6F显示作为载有10T1/2成纤维细胞的GelMA的温度函数的剪切模量。
图7A和7B显示在GelMA中形成的1D通道,其中直径范围为115微米到500微米。
图7C显示灌注有用于可视化的水溶性荧光染料的通道。
图7D-7E显示使用单个30μm玻璃毛细管打印的具有曲线细丝的2D分层分支网络。
图7F显示灌注有用于可视化的红色荧光染料的结构。
图7G-7I显示从牺牲丝打印的高度周期性的3D网格,其用于创建可以在短时性墨水排空后被灌注的3D脉管模型。
图7J显示灌注有HUVEC悬浮液的2D脉管网络内的代表性微通道的光学图像。
图7K显示在7J图中所示的微通道的共聚焦图像,所述微通道具有作为微通道壁衬里的活HUVEC细胞。
图8A显示通过沉积牺牲丝和移除短时性墨水创建的各种通道直径的代表性横截面。
图8B是显示包括普流罗尼克F127的各种打印的牺牲丝的溶胀率(D最终/D初始)的曲线图。每个数据点是6个样品的平均值,每个样品以固定的速度,压力和喷嘴高度(z轴)沉积。直接在打印后和再次在排空后通过自上而下光学显微镜测量直径。
图9A-9B显示,内皮化脉管通道可以在纤维蛋白凝胶中创建,如图所示。
图9C和9D显示在制造的分叉脉管网络中动物血液浸润的之前和之后的照片。
图10A提供了最终的3D打印的异质组织构建体结构的俯视图(top-down view),其由四种独立的墨水打印。
图10B提供了用于创建图10A中显示的组织构建体的复杂工具路径(complex tool-path)的倾斜视图(angled view),其中绿色丝包含载有GFP HNDF的GelMA,蓝色丝包含载有10T1/2成纤维细胞的GelMA,红色丝包含可采用RFP HUVEC内皮化的普流罗尼克墨水。灰色阴影区域对应于包封了3D打印的构建体的纯GelMA基质。
图10C是打印后直接与图10A的结构的绿色荧光通道叠加的亮视野显微镜图像。
图10D是显示所打印的结构的跨越(spanning)特性和突出于平面的特性的照片。
图10E显示了短时性墨水排空过程的演示。
图10F提供三个荧光通道的复合图像:来自图10A结构的10T1/2成纤维细胞(蓝色),HNDFs(绿),HUVECs(红色)。
图10G显示与非打印对照相比的打印的10T1/2的成纤维细胞的细胞活力测定结果。
图11A显示包含多个载有细胞的丝和含有短时性墨水的牺牲丝的三层结构的示意图。
图11B显示内皮化前排空的微观结构的照片。
图11C显示培养两天后GFP HNDFs(绿色)和RFP HUVECs(红色)的表面荧光图像。
图12A-12C显示示意性的图和图像,其说明通过直接打印包含纤维蛋白-明胶的载有GF的细胞外基质材料使生长因子(GF)梯度成形。
图12D显示示例性模具,其用于用荧光平行打印的脉管通道的灌注,其中只有一个通道中有标记的BSA。
图12E和12F显示,24小时中图12D的两个通道之间产生接近线性的梯度。
图13A-13D显示纤维蛋白-明胶互相贯通的聚合物网络的合成。首先,凝胶前体与转谷氨酰胺酶(TG)混合在一起。然后,通过经由酶凝血酶聚合的纤维蛋白原,形成纤维蛋白网络。然后围绕纤维蛋白凝胶形成第二相,并且两相通过TG缓慢交联在一起。
图13E-13F显示纤维蛋白-明胶基质材料的机械性能。
图13G-13J分别显示成纤维细胞(结缔组织)、平滑肌细胞,内皮细胞,和肾近端小管(上皮)细胞的纤维蛋白-明胶基质粘附性的多样性。
图14显示TG的孵育时间对纤维蛋白-明胶互相贯通的聚合物网络的光学特性的影响。透明度是通过纤维蛋白凝胶最终孔隙结构确定,这是使用若丹明标记的纤维蛋白原和共聚焦显微镜观察的。
图15A-15D显示用于组织构建体的被动摆动灌注的示例性模具。
图15E-15G显示了组织构建体基于主动泵灌注的示范模具。
图16A-16C示意性地显示了,由短时性墨水形成的牺牲丝内的内皮细胞沉积,用细胞外基质组合物包封牺牲丝,并排空短时性墨水,从而形成具有内皮细胞衬里的通道壁的通道。
图16D显示了包含HUVECs分散液的刚打印的(as-printed)短时性墨水(普流罗尼克F127);图16E显示浇铸和液化后的短时性墨水;图16F显示HUVECs孵育后1天的脉管网络;和图16G显示24小时主动灌注后的脉管网络。
图17A显示在细胞外基质组合物中的一个或多个功能性通道的建立,其用于形成组织构建体(在该实例中,具体地是上皮组织构建体)的功能性通道网络。步骤包括用于形成功能性通道模型的一根或多根包含短时性墨水(其可以是载有细胞的短时性墨水)的牺牲丝的沉积,采用细胞外基质组合物的通道模型的至少部分包封,移除短时性墨水以形成功能性通道,以及用于采用上皮细胞作为功能性通道的衬里的可选接种方法。
图17B-17C显示细胞外基质组合物中的两个功能性通道,其具有上皮细胞作为通道的衬里。
图17D-17F显示具有PTEC作为衬里的通道的各种共聚焦显微镜图像和与被表达的各种细胞特异性蛋白(包括Na/K ATP酶)的免疫荧光图像。
图18A-18C高亮了接种后3天的HUVECs(红色)和HNDFs(绿色)的初始均匀分布。图18D-18E显示八天之后同一通道,在该时刻所述通道包括不同的外基质(HNDF)层和融汇内皮(HUVEC)层。
图19A-19F显示,在直接将短时性墨水打印到载有细胞的基质、用更多的载有细胞的基质进行包封、排空短时性墨水以形成脉管通道并采用HUVECs接种脉管通道后,内皮细胞形成融汇层并随着时间的推移可以组装入毛细管结构。
图20A-20C是共聚焦显微镜图像,其显示在包含两种细胞类型(分散在明胶-纤维蛋白细胞外基质材料内的HNDFs和HUVECs)的打印的载有细胞的丝中自发的新脉管系统形成。
图21A显示描绘包埋的打印工艺的示意图;图21B显示包含适合包埋的打印的半互相贯通的聚合物网络(IPN)(例如,PAA-GelMA)的细胞外基质组合物的示意图;和图21C显示具有任意3D形状的复杂的异质结构,其可通过包埋的打印构成。
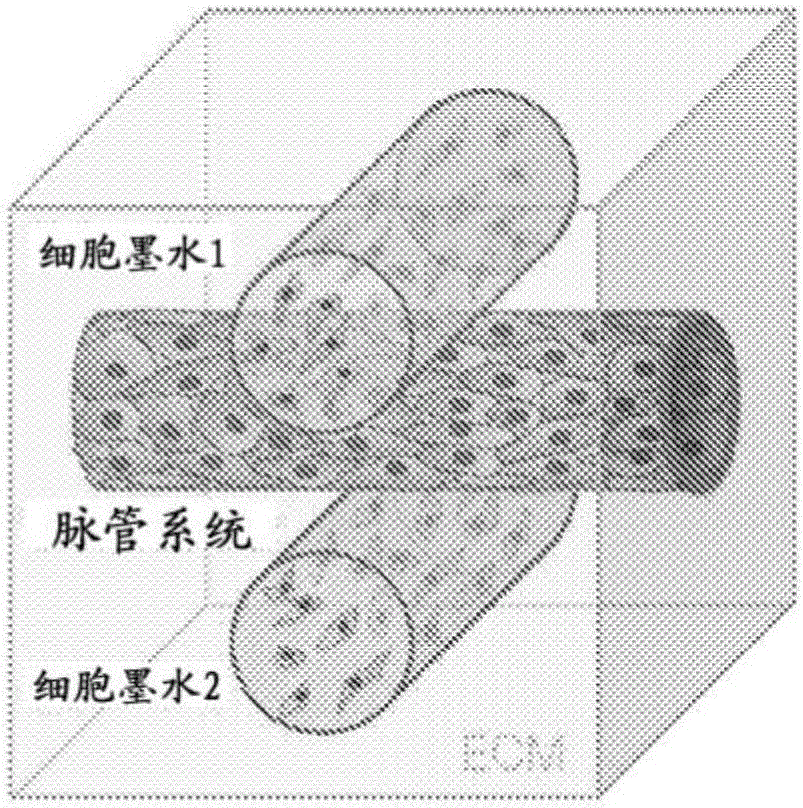
图21D提供适合于包埋的打印的墨水和基质流变性的代表性流变测量;图21E是包括包埋的打印形成的脉管网络的脉管立方体的照片;和图21F显示半IPN细胞外基质组合物内的打印的载有细胞的丝。
图22表明半IPN细胞外基质组合物的透明度可通过取代度(DS)来调节。
详细说明
如本文所述的是包括互相贯通的脉管系统的一种打印的组织构建体,和打印这样的组织构建体的方法。图1A提供了生物打印概念的图示。打印法可以在预定位置制造异质2D和3D组织构建体(其包含细胞,脉管系统,上皮导管,和细胞外基质),其应用范围是3D组织培养和药物筛选到器官移植。
图1B和图2A-2C提供了示意图,其显示示例性打印的组织构建体,所述组织构建体包含三维精确地放置的脉管系统和多种细胞类型。参照图2A或图2C,示例性打印的组织构建体100包括第一组织模型115a和第二组织模型115b,其中每个所述第一和第二组织模型115a,115b包括一种或多种预定的细胞类型的诸多活细胞。例如,第一组织模型115a可包括细胞类型A和B,以及第二组织模型115b可包括细胞类型C。包含活细胞和具有预定的细胞类型的一根或多根载有细胞的丝105可以确定每个组织模型115a,115b。在本实施例中,确定第一组织模型115a的载有细胞的丝105包含细胞类型A和细胞B,而确定第二组织模型115b的载有细胞的丝包含细胞类型C。脉管通道135的网络与组织模型115a,115b互相贯通。细胞外基质组合物130至少部分裹绕一个或多个组织模型115a,115b与脉管通道的网络135。
在打印的组织构建体中与其他模型或网络“互相贯通”的模型或网络可以被理解为包含与其它的模型或网络的一根或多根丝,一个或多个通道或一个或多个部分层叠,部分或完全重叠,和/或交织的一根或多根丝,一个或多个通道或一个或多个部分,或者,可以被理解为包含从其它的模型或网络的一根或多根丝,一个或多个通道或一个或多个部分下面部分地或完全露出的一根或多根丝,一个或多个通道或一个或多个部分,或者,可以被理解为包含裹绕或包埋入其它的模型或网络的一根或多根丝,一个或多个通道或一个或多个部分的一根或多根丝,一个或多个通道或一个或多个部分。“沉积在基底上”的丝可以被理解为可以直接在基底上沉积或直接沉积在在基底上先前沉积或形成的其它丝,通道或部分上。
现在参考图2B,包含包埋脉管系统的组织构建体可通过以下进行打印:沉积一根或多根载有细胞的丝105(其中每根载有细胞的丝105包含诸多活细胞)在基底110上,以形成一个或多个组织模型115(在本实施例中的一个组织模型)。组织模型115包含一种或多种预定的细胞类型的多个细胞。一根或多根牺牲丝120(每一根包含短时性墨水)也沉积在基底110上,以形成与所述一个或多个组织模型115互相贯通的脉管模型125。一个或多个组织模型115和脉管模型125是被细胞外基质组合物130部分或完全裹绕。然后短时性墨水被移除以在细胞外基质组合物130中创建脉管通道的网络135。因此,在组织构建体100中形成互相贯通的脉管网络。
所述的组织构建体可包括至多n种不同的预定的细胞类型。例如,n可以满足1≤n≤300,2≤n≤200或2≤n≤100。更典型地,n为不超过50,不超过30,或不超过20。例如,可以在组织构建体中存在2种或更多种,4种或更多种,8种或更多种,16种或更多种,或20种或更多种预定的细胞类型。
如通过图2A-2C的实例所示,每个组织模型包含一根或多根载有细胞的丝的二维或三维排列或由其确定,并且每个组织模型(因此载有细胞的丝的各排列)可以包括不同子集的预定的细胞类型。例如,在包含5种不同的预定类型的细胞(例如,细胞类型,A,B,C,D和E)和3种不同的组织模型(例如,组织模型1、2和3)的组织构建体中,组织模型1(是由一根或多根载有细胞的丝的第一排列确定)可包含细胞类型A;组织模型2(是由一根或多根载有细胞的丝的第二排列定义)可包含细胞类型B和C;和组织模型3(是由一根或多根载有细胞的丝的第三排列确定)可包含细胞类型A和E。
除了活细胞,一根或多根载有细胞的丝还可包括可称为细胞外基质材料的合成或天然来源的生物相容性材料。所述一根或多根载有细胞的丝的每根可以还包含如下所述的一种或多种功能性化学物质(例如,药物,毒素,蛋白和/或激素),或可替代地包括如下所述的一种或多种功能性化学物质(例如,药物,毒素,蛋白和/或激素)。每个组织模型可包含一层或多层载有细胞的丝(一根或多根),所述层可在一些实施例中至少部分地在它们之间的接触区域接合。例如,由一根或多根载有细胞的丝形成的相邻层可以部分地或完全接合,这取决于丝组成和沉积(或沉积后)的条件。
在组织构建体中载有细胞的丝的排列可以是连续的或不连续的。在连续排列中,示例性的组织模型(和包含一种或多种预定的细胞类型)的载有细胞的丝可以在组织构建体中形成单个互连的组织网络。例如,包含预定的细胞类型(一种或多种)的活细胞的单一载有细胞的丝可以在单个层或多个层被沉积以形成连续的排列。或者,包含所述预定的细胞类型(一种或多种)的活细胞的多个载有细胞的丝可以在单个层或多个层被沉积以形成连续排列,其中每根载有细胞的丝是与包含相同的预定的细胞类型(一种或多种)的其他载有细胞的丝物理接触,以及可能与包含相同的预定的细胞类型(一种或多种)的其他载有细胞的丝至少部分接合。
在包含一种或多种预定的细胞类型的载有细胞的丝不连续的排列中,预定的细胞类型(一种或多种)的单一的互连组织网络不在所述组织构建体内形成。相反,包含预定的细胞类型(一种或多种)的载有细胞的丝可以被均匀地或不均匀地在整个组织构建体中分散。因此,对应于预定的细胞类型(一种或多种)的细胞也可以均匀地或不均匀地(例如,在团块中)在整个组织构建体中分散。在本实施例中,一些、全部或没有给定组织模型和细胞类型(一种或多种)的载有细胞的丝可以与含有相同的细胞类型(一种或多种)细胞的另一根载有细胞的丝物理接触。
所述一根或多根载有细胞的丝的每根包含至少一种活细胞,并且可以包含大量的活细胞。例如,每一根载有细胞的丝可具有以下的细胞浓度:至少约100个细胞/ml,至少约1000个细胞/ml,至少约104个细胞/ml,至少约105个细胞/ml,至少约106个细胞/ml,至少约107个细胞/ml,或至少约108个细胞/ml。典型地,细胞浓度不超过约109个细胞/ml,或不超过约108个细胞/ml。与此相一致,所述组织构建体的一个或多个组织模型可以具有以下的细胞浓度:至少约100个细胞/毫升,至少约1000个细胞/ml,至少约104个细胞/ml,至少约105个细胞/ml,至少约106个细胞/ml,至少约107个细胞/ml,或至少约108个细胞/ml。通常,在组织模型中的细胞浓度不超过约109个细胞/ml,或不超过约108个细胞/ml。
细胞浓度可以在遍及整个每根载有细胞的丝中是基本均匀的(例如,在±10%以内,在±5%之内,或在±1%以内),并且细胞浓度也可以在遍及整个组织模型(一个或多个)的每个中是基本上均匀的。可替代地,可以沉积包含细胞聚集体或簇的载有细胞的丝,所述细胞聚集体或簇可以具有以下的尺寸范围:从约10个细胞/簇至约1000个细胞/簇,或约10个细胞/簇至约100个细胞/簇。这种簇可以均匀地或非均匀(因此均匀或不均匀地遍及整个一个或多个组织模型)分散在载有细胞的丝内。总体而言,将细胞浓度可以是在遍及整个组织构建体中基本上均匀的,或者细胞浓度可以包括组织构建体内的预定的不均匀性,所述组织构建体可以由所述一个或多个组织模型的位置和形态学来确定,和/或由所述一个或多个组织模型内的细胞分布来确定。
与所述一个或多个组织模型互相贯通的脉管网络是脉管通道的二维或三维互连的排列。所述网络可以包括从母体脉管通道到多个分支脉管通道的一种或多种分叉部(例如,二根分叉部,三根分叉部等)。所述网络可以具有分层分支结构,其中较大直径的通道分支成更小的直径的通道。一些或所有的脉管通道可以遵循弯曲路径,并且因此可以被认为是曲线的。所有的网络中的脉管通道可具有相同的直径,或至少一个(种),一些或所有的脉管通道可以具有不同的直径。在某些情况下,一个或多个脉管通道可具有沿着其长度的不均匀的直径。
有利的是,组织构建体的细胞足够接近脉管通道的互相贯通的网络,以保持存活。以前尝试创建组织和器官样结构的一个主要问题是,坏死区可能在不具有可接近的可灌注的脉管系统的区域发展。在目前的研究中,每根载有细胞的丝,和因此每个细胞可以被放置在脉管网络附近的位置,或可以形成脉管网络的位置附近的位置。例如,形成每个组织模型的一种或多种载有细胞的丝的至少一部分,和因此某些或全部的活细胞可以距离脉管通道不超过约1mm,不超过约500微米,不超过约300微米,不超过约200微米,不超过约100微米,不超过约50微米,和/或不超过约10微米。一根或多根载有细胞的丝和因此至少一些活细胞可被沉积,以便与脉管通道直接接触。可以构思到的是,可以在牺牲丝的沉积和短时性墨水的移除之后通过血管生成和/或小管生成(tubulogenesis),形成脉管网络的某些部分,例如最小的毛细管。例如,包含内皮细胞的载有细胞的丝可在邻近短时性网络的位置进行沉积,以促进小管生成和/或血管生成,以生成的新的毛细管。
因为对于载有细胞的(和其他)丝的沉积的后述打印方法允许高的位置精度,组织构建体中的活细胞和/或细胞外基质材料的放置可以被控制在±200微米以内,在±100微米以内,在±50微米以内,在±10微米以内,或在±1微米以内。
可以通过沉积如以上所讨论的包含多于一种细胞类型的细胞的载有细胞的丝,将不同类型的细胞放置在靠近彼此的位置。还可以预期的是,除了所述互相贯通的脉管系统,一个或多个组织模型可以与一种或多种其它组织模型互相贯通,以使某些类型的细胞可以被定位在靠近彼此的位置。例如,包含第一类型的细胞(例如,上皮或内皮细胞)的一根或多根载有细胞的丝可与包含第二类型的细胞(例如,平滑肌细胞)的一根或多根载有细胞的丝层叠,部分或完全重叠,和/或交织,或者,包含第一类型的细胞(例如,上皮或内皮细胞)的一根或多根载有细胞的丝可以从包含第二类型的细胞(例如,平滑肌细胞)的一根或多根载有细胞的丝下面部分地或完全露出,或者,包含第一类型的细胞(例如,上皮或内皮细胞)的一根或多根载有细胞的丝可以裹绕或包埋入包含第二类型的细胞(例如,平滑肌细胞)的一根或多根载有细胞的丝。在一些实施方案中,所有的组织模型的可与至少一个(种)其他组织模型互相贯通,并且也可以设想的是,所有的组织模型可与所有其他组织的模型互相贯通。
细胞外基质组合物可以部分或完全裹绕一个或多个组织模型,其中被完全裹绕的组织模型包含没有暴露的载有细胞的丝。细胞外基质组合物也可部分或完全裹绕脉管通道的网络,其中被完全裹绕的脉管网络包含没有暴露的脉管通道。例如,脉管通道的网络可以完全由细胞外基质组合物所裹绕,而可通过细胞外基质组合物仅仅部分地裹绕组织模型(例如,可与细胞外基质组合物邻近)。在这样的实例中,脉管模型被包封后载有细胞的丝可以被沉积。在一些实施方案中,细胞外基质组合物可以包括如以下描述的额外的活细胞和/或一种或多种功能性化学物质,其可以与细胞外基质组合物一起被沉积。这样的细胞外基质组合物可以被称为载有细胞的基质。如下面所描述的,细胞外基质组合物可以通过本领域普通技术人员已知的其他方法被打印,浇铸或形成。
所述的组织构建体可具有任何所需的2D或3D形状。例如,所述组织构建体可具有由单层或多层载有细胞的丝的和互相贯通的脉管网络构成的平面几何形状。这样的结构可以具有任何所需的高度(厚度)。典型地,组织构建具有约100cm或更小,约10cm或更小,约1cm或更小,约1mm或更小,约500微米或更小,或约100微米或更小,并且典型地为至少约10微米,至少约100微米,至少约200微米,或至少约1毫米的高度,其应用范围为组织培养和药物筛选到皮肤构建和角膜替换。
替代地,具有包埋的脉管网络的组织构建体可以具有任意或依赖于应用的3D尺寸和形状。组织构建体可以具有实心结构,多孔结构,和/或中空结构(例如,管状或非管状),并可以被制造成模仿特定器官的形态和功能。例如,所述组织构建体可具有肾,心脏,胰腺,肝脏,膀胱,阴道,尿道,气管,食道,皮肤或其他身体器官的尺寸和形状。在某些情况下3D尺寸和形状可以由如下所述的模具来确定。
一般地,在具有互相贯通的脉管模型的载有细胞的丝3D排列中,牺牲丝可具有覆盖载有细胞的丝的部分或在载有细胞的丝的部分下面的部分,并且牺牲和载有细胞的丝可或可以不局限于垂直于垂直方向(由重力的力所定义)的XY平面。牺牲丝可以物理接触某些或所有载有细胞的丝,并且在一些实施方案中,丝可在接触区域部分或完全接合。牺牲和载有细胞的丝可以具有跨越部分,其在该接触点之间延伸并且不受支撑。
图2A-2C显示的示例性的组织构建体100,每个组织构建体包含一个或多个组织模型115,其与脉管模型125或脉管通道的网络135互相贯通。如图2A所示,各自包含两种载有细胞的丝105的两个组织模型115a,115b沉积在单一层的基底110上。与载有细胞的丝105相邻的和/或与载有细胞的丝105物理接触的是脉管模型125的牺牲丝120,其中每个牺牲丝120包含短时性墨水。采用细胞外基质组合物130包封后,短时性墨水可以被移除以形成脉管通道的网络135。
图2B显示了组织构建体100示意图,组织构建体100包含载有细胞的丝105的3D网格结构115,所述载有细胞的丝105与互相贯通的脉管模型125的牺牲丝120交替。组成牺牲丝120的短时性墨水最终被移除以创建脉管通道的网络135,其也可在图2B中被可视化。
所述图2C的组织构建体100包含两个组织模型115a,115b,组织模型115a,115b的每一个由曲线载有细胞的丝105确定,载有细胞的丝105与脉管通道的网络135互相贯通(或若短时性墨水尚未移除,与包含牺牲丝120的脉管模型125互相贯通)。脉管网络135具有分层分支结构,其包含各种长度和直径的曲线通道。固体基底110被显示在组织构建体100下面;然而,在这个和在其它的示例性图中,在下面的固体基底110可以不存在。
图3A显示两个示例性的组织模型115a,115b的顶视图,组织模型115a,115b包含在采用脉管模型125的牺牲丝120半编织(机织)结构105中的载有细胞的丝。图3B显示多个层的相同的组织模型115a,115b与脉管模型125(或若短时性墨水已被移除则为脉管通道的网络135),其由细胞外基质组合物130裹绕。
组织构建体中的活细胞和预定细胞类型可以包括任何哺乳动物细胞类型,其选自构成哺乳动物体的细胞,包括生殖细胞,体细胞,和干细胞。取决于细胞的类型,构成哺乳动物体的细胞可以衍生自非常早期胚胎的三个主要生殖细胞层中的一个:内胚层,外胚层或中胚层。术语“生殖细胞”是指产生配子(卵子和精子)的细胞中的任一系。术语“体细胞”指的是形成多细胞生物体的物理的任何生物的细胞;任何非配子细胞,生殖细胞,配子体或未分化的干细胞。例如,在哺乳动物中,体细胞构成所有内部器官,皮肤,骨骼,血液和结缔组织。这样,细胞可以包括从哺乳动物组织,包括器官,皮肤,骨骼,血液和结缔组织(即间质细胞)分离的任何体细胞。体细胞的实例包括成纤维细胞,软骨细胞,成骨细胞,腱细胞,肥大细胞,游走细胞,免疫细胞,周细胞,炎性细胞,内皮细胞,肌细胞(心肌,骨骼肌和平滑肌细胞),脂质细胞(adipocyte)(即,脂细胞(lipocyte)或脂肪细胞),薄壁组织细胞(神经元和神经胶质细胞,肾细胞,肝细胞,胰腺细胞,肺薄壁组织细胞)和非薄壁组织细胞(例如,窦状肝内皮细胞,Kupffer细胞,肝星状细胞)。术语“干细胞”是指具有以无限期分裂并产生实质上所有哺乳动物体组织(包括专门的细胞)的能力的细胞。干细胞包括多潜能细胞,其在经受进一步特化后成为多潜能祖细胞,其能产生功能性细胞或体细胞。干细胞和祖细胞的实例包括来自骨髓的造血干细胞(成体干细胞;即,成血细胞),其产生红血细胞,白血细胞和血小板;来自骨髓的间质(mesenchymal)干细胞(成体干细胞),其产生间质细胞,脂肪细胞,和类型的骨细胞;上皮干细胞(祖细胞),其产生多种类型的皮肤细胞;神经干细胞和神经祖细胞,其产生神经元细胞和神经胶质细胞;和肌卫星细胞(祖细胞),其有助于分化的肌肉组织。
所述的组织构建体还可以包括选自药物,毒素,蛋白和/或激素的一种或多种功能性化学物质,包括,但不限于:生长因子,生长抑制剂,细胞因子,类固醇,和/或形态发生素。一些细胞的具体实例包括:骨形态发生蛋白,血管内皮生长因子,成纤维细胞生长因子,包括但不限于VEGF,EGF,TGF-β。一种或多种功能性化学物质可以与载有细胞的丝和/或牺牲性丝一同被沉积,并且可以扩散入周围的细胞外基质的组合物。
这样的方法可以用于在细胞外基质组合物内产生信号(cues)的梯度。细胞在发育过程、伤口愈合和炎症反应中响应于固定的和扩散的化学信号的梯度,这可以导向细胞迁移,增殖和分化的。引入信号梯度的一种方法是直接打印预装载有感兴趣的信号的载有细胞的丝,如图12A-12C所示,其在采用细胞外基质组合物包封后可扩散出来,以产生浓度梯度。这种梯度可以或可以不通过转谷氨酰胺酶的作用被固定在支架上。可替代地,为了产生固定的,长期的梯度,通过移除短时性墨水形成的通道可用于引入可能扩散到周围的细胞外基质组合物的因素。例如,通过创建一对平行的通道,和使荧光BSA通过仅仅一个通道流动,将荧光标记的BSA的线性梯度的形成表现在图12D-12F。在24小时后,接近线性的梯度是在两个通道之间明显的(图12E-12F)。
载有细胞的丝的细胞外基质材料和至少部分地裹绕组织和脉管模型的细胞外基质的组合物可包含合成或天然来源的生物相容性材料。细胞外基质材料和细胞外基质组合物可包含相同或不同的生物相容材料。因为载有细胞的丝,并且在一些实施方案中,细胞外基质组合物可以在如下面描述的需要通过微喷嘴挤出的3D打印工艺中沉积,可能有益的是,细胞外基质材料和细胞外基质组合物的一个或两个:(1)表现出剪切稀化行为;(2)表现出限定的屈服应力τy;和/或(3)具有剪切弹性模量G’和剪切粘性模量G”模量,其中在室温下G’>G”。
在一个实施例中,所述细胞外基质材料和/或细胞外基质组合物可包含凝胶。生物打印应用的理想凝胶可以表现出从低粘度溶液至固体状凝胶迅速过渡,其可以通过在剪切弹性模量的初始增加而被发现。快速、可控的凝胶化可以通过最大限度地减少或避免缓慢凝胶工艺典型的溶胀和分解,提高打印的结构保真度。术语“凝胶”可以指半固体物质,其可包含胶凝剂,以提供粘度或硬度。凝胶可以通过使用胶凝剂,诸如增稠剂,交联剂或聚合剂来形成,以及可以包含交联结构或非交联结构。所述凝胶可以是疏水性的或亲水性的。合适的凝胶剂的一些实例包括水凝胶,热可逆凝胶,光敏感性凝胶,pH敏感凝胶,肽凝胶,或细胞类型特异性的凝胶。凝胶的额外的实例包括硅胶,硅凝胶,芦荟凝胶,琼脂糖凝胶,全氟磺酸(nafion),聚氨酯(聚氨基甲酸乙酯,聚氨基甲酸酯),弹性体(热塑性的,矿物油热塑性等),离子交换珠,有机凝胶,干凝胶和水胶体。水凝胶包括由胶原蛋白,透明质酸,纤维蛋白,藻酸盐,琼脂糖,壳聚糖,明胶,基质胶,葡糖胺聚糖衍生的那些,以及它们的组合。在一个实例中,凝胶可包括甲基丙烯酸明胶(GelMA),它是采用可光聚合的甲基丙烯酸酯或盐(MA)基团改性的变性胶原。合适的水凝胶可以包括合成聚合物。在某些实施方案中,水凝胶可包括衍生自以下的那些:由聚(丙烯酸)及其衍生物,聚(环氧乙烷)及其共聚物,聚(乙烯醇),聚磷腈,以及它们的组合。细胞外基质材料和/或细胞外基质组合物可以包括天然衍生的生物相容的材料,例如一种或多种细胞外基质组分,包括胶原蛋白,纤连蛋白,层粘连蛋白,透明质酸(盐或酯),弹性蛋白和/或蛋白聚糖。用于细胞外基质材料和/或细胞外基质组合物的其他合适的生物相容性材料可以包括纤维素的变型,基质胶,丙烯酸酯或盐,丙烯酰胺,聚乳酸乙醇酸共聚物,环氧树脂(epoxies),醛,脲,醇,聚酯,丝绸,蛋白质,糖胺聚糖,碳水化合物,矿物质,盐,粘土,羟基磷灰石和/或磷酸钙。
在优选的实施方案中,细胞外基质材料和/或细胞外基质组合物可包含明胶和纤维蛋白。明胶和纤维蛋白可以形成模仿天然细胞外基质(ECM)的互相贯通的聚合物网络,并且可针对细胞附着,生物打印,透明度和生物相容性进行优化。纤维蛋白-明胶互相贯通的聚合物网络可通过以下来创建:混合纤维蛋白原和明胶的溶液与转谷氨酰胺酶(TG),缓慢作用的钙离子(Ca2+)依赖性酶,以创建凝胶前体溶液,其可以稍后与牛凝血酶混合以创建纤维蛋白凝胶骨架,如图13A-13D所示。纤维蛋白可以从已经由牛凝血酶和氯化钙活化的浓缩的纤维蛋白原溶液制成。纤维蛋白是一种快速凝固相,其允许打印的结构的快速,可控的凝胶化。有利的是,纤维蛋白和明胶可以通过移动表面链缠结被结合在一起,而形成了强大的接口。创建这种性质的单片(monolithic)凝胶是可能的,其原因在于转谷氨酰胺酶的慢的交联的动力学(TG)。虽然凝血酶迅速诱导的纤维蛋白凝胶形成,但是存在于IPN中的明胶可以实现在已经浇铸的层上打印牺牲墨水,并最终实现采用液态明胶纤维蛋白的包封。这两个相可以结合在一起,创建单片凝胶。这种材料系统(它是在实施例下面进一步讨论的)可以很容易地被调节以用于调整凝胶化动力学,界面粘合性(附着性),机械性能,光学性能,和细胞材料的相互作用。
如上所述,包含短时性墨水的一根或多根牺牲丝可以沉积在基底上以形成与一个或多个组织模型互相贯通的脉管模型。脉管模型包含一个或多个(一种或多种)牺牲丝的二维或三维互连的排列或网络。在采用细胞外基质组合物部分或完全包封后的短时性墨水的移除,在组织构建体中创建脉管通道的可灌注的网络。因为类似载有细胞的丝,牺牲丝可以沉积在涉及通过微喷嘴挤出的3D打印工艺中,可以有利的是,短时性墨水:(1)表现出剪切稀化行为;(2)表现限定的屈服应力τy;和/或(3)具有剪切弹性模量G’和剪切粘性模量G”模量,其中在室温下G’>G”。
用于沉积的基底典型包括如下材料:玻璃或其它陶瓷,PDMS,丙烯酸,聚氨酯(聚氨基甲酸乙酯,聚氨基甲酸酯),聚苯乙烯或其它聚合物。在一些实施方案中,基底可包含活组织或脱水组织,或上述的细胞外基质的组合物之一。打印前基底可以被清洗和表面处理。例如,玻璃基底可以经历硅烷处理以促进载有细胞的丝与玻璃基底的结合(粘结)。在一些实施方案中,可以构思的是,基底可能不是固相的材料,而是可以是处于液体或凝胶相,并且可以具有仔细控制的流变性质,如例如,在W.Wu等人,Adv.Mater.23(2011)H178-H183中所述的,其在此引入作为参考。在Wu等人的研究中,短时性墨水被直接打印入合成水凝胶以创建网络结构。然而,这些合成材料不支撑细胞附着(粘附)和增殖,限制其用于非生物应用。在本公开中,被描述的是,有利于细胞附着(粘附),迁移,增殖和组织特异性功能同时保持用于打印的适当的流变性的细胞外基质的组合物。在打印期间载有细胞的牺牲丝被包埋入细胞外基质组合物,并且因此细胞外基质组合物对所述组织和脉管模型的至少部分裹绕发生在每个载有细胞的牺牲丝的沉积过程中,如图21A中所示意性显示的。这包括任意复合的3D结构,其在打印工艺中可能需要支撑材料,如例如在图21C中所示。当如上所述的组织和脉管模型的形成和包埋同时发生时,其上发生沉积的基底可以被认为是保持细胞外基质组合物或细胞外基质组合物本身的容器。
为了形成细胞外基质组合物,微凝胶(例如,聚(丙烯酸)(PAA)微凝胶)可以用作流变改性剂和混有一种或多种细胞外基质材料,(如先前所述)如甲基丙烯酸明胶。半互相贯通的聚合物网络(半IPN)可以形成,如图21B示意性地显示。微凝胶可被理解为包括胶体凝胶颗粒,其包含化学交联的三维聚合物网络。微凝胶可充当空间稳定胶体,其仅具有壳但没有核心。它们的组分可以变化,并且可以包括PAA,聚苯乙烯,聚乙二醇(PEG),和/或其它生物材料。可以预期的是,天然的细胞外基质或生物材料可被转换成微凝胶形式以赋予理想的流变性。合适的生物材料的实例包括透明质酸酶(hyaluron),胶原蛋白(胶原),藻酸盐或酯,纤维蛋白,白蛋白,纤连蛋白,弹性蛋白,或基质胶。可替代地,合成材料,如PEG,丙烯酸酯或盐,氨基甲酸酯(氨基甲酸乙酯),或(聚)硅氧烷(有机硅)可以以类似的方式被修饰。
适合于包埋的打印的墨水和基质流变学的代表性流变测量显示在图21D。在一个实施例中,高分子量(>1.25MDA)PAA微凝胶用作流变改性剂和与明胶-甲基丙烯酸酯或盐(GelMa)混合以创建支持复合的3D的脉管网络的建立的细胞外基质组合物,它可以被如先前所述地内皮化。可通过改变取代度和筛尺寸而改变细胞外基质组合物的透明度,如图22所示。图21E显示脉管立方体,其展示对3D脉管网络的包埋的打印的控制,并且图21F显示PAA-GelMA细胞外基质组合物内的打印的载有细胞的丝。
在采用细胞外基质组合物裹绕或包封组织和脉管模型之前,所述方法可以进一步包括,以预定模型在基底上沉积逐层的一根或多根结构丝以形成模具。结构丝可以包括一种或多种结构材料,其选自以上提供的示例性的细胞外基质组合物或细胞外基质材料。模具可以在包封过程中保持细胞外基质组合物,并且可以残留为所述组织构建体的一部分,或者它可以在加工后被移除。结构丝可确定在基底上的组织构建体的周长和XY平面之外的组织构建体三维形状的所有或至少一部分。
模具也可以具有除了确定所述组织构建体的形状之外的其它功能。例如,模具可充当打印的组织构建中通道灌注的接口。图15A-15D和15E-15G展示打印模具或接口结构的示范性设计。在图中所示的示例性模具。图15A-15D被设计用于被动摇摆灌注。模具(其也可以被称为接口结构)可以通过固定模具的基部之间的组织构建体,在摇摆期间保持脉管化组织在合适的位置,模具的基部可包含PDMS,和叠压盖(overlying cover),其可以包含玻璃。
图15E-15G的模具设计实现组织构建体的基于主动泵的灌注,并包括在与组织构建体的脉管通道流体连通(例如,邻接)的流动通道。充当流动通道的导管可以部分地或完全地包埋入在模具本身中,并且空心销(例如,金属销)可用于与脉管通道接口(配合),如图15F-15G所示。在图15E中所示的示例性模具具有壁,所述壁具有包含流动通道的多个扶壁,所述模具包含延伸到模具内部的空心销,其中所述组织构建体被制成。组织构建体的脉管通道可以与空心销孔邻接,以使流被引入到来自连接到所述流动通道的管道的脉管通道,并且流体可以通过一种或多种其它的孔从脉管通道中移除。
在一个实施例中,所述模具可以由弹性体有机硅形成,已知弹性体有机硅是结构材料,其是粘弹性的,无毒的,生物相容的,并能形成可逆压配合(压接)的密封件。结构材料可以被3D打印,以形成一种或多种未固化的结构丝,所述结构丝包含一种或多种有机硅,环氧树脂,丙烯酸酯或盐,或上面提供的细胞外基质的组合物中的一种。打印完成后,结构丝(一种或多种)可以被固化(例如通过加热或光聚合),所述固化持续合适的持续时间(例如,约一小时或更长时间),在此之后,模具可以表现出所需的材料性能。
组织和脉管模型的包封可包括将液化基质前体浇铸成模具和胶凝的基质前体,以形成细胞外基质组合物。基质前体的浇铸可以发生在约25℃至约40℃的温度。例如,甲基丙烯酸明胶或GelMA可在约37℃的温度下浇铸。浇铸后,基质前体可以被冷却(在GelMA的情况下例如,被冷却至约15℃),以形成刚性的物理凝胶。或者,在如上所述的包埋的或全方向3D打印工艺中组织和脉管模型的沉积过程中可能发生包封。还可以预期,细胞外基质组合物可以通过丝沉积而被沉积,这类似于载有细胞的牺牲丝。例如,包含细胞外基质组合物的一种或多种ECM丝可从喷嘴挤出并在基底上逐层沉积以建立所需的3D几何形状,如下所述。在这样的情况下,可能没有必要采用模具以包含细胞外基质组合物。
移除短时性墨水之前或后可以对细胞外基质组合物进行固化,以形成永久的化学交联的结构。取决于细胞外基质组合物,固化可能需要加热,UV辐射或化学添加剂(例如,酶促固化)。
任何或所有沉积在基底上的丝(包括确定一个或多个组织模型的载有细胞的丝,确定互相贯通的脉管模型或功能性通道模型的一根或多根牺牲丝,可以确定模具的一种或多种结构丝,和/或可能产生细胞外基质组合物的一种或多种(一个或多个)ECM丝)可在沉积在基底上之前从喷嘴挤出。在以下挤压过程的讨论中,牺牲丝,载有细胞的丝,结构丝和/或ECM丝可以被统称为“丝”,其原因在于处理步骤可以适用于任何或所有的丝的组合物。
图4显示四个示范性的喷嘴或者打印头,其可以用于挤出丝和将它们沉积在基底上。显示的喷嘴是定制的3D打印机(包含装有四个独立z轴的大的构建平台(750×650mm))的一部分。图5A-5C提供了,通过从四个喷嘴的每一个连续沉积不同组合物的丝而3D打印四层的、多材料构建体的演示。图5C的插图显示,每个层的3D结构的重复单元。
虽然有四个喷嘴用于图4和图5A的示范打印机,用于由3D打印形成组织构建体的喷嘴的数量可以更低或更高。在一般情况下,1个或更多个,2个或更多个,3个或更多个,4个或更多个,5个或更多个,至多N个喷嘴可以用于挤出丝,其中1≤N≤1024,并且更典型地N不超过512,N不超过256,N不超过128,或N不超过64。在串行沉积过程中依次或在平行沉积过程中同时可以由N-喷嘴挤出丝,其中每个喷嘴可以含有不同的前体墨水(例如,包含一种或多种预定类型的细胞的载有细胞的墨水,短时性墨水,结构的墨水,或ECM墨水)。还可以预期,该沉积可以包括并行和串行沉积步骤。为了便于依次或串行打印,可以在z方向独立地控制喷嘴,如图4所示。
每个喷嘴可具有约1微米至约1mm,和更典型的约50微米至约500微米尺寸的内径。喷嘴的尺寸可以根据所希望的丝直径进行选择。取决于喷射压力和喷嘴平移速度,沉积的丝可以具有范围为约1微米至约10毫米,并且更典型的约100微米(0.1毫米)至约1毫米的直径。供给到喷嘴中的墨水可以被容纳在分开的注射器筒中,所述注射器筒可以由Luer-LokTM或其他连接器被单独地连接到用于打印的喷嘴。可能在施加以下的压力下发生各丝的挤出:约1psi至约200psi,约10psi至约80psi,或约20psi至约60psi。挤出过程中的压力可以是恒定的或可以改变。通过使用可替代的压力源,高于100psi或200psi的和/或小于1psi的压力可以在打印期间被应用。可变压力可以产生具有直径沿丝的长度变化的丝。这样的方法可以被使用,例如,以形成在图2C和图7E-7F中所示的分支,分层脉管网络,其是从不同的长度和直径的牺牲丝形成的。挤出可在环境温度或室温条件下进行(例如,从约18℃至约25℃)。
在各丝的挤压和沉积过程中,可以沿预定路径(例如,从(x1,y1,z1)到(x2,y2,z2)),采用±100微米内,±50微米内,±10微米内,或±1微米内的位置精度,移动喷嘴。因此,可以采用在±200微米内,在±100微米内,在±50微米内,在±10微米内,或在±1微米内的位置精度来沉积丝。喷嘴可以被移动和丝可被沉积,其采用的速度至多约3m/s(例如,约1cm/s至约3m/s),并且更典型地在以下范围:约1mm/s至约500mm/s,约1mm/s至约100mm/s,或约1mm/s至约10mm/s。
喷嘴的预定路径可以具有以下的XY边界区域:至少2400平方厘米(cm 2),至少约2700平方厘米和至多约1平方米(m2),其通过打印机的构建平台的尺寸来确定。例如,构建体平台可具有约60厘米至约100厘米的长度,和约40厘米至约100厘米的宽度。每个打印头可在z方向上移动约10厘米到约50厘米,或约15至约30厘米的距离。
从具有合适的组合物和流变学性质的前体墨水(例如,包含一种或多种预定的细胞类型的载有细胞的墨水,短时性墨水,结构的墨水,或ECM墨水),形成沉积的丝。前体墨水可以是粘弹性的并包含具有非线性剪切依赖性的粘度。前体墨水的粘度可以落在约0.001Pa-sec至约10,000Pa-sec的范围。前体墨水可以任选地包含增粘剂,以帮助控制流变性质。每种载有细胞的墨水可以在可以是液体或凝胶的载体中包含一种或多种预定的细胞类型的一种或多种细胞,以及短时性和/或ECM墨水可以在可以是液体或凝胶的载体中任选包含一种或多种预定的细胞类型的一种或多种细胞。载体可以包括,除了如上所述的细胞外基质材料的、如上面描述的一种或多种功能性化学物质。所述载体还可以或可替代地可以包括被设计为支持细胞生长的细胞培养基。在一个实例中,为了形成载有细胞的墨水(其包含与水凝胶混合的活细胞),预定量的水凝胶前体粉末与细胞培养基混合,以形成适当的组合物的溶液。然后感兴趣的细胞以所需的细胞浓度(例如,任何如上所述用于载有细胞的丝的细胞浓度)被分散在溶液中,并被充分混合。在以下实施例中描述用于制备示例性载有细胞的GelMA墨水,载有细胞的明胶纤维蛋白墨水,普流罗尼克F127短时性墨水,和PDMS结构的墨水的步骤。
组织和脉管模型的包封后,短时性墨水可以被移除以形成在细胞外基质组合物中的脉管通道的网络。短时性墨水可包含生物相容性材料和可被设计为在室温沉积期间具有与载有细胞的制剂和细胞外基质组合物的相容性。合适短时性墨水可包括,例如,普流罗尼克F127,普流罗尼克F123,琼脂糖,糖,蜡和脂肪油(例如,动物脂肪衍生的油如假猪油(Crisco))。如果将水凝胶用于细胞外基质组合物(和/或细胞外基质材料),和水凝胶例如普流罗尼克F127被用作短时性墨水,可以有利的是,短时性墨水和基质水凝胶具有类似的水含量(例如,在±30%内),以避免打印后短时性墨水的失真。短时性墨水和细胞外基质组合物也可被选择为具有互补的热转变,如下面进一步讨论的。
普流罗尼克F127是FDA批准的材料,其在完成制造过程所需要的短的时间段内对于多种细胞类型是生物惰性的。材料包括排列在PEO-PPO-PEO结构中的疏水性聚(环氧丙烷)(PPO)段和两个亲水聚(环氧乙烷)(PEO)段。普流罗尼克F127经受临界胶束浓度以上和胶凝温度的热可逆胶凝(CMC;约21重量%)。胶凝温度随PEO-PPO-PEO浓度增加而减少约10℃至4℃。当这两个关键参数被超过时,当亲水PEO段自组装成很好地被水溶剂化的冠状物时胶束形成,而疏水PPO段紧紧结合在胶束芯内。但是,在低于胶凝温度时,疏水PPO单元被水合,使得个体的PEO-PPO-PEO物质种类可溶于水,从而产生浓度超过CMC的系统的凝胶至流体的转变。因此,在冷却至低于凝胶点时材料液化。
重要的是,模型化的细胞和周围的细胞外基质组合物在牺牲性丝的沉积或短时性墨水的移除过程中不被损坏,因此优选的是,在移除过程期间不使用苛刻的溶剂和/或升高的温度。通过短时性墨水和细胞外基质组合物/材料的正确选择,短时性墨水可能被移除而不对组织构建体产生损伤。例如,如果短时性墨水经受如上所述的凝胶至流体的转变,包封后的脉管模型的冷却可有效移除短时性墨水。为了移除普流罗尼克F127,脉管模型可以被冷却到不超过约1℃的温度,这取决于浓度。还可以预期,短时性墨水可以溶解在用于移除的合适的水溶液。一旦短时性墨水被液化或溶解,真空可应用于脉管模型的暴露端以提取墨水。
优选的是,组织构建体可以被设计成支持内皮细胞的附着和增殖,内皮细胞作为脉管通道的衬里,这提供对流体扩散的阻挡,同时促进体内平衡功能,并帮助建立特异于各种组织的脉管生态位。为了促进内皮化,在一些实施方案中,包含短时性墨水的牺牲丝(一种或多种)可还包含多个内皮细胞或其它活细胞。细胞可与牺牲丝一同沉积并在移除短效墨后可保留在脉管通道中,如图16A-16C所示。如果短时性墨水的液化之后细胞吸附到通道壁,则可以实现通道的直接细胞化。这种方法可以允许将活细胞并入高度扭曲的网络或小通道,其可能难以通过直接注射被填充,其原因在于增加流动阻力。示例性打印的组织构建体(其包含通过包含内皮细胞和普流罗尼克F127的短时性墨水的排空而形成的通道)被显示在图16D-16G中,并在实施例中被进一步描述。在另一实例中,上皮细胞可以在短时性墨水中被递送和用于建立存在于乳腺,肾脏或肝脏中的管状上皮组织。
除了采用短时性墨水沉积内皮细胞和/或其它活细胞之外或作为采用短时性墨水沉积内皮细胞和/或其它活细胞的替代,内皮化可以在移除短时性墨水后通过注射活细胞(例如,内皮细胞)的悬浮液入脉管通道中来进行。使用这些方法的一种或两种,可以形成具有至多100%融汇的内皮层,并使所述内皮层成为一种或多种脉管通道的壁的衬里,其中100%融汇意味着壁完全被内皮细胞覆盖。脉管通道的网络中形成的每个内皮层可具有至少约80%,至少约90%,至少约95%,至少约98%,至少约99%,或100%的融汇,从而使得脉管通道可作为实际血管而发挥作用。如在下面实施例中所述,已经表明,可以采用人脐静脉内皮细胞(HUVEC)的悬浮液,随后通过温和摇摆,连续注入代表性分层二根分叉网络(见图7J)。48小时后,这些细胞保留了大于95%的存活率和组装成几乎融汇的层,如通过代表性、二根分叉微通道内的活/死染色以及共聚焦成像所确定。
多种类型的细胞可以被注射入脉管通道。在体内,具有大于毛细管的直径的每根血管包含外部的纤维组织层,平滑肌层,和内皮细胞的内层。一种或多种其它类型的细胞(如成纤维细胞)可在移除短时性墨水之后与内皮细胞一同被注入到脉管通道。如在下面的实施例所描述的,脉管通道可以与成纤维细胞和HUVECs一同被共接种,成纤维细胞和HUVECs是可以分别自组装成基质和内皮层的两种细胞类型,这模仿天然血管的解剖结构。
还可以预期的是,相同或不同的短时性墨水可被沉积作为牺牲丝并如上所述被移除以形成除了组织构建内的脉管通道之外的或代替组织构建内的脉管通道的通道,导管和/或隔室。换句话说,一种或多种额外的牺牲丝可以沉积以形成在基底上的除了脉管模型之外的或代替脉管模型的功能性通道模型。这在图17A中被示意性显示。
每个(种)额外的牺牲丝可以包含第二短时性墨水,其与用于确定脉管模型(如果脉管模型存在)的短时性墨水相同或不同。沉积之后,功能性通道模型可以是至少被细胞外基质组合物(例如,在图17A的步骤III中所示的水凝胶溶液)部分地裹绕,如上面针对脉管模型所述。还可以预期,采用细胞外基质组合物至少部分裹绕功能性通道模型,可能发生在一根或多根牺牲丝沉积过程中,使得所述一个或多个功能性通道模型同时形成并包埋入到细胞外基质组合物。当功能性通道模型的成形和包埋同时发生时,在其上沉积发生的基底可以被认为是保持细胞外基质组合物或细胞外基质组合物本身的容器。然后,第二短时性墨水可以被移除,如在图17A步骤v中所显示和如上述针对脉管通道所述,以创建在细胞外基质组合物中的一个或多个功能性通道。因此,可以在组织构建体(它在本例中是上皮组织构建体)中形成功能性通道网络,如示于图17A(中心)和17B中所示。一种或多种类型的活细胞(例如,上皮细胞)可与额外的牺牲丝一同被沉积,并且存活细胞的至少一部分可以在移除第二短时性墨水后留在一个或多个功能性通道中。在移除第二短时性墨水后,同样地或可替代地,存活的细胞(例如,上皮细胞)的悬浮液可注入功能性通道,如图17A的步骤VI中所示。
功能性通道可以确定管状组织或组织成分。可通过3D打印和上皮化而形成的管状结构的实例包括,但不限于,肾单位(肾的),肠,输乳管,尿道,和淋巴。这样的打印的上皮组织构建体可包含一个或多个功能性通道,所述功能性通道包含在其上的上皮细胞层,和细胞外基质组合物可以至少部分地裹绕一个或多个功能性通道,如图17A(中心)和17B所示。间质层也可存在于上皮细胞层上。打印的上皮组织构建体可还包含一个或多个组织模型,每一个组织模型包括在细胞外基质组合物中的一种或多种预定的细胞类型的诸多活细胞,如上所述。活细胞和一种或多种预定的细胞类型可包括先前所描述的上皮细胞和/或其它细胞类型。打印的上皮组织构建体可还包含细胞外基质组合物中的脉管通道网络,也如上所述。
例如,可以使用包含短时性墨水的牺牲丝来创建淋巴系统的脉管(通道)的网络。在另一实例中,任何期望的几何形状的隔室可通过沉积牺牲丝的预定排列而被包埋入组织构建体内。这样包埋的隔室可用于含有生长因子,额外的细胞和/或补充支架材料,其可在一些实施方案中与牺牲的丝一同被沉积以引导细胞的行为,分化,功能,移动和/或生长。
图17A-17F显示了一种打印的上皮组织构建体,其包含随后与上皮细胞一同接种(上皮化)的功能通道。参照图17A-17B,打印的组织构建体是近曲小管,肾单位的一部分。它可以被打印成简单的或旋绕形状和与上皮细胞一同接种,这使得功能通道成长和限制功能通道,如图17C-17F中所示。所用的细胞是人肾近端小管细胞(PTEC);然而,这种方法可应用于任何数量的类型的上皮组织。例如,体外模型可以被制造以用于组织特异性疾病和毒性研究。这种类型的功能性人组织模拟物可以用作构件,所述构件用于较大器官的生长或用于高通量药物毒性和筛选。
实施例
短时性墨水
参考图6A,高度浓缩(40wt.%)的普流罗尼克F127A(其当施加的剪切应力超过剪切屈服应力(τy)时(例如在打印期间)显示强烈剪切稀化反应)以及当施加的剪切应力低于τy时(例如,打印后)超过剪切粘性模量(G”)的高原剪切弹性模量(G’)被选择作为用于示例性系统的短时性墨水。在22℃短时性墨水弹性被发现是约2×104帕(Pa),如图6B所示。当低于CMT(约4℃)时,墨水液化和弹性减小几个数量级,从而有利于从组织构建体移除墨水。
如上所述,从短时性墨水形成的牺牲丝可以包含一种或多种额外的细胞,生长因子,药物等。例如,内皮细胞,上皮细胞和/或其它细胞可分散在短时性墨水内并与牺牲丝一同沉积。当短时性墨水被移除、以形成血管(或其他)通道时,所述细胞可以保持作为通道壁的衬里。
采用高浓度的载有内皮细胞的短时性(普流罗尼克)墨水(1×107个细胞/ml)表现出该方法。短时性墨水被沉积并被细胞外基质组合物包封。在移除短时性墨水以形成脉管通道后,内皮细胞保持固定到通道的壁上,如在图16A-16C中示意性显示和在图16D-16G中通过实验显示。图16G显示使用这种方法创建的简单的通道,其已被灌注24小时以上。内皮细胞表现出成为通道的衬里,并在性质上类似于那些使用传统的接种方法产生的细胞。该技术提供了采用内皮细胞接种现有脉管通道的替代品,尤其是在高度支化的脉管网络(其中细胞可堵塞和抑制流动,这导致非均匀的接种)的情况下。
细胞外基质组合物和材料
如上所述,基于明胶和纤维蛋白的互相贯通的聚合物网络已经发展用于模仿自然的ECM,并且其可以用于组织构建体的细胞外基质组合物和/或细胞外基质材料。
图13A-13D显示明胶纤维蛋白互相贯通的聚合物网络,或明胶纤维蛋白基质的制备。首先,首先将凝胶前体混合在一起。通过酶凝血酶聚合纤维蛋白原,形成纤维蛋白凝胶或网络。此相提供初始机械强度和刚性,如通过剪切弹性模量中的增加所显示的。然后第二相(明胶)被形成以裹绕纤维蛋白凝胶,并且两相通过转谷氨酰胺酶(TG)缓慢交联在一起。图13E和13F显示明胶纤维蛋白互相贯通的聚合物网络的剪切模量与时间的曲线(G’和G“)和应力-应变曲线。
TG是无数的生物功能的天然存在的酶蛋白质的交联剂;例如,它可以在体内伤口愈合过程中被上调。通过改变TG的孵育时间,纤维蛋白凝胶的光学性质(例如,透明度)可定制。透明度是由纤维蛋白凝胶的最终孔结构所决定的,这是使用若丹明标记的纤维蛋白原和共聚焦显微镜而被观察到的。也感兴趣的是,确定TG和明胶是否破坏天然的纤维蛋白聚合。共聚焦显微镜图像显示,纤维蛋白的纤维性质被保留,并且可以通过改变不同的处理条件,如孵育时间被精确地调节,如图14所示。更长纤维蛋白-TG孵育时间导致更致密纤维网,随后导致更高的光学透明度。
除了制造的考虑之外,细胞材料的相互作用在材料选择中发挥重要作用。明胶纤维蛋白基质已经显示与许多不同的细胞类型,包括成纤维细胞(结缔组织),平滑肌细胞,内皮细胞,和肾近端小管细胞(上皮)兼容。明胶纤维蛋白基质的粘合性(附着性)已经通过比较在各种基底上的细胞的投影面积定量。明胶纤维蛋白基质胜过所有其他材料,包括天然纤维蛋白,组织培养聚苯乙烯(TCPS),和明胶甲基甲基丙烯酸酯或盐(GelMa)。图13G-13I显示在示例性明胶纤维蛋白基质表面上的创建血管必不可少的各种细胞-成纤维细胞,内皮细胞和平滑肌细胞–。为了突出粘合性(附着性)的多样性,组织特异性的上皮细胞生长在表面上,如图13J所示。
在第二个实例中,甲基丙烯酸明胶(GelMA)(其是生物相容的,加工容易的且廉价的)被选择既用作用于载有细胞的制剂的细胞外基质材料也用作用于包封步骤的细胞外基质组合物。GelMA是采用光聚合性甲基丙烯酸酯或盐(MA)基团改性的变性胶原,这允许基质在打印后通过UV光共价交联。物理凝胶化产生于具有类似胶原的结构的分子间的三重螺旋的组装,如图6C中所示。通过改变浓度,甲基丙烯酸化程度和温度,剪切屈服应力和含水GelMA系统的弹性模量可以被系统地调整。
通过将15wt.%GelMA溶解在细胞培养基中产生细胞外基质组合物。在高于约25℃时,组合物是具有10-1Pa以下的G’值的低粘度流体。当冷却至低于25℃时,组合物经受凝胶化,产生清晰的,粘弹性的细胞外基质材料。随温度降低,细胞外基质的组合物的弹性增加,在22℃和2℃观察到约103Pa和2×104Pa的G’值(图6D),其分别对应于用于打印和短时性墨水移除的典型条件。
同样的含水GelMA组合物用于创建包含用于打印的活细胞的载有细胞的墨水。先前的研究已经表明,细胞通过GelMA附着(粘附),改造,并迁移,其原因在于存在整联蛋白结合基序和基质金属蛋白酶敏感基团。据发现,将中等浓度(例如,2×106细胞/mL)的10T1/2成纤维细胞掺入15wt.%GelMA墨水(图6E和6F),不显著改变接着发生胶凝的温度或例如2℃至40℃的感兴趣的温度范围内的组合物的弹性。因此,根据需要,可以以同样的方式打印和进一步处理纯和载有细胞的GelMA墨水。
针对短时性普流罗尼克F127,纯GelMA和载有细胞的GelMA墨水观察到的热可逆胶凝化差异引起三种不同的处理窗口。当在约4℃和25℃之间时,每种墨水是僵硬的并呈现固体状反应,其中G’>G”。在T≥25℃时,普流罗尼克F127短时性墨水是僵硬的和固体样的(G’>G”),而纯和载有细胞的GelMA墨水是容易流动的液体。在低于约4℃时,普流罗尼克F127短时性墨水是容易流动的液体,而纯和载有细胞的GelMA墨水是僵硬的和固体样的(G’>G”)。
脉管模型的打印
上述针对普流罗尼克F127-GelMA系统描述的令人赞美的热行为被用来打印包含多个牺牲丝的代表性脉管模型,其然后被包封在无细胞外基质组合物(纯GelMA)中。图7A-7K显示1D,2D和3D脉管网络的形成和通道的内皮化,其中采用每个脉管网络设计的示意图和相应的光学图像。移除短时性墨水后,每个脉管网络灌注有荧光红色染料以为可视化(图7C,7F和7I)提供帮助。每个组织构建体内,根据需要,可以通过改变打印压力,速度和/或喷嘴的高度而改变牺牲丝的直径。例如,使用单30微米的喷嘴、简单地在由每个打印的部件之间以逐步的方式增加打印压力和喷嘴高度,打印具有从45微米增加至500微米的直径的1-D微通道阵列(图7A-7B)。
在光聚合GelMA基质之后,通过冷却打印的构建体至低于4℃,移除短时性墨水,产生开放的1-D微通道。这些1-D通道的有代表性的横截面的图像在图8A中被显示,显示了它们的最终直径范围从约100微米至约1毫米。由于GelMA墨水具有比短时性墨水更高的含水量,打印的血管部件在水从周围的基质扩散到短时性墨水(普流罗尼克F127)时会膨胀。实际上,对于这种材料体系,直径尺寸几乎翻番,具有独立于初始微通道直径的溶胀率(图8B)。
2-D脉管网络设计模拟在生物系统中发现的分层、二根分叉的模型,大通道二根分叉,以形成更小的通道,这最大化有效的血流量,养分运输和废物移除,同时最小化代谢成本。使用30微米的单一喷嘴打印这些2D分层脉管网络(例如,图7E和7F)。作为打印的最大通道(650μm的直径)为灌注提供单一的入口和出口,而最小的通道(45μm)的直径)减小相邻导管(管道)之间的特性扩散距离。最后,3D微脉管网络设计(这在图7G,7H和7I中被显示并且包含均匀微通道的3D周期性阵列)被打印。因为包埋的微通道在所有三个维度中互连,能够从周围GelMA基质迅速和高保真地移除短时性墨水。
脉管通道的接种
多种类型的液体可通过内嵌的脉管网络流动以证明其可灌注的性质。例如,采用人脐静脉内皮细胞(HUVEC)的悬浮液注射2D分层二根分叉网络,随后是温和的摇摆。48小时后,发现这些细胞保留了大于95%的存活率和组装成几乎融汇的层,如通过代表性、二根分叉微通道内的活/死染色以及共聚焦成像所确定。
脉管通道可以与多种细胞类型(如除了HUVECs之外的成纤维细胞或平滑肌细胞)一同接种。本文中,成纤维细胞与HUVECs共同接种。据发现,灌注培养约一周后,均匀地共接种的内皮细胞和成纤维细胞自组装成外包封基质(人皮肤成纤维细胞;HNDFs)和融汇的内内皮(血管内皮细胞)的两个不同的层。图18A-18C突出接种后第3天的HUVECs(红色)和HNDFs(绿色)的初始均匀分布。图18D-18E显示八天之后同一通道,在该时刻所述通道包含不同的外基质(HNDF)层和融汇内皮(HUVEC)层。使用用于染色血管内皮细胞钙粘蛋白(VE-Cad)(当细胞形成融汇的网络时表达的内皮细胞特异性连接蛋白)的免疫组织化学(以红紫色显示),可视化融汇的内皮。
为了进一步促进沿所制造的通道壁的内皮细胞的附着和增殖,可以通过在引入HUVEC悬浮液之前经由通道灌注纤连蛋白溶液,对所述壁的内部进行包衣,如图9A-9D中所示。此外,当动物的血液被直接注入到2-D脉管网络的入口时,它迅速流过整个网络到出口。这些最初的示范说明创建几乎任何任意设计的可灌注的脉管的潜力。
包含多于一种细胞类型的载有细胞的丝的打印
显示了,允许在单个墨水丝内两种或多种细胞类型的输送的细胞共培养墨水的打印。据观察,载有细胞的墨水(在这个实例中,包含HNDFs和HUVECs在明胶纤维蛋白基质材料中的分散体)导致在打印的丝中自发新血管的形成,如图20A-20C中所证明。这在基于HUVECs的单一培养的打印的丝中没有被观察到。这种方法表明包含多于一种细胞类型(包括组织特异性细胞类型(例如,肝细胞,胰岛细胞,足细胞,神经元等)或干细胞(例如,iPSCs,MSCs等))的载有细胞的丝也可以用于达到预期的异质性,并且也可以用于提升功能。
将短时性墨水打印在载有细胞的基质上
如在前面的实例中,HNDFs和HUVECs被分散在细胞外基质组合物(具体地,明胶纤维蛋白基质材料)内以形成载有细胞的基质。短时性墨水被直接打印到载有细胞的基质上,然后由明胶纤维蛋白基质材料包封。短时性墨水被排空以形成脉管通道,和采用HUVECs接种脉管通道。随着时间的推移,被发现的是,HUVECs组装成在打印的载有细胞的丝内的毛细管结构。图19A-19D显示,内皮细胞附着于脉管通道,并形成融汇层,以及图19E-19F显示小毛细管从融汇血管快速生长,这指示该方法有利于细胞重塑和更高级别的生物过程。
两个效应被假设为有助于这一观察到的行为。首先,通过特定的化学信号如成纤维细胞生长因子(FGF),成纤维细胞已经无数次显示出是体外血管生成支持细胞,经常导致新血管形成的过程。此外,基质中的增殖的细胞的集中群体(concentrated population)具有不可能通过单独扩散满足的广泛的代谢要求。已被广泛接受的是,不在几个100微米的血管内的细胞将成为氧应激的并最终坏死。已被观察到的是,在体内,宿主脉管系统被招募入无血管结构,以防止坏死。
包含互相贯通的脉管系统的组织构建体的打印
为了证明充满血管,多种类型的细胞,和细胞外基质组合物的组织构建体的制造,改变的设计的3D异质结构被打印。
第一结构包括在平面内和在平面外打印半编织(woven)部件(图10A-10G)。这四层组织构建体包含两种组织模型,所述组织模型各自包含不同的细胞类型和从包含短时性墨水的牺牲丝形成的脉管模型。组织构建体以逐层构建顺序通过打印四种墨水制备:PDMS,短时性普流罗尼克F127和两种不同的载有细胞的GelMA墨水,接着在37℃沉积纯GelMA墨水以完全包封打印部件,最终光聚合以交联GelMA基质。这种3D结构被构思和制造以展示打印功能并且还通过整个4层,打印的构建体促进共聚焦成像。
如前所述,首先以长宽比边缘的形式打印PDMS墨水,所述边缘裹绕每个组织构建体并充当用于包封步骤的纯GelMA墨水的模具。短时性墨水和两种载有细胞的GelMA墨水(其含有表达绿色荧光蛋白的人新生儿皮肤成纤维细胞(HNDFs)或非荧光10T1/2s,已建立的小鼠成纤维细胞系)在预定的顺序(依次)过程中通过200微米的喷嘴以2×106细胞/毫升的浓度被共同打印。图10C显示打印后直接的3D结构的图像。只有绿色荧光通道叠加到亮场图像上,以使得能够容易地将打印的细胞通道可视化。制作完成后,短时性墨水液化,并从3D构建体中移除。排空过程涉及将空注射器尖端放置入微通道入口和出口,然后在适度真空下抽吸出整个脉管网络。移除过程是快速的并产生高保真度,互相贯通的脉管系统,然后将其如上所述进行内皮化。
组织构建体的表征
使用显微镜,被独立地染色的(绿色-GFP HNDFs,蓝色-10T1/2,和红色-HUVECs)三种细胞类型的位置被识别。这种工程化组织构建体的半编织性质是在图10B-10D中所示的示意图和图像中清晰可见的。使用共聚焦激光扫描显微镜,能够充分询问这种3D组织构建体和确定每个细胞的精确位置。培养2天后在XY,XZ和YZ中的3D打印的结构的共聚焦显微镜图像示于图10G。为了证明这种方法的通用性,其他3D组织构建体也被设计和打印。虽然由于载有细胞的丝的稠密、互相贯通的性质很难获得共聚焦图像,在GelMA表达HNDFs的绿色荧光蛋白和作为3-D脉管系统网络衬里的红色的HUVECs是可见的。
细胞活性的研究
作为最后的步骤,研究了打印的10T1/2成纤维细胞在一周的过程中的存活率。在0天,细胞存活率为61%;然而,它在7天后增加到82%。而与对照(在第0天的78%)相比存在较低的初始细胞存活率,打印的细胞的确随时间增殖和散布,这在培养1周后导致相似水平的存活率。降低的初始存活率可以源于在打印工艺中被细胞所经历的剪切或拉伸应力。施加的压力,喷嘴直径,细胞类型和环境条件可能会影响打印后细胞存活率。另一个重要的参数是打印所需的工程化组织构建体所需的总构建时间。有可能存在在受到损害之前载有细胞的墨水可被存储在储墨器中的最大时间。然而,与单一的喷嘴打印相比较,先前报道的用于高通量多材料打印的实施多喷嘴打印头(J.A.Lewis等人,“Multinozzle Deposition System for Direct Write Applications,”国际专利申请号PCT/US2012/044794,2012年6月29日提交的,该申请通过引用被并入本文)可能降低特性生成时间两个数量级。例如,打印具有1000cm3体积的工程化组织构建体(相当于典型的成年人肝脏)可以需要约72小时在典型的打印速度使用单一的200μm的喷嘴。然而,64-多喷嘴阵列的实施可能减少各构建时间到约1小时。
在本公开内容中已经发展和描述了一种新的方法,其用于根据需求经由3D生物打印创建脉管化、异质组织构建体。这种高度大小可变的平台实现工程化组织构建体的制造,在所述工程化组织构建体中,脉管系统,多种细胞类型和任选的其它功能性化学物质,如药物,毒素,蛋白和/或激素,被可编程地配置在细胞外基质内所希望的位置。这种技术可导致快速制造移植所需的功能的3D组织和器官。
尽管已经参照其某些实施方案相当详细地对本发明进行了描述,在不脱离本发明的范围内其他实施例是可能的。因此,所附权利要求的精神和范围不应该被限制本文包含的优选实施例的描述。意欲将从权利要求的含义在字面上得到的或与权利要求的含义等同的所有实施方案包含在本文中。
此外,上述优点不必是本发明的唯一优点,并且不一定预期所有所描述的优点将由本发明的每个实施例来实现。
- 还没有人留言评论。精彩留言会获得点赞!