组织移植物的制作方法
本发明涉及含有至少一种生物结构的装置和制造所述装置的方法,所述装置用于治疗性治疗和/或用于体外测试人体或其他哺乳动物组织。例如,所述装置可以用于烧伤、损伤或患病皮肤的皮肤伤口上,并且提供如在正常未损伤皮肤的结构和功能。
背景技术:
人皮肤由三个主要层组成:表皮(最外层)、真皮(中间层)和皮下组织(最深层)。当造成深度创伤(全厚皮肤(full-thicknessskin)创伤)时,例如烧伤事故后,表皮和全部真皮(某些情况下还有皮下组织)受损,并且需要外科手术干预。最佳地通过全厚皮肤自体移植物的方法治疗小型全厚皮肤创伤:从身体的健康部分获得表皮和完整真皮,并且将其移植到伤口上。相反,通过刃厚皮肤(split-thicknessskin)自体移植物(其由表皮以及仅仅非常且不完全的薄层真皮组成)的方法治疗大型全厚皮肤缺陷仍是一个临床上未解决的问题。的确,这样的创伤愈合很差,并且发展成大的、丑陋的并且无功能的疤痕。与刃厚皮肤自体移植物相比,全厚皮肤自体移植物最佳地愈合深度创伤有许多原因。这些原因中的一个在于,在全厚皮肤自体移植物中存在脉管结构,而在刃厚皮肤自体移植物中缺少脉管结构。脉管生物结构(血管和淋巴管)对于人体中的器官是必要的,这是由于其不断地提供氧气和营养物以及免疫细胞贩运(immunecelltrafficking),它们促成了全部功能和存活。脉管生物结构对移植的器官,甚至对薄的扁平的器官如皮肤是有效的。全厚皮肤移植物中的毛细管仅需要连接于创面床(woundbed)的毛细管,然而在刃厚皮肤移植物的情况下,毛细管需要向移植物内生长以散布于组织。
最近,研究和临床证据也表明,由于淋巴管基本上从创伤区域排出了免疫细胞、残骸和过多的流体,淋巴管对皮肤移植物存活可能是必需的。当考虑提供大量全厚皮肤移植物用于治疗大型全厚皮肤缺陷的方式时,会想到含有脉管生物结构的皮肤的组织工程。水凝胶作为支架材料的一个主要优势(与其他类型的支架如胶原蛋白海绵相比)是其作为3d细胞基质的特性。它是高度生物相容的和生物模拟性的,具有低免疫原性(跨物种保守的),并且可通过能容易地在纤丝网络内在组织间隙接种的细胞自然地改型。然而,水凝胶的机械性能差是在其临床中用作用于组织工程化应用的支架的主要限制。
机械稳定性对于基于水凝胶的组织工程化产品的临床应用是必要的,尤其是当这些产品的特征是如在皮肤移植物的情况下的大且薄的物理尺寸时(用于皮肤移植物的临床相关大小是最小50cm2,厚度为小于2mm)。
在培养期间和培养之后以及外科手术应用和/或测试期间和之后,要求机械稳定性以允许水凝胶的操作和加工。凝胶的机械稳定性可以通过压实增加。ep0187104公开了压缩胶原蛋白凝胶基质以形成纤维网络用于医学用途。ep1773416公开了在制备用于组织移植物的支架-细胞基质中塑性压缩凝胶的用途。
braziulis等人.2012(胶原蛋白水凝胶的改良的塑性压缩提供用于临床可应用的皮肤替代物的理想基质(modifiedplasticcompressionofcollagenhydrogelsprovidesanidealmatrixforclinicallyapplicableskinsubstitutes),tissueengineering:partc;vol.18,no.6,2012)报道了用于使基于水凝胶的大的(7×7cm)人真皮-表皮皮肤移植物工程化的改良塑性压缩方法。这些压缩的工程化产品在细胞培养期期间和之后以及在对猪的移植期期间显示了最佳的机械稳定性(braziulis等人.2011,皮肤工程i:用于在大型动物模型中自体移植的工程化猪真皮-表皮皮肤类似物(skingineeringi:engineeringporcinedermo-epidermalskinanaloguesforautologoustransplantationinalargeanimalmodel),pediatr.surg.int.(2011)27:241-257、schiestl等人.,2011,皮肤工程ii:在新的猪模型中移植大规模实验室生长的皮肤类似物(skingeineeringii:transplantationoflarge-scalelaboratory-grownskinanaloguesinanewpigmodel),pediatr.surg.int.(2011)27:249-254)。令人惊讶地,压缩过程没有改变接种于水凝胶中和水凝胶上的细胞的生物特性。
技术实现要素:
本发明的总体目的是在优选生物相容的、生物可降解的水凝胶基质中和/或水凝胶基质上,生产含有细胞和至少一种生物结构的改进的和机械稳定的组织移植物装置,用于人的临床用途和/或测试。更具体地,目的是开发优选为自体的具有生物结构的真皮-表皮皮肤移植物,用于临床用途和测试。
到目前为止,已经产生了用于研究目的的含有血管生物结构的预脉管化(prevascularized)真皮-表皮皮肤替代物。在使预脉管化真皮-表皮皮肤移植物生物工程化以用于治疗皮肤缺陷的预期临床应用方面没有可用的数据。
此外,到目前为止,在人毛细淋巴管的工程化方面的有限的数据是可用的,而在预脉管化含有功能性人毛细淋巴管的真皮-表皮皮肤替代物的工程化方面没有可用的数据。在人真皮中,淋巴管在组织液内稳态和免疫细胞贩运中起重要作用。真皮毛细淋巴管展示了宽阔的腔、固着性纤丝以及没有或不完整的基底膜,并且缺少壁细胞(muralcell)覆盖。这些特征使毛细淋巴管能通过吸取和移除过多的组织液对间质液压力响应。在受创伤后,淋巴管内皮也是破裂的;因此,淋巴管的引流能力受到损害。作为结果,组织液出现积累。持续存在的局部间质液以及局部残骸和炎性细胞的延迟移除阻碍了创伤愈合。相反,对淋巴管产生和免疫细胞募集的诱导显示了加速皮肤的再生。
本发明的第一种实施方式涉及生产组织移植物的方法,至少包括以下步骤:
-提供凝胶,
-用至少第一类细胞和/或第二类细胞接种凝胶,
-在所述凝胶中培养第一类细胞和/或第二类细胞,直到所述第一类细胞和/或第二类细胞在所述凝胶中形成至少一种第一生物结构。
也就是说,用一种或多种细胞类型接种凝胶,并且在所述凝胶中和/或所述凝胶上培养细胞直到至少一种生物结构形成。
用于本发明的方法的凝胶可以是任何3d生物基质,如胶原蛋白水凝胶,优选为i型胶原蛋白水凝胶,或纤维蛋白水凝胶。
在生物学中,结构存在于所有组织水平,分层排列从原子和分子水平到细胞、组织、器官、有机体、种群和生态系统水平。出于本发明的目的,术语“生物结构”被理解为任何结构/组织/器官,其由存在于人和其他哺乳动物身体/胚胎/胎儿内的多于一个细胞组成,具有一些类型的组织性和/或复杂性和/或功能性。因此,仅随机的一群细胞不会落入该定义内。
本申请提供的结果分别显示了在凝胶中和/或凝胶上,形成人脉管生物结构和内皮生物结构的数据。
然而,可使用根据本发明的系统工程化存在于人或其他哺乳动物身体/胚胎/胎儿内的任何类型的生物结构,例如上皮组织(包括腺组织、胎盘组织和羊膜组织)、脉管组织(血管和淋巴管)、神经组织、结缔组织(包括骨)、毛发、指甲和牙齿,间充质、肌肉、脂肪和所有人或其他哺乳动物的器官和组织。
通过接种和培养所有种类/类型的人或其他哺乳动物的细胞和它们的混合物,可以诱导(一种或多种类型的)生物结构的形成,所述所有种类/类型的人或其他哺乳动物细胞和它们的混合物可包括:内胚层来源细胞、中胚层来源细胞、外胚层来源细胞(包括神经嵴)、滋养层来源细胞、生殖细胞、干细胞、祖细胞、基因修饰的细胞等,其中待接种的细胞具有形成生物结构能力。
用于接种凝胶的细胞的选择和细胞类型的组合取决于要工程化的组织的类型。
在优选的实施方式中,在凝胶中形成第一生物结构。(在凝胶中或在凝胶上)形成多于一种类型的生物结构也是可能的。
在进一步优选的实施方式中,第一生物结构/第一类型的生物结构是脉管结构,优选是毛细血管和/或毛细淋巴管的脉管丛,优选是毛细血管和毛细淋巴管两者的脉管丛。
待接种在水凝胶内的用于诱导至少第一生物结构(或多于一种类型的生物结构)的第一类和/或第二类(和/或更多类)的细胞可以是存在于身体/胚胎/胎儿内的任意细胞类型,优选是存在于人或其他哺乳动物体内的任意细胞类型。优选地,第一类和/或第二类(和或更多类)的细胞选自由内皮细胞、上皮细胞、成纤维细胞、间充质细胞、造血细胞、免疫系统细胞、脂肪组织源性细胞、壁细胞、干细胞、祖细胞、基因修饰的细胞的组。也可能使用更多种类型(多于两种)的细胞,各种类型(即多于两种类型)的混合物对在凝胶中和/或在凝胶上诱导/建立至少一种,可能多于一种的(一种或多种类型的)生物结构是必要的。
对于诱导脉管生物结构,优选使用内皮细胞和成纤维细胞的混合物。也就是说,根据特别优选的实施方式,第一类细胞是内皮细胞,第二类细胞是成纤维细胞。然后将内皮细胞和成纤维细胞在凝胶中共培养以形成第一生物结构。优选地,将内皮细胞和成纤维细胞在凝胶中以成纤维细胞与内皮细胞之比为至少3:7,优选为至少2:3,更优选为约1:1来接种和共培养。
内皮细胞优选是人血管内皮细胞(hbec)和/或人淋巴管内皮细胞(hlec),优选是人真皮微血管内皮细胞(hdmec)或svf源性的内皮细胞。hdmec由hlec和hbec二者的混合物组成,所以在纤维蛋白水凝胶或胶原蛋白水凝胶中由这些细胞在体外形成两种类型的功能性毛细管(毛细血管和毛细淋巴管)。细胞的另一可能的来源是svf,其是血管内皮细胞、成纤维细胞和壁细胞以患者的特定比例的混合物,这导致在纤维蛋白水凝胶或胶原蛋白水凝胶中在体外形成功能性毛细血管。
根据本发明,在水凝胶系统中可以诱导所有种类的生物结构的形成。通过在水凝胶上和/或在水凝胶中接种和培养细胞,可以诱导生物结构的形成。
所有或部分的细胞和生物结构可以是自体的,意味着他们的来源是培养的装置的接受者(待用移植物治疗的患者)。从与要用替换组织移植物治疗的人体或其他哺乳动物体相同的人体或其他哺乳动物体分离自体细胞。自体移植有利地消除了对组织相容性和排异的担忧。
根据进一步优选的实施方式,由第一类细胞和/或第二类细胞在凝胶上(至少部分或全部地)形成至少一种第一生物结构后,将第三类(或更多类型的)细胞接种于凝胶上。接种第三类细胞后,优选在适当的培养基中培养凝胶,直到在凝胶中和/或在凝胶上形成至少一种第二生物结构。然而,第二生物结构部分或完全形成之前,移植也是可能的。第二生物结构可以是与第一生物结构相同的类型,然而,第二生物结构优选是(与由第一和/或第二细胞类型的细胞形成的类型)不同类型的生物结构。优选地,由第三类细胞形成/构成的第二生物结构是表皮结构。
优选地,在含有用于特定类型的细胞生长的适当细胞培养基的烧瓶中将凝胶与各种细胞共培养。
待接种于水凝胶上的用于诱导至少第二生物结构的第三类细胞通常可以是存在于体内,优选存在于人或其他哺乳动物体内的任何细胞类型。第三类(或更多类)细胞可以是与接种用于形成第一生物结构的细胞相同的和/或不同的类型。优选地,对于表皮生物结构的诱导,使用了角质细胞。然而,其他可能的细胞是例如黑色素细胞、梅克尔细胞、免疫系统细胞、脂肪组织源性细胞、非表皮源性上皮细胞、干细胞、祖细胞、基因修饰的细胞等。
第一类和/或第二类和/或第三类(或更多类的)细胞优选是哺乳动物细胞,最优选是人细胞。如果用于接种凝胶的细胞是自体细胞,则是特别有优势的。
根据特别优选的实施方式,上文提及的方法涉及由毛细血管和/或毛细淋巴管,优选由毛细血管和毛细淋巴管两者预脉管化的人真皮-表皮皮肤替代物的体外工程化和体内移植。hlec的纯种群(分离自人包皮)和存在于hdmec(分离自人包皮)中的hlec部分两者均在21天内在纤维蛋白或i型胶原蛋白水凝胶中在体外发育为形成腔的真正的毛细淋巴管。通过显示工程化的微血管呈现固着性纤丝,表达所有主要的淋巴标记物以及可以受淋巴管生成刺激物和抗淋巴管生成刺激物调节,证实了所述工程化的微血管的淋巴性质。通过证明工程化的微淋巴管在体外从间隙空间吸取流体以及在体内触发流体引流证实了淋巴功能。体内移植研究揭示了工程化微淋巴管保持了它们的腔以及它们的典型特征,如缺少完整的基膜以及缺少壁细胞覆盖。早在移植后14天时,就发现生物工程化人淋巴汇合至受体的淋巴。当移植到无免疫能力的大鼠中时,预脉管化真皮支持了表皮的发育,这表明在未来将这些预脉管化的真皮-表皮替代物移植到临床应用中是有可能的。
另外,通过使用人血管脂肪组织的基质部分(svf)可以在水凝胶中使毛细血管工程化。svf细胞显示了高血管生成潜能。svf细胞发育成人真皮-表皮皮肤移植物中的功能性毛细管丛。移植后,根据快速移植物散布的移植物成活和重构支持了所移植的移植物的存活和功能。
到目前为止,没有通过使用脂肪组织源性内皮细胞(基质血管部分,svf)使预脉管化的真皮-表皮皮肤移植物生物工程化的可用数据。与分离自其他组织的内皮细胞相比,svf细胞的优势如下:第一,一次单次svf活组织检查以理想的比例递送自体基质细胞、血管生成细胞和壁细胞。第二,svf细胞揭示了在所有年龄组,甚至在老年患者或烧伤患者中的高血管生成潜能。第三,可以以全自动程序大量地分离svf的细胞,使得它们不需要体外扩增,以及可以被新鲜地使用,例如可以用于直接的术中用途。
根据本发明的移植物可以用于使人体内的任何组织(如皮肤、角膜、软骨、内皮、瓣膜等)或其他结构(如腺体、毛发、神经、肌肉等)工程化,并且它们可以用作用于例如药物筛选的测试工具。
根据本发明的第一方面,上文提及的预脉管化移植物适用于研究目的,如测试和筛选,以及用于移植到小动物模型如小鼠和大鼠上。根据本发明的方法,可以在体外在水凝胶中将全功能的形成腔的人毛细管(毛细血管和毛细淋巴管两者)工程化。然而,例如对于大动物(如猪和兔等)的测试或更重要地对于人的临床研究来说,需要更大、更薄并且更机械稳定的构建体。
因此,根据本发明的第二个更高级的方面,提供了用于生产根据上文提及的实施方式的组织移植物的方法,其中,此外,在用第一类和/或第二类(或更多类)细胞接种凝胶之后,优选通过压缩,将凝胶压实
已经显示接种细胞的胶原蛋白凝胶(例如在ep1773416b1中)是对组织等价植入物的优秀的生物模拟起始点,然而它弱的机械强度是个缺点。通过添加凝胶压实的步骤,可以利用(例如由胶原蛋白制成的)凝胶的最佳特性而不必忍受它在机械强度方面的不足。因此,可以生产非常薄的移植物,即组织/器官生理厚度非常薄的移植物,而不必牺牲机械强度。不仅压实/压缩提高了具有特定厚度的凝胶的机械强度,而且通过压实/压缩获得的非常薄的凝胶的机械稳定性甚至高于具有远远更大厚度的凝胶的机械稳定性。
根据本发明特别优选的实施方式,通过塑性压实,优选通过用压缩装置压缩,优选通过将机械压缩力施加在凝胶上来压实凝胶。从而,提高了支架基质的密度和机械强度。
从本申请的意义来说,“塑性压实”是指使凝胶变形以减少它的体积,使得凝胶实质上保持它的新体积,甚至在去除压实的原因之后。凝胶的体积优选减少了至少40%,优选减少了高达90%。
在本描述方面,压实是快速的、不依赖于细胞的过程,所述压实由使凝胶经受物理处理如外力或压力产生,所述物理处理将间隙液从凝胶中排出。因此,塑性压实不依赖于凝胶内培养的细胞的作用。压实的量和程度可以根据希望减少的凝胶厚度而变化。
可以在至少一种第一生物结构形成之前或之后进行压实凝胶。对于真皮-表皮皮肤移植物的优选实施方式,压实应用于预脉管化的凝胶。也就是说,根据该优选的实施方式,在已经含有脉管生物结构的凝胶上进行凝胶的压缩。惊人地,生物结构的发育,即脉管丛的发育的情况下,不会被水凝胶的塑性压实/压缩影响。优选地,在压实凝胶后,用第三类(更多类)细胞接种凝胶。例如对于真皮-表皮皮肤移植物的优选实施方式,凝胶表面上的表皮结构会另外被压缩所损坏。
未压缩状态下的凝胶具有第一厚度,进行压实直到凝胶达到在压缩状态下的第二厚度是第一厚度的1/3~1/20,优选是第一厚度的约1/10。对于真皮-表皮皮肤移植物,例如,压缩状态下的凝胶的优选厚度是约0.7~1mm,这对应于皮肤的生理厚度。
可以在含有用于特定细胞类型的细胞生长的适当培养基的烧瓶中将凝胶与各自的细胞共培养。优选地,将凝胶从烧瓶中移出用于压缩,以及在压缩后移回烧瓶用于进一步的培养。
本发明进一步涉及包括凝胶的组织移植物,所述凝胶包括至少一种由至少第一类和/或第二类细胞(在体外)在凝胶中和/或凝胶上形成,优选在凝胶中形成的第一生物结构。优选地,组织移植物进一步包括至少一种由至少第三类细胞在凝胶中和/或凝胶上,优选在凝胶上形成的第二生物结构。优选地,第一类和/或第二类和/或第三类(或更多类)细胞是人来源的细胞,更优选是自体人来源的细胞。
优选地,通过根据上文提及的实施方式中的一种的方法,生产移植物。
第一和/或第二生物结构选自以下的组:器官结构和组织结构,优选为上皮结构,包括腺上皮结构、胎盘上皮结构或羊膜上皮结构;脉管结构,优选血管结构和/或淋巴管结构;神经结构;结缔组织结构,包括骨结构、毛发结构、指甲结构、牙齿结构、间充质结构、肌肉结构、脂肪结构。
第一和/或第二生物结构优选包括选自以下的组的细胞:内胚层来源细胞、中胚层来源细胞、外胚层来源细胞(包括神经嵴)、滋养层来源细胞、生殖细胞、干细胞、祖细胞、基因修饰的细胞。
根据特别优选的实施方式,移植物包括凝胶中的自体人内皮细胞和自体人成纤维细胞,成纤维细胞与内皮细胞的比例优选为至少3:7,更优选为至少2:3,最优选为约1:1。
第一生物结构优选是脉管生物结构,优选是毛细血管和/或毛细淋巴管的脉管丛。第二生物机构优选是表皮生物结构。有利地,第一生物结构是在凝胶中形成的脉管生物结构,以及第二生物结构是在凝胶上形成的表皮生物结构。
如果第一生物结构是凝胶中的毛细血管和毛细淋巴管的脉管丛,那么其中的毛细淋巴管优选具有生理大小的连续腔,优选为17~60μm的连续腔。这些形成腔的毛细淋巴管优选具有固着性纤丝,所述固着性纤丝优选是原纤蛋白固着性纤丝。
形成移植物的支架的凝胶优选是纤维蛋白或胶原蛋白水凝胶,所述胶原蛋白水凝胶优选是i型胶原蛋白水凝胶。优选地,凝胶是压实的凝胶,优选是压缩的水凝胶。优选地,所述凝胶已经用申请ep13174441中公开的装置进行压缩。
最优选地,组织移植物是真皮-表皮皮肤移植物,其中优选地,第一生物结构中包括的细胞是hdmec或svf细胞,以及第二生物结构中包括的细胞是角质细胞,优选为表皮角质细胞。特别是在真皮-表皮皮肤移植物的情况下,移植物优选具有0.2~3mm的厚度,优选为0.7~1mm的厚度。
基于水凝胶支架的自体的生物工程化预脉管化真皮-表皮皮肤移植物显示了在体内再生的能力。确实在移植后,预成型的毛细管功能性地连接于受体的脉管系统,以及大大地支持了表皮和真皮再生(marino等人.2014,生物工程化具有毛细血管和毛细淋巴管的真皮-表皮皮肤移植物(bioengineeringdermo-epidermalskingraftswithbloodandlymphaticcapillaries),scitranslmed.2014jan29;6(221):221ral4;和klar等人.2014,用脂肪源性细胞使组织工程化的真皮-表皮皮肤移植物预脉管化(tissue-engineereddermo-epidermalskingraftsprevascularizedwithadipose-derivedcells),biomaterials.2014jun;35(19):5065-78)。
根据本发明的方法在生产组织等价植入物中,或在生产用于植入个体中以修复或替换损伤或病变的内源组织的装置(组织移植物)中是特别有用的。这样的缺损的组织的例子包括皮肤、神经、腱、软骨、骨、泌尿生殖器、肝脏、心肺组织、肾、眼组织、血管、肠和腺体。如果组织移植物是真皮-表皮皮肤移植物,那么损伤的组织优选是皮肤组织。当与非脉管化皮肤移植物比较时,脉管化水凝胶的真皮-表皮皮肤移植物显示了在体内更快和更好地再生,它们在治疗例如烧伤和其他皮肤缺损中可能是临床可应用的。
在本发明的帮助下,可以在一种组织或器官移植物中使人血管和淋巴管两者工程化。体外生成的毛细管网络显著支持真皮成分的散布,因此,提供了通向氧和营养物的快速和有效的入口,这确保了皮肤移植物的快速成活、增殖和分化(bottcher-haberzeth等人,皮肤的组织工程(tissueengineeringofskin),burns36,450-460(2010))。使预先形成的毛细淋巴管网络工程化到真皮-表皮皮肤移植物中应通过改善淋巴引流和促进建立组织液内稳态来帮助避免血清肿的形成。
本发明进一步的实施方式记载在从属权利要求中。
附图说明
以下参照附图,描述了本发明的优选实施方式,附图用于说明本发明的本优选实施方式的目的,而非限制本发明的目的。在附图中,
图1显示了大的水凝胶的制备,其中a.)显示了通常的水凝胶培养和操作;b.)显示了薄的未压缩水凝胶的操作和稠度;c.)显示了厚的未压缩水凝胶的操作和稠度;以及d.)显示了薄的压缩水凝胶的操作和稠度。
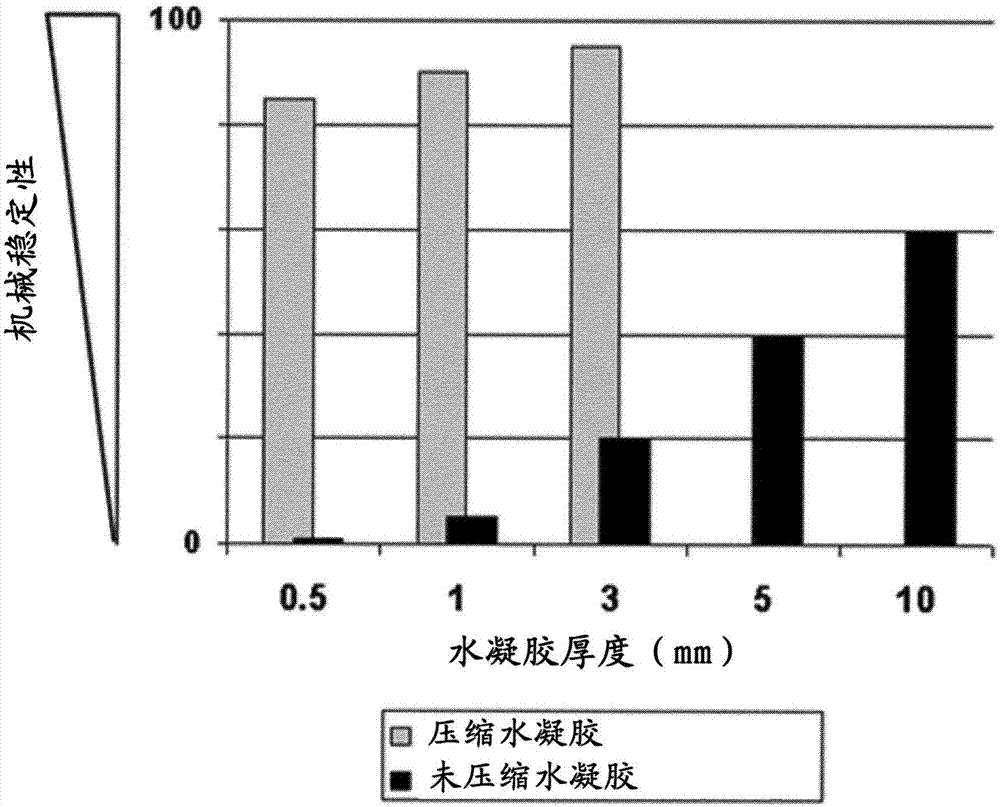
图2以条形示意图显示了机械稳定性和水凝胶厚度的关系。
图3显示了含有脉管结构的水凝胶的生产过程的示意图;首先通过显示用于生产含有脉管结构的大的压缩水凝胶的生产步骤的顺序(a);以及大的脉管化真皮-表皮皮肤移植物的生产步骤的顺序(b);然后是这样的方法在免疫荧光研究中的结果(c、d-上图,d')以及组织切片(d-下图)。
图4显示了,对于未压缩的预脉管化组织移植物,a.)内皮细胞(hdmec)与真皮成纤维细胞的比例与毛细管面积的关系,b.)内皮细胞(hdmec)与真皮成纤维细胞的比例与每mm2中分支点数目的关系,以及c.)内皮细胞(hdmec)与真皮成纤维细胞的比例与平均毛细管直径(以μm计)的关系。
图5显示了压缩水凝胶与未压缩水凝胶对比的未改变的脉管特征,其中a.)显示了脉管面积;b.)显示了分支点的数量;以及c.)显示了脉管长度。
图6显示了关于步骤顺序的两种变化的含有脉管生物结构的压缩水凝胶的生产过程的示意图。
图7-图10是压缩的预脉管化组织移植物的生产的照片文件;其中
图7显示了烧瓶组装和水凝胶制备的照片文件;
图8显示了压缩装置组装的照片文件;
图9显示了压缩步骤的照片文件;
图10显示了凝胶转移步骤的照片文件。
具体实施方式
本发明涉及皮肤移植物,与现有技术相反,所述皮肤移植物不仅包括患者的皮肤细胞,还含有离体(在体外)“预脉管化”,然后移植到伤口上的毛细淋巴管和/或毛细血管两者。通过从人包皮取hdmec或从人脂肪组织取svf,以及将它们植入三维水凝胶中,建立真皮-表皮皮肤移植物。为了移入体内,将含有hdmec以及人成纤维细胞或svf细胞和角质细胞的工程化皮肤移植物移植到裸大鼠(没有功能性免疫系统的动物)的受伤的背部。2周后人皮肤移植物形成了预期的皮肤层,毛细管功能性地与存在的大鼠毛细管相连。这些工程化的真皮-表皮水凝胶潜在地表现了皮肤移植物的下一代,包括血管和/或淋巴管生物结构以及准备用于移植。
实施例1:
含有毛细血管和毛细淋巴管的未压缩的预脉管化真皮-表皮皮肤移植物的生产
对将含有脉管(血管和淋巴管)丛的人真皮-表皮皮肤移植物移植到大鼠进行监测。首先,在体外在纤维蛋白水凝胶中使用cd31阳性(cd31+)的hdmec、人cd90阳性(cd90+)的成纤维细胞和人角蛋白5阳性(k5+)的角质细胞建立皮肤移植物。
组成移植物的真皮区域(dermalcompartment)的两种细胞类型均排布在几层角质细胞即表皮区域的下面(可见的并且通过共聚焦显微照片证实)。然后使用富泽尼希室(fusenigchamber)将这些皮肤移植物移植到无免疫能力的nu/nu大鼠的受伤的背部以避免大鼠角质细胞的竞争性横向向内生长/向外生长。移植后2周,通过外科手术将人皮肤替代物从大鼠底层组织中移出,并且分析真皮结构和新脉管生成。脉管化的新真皮(neodermis)支持了堆叠的表皮的层化(stratification)。2周后的免疫荧光分析揭示了新真皮中人微血管和微淋巴管二者的存在。大部分生物工程化的proxl阳性/cd31阳性(proxl+/cd31+)微淋巴管在体内保持了它们的腔。检测到了表达lyve-1和平足蛋白(podoplanin)的人微脉管,表明移植后2周,人毛细淋巴管保持完整。还检测到了唯一表达cd31的微脉管。尤其是,从未发现两种不同类型的微脉管汇合。
毛细管的进一步分析揭示了人微淋巴管呈现了纤维蛋白+固着性纤丝,这强有力地说明了毛细管可以对间隙压力变化做出反应,以及解决体内组织液积累。此外,生物工程化人毛细淋巴管没有壁细胞覆盖。
进行淋巴引流实验以研究生物工程化毛细淋巴管在体内是否是功能性的。移植后15天,将少量(25μl)的伊文氏蓝注射至移植物中。在注射后30分钟分析移植物时,与含有人毛细淋巴管和人毛细血管的水凝胶相比,在仅含有人成纤维细胞的水凝胶中保留了约5倍的伊文氏蓝,这说明了预脉管化移植物的淋巴引流功能。该数据表明移植的人淋巴管被受体淋巴管识别以及与受体淋巴管汇合,也表明了新产生的淋巴管丛有效地在体内引流液体。
实施例1的材料与方法:
如marino等人.2014,生物工程化具有毛细血管和毛细淋巴管的真皮-表皮皮肤移植物(bioengineeringdermo-epidermalskingraftswithbloodandlymphaticcapillaries),sci.transl.med.6,221ral4(2014)中描述的,将人细胞(角质细胞、成纤维细胞和内皮细胞)分离。在该研究中,首先,在3d水凝胶内将hlec与人真皮成纤维细胞共培养,以研究lec发育为形成腔的真实毛细淋巴管的能力。然而,然后使用hdmec(而不是lec)使预脉管化的真皮-表皮皮肤替代物工程化。选择hdmec是因为他们是真皮血液和lec的混合物;因此,这些细胞具有引起两种类型毛细管产生的潜力。
hdmec和真皮成纤维细胞的分离和培养:
从获得自苏黎世大学儿童医院的常规包皮环切术后的包皮(n=8)共分离hdmec(人真皮微脉管内皮细胞)和人真皮成纤维细胞。如montano等人,人毛细管的体外形成:预脉管化基质的工程化(formationofhumancapillariesinvitro:theengineeringofprevascularizedmatrices.)tissueeng.parta16,269-282(2010)所述,处理包皮。在涂覆了0.1%明胶的盘(sigma-aldrich)上在内皮细胞生长培养基-2(具有内皮补充剂的ebm-2mv;lonza)中共培养分离的hdmec和成纤维细胞。每天通过机械刮划移出成纤维细胞。使用对cd90(dianova)和cd31(dakocytomation)的facs分析计算成纤维细胞和hdmec的数目(在所有实验中它们的比例是1:1)。在所有实验中使用第1代细胞。
水凝胶中毛细管的产生:
用transwell系统(bdfalcon)生产纤维蛋白或胶原蛋白水凝胶,所述transwell系统由具有膜的6孔培养插入件组成,所述膜具有3mm孔。简单地说,对于纤维蛋白水凝胶,在nacl中将来自牛血浆(sigma-aldrich)的纤维蛋白原重组至终浓度为10mg/ml,然后添加11ml凝血酶(sigma-aldrich,100u/ml)。对于胶原蛋白水凝胶,用大鼠尾i型胶原蛋白水凝胶(3.2~3.4mg/ml,bdbiosciences)覆盖膜。如montano等,2010中描述的制备胶原蛋白基质。向1ml水凝胶溶液中添加100,000个人真皮细胞(hdmecs/成纤维细胞,1:1)(最开始,仅用于研究目的,60,000个hlec(如根据marino等人分离的,2014)与40,000个人真皮成纤维细胞组合)并且转移至6孔板的插入件内。在室温下凝块后,将制备物在含有5%co2的湿化培养箱中在37℃下温育35分钟以确保聚合。在温育期结束时,将培养基添加至上室和下室[内皮细胞生长培养基-2(具有内皮补充剂的ebm-2mv;lonza)],温育水凝胶高达3周。每两天更换培养基。
对成纤维细胞在淋巴管形成中的作用的测试:
如marino等人,2014中所描述的,如上文描述的生产纤维蛋白水凝胶,并且在体外培养3周。在培养基、培养基加vegf-a(40ng/ml,chemicon)、培养基加vegf-c(100ng/ml,r&dsystems)或适应纤维原细胞的培养基中培养具有0个成纤维细胞/100,000个lec的水凝胶。具有10,000个成纤维细胞/90,000个lec或40,000个成纤维细胞/60,000个lec的水凝胶生长于培养基中。对于transwell测定,将100,000个成纤维细胞接种于transwell的底面,而将具有100,000个lec的水凝胶在顶部培养。观察到少数成纤维细胞从插入件的底面通过多孔膜迁移进入凝胶中。每天更换培养基。
缺乏成纤维细胞时毛细管形成不会发生。同样地,适应纤维原细胞的培养基、血管内皮生长因子-a(vegf-a)或vegf-c的添加以及transwell系统的底面上存在成纤维细胞都不诱导hlec中的毛细管形成。因此,人真皮成纤维细胞和lec之间的物理接触对水凝胶中真实的分支毛细淋巴管的发育是必需的。通过对全包埋样本测量,组织学揭示了工程化毛细管产生了生理大小的连续腔(17~60μm)。通过对全包埋水凝胶制备物进行的双免疫荧光染色证实了毛细管的淋巴性质。生物工程化毛细淋巴管表达cd31和淋巴特异性核转录因子proxl。大多数毛细管显示核的生理大小(直径10μm)。两种其他的淋巴管标记物lyve-1和平足蛋白证实了生物工程化人毛细管的淋巴性质。
在测试中,结果示于图4中,观察毛细管面积(图4a)、每mm2的分支点数目(图4b)和平均毛细管直径(图4c),并且关于内皮细胞(hdmec)与成纤维细胞的变化比例定量。对于所有三个参数a.)-c.),内皮细胞与成纤维细胞以1:1的比例接种显示是未压缩的凝胶中毛细管形成方面的最佳比例,其中2:3和3:7的比例也显示了阳性结果。
预脉管化皮肤移植物的制备:
培养2周后,100万个人角质细胞(如braziulis等人.2012中的描述所分离的)被接种于预脉管化纤维蛋白水凝胶的顶部。一周之后,进行移植或全包埋免疫染色。
将生物工程化皮肤移植物移植到无免疫能力的nu/nu大鼠上:
通过吸入5%异氟烷(baxter)使无免疫能力的雌性nu/nu大鼠(elevagejanvier)(n=12)麻醉,并且通过经由面罩吸入2.5%异氟烷保持麻醉状态。操作之前,施用用于镇痛的丁丙诺啡(0.5mg/kg)(temgesic)和用于眼保护的视黄醇霜(维生素a“blache”;bausch&lomb)。为防止创伤从一侧闭合和大鼠组织对人移植物的过度生长,我们实验室设计了特殊的聚丙烯环(直径为2.6cm)(改进的富泽尼希室)。用不能吸收的聚酯缝合线(ethibond;ethicon)将环缝合于大鼠背部生成的全厚皮肤缺损处。将培养的直径约2.6cm,厚度3~8mm的预脉管化真皮-表皮圆形皮肤移植物放置于聚丙烯环内,用硅箔(silon-ses;biomedsciences)和聚氨酯海绵(ligasano;ligamed)覆盖。手术后15天时处死大鼠。处死时,将敷料和缝合线移除,并且收集多块移植物活组织(n=12)用于不同的分析。
实施例2:
通过svf细胞产生的含有毛细血管的未压缩预脉管化真皮-表皮皮肤移植物的生产
对大鼠移植含有血管丛的人真皮-表皮皮肤移植物进行监测。首先,在体外在纤维蛋白水凝胶中使用svf细胞和角质细胞建立皮肤移植物。
svf细胞排布在几层角质细胞(即表皮区域)的下面(使其可见并且可通过共聚焦显微照片证实)。然后使用富泽尼希室将这些皮肤移植物移植到无免疫能力的nu/nu大鼠的受伤的背部以避免大鼠角质细胞的竞争性横向向内生长/向外生长。将这些皮肤移植物移植到无免疫能力的nu/nu大鼠受伤的背部以避免大鼠角质细胞的竞争性横向向内生长/向外生长。移植后2周,通过外科手术将人皮肤替代物从大鼠底层组织移出,并且分析真皮结构和新脉管生成。脉管化的新真皮支持了堆叠的表皮的层化。2周后的免疫荧光分析揭示了新真皮中人血液的存在。生物工程化的微脉管在体内保持了它们的腔,并且早在移植后4天就散布于移植物,汇合于受体的脉管。这种快速的散布引起了皮肤的存活和功能性。
实施例2的材料与方法:
如klar等人.2014,用脂肪源性细胞使组织工程化的真皮-表皮皮肤移植物预脉管化(tissue-engineereddermo-epidermalskingraftsprevascularizedwithadipose-derivedcells),biomaterials.2014jun;35(19):5065-78所描述的分离人细胞(角质细胞和svf细胞)。在该研究中,svf细胞用于工程化预脉管化的真皮-表皮皮肤替代物。
细胞的分离和培养:
从来自男性或女性健康人供体(18至68岁之间)的脂肪抽取物或脂肪切除物获得人皮下脂肪组织样品,多数来自腹部身体部位,所有人经历了外科抽脂手术或切除手术。将脂肪抽取物或切除的脂肪样品切碎成小块,并且用0.075%(w/v)ii型胶原蛋白酶(355u/mg,worthington,lakewood,nj,美国)在37℃下摇动消化60min。以200g离心10min后,弃去油层和水层。在磷酸盐缓冲溶液(pbs,gibco,invitrogen,carlsbad,ca,美国)中洗涤产生的沉淀,并且使沉淀通过100mm和40mm过滤器。通过用含有0.15m/l氯化铵、1.0mm/l碳酸氢钾(二者均来自merck,darmstadt,德国)和0.1mm/lna-edta(flukaanalytical,sigma-aldrichchemiegmbh,buchs,瑞士)的缓冲液温育2min,裂解红细胞。离心和在pbs中洗涤后,在由补充了10%胎牛血清(fbs)、1%羟乙基哌嗪乙磺酸(hepes)、1%丙酮酸钠和1%青霉素链霉素谷氨酰胺(100×)溶液(均来自gibco)的改良伊格尔培养基(a-mem,gibco)组成的完全培养基(cm)中,重悬svf细胞沉淀物,用结晶紫(sigma)染色,以及使用牛鲍氏室(neubauerchamber)计数。通常从1ml脂肪抽脂术活组织中分离1.6~0.9×105个有核细胞,以及从1g切除的活组织中分离1~0.55×105个有核细胞。对于单层扩增,将svf细胞以2×103个细胞/cm2的密度接种于组织培养板上,在额外补充了5ng/mlfgf-2(r&dsystems)的cm中培养,当细胞汇合时以3×103个细胞/cm2的密度传代。为了与新分离的svf细胞群体区分,供体匹配的单层扩增的脂肪源性细胞此后被称为脂肪基质细胞(asc)。如pontiggia等人,评价工程化人皮肤替代物在体外和移植后的质量和自我更新潜能的标记(markerstoevaluatethequalityandself-renewingpotentialofengineeredhumanskinsubstitutesinvitroandaftertransplantation).j.invest.dermatol.2009;129:480-90所描述的,从包皮(2至18岁的男性)分离和扩增人真皮成纤维细胞(hdf)和角质细胞(kc)。
预脉管化水凝胶的制备:
使用来自牛血浆(sigma-aldrich)的在0.9%nacl中以终浓度10mg/ml重组的纤维蛋白原制备纤维蛋白水凝胶。为了在水凝胶内侧获得可比较的细胞接种,每3ml凝胶接种3×105个svf细胞、7.5×104个asc或7.5×104个hdf。对于在移植之前产生功能性的和均匀的真皮毛细管丛,优化svf细胞的浓度。移植后3-4天,相应的预脉管化移植物开始有效地散布。根据间充质细胞的数目标准化细胞的接种密度,其数目在asc中是在svf中的大约4倍。我们接种了每1ml水凝胶1×105个svf细胞以重组真皮皮肤。将细胞离心,重悬于100mlegm-2mv培养基(lonza,basel,瑞士)中,以及与3ml纤维蛋白原溶液混合。将凝胶放置于具有3.0mm孔径的膜的6孔细胞培养插入件(bdfalcon,德国)中。通过添加33ml凝血酶(sigma-aldrich,100u/ml)起始聚合,将凝胶在室温下保持10min,然后在含有5%co2的湿化培养箱中在37℃下保持1h。为了制备胶原蛋白水凝胶,将大鼠i型胶原蛋白(bdbioscience,franklinlakes,nj,美国)与含有0.15mnaoh的0.2ml中和缓冲液混合。聚合阶段之后,将egm-2mv添加至纤维蛋白/胶原蛋白水凝胶的上室和下室,将它们温育1周或3周,以及分析脉管网络的形成。为了制备用于移植的真皮-表皮皮肤替代物(dess),在egm-2mv培养基中在纤维蛋白/胶原蛋白水凝胶中培养细胞2周,随后用角质细胞覆盖(7.5×104个/凝胶),培养额外的1周,然后移植到无免疫能力的大鼠上。基质细胞(具有或不具有ec)形成了真皮区域,而角质细胞组成了dess的表皮区域中的主要细胞类型。因为vascdess的真皮区域是体外预脉管化的,因此其已经含有人工程化毛细管的成熟网络。
组织工程化皮肤替代物的移植:
手术方案是由当地的实验动物研究委员会批准的(许可号76/2011)。准备8至10周龄的无免疫能力的雌性nu/nu大鼠(哈伦实验室(harlanlaboratories),荷兰),以及将它们麻醉(如pontiggia等人,2009描述的);3个独立的供体用于svf(每种条件n=6;18只大鼠)和asc(每种条件n=6;18只大鼠)的独立供体,4个独立的供体用于hdf(每种条件n=4;12只大鼠)(总计48只大鼠)(schneider等人,matriderm对比integra:比较实验研究(matridermversusintegra:acomparativeexperimentalstudy).burns2009;35:51-7)。将dess移植到通过手术在大鼠背部上造成的全厚皮肤缺损上。为了保护移植物和防止创伤从周围的大鼠皮肤闭合,用不能吸收的聚酯缝合线将定制的钢环(直径2.6cm)缝合到大鼠背部上造成的全厚皮肤缺损中(ethibond_,ethicon,美国)。然后用硅箔(silon-ses,bms,美国)、聚氨酯海绵(ligasano,ligamed,奥地利)、黏着一致性绷带(cohesiveconformingbandage)(sincohaft,theofreyag,瑞士)和带子作为创伤敷料覆盖移植物。通过这些方法,包扎的部位被完全保护,大鼠不能抓挠移植物。每周进行一次敷料更换和照相记录。4天、7天和14天后,完全切下移植的皮肤类似物,并且进行处理以用于低温切片和石蜡切片,以及电子显微镜检查。
实施例3:
压缩的预脉管化真皮-表皮皮肤移植物的生产:
实施例3的材料与方法:
如上文描述地分离人细胞(角质细胞、成纤维细胞和内皮细胞)。如下文描述参考图7-图10从7×8cm的水凝胶制备组织移植物。为了获得机械稳定性,根据ep13174441用压缩装置进行改良的塑性压缩。
水凝胶的制备(如图7所示):
如图7所示,将插入框(a)和插入件(b)放置于115cm2的组织培养瓶中。在4ml内皮细胞培养基中重悬100万个成纤维细胞/内皮细胞(比例1:1)(“细胞”)。将18±1ml胶原蛋白水凝胶倒入管中(“水凝胶”)。将过滤后的850μ1乙酸添加至“水凝胶”(“混合物”)。通过轻轻旋转管混合“混合物”。
-将7.5±0.2ml重组缓冲液添加至细胞(“细胞+rb”)(重组缓冲液包含注射用水(aquaadinjectabilia)、氢氧化钠、碳酸氢钠、hepes缓冲液;参考原始方法:costea等人:纤维细胞和角质细胞生长因子对重组的人口腔上皮形态发生的关键作用(crucialeffectsoffibroblastsandkeratinocytegrowthfactoronmorphogenesisofreconstitutedhumanoralepithelium).jinvestdermatol121:1479-1486,2003)
-通过轻轻颠倒管混合“细胞+rb”
-将“细胞+rb”转移到“混合物”中:(“最终水凝胶”)
-通过轻轻颠倒管混合“最终水凝胶”
-将“最终水凝胶”倒入烧瓶中的插入件中(b)
凝胶化:
在室温(18~26℃)下温育烧瓶10±2min,然后在37±1℃下温育30±1分钟。
压缩装置的组装(如图8所示):
为了获得机械稳定性,根据ep13174441用压缩装置进行改良的塑性压缩,如图8所示:
-将基底托盘(c)放置于基底框上(d)
-将多孔板(e)放置于基底托盘内
-将垫片(f)放置于基底托盘上
-将活塞板(g)放置于顶板上
压缩(如图9所示):
-将烧瓶的插入件转移至压缩装置(h)内
-将具有活塞板的顶板(i)添加至压缩装置
-将3个压缩砝码(j)相继添加至压缩装置:150g保持5min,然后150g+200g保持5min,然后150g+200g+500g保持5min
凝胶转移(如图10所示):
-经过15±1min的压缩时间后,肉眼检查压缩成功
-从压缩装置中移出压缩砝码
-从顶板将活塞板解锁(点击机制)
-从压缩装置移出顶板,活塞板保持在插入件中
-从膜插入件移出活塞板,首先在一侧然后在另一侧,小心地抬起活塞板而不干扰水凝胶(k)
凝胶培养:
-将具有凝胶的插入件转移至烧瓶的插入框内
-将90ml内皮细胞培养基添加至烧瓶基底(屏障内)。必须使水凝胶完全浸没在培养基中
-将10ml内皮细胞培养基添加至凝胶上(插入件内)。必须使水凝胶完全浸没在培养基中
-将烧瓶在培养箱中保存21天以使脉管生物结构形成
角质细胞接种:
-在10±2ml角质细胞培养基中制备和重悬800万个角质细胞
-抽去凝胶上部的培养基
-抽去凝胶下部的培养基
-将90±5ml内皮细胞培养基添加至烧瓶基底(屏障内)。必须使水凝胶完全浸没在培养基中
-将10±2ml内皮细胞培养基添加至凝胶上(插入件内)。必须使水凝胶完全浸没在培养基中
-将烧瓶在培养箱中保存2~4天以使角质细胞贴附和增殖
然后,最后的增殖步骤之后是
体内移植
或
用于表皮生物结构形成的气-液时期:
在角质细胞培养基中培养角质细胞4天。然后将角质细胞层提高到气/液界面,以及培养额外的3周(根据气液层化方案:pontiggial等人.研究皮肤病学期刊(journalofinvestigativedermatology)(2009)129,480-490;doi:10.1038/jid.2008.254;publishedonline21august2008)。
分析:
对微淋巴管的形态学和功能进行表征,并且通过免疫荧光和组织学在体外和体内进行分析。如marino等人.2014中描述的进行组织学和全包埋分析。
图1显示了不同类型水凝胶之间的操作中的差异。a.)与细胞组合制备大的水凝胶(7×8cm,i型胶原蛋白),并且在允许移出水凝胶用于进一步处理的烧瓶中培养水凝胶。b.)到目前为止,如果需要制备薄的水凝胶,例如达到人皮肤的厚度(0.7~1mm),其机械稳定性差是引人注目的问题。c.)约10mm厚度的更厚的水凝胶呈现更高的机械稳定性,但是他们不适用于大多数组织工程化目的。d.)塑性压实/压缩允许对基于薄的、大的、机械稳定的水凝胶的组织产品进行生物工程化。
图2显示了压缩水凝胶对比未压缩水凝胶的机械稳定性和水凝胶厚度之间的关系。在未压缩水凝胶中(黑色柱),机械稳定性随水凝胶厚度增加而增加。在约0.5mm的相同厚度的压缩水凝胶中,机械稳定性为约80倍。人皮肤具有约0.7~1mm的厚度,这是为什么水凝胶的这个范围尤其令人感兴趣。根据图2的图解,0.5~3mm厚度的压缩水凝胶呈现了比相同厚度的未压缩水凝胶远远更高的机械稳定性,甚至比10mm厚的未压缩水凝胶的机械稳定性更高。
图3显示了可以与脉管和表皮生物结构组合制备压缩水凝胶。在顶部,描述了含有脉管结构的水凝胶和脉管化的真皮-表皮皮肤移植物的生产过程。用a标记的第一个箭头显示了四个步骤对制备含有脉管结构的大的压缩水凝胶是必要的(混合、倒、压缩、培养)。用b标记的第二个箭头显示了基于压缩水凝胶的大的脉管化真皮-表皮皮肤移植物的工程化,所有六个描述的步骤是必要的(混合、倒、压缩、培养、接种、培养)。在用c标记的两个图片中,在接种后21天,通过对内皮标记(cd31)和核淋巴管标记(proxl)的全包埋免疫荧光使脉管结构可视化。在上方第一个图片中,许多脉管结构是可见的。这证实了hdmec组成了脉管结构。在下方第二个图片中,仅淋巴管是可见的。这证实了从人包皮分离的hdmec含有proxl阳性的淋巴管内皮细胞和proxl阴性的血管内皮细胞两者。在用d标记的图片中,上方的第一图片显示了对cd31和角质细胞标记(细胞角蛋白5)的全包埋免疫荧光,使角质细胞层(箭头)下方的皮肤移植物中的脉管结构(箭头头部)可视。第二个下方的图片显示了使表皮层和具有腔的毛细管可见的组织切片。如果在气液条件下进一步培养水凝胶,会发生表皮生物结构的形成:在用d'标记的图片中,免疫荧光分析显示描绘了具有基膜堆积(箭头)的层化的表皮。该表皮在含有脉管生物结构的水凝胶上生长(箭头头部)。
图5显示了压缩水凝胶(白色柱)与未压缩水凝胶(黑色柱)对比,脉管特征保持不变。在压缩水凝胶和未压缩水凝胶两者中脉管形成都会发生。定量分析显示了与压缩水凝胶相比,未压缩水凝胶中的脉管面积和分支点数目更大。然而,统计学分析显示没有显著性差异(p>0.05)。脉管长度保持不变。惊人地,这显示了脉管丛的发育没有受到水凝胶的塑性压实/压缩影响。
图6中,顶排显示了图3的生产顺序。然而,颠倒ca细胞(用于第一生物结构形成接种的第一类和/或第二类细胞)的压缩和培养步骤是可能的。为了在压缩水凝胶中产生其他生物结构,可以使用其他细胞工程化其他组织。可以在结构形成之前或之后进行压缩。通过包括压缩步骤生产的组织移植物用于所有类型的薄组织如皮肤、角膜、软骨、膜、内皮、粘膜等。
本发明的方法显示了,除了毛细血管(可由hdmec或svf细胞产生)之外,功能性毛细淋巴管也可使用三维水凝胶形成。与正常的淋巴管一样,这些毛细管分支在移植到免疫低下的啮齿动物后形成了腔,并且在体外和体内吸取流体。毛细淋巴管的形成可以由淋巴管生成刺激物和抗淋巴管生成刺激物两者调控,说明了该系统用于体外测试的潜在用途。在脉管发育期间,血管内皮细胞和淋巴管内皮细胞绝不会混杂,在描述的环境下毛细血管和毛细淋巴管也不会汇合。移植工程化的移植物之后,人毛细淋巴管与裸大鼠的淋巴管丛汇合,并且支持流体引流。该数据表明具有生理、结构和功能特性的这些皮肤移植物/替代物总有一天会被应用于遭受重度皮肤缺损的患者。
- 还没有人留言评论。精彩留言会获得点赞!