用于诊断睡眠的系统和方法与流程
本申请要求于2014年1月8日提交的美国临时专利申请序列号61/925,177的权益,该申请的全部内容通过在本文中引用被结合于此。
技术领域:
本文描述的实施例涉及用于睡眠阶段确定的系统和方法,并且特别地涉及用于可适于在睡眠实验室之外执行的睡眠阶段确定的系统和方法。
背景技术:
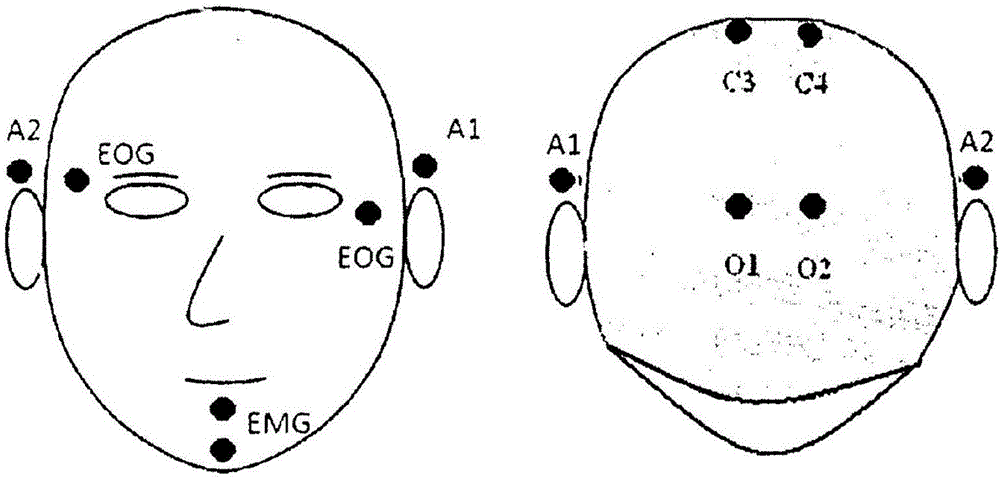
:睡眠是哺乳动物的基本需求之一。例如,人觉醒时的状态对睡眠状态具有影响,并且睡眠的质量往往对人白天(即,非睡眠)的活动具有显著的影响。干扰睡眠质量的睡眠障碍会具有显著的个人和社会后果,包括引起诸如高血压、心血管疾病、肥胖症和糖尿病的问题。当前,用于诊断目的(即,来诊断睡眠障碍)的睡眠记录是在睡眠实验室中执行的,并且被称为多导睡眠图(PSG)。多导睡眠图通常涉及获取受试者的许多不同的信号。这些组信号中的三个(即,大脑活动、骨骼肌张力和眼电图(electrooculogram))可以用睡眠图(hypnogram)进行概括,其表示在睡眠过程期间发生的睡眠阶段的整体(即,睡眠的水平和类型)。确定受试者在睡眠过程期间正在经历哪个睡眠“阶段”通常由手动识别每个阶段的睡眠技师基于标准的评分标准执行。例如,阶段1是睡眠周期的开始,这是相对浅的睡眠。在这一阶段期间,大脑产生阿尔法(alpha)波。但是,在阶段2睡眠期间,大脑产生被称为睡眠纺锤波的快速、有节奏的脑波活动。在作为浅和深睡眠之间的过渡阶段的阶段3中,大脑开始产生缓慢的三角(delta)波。然后,在阶段4中,大脑处于深睡眠并且产生许多三角波(取决于所使用的特定的睡眠分类系统,在一些情况下,阶段3睡眠和阶段4睡眠可以被分组在一起并且被简单地称为慢波睡眠(SWS))。最后,在阶段5中,大脑进入快速眼动(REM)睡眠,也称为主动睡眠。这是其中大多数的做梦将发生的阶段。附图说明现在将参考以下附图,仅仅作为例子,描述一些实施例,附图中:图1是示出用于多导睡眠图(PSG)记录的受试者头上的电极的常规布置的示意图;图2是示出根据如本文所描述的实施例的用于PSG的受试者头上电极的新布置的示意图;图3A是示出利用具有设定在1-70Hz、60Hz陷波、30秒/页和7uV/mm的滤波器设置的常规电极布置记录的受试者的深睡眠EEG的示例性曲线图;图3B是示出用于图3A的受试者的EEG的相同分段和利用与图3A相同的滤波器设置、但是利用根据本文教导的电极布置记录的示例性曲线图;图4是示出利用根据本文教导的电极布置、利用与图3A中相同的滤波器设置为受试者在REM睡眠期间记录的EEG的示例性曲线图;图5是根据一种实施例的用于确定睡眠阶段的系统的示意性框图;图6是示出根据一种实施例的用于与图5的系统一起使用的低通滤波器的频率特性的曲线图;图7是示出根据一种实施例的用于与图5的系统一起使用的高通滤波器的频率特性的曲线图;图8是示出根据一种实施例的用于与图5的系统一起使用的陷波滤波器的频率特性的曲线图;图9是根据一些实施例的用于图5的系统的REM/SEN密度估计器的示意框图;图10是示出根据一种实施例的在EOG频道上的REM活动(LOC,ROC)的示例性曲线图;图11是根据一种实施例的用于与图5的系统一起使用的阶段划分器(stager)的示意性框图;图12A是如由人类审查员利用标准的评分标准手动制作的受试者的睡眠阶段确定的示例性曲线图。图12B是为如在图12A中的相同受试者做出的自动化睡眠阶段确定的示例性曲线图,并且示出了在睡眠过程期间EEG的复杂度(规格化复杂度vs时间)。顶部水平线表示N1的边界并且底部线表示N2的顶部边界。图13是示出作为睡眠开始之前(在X点处)的最高局部最小值的在W-S1之间的边界的示例性曲线图,其中该曲线图表示规格化复杂度vs时间。图14是受试者中的阿尔法发生器的过渡W-S1-S2的示例性曲线图(被示为主导频率vs时间);图15是用于睡眠的整个过程的betaDPA的示例性曲线图(被示为百分比betavs时间)。顶栏和底栏表示beta分布的尾部。图16是示例性曲线图,其中该曲线图的顶部示出了规格化复杂度,而该曲线图的底部示出了复杂度的一阶导数(黑色)和复杂度的二阶导数(灰色),其中点A表示S1-S2边界;图17是根据一种实施例的在确定睡眠开始时的误差的示例性直方图。横坐标上的数字表示历元(30秒)。图18是根据一种实施例的在确定REM延迟时的误差的示例性直方图。横坐标上的数字表示历元(30秒)。图19是根据一种实施例的在确定DS开始时的误差的示例性直方图。横坐标上的数字表示历元(30秒)。图20是根据一种实施例的在确定睡眠效率时的误差的示例性直方图。横坐标上的数字表示百分比误差。图21是根据一种实施例的在确定总的深睡眠时的误差的示例性直方图。横坐标上的数字表示百分比误差。图22是根据一种实施例的在确定总的浅休眠(S1+S2)时的误差的示例性直方图。横坐标上的数字表示百分比误差。图23是根据一种实施例的在确定总的非REM时的误差的示例性直方图。横坐标上的数字表示百分比误差。图24是根据一种实施例的在确定总的REM时的误差的示例性直方图。横坐标上的数字表示百分比误差。图25是根据一种实施例的在确定总睡眠时间时的误差的示例性直方图。横坐标上的数字表示百分比误差。图26是根据一种实施例的在确定睡眠开始之后在觉醒阶段中的总时间时的误差的示例性直方图。横坐标上的数字表示百分比误差。图27是根据一种实施例的在CDP模型中的示意性关系图。具体实施方式为了简化和清楚地说明,在认为适当时,标号可以在各个图中重复以指示对应的或类似的元素或步骤。此外,阐述了大量的具体细节以便提供对本文所描述的示例性实施例的透彻理解。但是,本领域普通技术人员将理解,本文所描述的实施例可以在没有这些具体细节的情况下进行实践。在其它情况下,众所周知的方法、过程和部件没有被详细描述,以便不模糊本文所描述的实施例。此外,本描述不应该被视为以任何方式限制本文所描述的实施例的范围,而是视为描述各种实施例的实现。在一些情况下,本文所描述的系统和方法的实施例可以用硬件、用软件、或硬件和软件的组合来实现。例如,一些实施例可以用在包括至少一个处理器、数据存储设备(在一些情况下,包括易失性和非易失性存储器和/或数据存储元件)、至少一个输入设备和至少一个输出设备的一个或多个可编程计算设备上执行的一个或多个计算机程序来实现。在一些实施例中,程序可以用高级过程式或面向对象的编程和/或脚本语言来实现,以与计算机系统通信。但是,如果期望,程序可以用汇编或机器语言来实现。在任何情况下,语言可以是编译或解释语言。在一些实施例中,如本文所描述的系统和方法也可以被实现为配置有计算机程序的非临时性计算机可读存储介质,其中存储介质被配置为使计算机以特定和预定义的方式操作,以执行如本文所描述的至少一些功能。如以上所讨论的,用于诊断目的的睡眠记录当前在睡眠实验室中执行。不幸的是,在睡眠实验室中确定睡眠阶段所涉及的设置过程是耗时的。例如,进行睡眠阶段调查需要在受试者的头上布置大量的电极。这种电极布置需要准备用于最佳电接触的记录点。而且,根据现有技术,在受试者上布置电极必须精确并且遵循标准化的系统(称为10-20系统),根据该系统,睡眠技师必须测量和识别在其上放置电极的头皮上的特定位置。一些睡眠实验室会使用自动化软件工具来生成睡眠图。但是,虽然这些工具具有合理的精确程度,但是它们高度依赖电极位置。这往往限制了它们在某些应用中的使用,并且阻碍实现即将到来的睡眠阶段的家庭研究。尤其,患者通常不能由自己或在非专业人员的帮助下以足够的精度准备电极应用点和放置电极来实现准确的结果。此外,已知的软件工具还没有一般地对其中脑电图(EEG)读取(reading)与成人EEG读取不同的儿科人群(即,儿童)进行测试。现代睡眠医学的巨大挑战之一看来是其成本有效性扩展。尽管人群中有大量的睡眠问题存在,但是只有少数患者实际上曾治疗过,因为大多数的情况在普通的家庭医疗实践中通过而未被发现。当前,阻碍睡眠障碍的检测和诊断过程的两个主要壁垒是教育壁垒和技术壁垒。本文的教导一般地针对技术壁垒。常规的已知睡眠测试是昂贵的并且必须在具有有限容量的睡眠实验室中执行。但是,由于大多数人群并不经常访问睡眠实验室,因此大量的患者仍在这些实验室所能触及的范围之外。这具有显著的公共健康后果,例如,关于诸如高血压、心血管疾病、肥胖症和糖尿病的问题。一般而言,本文的教导针对适于在传统的睡眠实验室环境之外执行的用于人类睡眠阶段确定的新系统和方法。特别地,如本文所讨论的技术中的一个或多个可以具有优于常规睡眠诊断技术的一个或多个优点,包括潜在地提高准确性、更易于使用、便于患者自我测试的可能性、提供睡眠障碍的低成本诊断、提供可以在睡眠实验室之外进行的睡眠阶段确定、允许睡眠阶段确定在患者的家中完成、以及提供与在常规的实验室中睡眠测试中获得的信息水平可比的信息水平。在一些情况下,本文的教导可以允许一些睡眠诊断的至少一部分从睡眠实验室迁移出并且朝家庭医疗类型的实践迁移。这可以允许对睡眠障碍更广泛规模的测试。此外,在其中家庭医疗专业人员(即,医生或护士专业人员)利用本文的教导检测到睡眠问题的患者中,患者然后可能被转诊以便在睡眠实验室中进行更专门的诊断和治疗。这会更好地使用有限的医疗保健资源,因为睡眠实验室可以更专注于已被预先筛选出具有睡眠障碍的患者,并且减少对可能没有任何睡眠障碍的患者的关注。本文的一些教导可以允许医疗保健专业人员在没有睡眠医学的详细知识的情况下以与家庭专业人员当前可以测试血压和体温大致一样的方式执行全面的睡眠测试。此外,在一些情况下,本文的教导可以与其它精神健康、呼吸和/或心脏诊断模块结合,这些模块诸如在于2013年5月28日提交的并且标题为“SystemsandMethodsforDiagnosisofDepression”的美国临时专利申请序列号61/828,162中描述的模块中的一个或多个模块,其中该申请的全部内容通过在本文中引用被结合于此。将本文的教导与其它精神健康、呼吸和/或心脏诊断模块结合可以提供高度先进的家庭诊断睡眠、呼吸和/或精神障碍的可能性。在一些情况下,本文的教导可以用于创建集中式诊断中心,类似于诊断多个合并症(例如在一些情况下,精神障碍、睡眠障碍、呼吸和心脏问题可以被诊断)的放射学或血液学实验室,该多个合并症迄今被单独诊断和处理而具有普遍不理想结果。例如,运营用于精神健康的中央诊断点(CDP)的一个模型在图27中示出,其中睡眠医学、呼吸病学和心脏病学可以利用在患者家中实现的自动远程诊断技术来执行。来自多个专门学科(家庭医生、精神病学、睡眠医学、呼吸病学和心脏病学)的多个医师可以附属于中央诊断点,中央诊断点可服务城市、城市的部分或取决于其容量的更大的地理区域。诊断点将从该组中的任何医师接收转诊并且将向患者发送设备。患者将针对多个状况执行家庭测试,并且亲自、通过邮件或一些其它方式返回设备。可替代地,CDP可以具有其自己的快递服务。显著的优势在于检测并发症和进行更好的关爱以及对医疗保健系统的大量节省。这可以包括,例如,与呼吸、心脏和睡眠问题一起检测合并症精神健康问题,并且针对所有状况以潜在改进的结果治疗患者。本文描述的一些实施例可以提供至少一个显著的优点,在于一些患者可以不必去睡眠实验室进行诊断,而是可以在自己家中进行测试。一个或多个诊断中心然后可以取决于在家庭测试期间标记的任何状况和需求(并遵循适当的评估)将这些家庭测试的结果分发给一个或多个医师或其他医务人员。现在转向附图,现在将描述一些实施例的进一步细节。特别地,图1示出了通常在实验室中睡眠诊断中使用的患者头上的电极布置的常规模式。与此对照,图2示出了根据本文的教导、可以特别适于在睡眠实验室之外使用的电极布置的新模式。特别地,这种新模式被设计成具有面向简化记录并且允许由患者自己或者在一些情况下在非技术人员的帮助下应用电极的视图。如在图1中所示,在常规的电极模式中,头皮电极O1、O2、C3、C4被放置在通常被头发覆盖的患者头皮的后方区域上。但是,根据在图2中示出的新模式的电极布置,这些头皮电极O1、O2、C3、C4已被去除。此外,在图2中示出的电极布置的模式通常使用单极方法。这种方法将EEG与标准眼电图和与从颞肌、颏下肌电图(EMG)或两者收集到的骨骼肌活动相结合。这种方法的一个独特特征是从通道A1-REF和A2-REF收集EEG。这种布置可以提供一个或多个益处,诸如:信号可以直接可比较以便伪影抑制;更好地保存收集到的信号的频谱纯度,这主要由于没有一般具有相同频率内容的对侧通道的干扰;使由眼睛的电偶极导致的污染最小化(由于离源较大的距离);允许更好地使源分离;信号振幅一般不受损害;所有图形元素(graphoelements)都一般存在;易于应用;以及可选地允许自我应用(即,由患者)。低共模抑制比(CommonModeRejectionRatio,CMRR)的一个缺点可以通过在内部包括用于伪影拒绝的双极A1-A2通道来消除。值得注意的是,已经观察到,这只在少于大约1%的研究中呈现出重要性。下面表A给出了用于根据本文教导的睡眠阶段划分的一个蒙太奇(montage)的简短摘要:A1-REFA2-REFLOC-REFROC-REFCHIN1-CHIN2表A:用于睡眠阶段划分的蒙太奇现在转向图3A和3B,其中示出的是利用常规电极布置(在图3A中示出)和本文描述的新电极布置(在图3B中示出)收集到的振幅统计的相似性的比较。具体地,这些图示出了当与A1-REF(图3B)比较时C3-A2(图3A)上的和当与A2-REF(图3B)比较时C4-A1之间(图3A)的三角波的振幅统计的相似性。一般而言,这种水平的一致性不是实践本文的教导所必要的;但是,它对结果的可视验证会是有帮助的。现在转向图4,通过目测显然的是,快速眼动(REM)不会污染A1和A2通道上的EEG。虽然这会偶尔发生,但是新电极模式通常允许比双极蒙太奇好的源分离,并且因此将往往引起较少的或者甚至没有EEG的错误解释。除了利用这种技术通过信号质量给出的优点之外,另一个优点来源于使电极的应用容易。具体地,在图2中示出的电极模式允许由患者或其他非技术人员相对快地自己应用电极,而一般不会损害诊断的准确性。为了提供对本文教导的更好理解,现在将提供暗示性类比。睡眠可以被想象成以海拔和地标为特征的丘陵景观。睡眠景观由时间生物学因素来决定。地标是由与内部状态交互的外源性刺激引起的异步、不可预知的事件。这些事件的例子可以是唤醒、叫醒、K复合物(Kcomplexes)、睡眠纺锤、V波,等等。注意,这些事件不总是存在的或可见的,并且通常不改变睡眠的景观;它们仅仅装饰景观并被它调节。如本文所描述的用于确定睡眠阶段和用于构建睡眠图的教导可以类推来直接描述睡眠的景观。作为对照,确定睡眠状态的常规方法更接近于通过看只在景观的特定高度处生长的植物群(即,植物和树),并且然后利用植物群信息来间接算出景观的海拔来绘制景观图。按照相同的类比,本文的教导可以用来从直接测量确定海拔,同时不时地,直接测量可以与可沿途找到的植物群(即,植物和树)证实来确认直接测量的精确度。如本文所描述的,已经发现,这种睡眠的“景观”可以在其它“植物群”标志存在或不存在的情况下直接被确定。这种方法的一个可能的优点是能够在其中“植物”可能不存在(无论何种原因,这在睡眠诊断中会由于病理状况或有争议的情况)的条件下确定睡眠景观。例如,在现实世界中,存在大量不出现纺锤、阿尔法活动或其它事件的患者。因此,对这些患者的睡眠阶段划分的常规方法由于偶尔缺少这些“植物群”元素而变复杂。这些可变条件也可以说明在为同一患者手动执行睡眠阶段确定的不同人类评分人员之间缺少一致性。我们发现,通过利用大脑过程的复杂度随着睡眠的加深而降低的基本观察,睡眠的直接阶段划分是可能的。因此,大脑过程的复杂度可以用作睡眠深度的直接衡量。已经注意到,REM睡眠是在睡眠状态中(一般而言)呈现最高复杂度的状态,指示大脑活动的最高水平在REM睡眠期间出现。与睡眠的所有其它阶段不同,REM睡眠是意识的平台期,并且与其它睡眠状态相比,REM睡眠非常浅。一种可能的解释可以归因于大脑的高水平激活,但运动神经元饱和、缺少运动活动和肌肉张力。这减少了叠加在EEC上的噪声(EMG)。现在转向图5,其中示出了根据一种实施例的用于确定睡眠阶段的系统100的示意性框图。系统100一般包括功能上适于特定处理任务的操作框。一般而言,对系统100的输入102是可变大小的数据报文的流,并且其可以被存储在缓冲区104中。在这个例子中,系统100一般地对每种相关的信号类型(EEG、EMG、EOG)逐历元(epoch)地进行分析。在一些情况下,每个信号从数据报文中逐通道地提取。每个通道然后专门针对它携带的信号类型进行处理。通常,EEG通道106是用于睡眠图的产生的主要输入,而其它通道108是辅助通道,其作用一般是提高睡眠图的准确度。以下小节提供了关于系统100的模块的进一步的细节。系统100包括一个或多个预处理器110。每个预处理器110可以取决于输入102的类型对数据应用特定的滤波步骤。在一些情况下,滤波可以由如在图6-8中示出的滤波器执行。例如,滤波可以利用数字Butterworth、低通和高通IIR滤波器、以-40dB/dec和分别在70Hz和0.5Hz的转角频率(cornerfrequency)来完成。在一些情况下,也可以使用陷波滤波器和重采样滤波器用于其中采样速率高于某个阈值的情况(即,大于200Hz)。系统100还包括数字周期分析(DPA)模块112。在睡眠医学的常规实践中,睡眠研究的分析通常以30秒的步长(称为历元)来执行。作为睡眠阶段划分的常规方法的一部分,一些阶段通过利用指定持续时间和幅度的波的比例来识别。不是利用连续的比例,而是固定的阈值通常被应用,并且历元取决于阈值或者是子阈值或者高于阈值(例如,基于特定三角波的密度,确定阶段3或4睡眠)。特定类型的波的比例是睡眠的某些特性的信息。利用比例可以被认为是比功率频谱分析方法更准确的用于表征睡眠的替代方法。但是,本文的教导针对为不同持续时间的波,即波的频谱分布流,提供比例的精确测量。为了这些目的,计数波的方法往往比功率频谱分析的平均方法更充分,这是因为频谱内容和原始时间序列之间较紧密的时间-频率关系。特别地,根据这一技术,特定波具有持续时间和相应的频率,因此它被认为或者在一个频带中或者在另一个频带中,并且波的持续时间的总和始终等于原始时间序列的持续时间。该方法的变型以名称数字周期分析(DPA)为人所知。下面的文本将描述数字周期分析(DPA)的示例性版本。基于分段之前应用的滤波和分段方法,存在DPA的变体,但是所有的都具有以简单的方法并且尽可能好地识别小波边界的目标。在一个具体例子中,样本利用具有-50db/dec和通带(0.5Hz,70Hz)的数字带通无限脉冲响应(IIR)滤波器进行随机过程的滤波。此外,数字带阻滤波器是用于线频率(linefrequency)。带阻滤波器利用具有过渡频带(0.1,0.5Hz)和-40db/dec的高通滤波器和具有过渡频带(70,80Hz)、-40db/dec的低通滤波器创建。这些滤波器的特性可以在图6-8中看到。滤波操作将数据转换为零均值随机变量。原始数据将分别在感兴趣的两个通道x1和x2上表示。每个通道将携带随机过程的四维样本。通过在离散时间n(历元)的过程的部分将由随机向量来表示:x[n]=[nδnθnβ]′(1)在这些部分的时间中的分辨率为30秒。当计算被进行时,随机分量的重要性将变得清楚。特别地,其中i∈{δ,θ,β}的ni的计算如下进行。寻找时间序列的过零点的算子(operator)可以被定义为:zx=Zero(x)={n|x[n-1]*x[n]≤0};x是随机变量。导数算子D然后被定义:Dx=x[n]-x[n-1]利用算子D和Z,可以建立以下随机过程:nδ表示具有在[1,4Hz]范围中的频率的波的数量。然后可以建立集合:zdx=Zero(Dx),并且然后定义以下两个随机过程:系统100还包括频谱分析器114。对于伪影和短期瞬态的检测,通常需要比历元(30秒)高的分辨率。在一些情况下,3秒的分辨率被用于频谱分析。这提供了0.3Hz的频谱分辨率。这种方法根据Blackman-Tuckey方法从众多的频谱估计技术改编而来:其中W是奇数长度对称窗口,N是窗口的宽度,X是过程x的功率频谱密度。等式(2)通常更容易在时域中计算:其中(3)由于卷积和互协方差之间的关系,出现进一步的简化:kxy=x*[-n]*y[n]以及类似地(4)kxx=x*[-n]*x[n]在等式(4)中,x*是x的复共轭。在(3)中利用(4),得到计算关系:Gxx(θ)=|DFT((x*[-n]*x[n])w[n])|然后可以为每个窗口(n)计算主频率:fLd[n]=argmax(GLL(θ))|θ∈[2,30]Hz(5)fRd[n]=argmax(GRR(θ))|θ∈[2,30]Hz(6)并且然后可以计算EMG功率:然后可以计算在纺锤频带中的功率:系统100还包括复杂度模块116。利用上述“景观”类比,复杂度模块116直接确定睡眠的景观,而其它模块找出特定的地标。睡眠可以被感知为清醒意识的可逆变化。随着大脑下降到睡眠更深的状态,大脑的可唤醒度降低。一般而言,睡眠期间大脑的神经功能与清醒比较降低(尽管在REM睡眠不是这样)。同时,清醒和REM睡眠的状态以在EEG失步(desynchronization)中表现出的添加同步的缺少为特征。随着可唤醒度降低,大脑“安静下来”。将在本文中示出,测量神经活动的复杂度将导致确定睡眠阶段。一个要被处理的迫切问题是如何表征大脑过程的复杂度。科学中的复杂度以多种不同的方式进行测量。熵是一种可能的衡量,但是它存在问题:虽然最小熵是同步状态和低复杂度的反映,但是对于绝对随机性的状态达到最大熵,绝对随机性(尽管它们的复杂外形)实际上不等同于复杂度。特别地,随机性不等同于复杂度。例如,关于建立人体的信息(即,DNA)被编码在我们的基因中。核苷酸碱基的随机模式将可能不会导致任何工作的或可行的物种,而某种特定程度的排序将创建不同的生命形式。这给出了复杂度存在于有序和完全无序之间的某个地方的指示。表征复杂度的另一种方式是通过找出可以准确描述对象的最短代码。如果具有冗余序列TICTOCTICTOCTICTOCTICTOC,则这可以容易地通过伪代码:“重复TICTOC4次”表征。更复杂的序列将需要更复杂的伪代码。EEG可以被认为是大脑活动和噪声的总和。噪声不携带关于大脑的状态的信息,并且理想地,我们的复杂度测量应该忽略噪声。因此,有效的复杂度将测量EEG中规律性的复杂度,并且忽略噪声部分。在其中噪声相对于信号小的情况下或者如果有可能去除或分离噪声以与信号单独工作(或者两者兼而有之),则这是可能的。下一个问题是如何找出EEG中的规律性。为此,噪声可以被认为是小的或统计上无关的。为了解决它,使用了类似于数据压缩的Lempel-Ziv方法的方法。特别地,对于每个历元,找出允许重新产生全部数据(无损压缩)的最小描述符长度。为了做到这一点,必须建立随机变量zx,tx。然后定义找出时间序列的过零点的有序集合的算子:zx=Zero(x)tx={zx[n]-zx[n-1]}并且建立具有5ms分辨率的持续时间tx的字典。我们建立持续时间集合:T={fs-1,2*fs-1,3*fs-1....256*fs-1}具有1秒的持续时间的小波将对应于具有值1的元素;在每一步骤中,tx序列的元素通过发射与T的元素相关联的二进制代码被编码,其中T的元素与tx的元素匹配并且向集合T添加与我们在T中已经有的相比长1个的tx的元素的扩展序列(两个元素,三个元素……)。该过程继续,直到集合T不能进一步增长,并且我们具有满的集合T。在每一步骤中,取决于在那个特定步骤中的T的基数,我们利用比特数N编码数据:2N(t)>=card(T(t))代码的长度取决于编码元素的冗余。有规律的模式将被更高效地编码,并且因此产生较短的代码。通过为相同量的数据测量代码的大小(一个历元=30秒),可以获得关于数据和大脑功能的复杂度的信息。tx的元素被编码最长序列的二进制代码取代。复杂度模块在睡眠图的产生中具有核心作用。在一些实施例中,可能存在可被利用的另一个方面。具体地,有可能利用振幅和时域两者执行双复杂度分析。上面概括的描述指时域复杂度。振幅复杂度将把振幅缩放在范围[0-255]中并且应用相同的过程来估计振幅复杂度。以这种方式,可以获得可添加一些额外信息并且在某些情况下会有帮助的复杂度的另一种测量。但是,这种附加的方面会进一步使分析复杂,而且是不必要的。系统100还包括EMG分析器120。EMG分析器120估计骨骼EMG,主要为了帮助分离REM状态。单独的EMG估计可以在频谱分析器模块114中在颞肌上执行。具体地,EMG张力可以利用3秒的分辨率来估计。我们然后建立EMG信号的零导数集合:Zx=Zero(Demg),其中,我们向EMG信号(emg)应用在DPA部分中定义的导数算子(D和Zero)。EMG_CHIN[n][k]=median({emg[Zx[i]-emg[Zx[i-1]|Zx[i]>3*k*fs,Zx[i]<3*(k+1)*fs],k<eplen/3})对历元n和分段k的EMG的估计值是由信号的一次导数的零值界定的分段的中值。系统100还包括REM/SEM检测器122。在进入REM/SEM检测器122之前,数据可以利用带通滤波器进行滤波,带通滤波器例如具有通带边界(0.5,10Hz)的滤波器和在预处理器110中的陷波滤波器(如以上所描述的)。示例性REM/SEN密度估计器122的框图在图9中更详细地示出。滤波器在创建零均值时间序列。双边分割在左EOG信号和右EOG信号上执行同时分割,并且产生候选小波,如在图10中所示。空间滤波器分析信号的场,并且如果不是眼部原点,则丢弃候选小波。用于分割的输入时间序列都是零均值。我们建立时间序列:A[n]=loc[n]-roc[n]其中我们使用通道标签来表示从具有相同名称的通道获得的时间序列(例如,loc[n]表示左眼电图的第n个样本)。我们定义一些常量:MIN_REM_A=30uVMIN_REM_T=140ms我们定义候选小波wave[i]作为索引的凸集:小波的顶点是由顶点算子提取的索引:vertex(x,wave[i])=(x[wave[i]]>0)*argmax(x[wave[i]])+(x[wave[i]]<0)*argmin(x[wave[i]])x={eogL,eogR}在以下的文本中,为了简化记号,应当理解,当从左侧信号估计时,顶点将具有vertex(eogL,.)的形式,并且我们将简写为vertex(.)。这同样适用于开始和结束的小波算子。在以上等式中,顶点算子为索引集合wave[i]提取集合x的顶点。对于每个候选小波,我们确定每一侧上的噪声:我们建立ndx集合:其中x={loc,roc}定义:NoiseL[i]=eogL[vertex(wave[i]]-eogL[start(wave[i])]>0*max(|min{eogL[k]-eogL[k-1]|k∈[start(wave[i]),vertex(wave[i])}|,|max{eogL[k]-eogL[k-1]|k∈[vertex(wave[i]),end(wave[i])}|+eogL[vertex(wave[i]]-eogL[start(wave[i])]<0*max(max{eogL[k]-eogL[k-1]|k∈[start(wave[i]),vertex(wave[i])},|min{eogL[k]-eogL[k-1]|k∈[vertex(wave[i]),end(wave[i])}|))NoiseR[i]=eogR[vertex(wave[i])]-eogR[start(wave[i])]>0*max(|min{eogR[k]-eogR[k-1]|k∈[start(wave[i]),vertex(wave[i])}|,|max{eogR[k]-eogR[k-1]|k∈[vertex(wave[i]),end(wave[i])}|+eogR[vertex(wave[i]]-eogR[start(wave[i])]<0*max(max{eogR[k]-eogR[k-1]|k∈[start(wave[i]),vertex(wave[i])},|min{eogR[k]-eogR[k-1]|k∈[vertex(wave[i]),end(wave[i])}|))计算:Twave[i]=end(wave[i])-start(wave[i])Twave[i]是第i个候选小波的持续时间;小波的进一步选择被应用如下:对于REM,我们抽取波集合{wave[i]}:我们建立场:source[i]=argmax(eegL(wave[i]),eegR(wave[i]),eogL(wave[i]),eogR(wave[i]))>2我们还抽取集合wave[k]:wave[k]=wave[k]*source[k]当source[k]=0时,wave[k]被删除。在这时,我们具有带正确的相对极性和场的一组小波。这些小波表示在睡眠的觉醒和REM阶段期间REM的总和集合。每个历元具有时间的集合{REMj},其中发生REM。这些时间对应于:REMi=vertex(wave[i])相同的过程被用来检测慢速眼动(SEM),其中具有两个小变化:我们用MIN_SEM_T替代MIN_REM_T并且在算法中的任何位置插入小波对称的条件:vertex(loc,wave[i])-start(loc,wave[i])<C*vertex(roc,wave[i])-start(roc,wave[i])vertex(roc,wave[i])-start(loc,wave[i])<C*vertex(loc,wave[i])-start(roc,wave[i])MIN_SEM_T=600msC=1.5整个研究具有一组REM集合;一个REM集合用于每个历元“j”{REMj},REMj是在历元“j”中的一组REM。REM密度然后可以取决于意图以多种方式来估计。在一种情况下,取决于REM片段的长度,可变持续时间的滚动窗口可以被使用。设置M=1,我们得到每历元的REM计数。设置:这将设置M转换为最大的可能值,使得该组REM历元是凸的。在这种情况下,我们得到每REM片段的平均REM计数,其中REM片段的持续时间可以是一个和上百个历元之间的任何值。在历元k对应于REM阶段的情况下,StageREM(k)是1,否则为0。系统100还包括阶段划分器130。阶段划分器130的一种实施例在图11中更详细地示出。对阶段划分器130的输入是包含历元描述符的状态向量的时间序列(参见图5和11)。state[i]表示历元“i”的状态向量。复杂度cmplx[i]表示可以编码历元并且允许在没有任何损失的情况下进行再现的最短代码的长度。在图11中,可以遵循执行阶段划分所需的操作。这个模块将被概括地描述并且然后对每个模块进行详细的描述。由于患者可变性和可变的噪声环境,分析针对每个患者进行自动校准。因此,这些技术可能不会一般地呈现实时的方法,但是可以预期对这种实时应用进行方法的修改。患者的意识状态是连续的,而在临床实践中使用的睡眠阶段是离散的。打破连续变为离散状态需要设置状态边界。我们将参考如端点(End-Point)检测的确定这些边界的过程。有时确定端点并不简单,并且会表示误差的来源。EMG解释器134确定用于对分类模棱两可的状态或短瞬态有用的觉醒、睡眠和REM的代表性EMG水平。REM复杂度模块136根据复杂度建立REM状态的平台期并利用来自EMG分析器的信息建立REMEMG水平。在建立了REMEMG和REM复杂度之后,然后确定REM端点(即,利用检测REM端点模块138)。在确定了REM端点之后,为了检测没有检测到的REM的REM片段,可以然后基于目前为止检测到的REM片段合成理想的REM140。在REM片段已被识别之后,我们进入阶段划分循环142并且利用先前检测到的端点逐历元地执行整个研究的阶段划分。估计端点模块132对于阶段划分器130通常很重要,并且在这一点处的误差对于阶段划分器130的性能会是灾难性的。输入状态向量是准确的和非常可靠的。确定端点可以是阶段划分的关键步骤。虽然复杂度是连续患者状态的准确连续反映,但是为了与使用离散状态的睡眠阶段划分的当前实践建立一致性,准确地确定端点是重要的。在图12A和12B中,可以看到如由人类评审员确定的睡眠阶段的相关性(图12A)和利用本文的教导估计的EEG的复杂度(图12B)。显然,根据本文教导产生的EEG遵循由人类评审员标记的阶段。这个模块建立阶段W-S1、S1-S2和S2-S3之间的边界。虽然可能不知道用于每个患者的确切端点,但是一般而言端点相当稳定,其中具有一些例外情况。为了包括例外情况,在一些实施例中,可以修改技术来获得跨年龄组有用的普遍性以及治疗方案和条件。端点计算通过找出确定地落入睡眠期间的时间点开始,我们称那个历元为epend。epend={min(i)|cplx[i]<DB∨cplx[i]<cplx[deepndx]+0.02;i∈[1,N];deepndx=argmin(cplx[i]=□0.1{cplx[i]})DB=0.76。接下来,我们检测W-S1边界。经验观察使我们得出结论,从epend向后看,我们在睡着之前设置最高局部最小值作为用于W的最小特征复杂度。接下来,我们检测S1-S2边界。这里,我们有两种情况或类别的受试者或患者:阿尔法发生器的情况和不是阿尔法发生器的情况。阿尔法发生器是在EEG上具有足够的阿尔法活动以帮助基于阿尔法区分觉醒状态的单独的专利。对于阿尔法发生器,存在标志着基于主频从S1-S2的过渡的里程碑。复杂度急剧下降并且主导性的节奏从高于7Hz落到低于7Hz。在图14中,我们注意在B处从S1-S2(B)的过渡和W-S1(A)。过渡的特征是主频从非常低到高于7Hz的切换。我们称这个区域为双稳态(在两种状态之间切换)区域。一旦状态安定下来,双稳态消失并且其中一个状态“觉醒”或“S2”变为清晰的模式。具有低于5Hz主频的区域是S2并且高于5Hz的是S1。但是,对于不是阿尔法发生器的患者,另一个机制被用来区分觉醒状态。首先,我们确定其中在睡眠开始之前在beta从最后一个最大值下降到1/2(参见图15中的点A)之前beta具有局部最大值的点。S1-S2过渡对应于处于在点beta0.5和S3的上边界之间复杂度的最小负变化0.008/历元的复杂度的值。睡眠的开始被认为是在边界S1/S2的水平之下的信息内容(复杂度)中的最早下降。S2-S3边界经验上被确定为与在排除当患者醒着时的时间段的整个睡眠记录期间相对于中值增量(delta)增加20%的增量的历元概率对应的复杂度的98百分比。我们建立与相对于睡眠中值(C)增加20%的增量对应的历元增量估计(D)和历元复杂度的集合。D={delta[i];cplx[i]<WS1}C={cplx[i]|delta[i]>0.2+□0.5D}□p表示等级(rank)p集合算子。p=0.98*card(C),S2S3=□pC在此时,我们已估计所有必要的边界(WS1,S1S2,S2S3)。EMG解释器模块134根据以下算法分析所有通道(A1,A2,CHIN1-CHIN2)上的EMG活动,并且输出用于觉醒(W)、非REM(NREM)和REM睡眠(REM)的代表性水平的骨骼肌张力:wemgL=□0.5{emgL[i]|cplx[i]>WS1}wemgR=□0.5{emgR[i]|i<argmin(cplx[i]>WS1)}wemgC=□0.5{emgC[i]|i<argmin(cplx[i]>WS1)}我们认为睡眠在其中第一次cplx[i]<S1S2的历元处开始。同时,我们计算觉醒期间的占主导的阿尔法:alphaWL=mode{alphaL[i]|i<onset}alphaWR=mode{alphaR[i]|i<onset}alphaWX=mode{alphaX[i]|i<onset}slemgL=mode{emgL[i]|cplx[i]<S1S2}slemgR=mode{emgR[i]|cplx[i]<S1S2)}slemgC=mode{emgC[i]|cplx[i]<S1S2)}emgremL=□0.5{emgL[i]|cplx[i]<S1S2,emgL[i]<0.8*wemgL}emgremR=□0.5{emgR[i]|cplx[i]<S1S2,emgR[i]<0.8*wemgR}emgremC=□0.5{emgC[i]|cplx[i]<S1S2,emgC[i]<0.8*wemgC}studyfmodeL=mode{domfL[i]|cplx[i]<S1S2}studyfmodeR=mode{domfR[i]|cplx[i]<S1S2}studyfmodeX=mode{domfX[i]|cplx[i]<S1S2}REM复杂度模块136估计REM睡眠的复杂度(信息)。首先,基于由EMG解释器建立的最大REMEMG水平和与快速REM的检测相关联的复杂度,执行初步REM边界检测。接下来,针对最小EMGREM片段递归地测试候选者,并且将删除具有大部分不同EMG的片段。最高密度的REM将用作REMEMG和REM复杂度的健壮代表。通过找出具有非零REM密度的历元并且当或者骨骼EMG张力增加或者由于出现纺锤或复杂度相对于从该片段开始的复杂度摆动大于2%时结束,建立REM边界。REM密度计算本质上是在第一个和最后一个REM历元之间的窗口中的平均REM计数。重要的方面是单独的REM针对与REM重合或REM后续的潜在的唤醒进行验证。这是必要的,因为该组原始检测到的REM或者对应于觉醒、REM或者对应于唤醒。布尔函数检查是否在频带中存在在W减1Hz期间的高于阿尔法的功率跳跃(powalpha[t]):isArousal[i]=(t-REMi<3fs)∧powalpha[t]>max{powalpha[k]|k∈[t-10,t-6]}start[i]=i|RD>0∧emgC[i]<k*emgremC∧cplx[i]<WS1∧(emgC<0.8wemgCVcplx[i]<S1S2+0.02)end[i]=min(j)|RD=0∧(emgC[j]>k*emgremCV|cplx[j]-cplx[start[i]|>0.02)第i个REM片段边界是:接下来,我们删除具有高骨骼张力的REM片段:REM[i]={REM[i]|□0.5{emgL[i]|start[i]<i<end[i]}<2*minemgL∧□0.5{emgR[i]|start[i]<i<end[i]}<2*minemgR∧□0.5{emgC[i]|start[i]<i<end[i]}<2*minemgC}cplxREM=□0.5{cplx[k]|k∈∪i[start[i],end[i]]emgremL=□0.8{emgL[k]|k∈∪i[start[i],end[i]]}}emgremR=□0.8{emgR[k]|k∈∪i[start[i],end[i]]}emgremC=□0.8{emgC[k]|k∈∪i[start[i],end[i]]}REM边界模块138是以上描述的REM边界检测的第二次迭代,但利用其中估计的细化参数。边界利用在REM睡眠期间的条件或窄信息(复杂度)摆动进行调整,注意集合的凸度如下:K=1.6;在“合成理想的REM模块”140中,我们具有多个检测到的REM片段,并且我们正在试图检测由于空REM密度或者由于各种原因(例如:单侧松的EOG电极)检测REM失败而可能还没有被检测到的REM片段。这类似于估计REM复杂度,但是因为我们此时通常确信REM集合是准确的,因此对EMG值具有更严格的规则并且无需递归。阶段划分循环模块142然后逐历元进行并且输出相应的阶段。布尔向量的元素中只有一个是非零的。stage[i]向量的元素是布尔函数。第i个REM片段边界是:布尔函数:如果历元数字落在具有边界REM[i]的第i个REM片段的边界内或者复杂度在从理想的REM复杂度不超过1%频带内并且骨骼肌张力特征化为REM,则历元I将被阶段划分为REM。同时,我们排除暂时的状态,即复杂度必须是静态的并且必须存在至少一个具有非零REM密度的历元。布尔函数的其余部分是:s3[i]=(cplx[i]<S2S3)s4[i]=(cplx[i]<S3S4)w[i]=(cplx[i]>WS1)*(emgL[i]>k*wemgL+emgR[i]>k*wemgR+emgL[i]>k*wemgL≥2)s2[i]=(cplx[i]<S1S2)s1[i]=(cplx[i]>S1S2)讨论下面给出的是我们107个成年患者和25个青年患者(年龄低于18岁)的测试结果。由于可用的不同患者组,结果被以这种方式分组,但是利用加权平均,考虑组的历元的相对数量作为权重,整体值可以容易地被计算出。从表(表1-10)中很清楚,关于一致性的结果紧紧围绕80%分组。特别地,整体灵敏度逐历元一致性是比80%好。每阶段整体灵敏度一致性是大约80%。检测器灵敏度总TP总FP总FN总历元REM0.866887209726232212672SD0.783615125344534612672SL0.83614552051093102012672觉醒0.775216188343454612672表1:集合ADC(14个患者)的结果。整体一致性81%。表2:集合ADD(12个患者)的结果。整体一致性82%。检测器灵敏度总TP总FP总FN总历元REM0.80061110481912619708SD0.7784557662852189708SL0.810006440478710339708觉醒0.81496516126153669708表3:集合LFT(10个患者)的结果。整体一致性80%。检测器灵敏度总TP总FP总FN总历元REM0.82356850461340108136442SD0.8087562660150962936442SL0.790137167432555444736442觉醒0.78821146001989123636442表4:集合SFRV(41个患者)的结果。整体一致性80%。检测器灵敏度总TP总FP总FN总历元REM0.840122165040231411319SD0.824924107937422911319SL0.8116995384751124911319觉醒0.774399109558431911319表5:集合SFR(13个患者)的结果。整体一致性81%。表6:集合SLV(10个患者)的结果。整体一致性82%。检测器灵敏度总TP总FP总FN总历元REM0.9273625253496479SD0.883756593263786479SL0.7649523193577146479觉醒0.86625418202492816479表7:集合SL(7个患者)的结果。整体一致性83%。检测器灵敏度总TP总FP总FN总历元REM0.862003268693643015596SD0.885948324766941815596SL0.76333255541320172215596Wake0.62118395622858315596表8:集合KCB(15个患者)的结果。整体一致性80%。检测器灵敏度总TP总FP总FN总历元REM0.76583511971983666227SD0.9628321088480426227SL0.76141623015507216227觉醒0.5722662931202196227表9:集合KD(6个患者)的结果。整体一致性78%。表10:集合KT(4个患者)的结果。整体一致性88%。除了逐历元的统计之外,最终报告参数的误差被量化为逐历元误差的结果。取决于什么是更相关的,误差用百分比误差或者绝对误差描述(例如,延迟中的误差是绝对误差,而TST中的误差是相对误差)。生成下面描述的误差直方图来通知关于样本中的误差分布。在图17中,观察到80%的情况具有在+/-10历元内确定的睡眠开始。在图18中,观察到REM延迟在65%的时间是在+/-10分钟内并且85%的情况是在+/-25分钟内。在图19中,注意到深睡眠的开始在超过90%的时间被准确地确定(0延迟)。睡眠效率确定(图20)中的误差在超过90%的情况下不到10%。在研究中,全部深睡眠中的误差在107种情况中的104种当中小于3%。LS误差是由于S1和S2中的误差,并且通常由REM边界和DS边界中的误差引起。LS中的误差在超过75%的情况下少于10%。全部NREM睡眠在超过95%的情况下被估计好于80%(图23)。REM误差在超过80%的情况下少于20%(图22)。全部睡眠时间(TST)在90%的情况下被估计具有少于10%的误差(图25)。在开始之后的觉醒在90%的情况下被估计具有少于10%的误差(图26)。基于这些结果,相信如本文所描述的系统和方法能够执行无人看管的睡眠诊断。应当注意,在对睡眠诊断的当前“黄金标准”(即,有经验的多导睡眠图制作者(polysomnographer)以他或她最好的能力应用一组相对任意的规则)的明显对比中,如本文所描述的系统和方法往往具有非常清楚地定义的标准并且应该从一种情况到另一种情况具有相对好(并且实际上潜在地完美)的可重复性。此外,根据这些教导的系统和方法可以具有客观性的优点,而人类评分员更易于受到特定的睡眠架构如何表征群聚(cluster)的变化无常(vagaries)的影响。因此,本申请的教导趋于提供真正客观的算法,同时保持与人类评分所能提供的最好情况的高(但不完美的)相关的优点。可以预期,随着时间的推移,本文描述的技术会变得被广泛采用,并且具有成为用于睡眠诊断的事实标准的潜力。本文的一些教导会导致优于常规睡眠诊断技术的一个或多个优点,诸如简化的患者设置、方便患者、睡眠确定测试的显著成本减少、允许在患者的家中实现、允许患者在测试期间在家里睡眠、不需要患者离开工作几天时间、对于患者没有或减少了旅行开销、简化的实验室设置和实验室成本、降低医疗保健系统的成本、没有或减少用于实验室可用性的等待时间、以及更广泛的人群覆盖。这些优点中的至少一些可能与以上相对于图2描述的新电极布置模式有关并来自能够根据新电极数据估计睡眠图的技术。具体地,如在图2中所示,在头皮上不再有电极(如与常规系统相比),而脑电极可以被简单地夹到患者的耳朵上(并且可以是无线的),操作容易由患者在几秒钟内无人看管地执行(如与需要利用胶带和在头皮上的电极精确定位的测量的标准方法相比)。作为对照,电极布置的常规操作由于电极阻抗的考虑和在其中电极必须被应用的区域中有毛发而耗时。本文的教导可以为患者提供一个或多个优点。例如,患者可以无需经历长时间的不方便的设置、可以无需离开家睡觉、没有由于实验室预约而需的等待时间、不必离开工作几天时间、并且没有患者否则可能承担的旅行开销。在一些情况下,本文的教导可以提供至少一个其它好处,即提高的安全性。特别地,医师时常识别存在的威胁并且让政策制定者实施监管措施来减少相关联的风险。例如,呼吸病学家带领提高对吸烟威胁的意识,并且促进政策制定者实施减少吸烟的措施的过程。通过类似地认识睡眠不足和嗜睡日益成为威胁和成为安全风险,可以实施新的政策来帮助满足相应的挑战。利用如本文所描述的一些系统和方法来跟踪遵守,强制执行这种新政策是可能的。例如,在昏昏欲睡时驾驶会像在饮酒后驾驶一样危险。具有可以在驾驶期间自动监测瞌睡的系统会极其有利。在另一种实施例中,本文的教导对检测诸如由于酒精损伤或使用药物导致的其它形式的精神损伤可能是有用的。在一些情况下,这可以通过提供差分复杂性的至少一些最小水平的实时或基本上实时的测量来完成。例如,损伤会通过失去警觉性体现自身。诊断系统可以实时或基本上实时地测试车辆的驾驶员。如果检测到某种损伤,则诊断系统可以警告驾驶员或采取其它合适的行动(即,禁用车辆、通知权威机构,等等)。类似于“黑盒子”飞行记录器,诊断系统可以被用作车辆中的记录器来记录在旅行期间的大脑活动和给出警觉水平的指示,并且潜在地警告驾驶员操作车辆是不安全的。在一些情况下,这些警告可以被记录。一般而言,本文的一些教导对帮助实现用于减少与被打扰的睡眠有关的经济、社会、健康和安全问题的策略会是有用的。公共政策已帮助减少由于使用酒精导致的撞车死亡的风险。类似地,瞌睡会是严重的风险因素,并且应当开发政策和技术手段来检测和限制昏昏欲睡的驾驶员操作汽车。根据本文的教导,基于物理原则产生睡眠图的新方法可以是可能的。利用睡眠医学的常规方法,不可能在患者的家中执行睡眠诊断。但是,本文描述的系统和方法可以允许睡眠的大脑方面的调查,并且为在患者家中进行完全无人看管的PSG测试打开大门。睡眠是我们生活的非常重要的方面并且健康的睡眠是个人总体健康中重要的组成部分。目前,睡眠健康很大部分被家庭实践忽略,并且当务之急对此改变。本文描述的一些系统可以允许实施由家庭实践发起的、在患者家中的、无需睡眠实验室的、无人看管的睡眠测试。由于没有诊断出就通过的与睡眠相关的问题的大发生率,这是有用的,因为人群的显著部分不经历睡眠实验室。一般而言,家庭医疗实践应该在检测睡眠有关问题中是防御的前线。对大多数医学专家来说,患者只在已做出来自家庭医生的转诊之后才访问专家。一方面,家庭医生没有针对初级睡眠诊断进行常规地装备并且一大群患者未被治疗就通过,具有许多长期的健康后果(发展心脏问题、阿尔茨海默病(Alzheimer’s)病等)。本文描述的系统和方法具有在初级诊断中带来典范转移(paradigmshift)、对人群的总体健康具有很大影响的潜力。例如,本文所描述的系统可以允许睡眠实验室以显著降低的成本覆盖更大数量的患者。这可以通过与如可以利用“快道”研究获得的可比较的信息(即,没有任何具体信息来建议例如完整的EEG蒙太奇是必需的)胜任地完成。标准睡眠实验室使用然后会成为用于复杂和不寻常的患者/情况的资源,而患者的大多数测试将在自己家中完成。患者通常带着瞌睡和/或疲劳的抱怨来到睡眠诊所。本文描述的一些系统将等同于实验室中过程(例如REMvsNREM窒息速率),并且还可以允许更好地评估失眠,其中失眠一般还没有经过PSG研究,这是因为感觉成本-效益比不是“物有所值”。这会为更好地诊断(包括抑郁症的误诊)和功能的长期跟踪打开大门。在还有的另一种实施例中,本文的教导可以允许患者的手术前筛选,以便预测在麻醉期间和之后潜在的问题。在睡眠和麻醉之间存在密切关系是众所周知的事实。临床研究已显示,在睡眠期间经历呼吸问题的患者具有在施用各种麻醉剂方案期间或之后发展并发症的风险。有迹象表明,由于与在麻醉期间和之后的问题关联的显著发病率和死亡率,因此在睡眠期间呼吸问题的手术前筛选将在不久的将来成为护理的标准。当前,通过在睡眠实验室中可用的昂贵测试,把呼吸的大脑方面加以考虑的唯一解决方案是可能的。此外,对患者存在成本,因为旅行和可能离开工作几天。睡眠实验室将无法测试接受手术的大量患者。本文的系统可以为家庭实践提供自动睡眠诊断。GP可以做睡眠研究,无需关于睡眠的深度知识(这同样适于对睡眠诊断感兴趣的其他专家,例如,呼吸病学或精神病学专家)。系统然后可以产生类似于血液学中的血球计数的报告,包括临床睡眠参数,并且如果这些超出范围,则他/她可以将患者转诊到睡眠专家。由于潜在地用于驾驶员、需要提高的警惕的安装操作员以及误差会导致灾难性后果的情况的瞌睡、警告和记录风险水平,本文的系统对于检测损伤是有用的。另一方面,由于观察到每年10天测得的增加的睡眠唤醒预测着阿尔茨海默病,因此本文的教导是有用的。这个系统可以提供成像诊断的低成本的替代方案,从而便于筛选测试。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1