用于治疗递送的光学触发的制作方法
本公开涉及可植入式医疗装置系统以及用于使用光学触发式治疗递送装置来递送治疗的相关联方法。
背景技术:
可植入式起搏器和复律除颤器(ICD)可用于向患者的心脏递送电刺激治疗,如心动过缓起搏、心脏再同步治疗(CRT)、抗心动过速起搏和心脏复律/除颤电击。医疗装置技术进步导致产生了越来越小的可植入式装置。最近,提出了可被直接植入心脏腔室中的无引线心内起搏器。去除静脉引线、心内引线具有若干优点。例如,可以消除与从皮下起搏器袋经静脉延伸至心脏中的引线相关联的干扰所导致的复杂性。在使用没有静脉引线的心内起搏器时,消除了其他复杂性,如“Twiddler综合征”、引线断裂或引线与起搏器连接较差。
然而,在控制心内起搏器与另一心脏腔室中发生的起搏或感测事件同步递送起搏脉冲方面出现了新的挑战。心脏再同步治疗(CRT)是在一个心脏腔室中的感测或起搏事件之后以预定时间间期在另一个心脏腔室内递送起搏脉冲的起搏治疗的示例。CRT是一种针对心力衰竭患者的疗法,其中一个或多个心脏腔室被电起搏以便恢复或改善心脏腔室同步性。改善的心脏腔室同步有望缓解心力衰竭的症状。然而,实现CRT的积极临床效益可能取决于若干治疗控制参数,如用于控制起搏脉冲递送的定时间期,例如房室(AV)间期和/或室间(VV)间期。AV间期控制心室起搏脉冲相对于心房去极化(固有或起搏)的定时。VV间期控制一个心室中的起搏脉冲相对于另一个心室中的起搏或固有的感测事件的定时。起搏可以在右心室(RV)和/或左心室(LV)中被递送以便恢复心室同步性。
技术实现要素:
总体而言,本公开涉及一种包括治疗递送装置和感测装置的可植入式医疗装置(IMD)系统以及用于触发所述治疗递送装置递送治疗的相关联方法。所述感测装置感测生理信号从而确定需要治疗并且生成控制信号,当需要由所述治疗递送装置进行治疗递送时所述控制信号被传递至光学发射装置。所述光学发射装置发射由所述治疗递送装置检测的光学触发信号。响应于检测到所述触发信号,所述治疗递送装置对治疗的至少一部分进行递送。
在一个示例中,本公开提供了一种用于自动递送治疗的医疗装置系统,所述系统包括:第一装置,所述第一装置被配置成用于感测生理信号并响应于所述生理信号而生成控制信号;光学发射装置,所述光学发射装置由所述第一装置控制用于响应于从所述第一装置接收到所述控制信号而发射光学触发信号;以及第二装置,所述第二装置包括用于接收所述光学触发信号的光检测器。所述第二装置被配置成用于检测所述光学触发信号并响应于检测到所述光学触发信号而向患者递送治疗。
在另一示例中,本公开提供了一种用于由医疗装置系统递送自动治疗的方法。所述方法包括:通过第一装置感测生理信号,响应于所述生理信号而通过所述第一装置生成控制信号,控制光学发射装置响应于所述控制信号而发射光学触发信号,由包括光检测器的第二装置检测所述光学触发信号,以及响应于所述光检测器检测到所述光学触发信号而向患者递送治疗。
在又另一示例中,本公开提供了一种存储有指令集的非瞬态计算机可读存储介质,所述指令集使可植入式医疗装置系统:通过第一装置感测生理信号;响应于所述生理信号而由所述第一装置生成控制信号;响应于所述控制信号而控制光学发射装置发射光学触发信号;由包括光检测器的第二装置检测所述光学洗护发信号;以及响应于所述光检测器检测到所述光学触发信号而向患者递送治疗。
本发明内容旨在提供对本公开中所描述的主题的概述。本发明内容并不旨在提供对附图和以下说明书中详细描述的装置和方法的独有的或详尽的解释。以下附图和说明阐述了一个或多个示例的进一步细节。
附图说明
图1A是包括光学触发式治疗递送装置的可植入式医疗装置(IMD)系统的概念图。
图1B是可以包括在用于触发光学触发式治疗递送装置的IMD系统中的感测装置的概念图。
图2A是概念图,展示了可以用于感测患者的心脏电信号并向患者的心脏提供治疗的IMD系统。
图2B是概念图,展示了根据替代性示例的IMD系统10’。
图3A和图3B是患者的解剖结构的截面视图,描绘了在图2A中所示的系统中所包括的光学触发信号发射装置的替代性配置。
图4A是概念图,展示了根据替代性示例的IMD系统。
图4B是概念图,展示了包括多个医疗递送装置的IMD系统。
图5是在图2中所示的可植入式复律除颤器(ICD)的一个实施例中所包括的电子电路的功能框图。
图6A是在图2中所示的系统中所包括的触发式起搏器的概念图。
图6B是根据替代性实施例的触发式起搏器的概念图。
图6C是图6A中所示的起搏器的截面视图。
图7A是图2A的根据一个示例的起搏器的功能框图。
图7B是在图7A的起搏器中所包括的光检测器的一个示例的图。
图8A是被示为心内起搏器的光学触发式治疗递送装置的概念图。
图8B是图8A中所示的起搏器的概念侧视截面视图。
图9A是起搏器的替代性示例的概念图。
图9B是图9A中所示的起搏器的概念侧视截面视图。
图10为根据一个示例的用于控制加治疗递送装置的方法的流程图。
图11为用于控制由心内起搏器自动递送的心脏起搏治疗的方法的流程图。
图12为根据一个实施例的用于控制加CRT的方法的流程图。
具体实施方式
在此公开了IMD系统及相关联技术,用于使用植入在一个位置处的感测装置感测生理信号并触发治疗递送装置向第二位置处的靶标患者组织递送自动治疗。所述治疗递送装置被由所述感测装置控制的发光装置所传输的光学触发信号触发以递送治疗。由分开的感测装置和治疗递送装置实现自动治疗递送,而不需要这两个装置彼此物理地连接。除了别的以外,去除IMD系统的感测部件与治疗递送部件之间的物理连接使得能够使用微创植入手术,减小了IMD系统部件的尺寸和/或去除了一些部件,如医疗引线感测能力、和治疗递送装置中的射频(RF)放大器和收发器。
如在此所使用的,“光学触发信号”是当将电子控制信号应用于光学换能器时所述换能器所发射的光学信号。所述光学触发信号是命令信号,由感测装置生成所述命令信号并使用光能作为通信手段通过发射装置将其发送至治疗递送装置。如在此所使用的光学触发信号并不是可以由光学传感器感测到的生理信号,如血氧饱和信号,所述光学传感器采集用于测量生理参数的光以便确定是否需要治疗。相反,所述光学触发信号是在已经做出需要治疗的决定之后所发射的由装置生成的控制信号。所述光学控制信号是用于控制治疗的定时的控制信号。
如在此所使用的“触发式治疗递送装置”是被所述光学触发信号触发用于向靶标患者组织递送治疗的装置。在此所述的示意性实施例中,所述治疗是电刺激治疗,如心脏起搏脉冲,但是还考虑了其他类型的治疗,如药物递送。
所述触发式治疗递送装置包括响应于经受所述光学触发信号而产生电信号的换能器或光敏部件。将所述电信号与触发信号检测阈值进行比较,并且当超过所述检测阈值时使所述治疗递送装置向患者的靶标组织递送治疗性刺激脉冲(或其他治疗)。因此,如在此所公开的“触发式治疗递送装置”并不是在对使用光学换能器所感测到的生理信号(如被测量以用于检测生理事件或条件的血氧饱和信号或其他随时间改变的光学信号)进行处理或分析的基础上做出递送治疗决定的。递送治疗的决定是由正控制所述发射装置发射所述光学触发信号的所述感测装置做出的。所述感测装置和所述治疗递送装置不需要彼此处于有线连接。
图1是包括光学触发的治疗递送装置的IMD系统2的概念图。系统2包括感测装置4、光学发射装置5、和治疗递送装置6。感测装置4能够感测生理信号以便确定何时需要治疗。感测装置4可能或可能不能够直接向患者递送治疗。感测装置4至少能够感测生理信号、基于所述生理信号确定需要治疗、并且产生被传递给发射装置5的控制信号3。在各个示例中,感测装置4可以是起搏器、ICD、ECG监测器、血液动力监测器、神经刺激器、药物泵、或其他IMD。
感测装置4与光学发射装置5处于无线通信或有线通信。感测装置4向发射装置5发送控制信号3,从而使发射装置5发射光学信号7。在图中,发射装置5被示为与感测装置4分开的装置,然而在一些示例中,发射装置5被结合在感测装置4中。在一些应用中,合并有发射装置5的感测装置可以被植入在治疗递送装置6的光学触发信号接收范围内的位置处(或者位于其外部)。在其他示例中,感测装置4和治疗递送装置6的物理位置可能相距太远或被高度反射性组织或光衰减性解剖结构所分隔开,所述高度反射性组织或光衰减性解剖结构会阻止治疗递送装置6从感测装置4对光学触发信号的可靠接收。在这些情形下,发射装置5位于与感测装置4间隔开的位置处,并且被定位成用于将所述光学触发信号可靠地传输至治疗递送装置6。
在各个实施例中,感测装置4可以感测用于确定需要治疗的具体应用中所使用的任何生理信号或生理信号的组合。此类信号可以包括但不限于电信号,如ECG(心电图)、EGM(心脏电描记图)、EMG(肌电图)、EEG(脑电图)、或神经动作电位。另外或替代性地,感测装置4可以被配置成用于感测机械或化学生理信号。感测装置4可以感测到的其他生理信号包括但不限于:血压信号或其他压力信号、光学信号(如用于确定血氧饱和或阻止氧饱和的光学信号)、声学信号(如心音)、活动信号、或姿势信号。
所述生理信号可以用于控制治疗递送装置6被触发以相对于所感测到的生理事件递送治疗的时间和/或基于由感测装置4所感测到的生理信号确定的状态或条件确定需要治疗递送。这样,感测装置4被配置成用于根据针对给定应用的程序化的治疗递送算法和治疗递送控制参数来确定需要治疗的时间。
当感测装置4确定到了递送治疗的时间时,控制信号3被传递给光学发射装置5。发射装置5可以通过医用引线物理地耦合至感测装置4,用于将控制信号3作为电信号传递至发射装置5。替代性地,发射装置5可以被配置成用于从感测装置4接收无线遥测通信信号,如使发射装置5发射光学触发信号7的射频(RF)命令信号。
治疗递送装置6包括光检测器8,所述光检测器可以包括导光性窗口和光电检测器或其他光探测部件。响应于检测到光学触发信号7,治疗递送装置6递送治疗,如一个或多个电刺激脉冲。
治疗递送装置6一般是被适配成植入靶标治疗递送位点的小型化装置。在一些应用中,目标治疗递送位点需要最小化的装置尺寸以避免复杂性、使患者不适最小化、和/或便于微创植入手术。这样,治疗递送装置6可以具有降低的用于感测生理信号、数据采集、RF或其他遥测通信的功能,或者可以正常存在于起搏器、ICD、神经刺激器或被配置成用于向患者自动递送治疗的其他类型的IMD中的功能。
例如,治疗递送装置6可以是具有沿着装置6的外壳定位的电极的经导管脉冲发生器。在其他示例中,携带一个或多个电极的短引线可以延伸自装置6。在下文更详细描述的示意性实施例中,治疗递送装置6是经导管心内起搏器,所述经导管心内起搏器被来自发射装置5的光学信号触发以递送一个或多个心脏起搏脉冲。如在此所使用的,“经导管”起搏器(或其他经导管装置)是这样的装置:可以通过导管或其他细长管状递送工具植入在目标位置处,以便将所述装置前进至所述目标位置,而不必在目标位置具有直接视线。治疗递送装置6并不限于心脏起搏器。装置6可以具体化为其他类型的电刺激治疗递送装置,如被配置成用于向任何可兴奋组织递送电刺激(包括中枢神经系统、外周神经系统、平滑肌组织和/或骨骼肌组织)的装置。
而且,应认识到,被光学触发信号7所触发以递送治疗的治疗递送装置6并不限于电刺激治疗递送装置。在替代性实施例中,治疗递送装置6可以被配置成用于使用机械、光学、制药或其他治疗性装置递送其他类型的治疗。例如,治疗递送装置6可以是用于递送药物或生物制剂的流体递送装置。
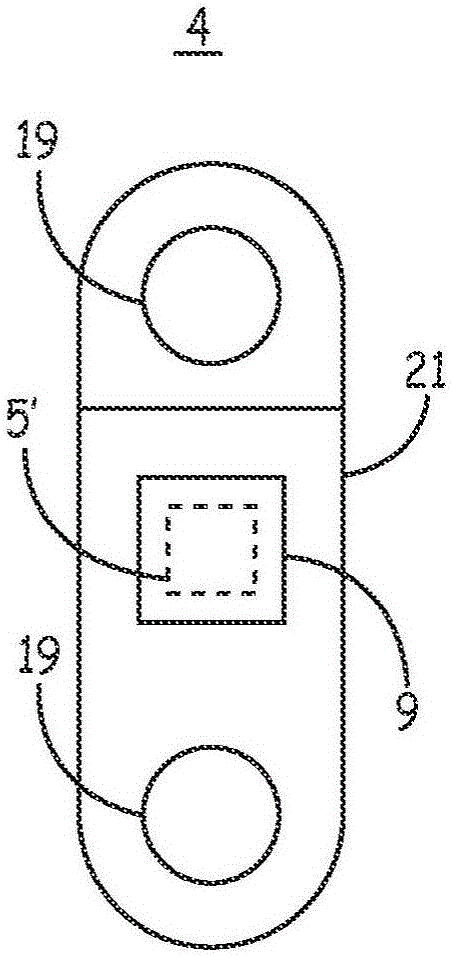
图1B是可以包括在图1A的用于触发光学触发式治疗递送装置6的IMD系统2中的感测装置4的一个示例的概念图。感测装置4可以或可以不包括治疗递送能力。在图1B的示例中,感测装置4是向治疗递送装置6发送光学触发信号以实现治疗递送的仅感测装置。“仅感测”装置是感测一个或多个生理信号从而确定需要治疗但并不向靶标患者组织直接递送治疗的装置。
感测装置4可以包括一对感测电极19,这对感测电极沿着导电外壳21的非绝缘部分。发射装置5’被设置为基于外壳的发射装置,所述基于外壳的发射装置沿着光学窗口9被定位于外壳21内。发射装置5’可以包括一个或多个通过窗口9和相邻组织向治疗递送装置6传输触发信号的光学换能器。窗口9被密封在外壳21的开口内并且被配置成将发射的光学信号从发射装置5高效地联接至相邻组织。
在一个示例中,感测装置4可以皮下地定位于胸骨旁位置以感测患者心脏的ECG信号。治疗递送装置6可以是植入在心脏腔室的心内起搏器。感测装置4将光学触发信号从发射装置5’传输至治疗递送装置6,从而触发治疗递送装置6递送一个或多个起搏脉冲。以这种方式,无引线的心脏起搏系统被设置为包括两个尺寸最小化的可植入装置。
图2A是概念图,展示了可以用于感测患者12内的心脏电信号并向心脏26提供治疗的可植入式医疗装置(IMD)系统。IMD系统10包括心内起搏器100以及耦合至血管外除颤引线16的ICD 14。除颤引线16包括除颤电极24(可以是细长的线圈电极)、一对感测电极28和30(被展示为环形电极但可以是其他类型的电极)和光学信号发射装置18。光学信号发射装置18包括光学换能器,所述光学换能器被ICD 14控制发射光学触发信号以使起搏器100递送一个或多个起搏脉冲。
ICD 14被示为皮下地植入在患者12的左侧。连接到ICD 14上的除颤引线16从ICD 14居中地延伸到患者12的胸骨22和剑突20。在靠近剑突20的位置处,除颤引线16皮下地向上方弯曲或转动并延伸,基本上平行于胸骨22。除颤引线16可以被植入为使得引线16对于胸骨主体22的左侧或右侧横向地偏移,并且可以皮下地植入例如皮肤与肋骨或胸骨之间。取决于ICD 14的位置、电极24、28、和30和光学信号发射装置18沿着引线16的位置以及起搏器100的位置、或其他因素,除颤引线16可以被相对于胸骨22植入在其他位置或角度,或者被进一步定位于上方或下方。在其他实例中,可以将引线16植入在其他血管外位置处。在一个示例中,引线16可以被至少部分地植入在胸骨下位置或胸廓32内、胸腔内以及心包内或外,没有必要与心脏26直接接触。
除颤引线16被定位成使得除颤电极24与第二电极(如ICD 14的外壳15的一部分或安置在第二引线上的电极)之间的治疗向量基本上跨过心脏26的心室。在一个示例中,治疗向量可以被视为从除颤电极24上的点向ICD 14的外壳15(有时称为“罐”电极)或罐上的点延伸的线。在另一个示例中,可以沿着胸骨22安置除颤引线16,这样使得除颤电极18与外壳15(或其他电极)之间的治疗向量基本上跨过心脏26的心房。在这种情况下,系统10可以用于提供心房治疗,如治疗心房纤维性颤动的治疗。
光学信号发射装置18被定位成用于建立光学信号传输通道,所述光学信号传输通道并不过分地衰减从发射装置18向心内起搏器100中所包括的接收器或检测器传输的光学触发信号。例如,发射装置18的位置可以被选择为使得发射装置18与起搏器100之间的直接光学通道尽可能地避免高度反射性或光衰减性组织。当引线16被定位成在胸外时,发射装置18可以被定位成在剑突20下方近似所示的位置。在其他示例中,发射装置18相对于起搏器100被定位成用于建立高效光学传输通道,所述高效光学传输通道考虑了周围和中间组织的光学特性。
除颤引线16可以包括在引线16的远端处或朝向引线16的远端的附接特征29。附接特征29可以用于辅助引线16的植入和/或用于将引线16固定在希望的植入位置的圈、链环、缝合或其他附接特征。在一些情况下,除了或代替附接特征29,除颤引线16可以包括固定机构。例如,除颤引线16可以包括邻近电极30或接近发射装置18定位的缝线套管或其他固定机构(未示出),所述缝线套管或其他固定机构被配置用于将引线16固定在剑突20或下胸骨位置附近。固定机构(例如,缝线套管或其他机构)可以是与引线一体的或者可以在植入之前由用户加入。固定机构可以用于将发射装置18稳定地定位于(沿着肋间空间)剑突20下方、或其他期望位置从而防止发射装置18转动或偏移,由于身体组织的干涉或衰减,所述转动或偏移会导致触发信号错向或触发信号丢失。
尽管ICD 14被说明为植入在患者12的腋中线附近,但是也可以将ICD 14植入患者12的其他皮下位置处,如朝向腋后线在躯干上进一步向后、朝向腋前线在躯干上进一步向前、在胸肌区中、或在患者12的其他位置处。在ICD 14植入在胸部的情况下,引线16将顺着不同的路径,例如跨过上胸部区域并且沿着胸骨22向下。当ICD 14植入在胸肌区中时,所述系统10可以包括第二引线,所述第二引线包括除颤电极、以及可选地光学发射装置,所述第二电极沿着患者的左侧延伸,这样使得第二引线的除颤电极沿着患者的左侧定位,以充当用于对心脏26进行除颤的治疗向量的阳极或阴极。
ICD 14包括外壳15,所述外壳或罐形成保护ICD 14内的部件的气密密封件。外壳15可以围住一种或多种部件,包括处理器、存储器、发射机、接收机、传感器、传感电路系统、治疗电路系统以及其他适当的部件(在此通常称作模块)。ICD 14的外壳15可以由导电材料(如钛)或其他生物相容性导电材料或导电材料和非导电材料的组合形成。在一些情况下,外壳15充当与电极24、28、和30之一组合使用的电极(有时称作外壳电极或罐电极),以向心脏26递送治疗或以感测心脏26的电活动。
ICD 14可以包括用于接收引线16的近端连接器(未展示)的连接器组件13(有时称为连接块或接头)。连接器组件13包括引电器,通过所述引电器除颤引线16内的导体与在外壳15内所包括的电子部件之间进行电连接。取决于ICD 14的期望植入位置,光学发射装置18可以包括在连接器组件13和/或外壳15中,除了或代替用于向起搏器100传输光学触发信号的引线16所携带的发射装置18。例如,光学发射装置可以嵌入(例如,注塑)连接器组件中或包括在晶片级密封封装中,所述晶片级密封封装被并入连接器组件13中并耦合至馈通,所述馈通延伸至外壳15中用于从ICD内部电路接收控制信号。
引线16可以包括在引线16的近端处的连接器,如DF4连接器、分叉连接器(例如,DF-1/IS-1连接器)、或具有耦合至ICD 14的连接器组件13内的端口的至少一个引线脚的其他类型连接器。除颤引线16的引线体17可以由非导电材料(包括硅酮、聚氨酯、氟聚合物、其混合物、和其他适当的材料)形成,并且被成形用于形成一个或多个腔,一个或多个导体在所述一个或多个细长腔内延伸。
除颤引线16包括细长电导体(未说明),所述一个或多个细长电导体各自在细长引线体17内从除颤引线16的近端上的连接器向对应电极24、28和30以及发射装置18延伸。尽管除颤引线16被说明为包括三个电极24、28和30,但是除颤引线16可以包括更多或更少的电极。当除颤引线16的连接器连接到连接器组件13上时,对应的导体可以经由连接器组件13中的连接件(包括相关联馈通)电联接到ICD 14的电路(如治疗递送模块或感测模块,或触发信号驱动信号电路)上。
电导体将来自ICD 14内的治疗模块的电刺激脉冲传送到电极24、28和30中的一个或多个,并且将来自电极24、28和30中一个或多个的感测的电信号传送到ICD 14内的感测模块。从近端引线连接器延伸至发射装置18的电导体将控制信号引导至发射装置18,从而使发射装置18在适当的时间发射光学触发信号,以便使心内起搏器100向心脏26递送一个或多个起搏脉冲。
ICD 14可以经由一个或多个感测向量来感测心脏26的电活动,所述一个或多个感测向量包括电极28和30及外壳15的组合。例如,ICD 14可以使用电机28和30之间的、电机28和导电外壳15之间的、电极30与外壳15之间的或其任何组合感测向量获得心脏电信号。在一些情况下,ICD 14可以甚至使用包括除颤电极24的感测向量来感测心脏电信号,如除颤电极24与电极28和30之一之间的感测向量、或除颤电极24与外壳15之间的感测向量。
ICD 14响应于例如可以包括P波和R波的感测到的心脏电信号确定需要起搏治疗,并控制发射装置18基于所述确定来发射光学触发信号。可以根据程序化单腔室、双腔室或多腔室心动过缓或CRT控制参数其他心脏起搏治疗参数确定需要起搏脉冲。ICD 14还可以分析感测的电信号以检测心动过速(如心室性心动过速或心室纤维性颤动),并且响应于检测心动过速可以产生并向心脏26递送电治疗。例如,ICD 14可以经由治疗向量递送一个或多个除颤电击,所述治疗向量包括除颤电极24以及外壳15。
电极24、28、30和外壳15可以用于感测ECG信号,所述ECG信号用于控制ICD 14递送的R波同步电击的定时并且用于控制起搏器100递送的起搏脉冲的定时。在一些情况下,可以在由ICD 14递送除颤电击之前或之后递送一个或多个治疗,如抗心动过速起搏(ATP)或电击后起搏。在这些情况下,ICD 14可以产生并经由治疗向量递送起搏脉冲,所述治疗向量包括电极24、28、30和/或外壳15。替代性地,ICD 14可以使光学发射装置18发射触发信号,从而使当需要ATP或电击后起搏时以及需要心动过缓或CRT起搏治疗时起搏器100在合适的时间向心脏26递送起搏脉冲。
图2A中所展示的示例ICD 14在本质上是示意性的并且不应该被视为是对触发式治疗递送系统和本公开中所描述的相关联技术中所使用的感测装置的限制。例如,除了感测ECG信号之外,ICD 14可以包括电击治疗能力,仅仅不具有起搏治疗能力。在其他示例中,ICD 14可以耦合至不只一条用于感测ECG信号和/或向起搏器100发送触发信号的引线。在仍其他示例中,感测装置可以替代ICD 14(是不具有心脏复律/除颤能力的单腔或双腔皮下起搏器),或不具有治疗递送能力的仅感测装置,例如,如图1B中所示。这些感测装置中的任何一个可以耦合至基于外壳的电极和/或静脉、心内或血管外、心外引线所携带的电极,以便感测心脏电信号并确定触发起搏器100递送治疗的适当时间。
起搏器100是经导管心内起搏器,被适配成完全植入心脏腔室,例如完全植入RV、完全植入LV、完全植入心脏26的右心房(RA)或完全植入心脏的左心房(LA)。在图2的示例中,起搏器100定位于邻近LV的内壁以便提供左心室起搏。在其他示例中,起搏器100定位于邻近右心室的内壁以便提供右心室起搏。在其他示例中,起搏器100可以位于心脏26外或内的任何其他位置。例如,IMD 16可以定位在右心房或左心房的外部或内部,例如从而提供对应的右心室和左心室起搏。在其他实施例中,起搏器100可以具体化为用于在另一身体位置递送电刺激治疗的治疗递送装置。起搏器100在图2中被示为无引线装置。然而,考虑到的是,在其他实施例中,起搏器100可以耦合至延伸自起搏器100的引线,从而将治疗递送电极定位在离起搏器100间隔开的位置。
取决于植入位置,起搏器100可以被配置成用于向除心肌西外的治疗递送位点递送电刺激治疗。例如,起搏器100可以提供房室结刺激、脂肪垫刺激、迷走神经刺激、或其他类型的神经刺激。在其他示例中,系统10可以包括多个起搏器100,例如,以在多个位点递送电刺激治疗,如在针对多腔室起搏治疗的多个心脏强室内。
起搏器100能够产生电起搏脉冲,所述电起搏脉冲通过起搏器100的外外壳上的一个或电极被递送至心脏26。起搏器100包括光检测器,所述光检测器用于接收由发射装置18所发射的光学触发信号。响应于检测到光学触发信号,起搏器100递送一个或多个起搏脉冲。
在一个实施例中,起搏器100包括脉冲发生器,所述脉冲发生器被配置成用于在从发射装置18接收到光学触发信号时递送一个或多个起搏脉冲。起搏器100可以不被配置成用于感测心脏信号。心脏信号感测由ICD 14进行。ICD14通过引线16感测ECG信号,并通过由发射装置18在ICD 14的控制下发射的光学触发信号控制由起搏器100递送的起搏。
心内起搏器100可以不被配置成用于感测心脏信号。起搏器100可以单独地依靠来自发射装置18的触发信号用于控制起搏脉冲递送的定时,而不感测任何其他心脏电事件信号或任何其他生理信号。结果是,独立地递送CRT或与另一心脏腔室内发生的被起搏或感测事件同步的其他类型的起搏治疗的能力可能受到限制。为了将起搏器100的尺寸最小化,可以省略心脏信号感测和射频遥测功能,这样使得起搏器100包括脉冲发生器,所述脉冲发生器具有有限的存储器、处理、和其他针对治疗递送的功能。
在其他实施例中,起搏器100感测它被植入的心脏腔室中的EGM信号。由于起搏器100完全位于心脏腔室中,起搏器100所感测到的EGM信号将对其他心脏腔室内发生的P波和/或R波不那么敏感或不敏感。在过去实践中,皮下起搏器可以耦合至一条或多条引线,所述一条或多条引线将感测电极定位在多个心脏腔室中或沿其定位,这样使得可以对多个感测通道进行监测。通过监测多个感测电极,可以将协调的起搏脉冲以限定的时间间期(例如,AV或VV间期)递送至一个或多个心脏腔室。
由于起搏器100可以不具有或具有有限的感测能力,起搏器100对发生于其他心脏腔室中的事件是“盲目”的。递送CRT、双腔起搏、或其他多腔室起搏治疗可能需要在另一心脏腔室内(被感测或起搏)的事件之后以预定时间间期递送起搏脉冲。这样,发射装置18响应于ICD 14所感测到的ECG信号向起搏器10提供触发信号,从而使起由起搏器100以期望的时间间期相对于其他心脏腔室事件递送起搏脉冲。与ICD 14(用于感测生理信号从而决定治疗递送)组合的起搏器100(用于生成起搏脉冲)提供了递送各种治疗所需的功能,所述功能可能需要多个解剖位点之间的同步或协调,而在起搏器100与植入在分开位点的ICD 14之间没有物理连接。
图2A进一步描绘了通过通信链路42与ICD 14无线通信的编程器40。在一些实例中,编程器40包括手持式计算装置、计算机工作站、或网络计算装置。编程器40包括向用户呈现信息以及从用户接收输入的用户接口。应注意,用户也可以经由网络计算装置与编程器40进行远程交互。
用户(诸如内科医生、技术员、外科医生、电生理学家、其他护理人员、或患者)与编程器40进行交互以便与ICD 14通信。例如,用户可以与编程器40进行交互以便检索来自ICD 14的生理信息或诊断信息。用户可以与编程器400交互以对ICD 14进行编程,例如选择ICD 14的运行参数的值,包括用于控制光学触发信号发射装置18的参数,所述光学触发信号发射装置用于控制起搏器100。用户可以使用编程器40从ICD 14检索与心脏26的心律、心脏中随着时间的趋势、或者心律失常事件相关的信息。
如所指示的,ICD 14和编程器40经由无线通信来进行通信。通信技术的实例包括例如低频或射频(RF)遥测术,但也可以使用其他技术。在一些实例中,编程器40可以包括编程头部,该编程头部邻近患者的身体靠近ICD 14植入位点放置,以便改善ICD 14与编程器40之间的通信质量或安全性。
图2B是概念图,展示了根据替代性示例的IMD系统10’。携带光学信号发射装置18的专用引线62可以被设置为将发射装置18定位在最优位置以便向起搏器100传输光学触发信号。最佳位置将相对于起搏器100使发射装置60定位成使得光学触发信号以有待由起搏器100可靠地感测的足够强度和信噪比到达起搏器100。发射装置60与起搏器100之间的光学路径可以包括散射、吸收、反射或折射光学触发信号的组织。发射装置60的位置被选择为使得沿着路径的光学信号损失并不将触发信号的强度降低至起搏器100可检测的阈值水平以下。
发射装置60能够接收来自ICD 14的被沿着引线62引导的控制信号。在接收到所述控制信号时,发射装置60发射光学触发信号从而使起搏器100递送LV起搏脉冲。发射装置60可以具有其自己的电池,所述电池是可再充电的,这样使得LCD 14用于感测和治疗递送功能所需的电力以及光学触发信号发射所需的电力跨两个装置和两个(或更多个)电池或其他电源分布。
图3A和图3B是患者的解剖结构的截面视图,描绘了系统10内的发射装置的替代性配置。发射装置18被示为在引线16上的胸骨下位置(在图3A的截面视图中不可见)。通过使引线16的远端前进至胸骨下的位置,发射装置18可以被胸骨下地并且更加上方地定位,而非被胸骨上地定位在剑突下方。如所示的,发射装置18被配置成用于半球状光发射,所示半球状光发射总体上指向起搏器100在心脏26内的植入位置并且包含如箭头72所代表的到达起搏器100的光学路径。从发射装置18到起搏器100的光学路径72在不穿越胸骨22的情况下延伸穿过心肌到达起搏器100。起搏器100通过发射装置18所发射的光学触发信号在ICD 14的控制下向心脏26递送治疗性刺激脉冲。
引线16可以安置在纵膈中的、并且更具体地前纵膈中的胸骨底下或下方。前纵膈侧向地以胸膜为界,向后以心包为界,并且向前以胸骨为界。引线16可以至少部分地植入在其他心包外位置中,即在心脏26的外表面周围的区域中、但没有必要与心脏26的外表面直接接触的位置。这些其他心包外位置可以包括在纵膈中但从胸骨22偏移、在上纵膈中、在中纵膈中、在后纵膈中、在剑突下或剑突下方区域中、心尖附近、或其他不与心脏26直接接触且不是皮下的位置。在其他实施例中,引线16可以在心包中延伸并与心脏26直接接触。在这些示意性植入位置中的任何一个,引线16可以被定位成用于将光学发射装置18最佳地定位以便向起搏器100可靠地传输触发信号。
在图3B中,ICD 14被示为被配置成包括发光能力。在一些实施例中,除基于引线的发射装置之外或与其替代性地,发射装置18可以包括在ICD 14中。ICD 14可以包括发射装置18,所述发射装置在引线连接块13中或通过外壳15中的导光性光窗口沿着ICD外壳15暴露。ICD 14耦合至引线16,所述引线可以胸骨上地或胸骨下地延伸,用于使用如上所述由引线16携带的电极感测ECG信号。
位于胸廓外部(如ICD 14内或沿着它或皮下地沿着延伸自ICD 14的引线定位)的发射装置18可以被定位成使得光通过肋间空间和肺组织(如左肺70)被朝心脏26中的起搏器100引导。光学触发信号沿着箭头74所代表的通过肺组织的光学路径的传输与可以延伸穿过血容量的光学路径72(图3A)相比可能更加高效。如下所述,光学触发信号的波长被选择为提供沿着光学触发信号发射装置18与接收起搏器100之间的光学路径高效传输通过或离开组织(例如,肌肉、血液、骨骼、肺等)。
图4A是根据替代性示例的展示了可植入式医疗装置(IMD)系统10”的概念图。耦合至引线16的ICD 14用于感测患者12内的心脏电信号并如上所述向心脏26提供治疗。心内起搏器100被植入LV中并响应于接收到光学触发信号向LV递送起搏脉冲。在本实施例中,无引线光学触发信号发射装置60’被沿着肋间空间胸腔外地定位,从而穿过肋间空间和中间组织及肺组织将光学触发信号朝向起搏器100引导。
发射装置60’能够接收来自ICD 14的无线控制信号61。在接收到述控制信号61时,无引线发射装置60’发射光学触发信号从而使起搏器100递送LV起搏脉冲。发射装置60’具有其自己的电池,所述电池是可再充电的。
无引线发射装置60’可以定位在最优位置以便向起搏器100传输光学触发信号,而不需要用于感测ECG信号并递送电击治疗的电极24、28和30的最优定位相关联的限制。无引线发射装置60可以被植入在期望位点,而不需要引线隧穿。无引线发射装置60可以充当中继装置,所述中继装置用于通过将无线传输的控制信号61转换成光学触发信号将控制信号61从ICD 14传输至起搏器100。ICD 14(例如)可以传输包括在无引线发射装置60中的RF接收器所接收的RF控制信号61。无引线发射装置60将RF信号转换成光学信号,所述光学信号被作为光学触发信号传输至起搏器100。
在一些示例中,源自ICD 14的控制信号61可以是光学信号。由于更加具有电效率的信号可以用于触发发射装置60发射光学信号,然而,控制信号可以是并非光学信号的遥测通信信号。然而,考虑到的是,ICD 14可以将光学控制信号61传递至充当光学中继装置的发射装置60。发射装置60可以在发射和接收模式之间交替,在这些模式下,发射装置从ICD 14接收光学控制信号然后将所述光学触发信号传输至起搏器100上。
在一些示例中,系统10、10’或10”中可以包括多个发射装置。取决于起搏器100的最终植入位置以及可能随着时间而发生的偏移,起搏器100对在一个位置的一个装置所发射的比在不同位置的另一装置所发射的光学信号会更加敏感。位于不同的间隔开的位置的多个发射装置可以由ICD 14单独地或联合地选择,从而发射光学触发信号以便由起搏器100使用最大的功率效率实现可靠的触发信号检测。
图4B是包括多个医疗递送装置100、100’和100”的IMD系统11的概念图。在包括多个心内起搏器100、100和100”的实施例中,每个起搏器100、100和100”中的光检测器可以被配置成对不同的波长敏感。在所示的示例中,一个起搏器100被示为在LV中,起搏器100’被示为在RV中并且100”被示为在RA中。发射装置18可以被控制成发射处于第一波长的光,以便触发对所述第一波长敏感的RV起搏器100’,并发射第二波长,以便触发对所述第二波长敏感的LV起搏器100。发射装置18可以被ICD 14控制以发射处于所述第一波长的触发信号从而使递送光学触发的RV起搏脉冲,并发射处于所述第二波长的触发信号从而以相对于RV中被触发的步调(正或负的)受控时间间期触发LV起搏脉冲。类似地,RA起搏器100”可以响应于第三波长被触发以递送起搏脉冲。
如下所述,起搏器100、100’和100”中的每一个可以包括可编程的波长光检测器,在所述可编程的波长光检测器中,选择多个可选择的光敏部件之一(包括一个或多个光电检测器、一个或多个光电二极管、一个或多个光敏电阻器等)用于接收具体的触发信号波长。
替代性地,多个触发式起搏器100、100’和100”可以包括光检测器,所述光检测器用于检测处于同一波长的触发信号但被配置成用于检测互相排斥的不同触发信号模式。例如,给定的触发式起搏器100、100’和100”可以被配置成用于检测触发信号,所述触发信号包括处于限定的脉冲间期、脉冲幅度和/或其他脉冲成形参数或模式的多个光脉冲。可以用规定的触发信号模式来处理个体触发式起搏器100,同时可以用另一种触发信号模式来另一个触发式起搏器100’或者100”。不同的触发信号参数可以用于传输相互排斥的触发信号,所述相互排斥的触发信号由合适的治疗递送装置100、100’或100”识别和检测。可以由不同的光学信号脉冲数量、不同的脉冲间期、不同的脉冲宽度、触发信号脉冲的不同上升斜率和/或下降斜率或其任何组合来定义相互排斥的触发信号模式。
为了展示,一个治疗递送装置100可以检测具有不只两个脉冲的无效触发信号,同时另一个治疗递送装置100’或100”可以要求检测三个脉冲中的最小值以识别有效的触发信号。在另一示例中,一个治疗递送装置100可以检测具有短-长-短脉冲间期的有效触发信号,并且另一治疗递送装置100’或100”可以检测具有长-短-长脉冲间期模式的一个有效触发信号。
替代性地,当IMD系统11中包括两个或更多个治疗递送装置100、100’和100”时,可以使用多个发射装置18、18’和18”,所述多个发射装置各自被配置成将触发信号瞄分别准一个特定的治疗装置100’、100和100”。例如,成对的发射和治疗递送装置(例如,18与100’成对、18’与100成对、并且18”与100”成对)可以相对于彼此被植入在光学触发信号范围内,从而使得每个发射装置18、18’和18”被定位和控制成用于分别在对应的治疗递送装置100’、100、和100”递送所发射的光学触发信号。
发射装置18、18”和18”’中的每一个被示为由耦合至ICD 14的引线16和62携带,但在一些示例中,包括在IMD系统11中的发射装置5’可以由仅感测装置4控制,所述仅感测装置可以被设置为如结合图1A所描述的ECG监测器。发射装置5’可以是用于控制多个治疗递送装置100、100’和100”的多个发射装置之一或用于控制所述多个治疗递送装置100、100’和100”的IMD系统11的单个发射装置。
图3B中所示的所述多个治疗递送装置100、100’和100”、发射装置18、18’和18”以及感测装置4和14被描绘以用于展示可以包括在IMD系统11中的一个或多个感测装置、一个或多个发射装置和/或一个或多个治疗递送装置的各种可能的组合,所述IMD系统使用光学触发信号控制至少一个触发式治疗递送装置。这些装置的任何变化或组合可以用于递送由光学触发信号所触发的治疗。除了附图中所示的组合和安排之外,采用了在此所公开的技术的治疗递送系统可以包括至少一个治疗递送装置、至少一个感测装置和至少一个触发信号发射装置的不同组合和安排。
图5是在ICD 14的一个实施例中所包括的电子电路的功能框图。ICD 14包括处理和控制模块80(在此还称为“控制模块”80)、存储器82、治疗递送模块84、电感测模块86、遥测模块88和心脏信号分析器90。电源98对ICD14的电路提供电力,包括这些模块80、82、84、86、88、和90中的每一个。电源98可以包括一个或多个能量储存装置,例如一个或多个可充电电池或不可再充电电池。
图5中所示的功能块代表可以包括在ICD 14中的功能,并且可以包括实现能够产生归属于在此的ICD 14的功能的模拟电路和/或数字电路的任何离散和/或集成电子电路部件。例如,这些模块可以包括模拟电路,例如放大电路、滤波电路、和/或其他信号调节电路。这些模块还可以包括数字电路,例如模数转换器、组合或时序逻辑电路、集成电路、存储器装置等。存储器82可以包括任何易失性、非易失性、磁性、或电的非临时性计算机可读存储介质,例如随机存取存储器(RAM)、只读存储器(ROM)、非易失性RAM(NVRAM)、电-可擦除可编程ROM(EEPROM)、闪速存储器、或任何其他存储装置。而且,存储器82可以包括存储指令的非临时性计算机可读存储介质,在由一个或多个处理电路执行这些指令时使控制模块80或其他ICD模块执行归属于ICD 14的各个功能。存储指令的非瞬态计算机可读介质可以包括上述列出的介质中的任何一种,其中唯一的例外是瞬态传播的信号。用于实现在此所公开的功能的软件、硬件、和/固件的具体形式将主要由IMD系统装置中所采用的具体系统架构来确定。在考虑到在此的公开的情况下,在任何现代IMD系统的背景下提供软件、硬件、和/或固件以完成所述功能在本领域技术人员的能力之内。
归属于在此的这些模块的功能可具体化为一个或多个处理器、硬件、固件、软件或它们的任何组合。对作为模块的不同特征的描绘旨在突显不同的功能方面并且不一定暗示此类模块彼此由分开的硬件或软件部件来实现。而是,与一个或多个模块相关的功能可以由分开的硬件或软件部件来执行、或者集成在共同的硬件或软件部件中。例如,心脏信号监测可以由心脏信号分析器90执行以确定需要由ICD 14和/或起搏器100递送或在执行存储器82中所存储的指令的控制模块80中实现治疗。
处理和控制模块80与治疗递送模块84、心脏信号分析器90和电感测模块86通信,以感测心脏电活动、检测心律、并响应于所感测到的信号生成心脏治疗。治疗递送模块84和电感测模块86电耦合至图2A中所示的引线16所携带的电极24、28、和30,以及外壳15,所述外壳的至少一部分还充当公共电极或地电极。
电感测信号86耦合至电极28和30,从而监测患者心脏的电活动。电感测模块86可以可选地耦合至电极24和15,并且被使能以选择性地监测选自可用电极24、28、30和15中的一个或多个感测电极。例如,感测模块86可以包括切换电路,所述切换电极用于选择电极24、28、30和外壳电极15中的哪一些被耦合以感测在感测模块86中所包括的放大器。开关电路可以包括开关阵列、开关矩阵、多路调制器或适合于将感测放大器选择性地联接到所选择电极的任何其他类型的切换设备上。电极28和30之间的感测向量可以被选择为用于感测ECG信号,或者感测向量可以被选择为利用线圈电极24和/或外壳15,例如从感测电极28到外壳15或从感测电极30到外壳15。
一个或多个ECG信号被传递至感测模块86的输入,所述感测模块包括一个或多个感测放大器或用于从ECG信号感测心脏事件(例如,P波和/或R波)的其他心脏事件检测电路。感测模块86包括向心脏信号分析器90传递感测事件信号的感测放大器。例如,当ECG信号跨过对应的P波感测阈值和R波感测阈值(可以各自是自动调整的感测阈值)时,P波感测信号和R波感测信号被传递至心脏信号分析器90。心动过缓或心搏停止通常由定时电路92内的起搏逸搏间期定时器到时确定。响应于起搏逸搏间期到时,控制信号95被传递至光学发射装置18。在起搏脉冲触发或感测事件信号时,重新开始起搏逸搏间期。当在一个心脏腔室(心房或心室)中感测到事件并向起搏器100发送触发信号从而以AV或VV间期递送与所感测到的事件同步的起搏脉冲时,由控制模块80开始其他起搏间期(如AV或VV起搏间期)。
在此所介绍的示意性示例中的控制信号95可以被称为起搏控制信号,因为它使起搏器100向心脏腔室递送起搏脉冲。在其他示例中,控制信号95可以由心脏信号分析器90产生,以使其他类型的治疗脉冲由治疗递送装置(如起搏器100)递送。例如,可以产生控制信号95以使起搏器100或另一治疗递送装置递送ATP脉冲、迷走神经刺激脉冲、或其他类型的电刺激脉冲。
控制信号95是当发射装置以有线连接耦合至ICD 14时被沿着引线16(或携带发射装置18的另一引线)传递至发射装置18的电信号。控制信号95替代性地是被传递至遥测模块88的电信号,在所述遥测模块,所述电信号被转换成无线遥测信号,所述无线遥测信号被通过遥测模块88传输至发射装置18。发射装置18可以由引线携带但被配置成用于从遥测模块88无线地接收控制信号95。替代性地,所述发射装置并不是基于引线的发射装置,如图4A中所示的无引线发射装置60’,并从遥测模块88接收无线控制信号,例如,RF信号。
光学发射装置18包括驱动信号电路34,所述驱动信号电路从遥测模块88接收控制信号95或者作为有线电信号或者作为无线电信号。被理解的是,在一些实施例中,驱动信号电路34可以包括在ICD 14的外壳15中并耦合至位于外壳15外部的换能器36。
驱动信号电路34向光学换能器36传递电信号,从而使光学换能器36能够发射光学触发信号。如在此所描述的,光学触发信号被起搏器100接收并检测,从而使起搏器100向患者的心脏递送一个或多个起搏脉冲。可以根据预设强度、波长、和信号持续时间以及其他信号特性来生成所述光学触发信号。换言之,所述控制信号可以仅用信号向发射装置18通知需要触发新。所述触发信号仅向起搏器100用信号通知递送治疗,而不用信号通知任何与多个起搏脉冲、什么脉冲幅度或脉冲宽度有关的任何信息或其他起搏脉冲控制参数信息。起搏器100可以被编程用于当检测到触发信号时根据预定义的脉冲控制参数递送预定义个数的起搏脉冲。
替代性地,控制信号95可以包括编码的起搏脉冲控制信息。驱动信号电路34所生成的控制信号可以使换能器36根据光学触发信号的强度、波长、信号持续时间和/或根据控制信号有意调整的其他特性来发射触发信号。在这种情况下,控制信号95用信号向发射装置18通知需要触发信号以及所发射的触发信号需要什么特性。起搏器100可以被配置成用于检测所发射的触发信号的特性并基于所述特性设定起搏脉冲控制参数。
光学换能器36可以包括多个发光换能器。光学环能器36包括多个换能器,所述多个换能器被配置成用于在多个方向从发射装置18发射光学信号,从而促进起搏器100对光学触发信号的接收,而不管发射装置18和起搏器100相对于彼此的偏移、旋转或相对取向的其他改变。所述多个换能器可以是驱动单元34可选择的,这样使得选择在起搏器光检测器产生最佳信噪比的换能器。光学换能器36可以包括多个不同换能器或发光装置,所述多个不同换能器或发光装置是驱动电路34可选择以使能传输不同触发信号(例如,不同触发信号波长),用于触发如结合图4B所描述的不同的心内起搏器和/或触发不同类型的触发脉冲或治疗(例如,不同脉冲形状、脉冲幅度、脉冲宽度、脉冲频率等)。
光学换能器36包括一个或多个平行或非平行光源,如一个或多个发光二极管(LED)、一个或多个垂直腔表面发射激光器(VCSEL)、量子点发光装置(QD-LED)、量子点激光器、有机LED、放电/闪光灯、或其他在选择的光波长具有高量子效率的光源。光学换能器36包括具有指向窗口37的光子表面的任何光电装置,所述窗口可以包括用于提高从发射装置18发射的光的效率的透明镜片和光学耦合介质或构件。根据共同转让的第8,275,432号美国专利(库恩(Kuhn)等人)和第8,452,402号美国专利(埃克(Ecker)等人)中总体上公开的示例,光学换能器36可以被配置成用于透过窗口37发射光,这两个专利通过引用一起整体结合在此。
光学换能器36具有下述发射光带宽,所述发射光带宽被选择为提供由起搏器光检测器在衰减之后可检测的传输强度,所述衰减是由于沿着光学换能器36与起搏器光检测器之间的光学通路的组织吸收和光散射损失造成的。总体上,随着波长增大,散射单调地减少。吸收随着增大的波长而增加,但局部极小值出现在吸收光谱中。相应地,触发信号波长可以被选择为使得考虑了吸收和散射两者对起搏器光检测器处的结果信号强度的影响。
例如,可以选择具有一定信号带宽的发光装置,所述信号带宽在吸收光谱上的局部极小值具有中心频率。当波长增大时,吸收光谱从血红蛋白依赖性过渡至水依赖性。这样,可以选择相对高的中心波长,例如大于近似1000nm。近似1,100nm、1,300nm、和1,700nm的波长各自与水的吸收光谱的局部最小值相关联。这些示例中的任何一个不限于可以被选择为光学触发信号带宽的中心波长。发射装置与起搏器之间的光学通路可以延伸穿过具有不同光学特性的多个组织。相应地,当选择光学换能器36的类型和中心波长以及其植入位置时,可以进行多种考虑。
定时电路92可以生成控制信号95,用于触发起搏器100递送起搏脉冲,从而根据存储器82中所存储的起搏算法和定时间期提供心动过缓起搏、心房同步心室起搏、ATP、CRT、AV结刺激、或其他起搏治疗。当由ICD 14递送心脏复律-除颤电击之后当心脏恢复回正常电击后功能时,可以暂时递送心动过缓起搏以维持心脏输出。
心脏信号分析器120包括快速心律失常检测器94用于检测和区别室上性心动过速(SVT)、心室性心动过速(VT)和心室纤维性颤动(VF)。感测和处理皮下ECG信号的一些方面总体上在共同转让的第7,904,153号美国专利(格林哈特(Greenhut)等人)中公开,该专利由此通过引用以其全文结合在此。来自感测模块86的R波感测信号的定时被快速心律失常检测器94用于测量R-R间期,所述R-R间期用于对不同检测区域内的RR间期进行计数或确定心律或其他用于检测心室快速心律失常的基于速率的测量结果。电感测模块86可以另外或替代性地向心脏信号分析器120提供数字化的ECG信号,以用于检测快速心律失常。可以被适配成用于触发式起搏器100的ICD的示例以及可以由用于检测、区别和治疗快速心律失常的快速心律失常检测器94检测的操作总体上在第7,742,812号美国专利(加尼姆(Ghanem)等人)、第8,160,684号美国专利(加尼姆(Ghanem)等人)、第5,354,316号美国专利(凯梅尔),第6,393,316美国专利(吉尔伯格(Gillberg)等人)、第5,545,186号美国专利(奥尔森(Olson)等人)、和第5,855,593号美国专利(奥尔森(Olson)等人)中公开,所有这些专利通过引用以其整体结合在此。
检测算法对威胁生命的VT和VF的存在或不存在高度敏感和特定的。治疗递送模块84包括HV治疗递送模块,所述HV治疗递送模块包括一个或多个HV输出电容器。当检测到恶性心动过速时,HV电容器通过HV充电电路被充电至预编程电压水平。当检测到来自治疗递送模块84的反馈信号时,控制模块80应用信号来触发HV电容器的放电,所述反馈信号是HV电容器已经到达了递送编程电击能量所需的电压。以这种方式,控制模块80控制治疗递送模块84的高压输出电路的运行,从而使用线圈电极24和外壳电极15递送高能量心脏复律/除颤电击。
应当注意的是,所实现的心律失常检测算法不仅可以利用ECG信号分析法,而且还可以利用补充传感器96,如组织颜色、组织氧合、呼吸、患者活动、心音等,以便由处理和控制模块80促进决定应用还是制止治疗。传感器96还可以用于确定需要由起搏器100对起搏脉冲进行起搏和定时。例如,活动传感器信号或其他速度响应型信号(如分换气量信号)可以用于确定起搏速率满足患者的新陈代谢需求。定时电路92产生控制信号95用于使发射装置18生成光学触发信号,所述光学触发信号使起搏器100以基于速率响应型信号的速率递送起搏脉冲。传感器96可以包括由引线携带的一个或多个传感器,所述引线延伸自ICD 14、在外壳15和/或连接块13内或沿着。
当被配置为无线装置时,遥测模块88包括用于与另一装置(如外部编程器40和发射装置18)通信的收发器和天线。在控制处理器80的控制下,遥测模块88可以从编程器40或其他外部装置接收下行遥测并向其发送上行遥测。遥测模块88可以向发射装置18无线地发射控制信号95(例如,作为RF信号)。
图6A是触发式起搏器100的概念图。起搏器100包括沿着起搏器100的外壳150的间隔开的电极162和164。电极164被示为延伸自起搏器100的远端102的尖端电极,并且电极162被示为沿着外壳150的中间部分的环形电极,例如与近端104相邻。在替代性实施例中,起搏器100可以包括两个或更多个环形电极或沿着起搏器外壳150暴露的其他类型电极,用于向心脏26递送电刺激。电极162和164可以不限于钛、铂、铱或其合金,并且可以包括低偏光涂层,如氮化钛、氧化铱、氧化钌、尤其铂黑。电极162和164可以位于除了所示位置之外的沿着起搏器100的位置。
外壳150包括控制电子设备子组件152,所述控制电子设备子组件容纳用于产生刺激脉冲并控制起搏器100的治疗递送功能的电子设备。作为一个示例,控制电子设备子组件152可以包括脉冲发生器和光检测器,用于接收光触发信号并响应于所述光学触发信号触发脉冲发生器通过电极162和164递送起搏脉冲。
外壳150进一步包括电池子组件160,所述电池子组件向控制电子设备子组件152提供电力。电池子组件160可以包括共同转让的第8,433,409号美国专利(约翰逊(Johnson)等人)以及第8,541,131号美国专利号(伦德(Lund)等人)中所公开的电池的特征,此专利的全部内容通过引用以其整体结合在此。外壳150由生物相容性材料(如不锈钢或钛合金)形成。在一些示例中,外壳150可以包括绝缘涂层。绝缘涂层的实例包括聚对二甲苯、氨基甲酸乙酯、PEEK、或聚酰亚胺以及其他涂层。外壳150的全部可以是绝缘的,但只有电极162和164是非绝缘的。在其他示例中,外壳150的全部可以起电极的作用而非提供局部电极如电极162。替代性地,电极162可以与控制外壳150的其他部分电绝缘。电极162和164形成用于双极心脏起搏的正极或负极。在一些实施例中,电极162和164可以用于感测心脏EGM信号,在这种情况下,控制电子设备子组件152包括感测电路。
起搏器100可以包括一组固定齿166用于将起搏器100固定至患者组织,例如通过与心室骨小梁相互作用。起搏器100可以包括如在共同转让的、预授权的公开美国2012/0172892(格鲁巴茨(Grubac)等人)中公开的一组主动固定齿,该公开由此通过引用以其全文结合在此。固定齿166可以被配置成用于将起搏器100锚定,从而将电极164定位成操作地邻近靶标组织,以便递送电刺激脉冲。可以采用许多种类型的有源和/或无源固定构件用于将起搏器100锚定或稳定在植入位置。
起搏器100可以进一步包括递送工具接口158。递送工具接口158位于起搏器100的近端并且被配置成用于连接递送装置(如导管),所述递送装置用于在植入过程中将起搏器100定位(例如)在植入位置,例如心脏腔室内。
起搏器100包括光学耦合窗口180,所述光学耦合窗口用于从光学信号发射装置18接收光学触发信号并将其耦合至外壳150中所封闭的光检测器。窗口180可以包括二氧化硅、石英、蓝宝石、或其他透明的导光材料,用于在没有显著光散射的情况下将光学触发信号传输至光检测器。在一个示例中,窗口180是蓝宝石环,所述蓝宝石环或者直接地或者使用钛套圈金焊至控制电子设备子组件152,所述钛套圈或者直接地或者间接地使用第二钛套圈被焊接至控制电子设备子组件,并且被焊接至电池组件,所述第二钛套圈焊接至电池子组件160。在另一示例中,窗口180可以熔结至外壳150,使用或不适用中间金属套圈。例如用于在IMD中形成光学窗口的材料和方法,参照了共同转让的第8,275,432号美国专利(库恩(Kuhn)等人)和第5,902,326号美国专利(莱萨(Lessar)等人)。这两个专利整体通过引用结合在此。
控制电子设备子组件152中所包括的光检测器接收通过窗口180入射在起搏器100上的光。当起搏器100经静脉前进至心脏腔室中时,起搏器100的最终取向可以不同,并且光学窗口180相对于患者的解剖结构、以及因此相对于发射装置18的最终取向可能是未知的。而且,由于或者起搏器100和/或发射装置18的偏移或者由于心脏运动、呼吸运动、或其他身体运动,光学窗口180相对于发射装置18的取向可以随着时间而波动。这样,窗口180可以是连续的窗口,所述连续的窗口外切外壳150以便从起搏器100的所有侧接收光。
在其他实施例中,窗口180可以是非连续的,并且沿着外壳150的周长包括多个分段的窗口。所考虑到的是,可以设想沿着远端102、近端104或沿着外壳150的周长(例如,沿着在近端和远端102和104之间延伸的圆柱形纵向侧壁)的一个或多个光学窗口的许多种配置。在又其他实施例中,外壳150或其多个部分可以由透明导光材料(如晶片级玻璃封装)形成,这样使得封闭在外壳150中的光检测器可以直接通过外壳150接收光,而不需要分开的光学窗口。可以用于容纳起搏器100的光检测器和/或感测装置(例如,感测装置4或ICD 14)内的发射装置18的晶片级封装总体上在共同转让的第8,666,505号美国专利(奥勃良(O’Brien)等人)中公开,此专利通过引用以其整体结合在此。
图6B是根据替代性实施例的起搏器100的概念图。多个分离的光学耦合窗口180a至180d可以沿着起搏器100的多侧分布,而非如图6A中所示的连续的圆周窗口180。在图6A和图6B中,起搏器100被示为具有总体上圆柱形的外壳150。在其他实施例中,起搏器100可以具有棱柱形外壳,所示棱柱形外壳具有沿着外壳150的一个或多个侧延伸的一个连续的或多个分离的光学耦合窗口。
所示光学耦合窗口180a至180d可以由二氧化硅、石英、蓝宝石、或如上所述的其他光学上可穿透的材料。光检测器可以位于光学窗口180a至180d中的每一个后方。当包括多个光检测器时,可以通过切换电路选择由于入射光而产生最大电压信号的单个光检测器作为用于检测用于触发起搏器100递送起搏脉冲的光学触发信号的光检测器。替代性地,图案检测器组合的输出信号可以用于逻辑OR或AND运算以检测光学触发信号。
图6C是沿着光学耦合窗口180的起搏器100的截面视图。窗口180被示为连续的环,例如具有蓝宝石或其他透光材料。光敏部件190(例如,光敏电阻器、光电二极管、或其他光电检测器)沿着窗口180的内表面182安装。光敏部件190可以通过可选的光学耦合构件192耦合至表面182,或者可以被密封在耦合构件192中,所述耦合构件与表面182密封。可以按照上文结合的‘432专利中总体上公开的对光学耦合构件192进行配置。虽然窗口180的内表面182和外表面184被示为圆形的,表面182和184可以包括平坦的部分或面,在所述平台的部分或面处,光敏部件190耦合至表面182以减少在弯曲表面上的光散射。
每个光敏部件190通过导体194电耦合至混合电路196。混合电路196在通过窗口180从起搏器100的任一侧接收到光时从光敏部件190中的每一个接收电信号,并将所述电信号(单独地或联合地)与触发检测阈值进行比较,如下文更加详细描述的。
图7A是起搏器的示例配置的功能框图。起搏器100包括脉冲发生器202、感测模块204、控制模块206、存储器210、光检测器212和电源214。脉冲发生器202生成电刺激信号,所述电刺激信号经过电极160和162被递送至心脏组织。控制模块206响应于从光检测器212接收到触发检测信号216控制脉冲发生器202递送刺激脉冲。在其他实施例中,可以直接通过从光检测器212接收的触发检测信号216使能脉冲发生器202递送刺激脉冲。例如,响应于光检测器212所产生的触发检测信号216的开关可以使能脉冲发生器202产生被应用至电极162和164的刺激脉冲。
脉冲发生器202包括一个或多个电容器和充电电路,从而在控制模块206的控制下将电容器充电至起搏脉冲电压。在控制模块206等待来自光检测器212的触发检测信号216的同时,起搏电容器可以被充电至起搏脉冲电压。在检测到所述光学触发信号时,起搏电容器耦合至起搏电极162、164从而至少部分地对电容器电压放电并借此递送起搏脉冲。替代性地,对光学触发信号的检测发起起搏电容器充电,并且当达到预定的电容器电压时,递送脉冲。第8,532,785号美国专利(克拉奇菲尔德(Crutchfield)等人)中总体上公开的起搏电路可以实现在起搏器100中从而在控制模块202的控制下将起搏电容器充电至预定的起搏脉冲幅度并递送起搏脉冲,此专利通过引用以其整体结合在此。替代性地,脉冲发生器202可以包括将电源214连接至起搏电极162和164以递送起搏脉冲的开关。
光检测器212通过光学耦合窗口180接收光。光检测器212包括一个或多个光学换能器,所述光学换能器可以包括但不限于光电检测器、光电二极管、光敏电阻器、光电倍增管、PIN二极管、雪崩二极管或对发射装置18所发射的光波长响应的其他光敏性光电部件。光检测器212中所包括的一个或多个光学换能器被选择用于将起搏器100中用于光学触发信号检测的能耗最小化。在通过窗口180接收到联接至光检测器212的光学触发信号时,光检测器212产生电压信号,将所述电压信号与触发检测阈值进行比较。当所述电压信号超过所述触发检测阈值时,所述触发检测信号216被传递至控制模块206。
在一个实施例中,发射装置18可以被配置成用于发射具有1100nm的中心波长的光学触发信号。在本示例中,砷化镓铟光电检测器可以用于提供对1100nm触发信号的高效感测。从美国新泽西州普林斯顿大学传感器无限公司(Sensors Unlimited,Inc.,Princeton,NJ,USA)可获得砷化镓铟光电检测器的示例。光检测器212中所使用的半导体材料可以包括但不限于硫化铅、硒化铅、砷化铟、砷化镓、亚锑酸铟、亚锑酸铝、锗、硅、或其组合。
光检测器212可以包括多个光学换能器,所述多个光学换能器可以被定位成用于通过一个或多个光接收窗口180接收光,例如沿着起搏器100的一个或多个侧。在一些实施例中,如图6A中所示,窗口180是外切圆柱形起搏器的连续环。多个光学换能器可以沿着窗口的内表面定位,从而产生电压信号,由光检测器212中所包括的比较器将所述电压信号与触发检测信号进行比较。可以对多个光学换能器所产生的电压信号求和,例如以便与触发信号检测阈值进行比较,或者光学换能器所产生的最大电压信号可以与检测阈值进行比较。
在一些实施例中,多个光学换能器可以包括在对不同波长响应的光检测器212中。提供对不同波长的检测可以使能不同的触发信号由发射装置18传输,以便使起搏器100执行不同的起搏功能。在一些实施例中,光检测器212可以被配置成用于仅检测来自发射装置18的装置生成的光学触发信号。换言之,光检测器212可以不被配置成用于感测和处理生理光学信号以确定生理事件、条件或状态。
在包括多个治疗递送装置的示例中(例如,如图4B中所示),每个光检测器212可以包括多个可选择的光敏部件,包括一个或多个光电检测器、一个或多个光电二极管、一个或多个光敏电阻器等,用于感测处于不同波长的光学触发信号。在植入时,选择触发信号波长并将其编程至存储器210中。对所选择的波长敏感的光敏部件被使能,并且使其他光敏部件失能。以这种方式,光检测器212可以被配置成用于检测所选择的触发信号波长,从而使得起搏器100对于所选择的波长匹配的特定光学触发信号响应但并不对其他波长的触发信号响应。
可选择性地对不同波长响应的光检测器212还可以允许选择不同波长,从而优化用于检测光学触发信号的信噪比。在一些情况下,一个波长可以比其他可用波长更大程度地衰减。
提供对不同波长敏感的多个光敏部件进一步允许起搏器100可以由完全相同的部件制造但稍后被配置成是对不同触发信号波长响应的,例如在植入时。替代性地,起搏器100可以由不同的光检测器212制造,所述不同的光检测器对不同的触发信号响应,而不需要可选择的检测波长。
光检测器212产生触发检测信号216,所述触发检测信号由控制模块206或直接由脉冲发生器202接收。控制模块206然后控制脉冲发生器202根据可以存储在存储器210中的治疗递送控制参数(如脉冲幅度、脉冲宽度、脉冲个数等)递送起搏脉冲。在一些实例中,在或者直接从光检测器212或者通过控制模块206接收到触发检测信号216时,立即使能脉冲发生器202递送起搏脉冲。在其他示例中,在接收触发检测信号216之间的时间延迟之后,脉冲发生器202按照控制模块206的控制递送起搏脉冲。
起搏器100可以唯一地是不具有感测能力的治疗递送装置。在其他示例中,起搏器100可以包括感测模块204,所述感测模块耦合至电极162和164用于感测用于控制起搏脉冲的递送的近场EGM信号。例如,当起搏器100被植入LV时,LV中的R波可以被感测模块204感测到。感测模块204生成被提供给控制模块206的R波感测事件信号。在从光检测器212接收触发检测信号216时,控制模块206可以开始起搏定时间期。如果在起搏定时间期到时之前,R波感测信号被控制模块206从感测模块204接收到,不递送起搏脉冲。如果在从感测模块204接收到R波感测事件信号之前起搏定时间期到时,控制模块206使能脉冲起搏器202递送起搏脉冲。
起搏定时间期可以是(例如)用于相对于感测装置4或ICD 14所感测的固有R波控制向LV(或RV)递送起搏脉冲的VV间期。起搏定时间期可以是用于相对于感测装置4或ICD 14所感测的固有P波控制心室中的起搏脉冲递送的AV间期。起搏定时间期可以相对于另一心脏腔室中递送的起搏脉冲,所述起搏脉冲还可以由另一心内起搏器递送,所述另一心内起搏器被来自发射装置18的光学触发信号触发递送起搏脉冲。例如,ICD 14可以控制发射装置18产生光学触发信号。在接收到所述光学触发信号时,可以立即由第一心内起搏器在一个心脏腔室内递送起搏脉冲。只要感测模块24在起搏定时间期截止之前不产生固有感测事件,就可以在起搏定时间期截止时递送第二心脏腔室内的起搏脉冲,所述起搏定时间期在接收到光学触发信号时开始。
虽然图7A中未示出,意识到的是,起搏器700可以包括其他生理传感器,如压力传感器、活动传感器、声传感器、氧传感器、或适配成用于可植入式医疗装置的其他传感器。
电源214根据需要向起搏器100的其他模块和部件中的每一个提供电力。控制模块206可以执行功率控制操作,以便控制何时向不同的部件或模块供电以执行不同的起搏器功能。电源214可以包括一个或多个能量储存装置,例如一个或多个可再充电电池或不可再充电电池。控制模块206还可以被配置成执行起搏器100的诊断测试,该诊断测试可以包括例如监测电源214的剩余电荷。为清楚起见,图7A中未示出电源214与其他起搏器模块和部件之间的连接。
图7A中所示的框图所代表的电路可以包括任何离散和/或集成电子电路部件,这些部件执行能够产生归属于在此的起搏器100的功能的模拟电路和/或数字电路。归属于在此的起搏器100的功能可具体化为一个或多个处理器、硬件、固件、软件或它们的任何组合。控制处理器206可以包括微处理器、控制器、数字信号处理器(DSP)、专用集成电路(ASIC)、现场可编程门阵列(FPGA)或等效离散或集成逻辑电路中的任何一个或多个。作为离散模块或部件的起搏器100的不同特征结构的描绘旨在强调不同的功能方面,而并不一定暗指这类模块必须通过分开的硬件或软件部件来实现。相反,与一个或多个模块相关联的功能性可以通过分开的硬件或软件部件来执行,或整合在共同的或分开的硬件或软件部件中,所述部件可以包括组合或时序逻辑电路、状态机、存储器装置等。
存储器210可以包括计算机可读指令,这些计算机可读指令在由控制模块206执行时,使控制模块206执行贯穿本公开归属于起搏器100的各种功能。计算机可读指令可以被编码在存储器210内。存储器210可以包括任何非暂时性计算机可读存储介质,包括任何易失性介质、非易失性介质、磁性介质、光学介质或电介质,诸如随机存取存储器(RAM)、只读存储器(ROM)、非易失性RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、快闪存储器、或其他数字介质,唯一的例外是瞬时传播信号。存储器210存储间期、计数器、或控制模块206控制由脉冲发生器202响应于从光检测器212接收到触发检测信号216递送起搏脉冲所使用的其他数据。
图7B是在图7A的起搏器中所包括的光检测器212的一个示例的图。多个光敏部件250可以并行耦合在数字化逆变器254的输入与地电位252之间。在一个示例中,光敏部件250是光敏电阻器。当未接收到光时,通过电阻器256将数字化逆变器254的输入向Vcc 258偏置,所述电阻器具有小于光敏电阻器250的电阻的高电阻。当通过窗口180接收到光学触发信号时,一个或多个光敏电阻器250的电阻将显著地降低,从而切换数字化逆变器254的状态。数字化逆变器254的输出信号可以被作为触发检测信号216提供给控制模块206。光敏电阻器250可以沿着外切起搏器100的窗口180安排,从而360度实现光学触发信号接收,如图6C中所示。虽然图7B中示出了四个光敏电阻器250,但应当认识到,光检测器212中可以包括一个或多个光敏电阻器或其他光敏部件。
图8A是被示为心内起搏器400的光学触发式治疗递送装置的又另一示例的概念图。起搏器400具有远极面402,所述远极面具有被保持在绝缘电极馈通404的孔径中的尖端电极462。尖端电极462是具有开放中心的环形电极的形式,光学窗口480存在于所述开放中心中。窗口480可以由本文中之前列出的示例材料中的任何一种形成,并且可以通过金焊、医用粘合胶、融结或其他密封方法密封在尖端电极462中。尖端电极462是环状电极,其中,光学窗口480同轴地延伸穿过尖端电极462的中心。光检测器212直接位于窗口480的后方以便接收光学触发信号。尖端电极462在直径方面可以增大,这样使得窗口480可以包含起搏器400的远极面402的更大的表面积。
尖端电极462被固定齿466推进抵靠或邻近心脏腔室壁。这样,远极面402将以总体上朝外的方向取向,从心脏腔室血池朝向胸壁。光学耦合窗口480被定位成抵靠或接近心肌壁,从而提供从发射装置直接朝向窗口480的光学路径,例如通过肋间肌肉、肺组织和心肌壁。
图8B是图8A中所示的起搏器400的概念侧视截面视图。起搏器400包括外壳450以及电极和光检测器组件410,所述电极和光检测器组件沿着起搏器400的远端面402暴露。电极和光检测器组件402包括电极馈通404、尖端电极462、光学耦合窗口480和光检测器412。脉冲发生器452通过馈通导体466电耦合至电极462。尖端电极462具有中空内核,透明光学窗口480被定位于所述中空内核中以便向光检测器412传递光学触发信号。光检测器412被示为位于在尖端电极462的中空内核中,然而,取决于检测器412和电极462的相对尺寸,认识到的是,光检测器412可以位于相对于远端尖端电极462更加临近的位置。在这种情况下,光学窗口480将填满电极462的中空内核。组件410可以在与外壳450组装之前预组装。替代性地,馈通404、电极462、光检测器412和窗口480可以被单独地或以子组件组装至外壳450中。使用钎焊、焊接、医用级粘合胶或其组合和/或其他密封方法将组件410和外壳450以防止体液进入起搏器400的内部。
可以设定应用于光检测器412的触发检测阈值并将其存储在存储器中,以便用于检测光学触发信号。当光检测器412产生触发检测信号454时,控制模块406向脉冲发生器452传递P出信号456。脉冲发生器452响应于来自控制模块406的P出信号通过电极462和返回阳极电极(例如,绕外壳450或外壳450的任一部分或整体的环形电极(未示出))递送一个或多个起搏脉冲。脉冲发生器452根据所存储的起搏脉冲参数(例如,脉冲幅度、脉冲宽度、脉冲形状等)生成所述一个或多个起搏脉冲。只要出发检测信号454保持低或在出发检测阈值以下,不递送起搏脉冲。
在一些示例中,一旦有出发检测信号454,控制模块406可以立即传递P出信号456从而使起搏脉冲递送。在其他示例中,控制模块406在存储的时间延迟之后传递P出信号456,如用于控制双腔室或多腔室心动过缓起搏或CRT的房心室(AV)或室间(VV)延迟或其一部分。
图9A是具有光学耦合窗口580的起搏器500的替代性示例的概念图,所述光学耦合窗口沿着起搏器500的远极面502包围尖端电极562。光学窗口580可以是环绕尖端电极562的绝缘电极馈通504的一部分。电极馈通504可以包括玻璃绝缘构件,所述玻璃绝缘构件是透明的并且用于向沿着馈通504的内表面定位的(图9B中所示)光检测器512导光。替代性地,光学窗口580可以是玻璃或其他包围馈通504的透明环,所述馈通环绕尖端电极562。在这种情况下,光学窗口580可以是绕尖端电极562同轴地延伸的环状窗口。
图9B是图9A中所示的起搏器500的概念侧视截面视图。起搏器500包括外壳550以及电极和光检测器组件510,所述电极和光检测器组件沿着起搏器500的远端面502暴露。电极和光检测器组件502包括电极馈通504、尖端电极562、光学窗口580和光检测器512a和512b,统称为512。虽然示出了两个检测器512,但认识到的是,一个或多个检测器可以沿着窗口580的内表面560定位。尖端电极562在本示例中是固态尖端电极,通过馈通504的玻璃绝缘体构件与外壳550绝缘并通过馈通导体566电耦合至脉冲发生器552。
馈通504包括窗口580(此窗口是馈通504的玻璃电绝缘体构件)以及用于向光检测器512传递光学触发信号的光学窗口。组件510可以在于外壳550组装之前预组装。替代性地,馈通504、电极562、和光检测器512可以被单独地或以子组件被组装至外壳550中。使用钎焊、焊接、医用级粘合胶或其组合和/或其他密封方法将组件510和外壳550以防止体液进入起搏器500的内部。
控制模块506从光检测器512接收光检测器信号554a和554b。在这种情况下,控制模块506可以包括比较器或其他用于将信号554a和554b与触发检测阈值进行比较的检测电路。控制模块506可以选择光检测器信号554a和554b中的一个或两者来检测光学触发信号。可以将所选择的触发检测信号554a和554b之一或两者与触发检测阈值进行比较,或者可以将触发检测信号554a和554b之和或者其他组合与起搏触发阈值进行比较。控制模块506通过P出信号线556耦合至脉冲发生器552,以便控制脉冲发生器552通过电极562和返回阳极电极(例如,绕外壳550或外壳550的任何一部分或全部的环形电极(未示出))递送起搏脉冲。如果触发检测信号554a和/或554b或其组合跨越了触发检测阈值,控制模块506向脉冲发生器552传递P出信号556。在接收到P出信号556时,脉冲发生器552生成如上所述的一个或多个起搏脉冲。
图10为根据一个示例的用于控制被触发的治疗递送装置的方法的流程图600。流程图600和在此所介绍的其他流程图中所示的方法可以由图1A、图2A、图4A或图4B中所示的系统2、10、10’、10”或11执行。在框602,感测装置(例如感测装置4或ICD 14)获取生理信号用于感测指示需要自动治疗递送的事件或条件。在框604,感测装置基于所述生理信号检测需要治疗。感测装置不需要直接电耦合至触发式治疗递送装置。感测装置在框606生成控制信号,所述控制信号被直接传递至于感测装置处于有线连接的发光装置。替代性地,在框606,感测装置生成控制信号,所述控制信号由感测装置的遥测通信模块编码并被被无线地传输至发光装置。
在框608,发光装置响应于接收到控制信号生成光学触发信号。在框610,触发式治疗递送装置(例如,治疗递送装置6或起搏器100)检测光学触发信号。响应于检测到光学触发信号,在框612,自动地递送治疗。如果未检测到光学触发信号,不递送治疗。在递送治疗之后,在框602,感测装置继续监测生理信号。
图11为用于控制由被触发的起搏器(例如,起搏器100)自动递送的心脏起搏治疗的方法的流程图700。在框702,感测装置(例如,仅感测装置4或ICD 14)获取ECG信号。感测装置可以被配置成仅感测装置(例如,如图1B中所示),用于使用感测装置或延伸自感测装置的引线所携带的电极监测ECG信号。感测装置可能或可能不能够递送治疗。在一个示例中,感测装置包括用于治疗快速心律失常的心脏复律/除颤能力。如上所述,感测装置可以是ICD,被配置成用于监测ECG从而检测需要起搏以及需要检测VT和VF并按照需要递送电击治疗。感测装置可以是胸腔外装置(例如,植入在皮下或肌肉下袋中)或胸腔内装置,并且不需要与起搏器100有线连接。
如果依据基于所感测的ECG信号在框704所确定的需要起搏治疗,在框706,由感测装置生成控制信号。所述控制信号可以是电信号,所述电信号被直接传递至光学发射装置,或者通过有线连接或者通过无线遥测信号(如RF通信信号)的转换和传输。
在框708,光学发射装置(例如,发射装置18)响应于从感测装置接收到控制信号生成光学触发信号。如果依据在框710处所确定的起搏器100检测到光学触发信号,在框712响应于触发信号检测递送一个或多个起搏脉冲。如果未检测到光学触发信号,感测装置继续监测ECG信号以防需要触发脉冲。可以根据起搏器的控制模块所存储的起搏脉冲控制参数递送起搏脉冲,或者可以根据所检测到的触发信号调整起搏器。
图12是根据一个实施例用于控制心脏再同步治疗(CRT)的方法的流程图800。在框802,感测装置接收ECG信号以便分别检测伴随心房和心室的去极化的P波和/或R波。感测装置可以是如图1B中所示的仅感测装置4或者例如如图2A、图3A、图3B和4A中所示的ICD 14。在框804感测定时事件(即,P波和R波),从而使在感测装置中开始起搏逸搏间期。在所示的示例中,在框806,开始LV起搏逸搏间期。所示LV起搏逸搏间期可以基于所感测到的R波、所感测到的P波的开始,或ECG信号上所标识的其他时间点。
如果起搏逸搏间期到时(框808),在框810,控制信号由感测装置产生并被发送至光学发射装置18。感测装置所产生的所述控制信号可以是被电导体发送至发射装置18的电信号,所述电导体将感测装置耦合至发射装置18。如上所述,发射装置18可以被容纳在感测装置的外壳内或沿着它,或者被容纳在感测装置的接头或连接块中。替代性地,发射装置18可以由耦合至感测装置的引线携带。
在其他示例中,感测装置所产生的控制信号被转换成无线遥测通信信号,所述无线遥测通信信号被传输至在发射装置中所包括的接收器。发射装置18可以远离感测装置植入的无引线装置,或者可以由延伸自感测装置但被配置成用于接收无线遥测信号(如RF信号)的引线携带。
在框812,在从感测装置接收到控制信号时,发射装置18生成光学触发信号。心内起搏器100被植入LV并且被配置成用于检查如上所述的光学触发信号。如果依据在框814所确定的起搏器100检测到了光学触发信号,在框816,起搏器100递送LV起搏脉冲。如果未检测到光学触发信号,感测装置继续从ECG信号感测事件,以便控制起搏定时间期并生成控制信号以使由起搏器100进行被触发的起搏脉冲递送。
从而,根据示意性实施例描述了包括触发式治疗递送装置和相关联的方法的医疗装置系统的各个示例。在此所介绍的示例的各个方面可以组合在除了所介绍的具体示例之外的不同组合中。本领域的普通技术人员将理解,可以在不脱离所附权利要求书的范围的情况下对所描述的实施例做出不同的修改。
- 还没有人留言评论。精彩留言会获得点赞!