离心机及离心分离血液样品的方法与流程
离心机及控制离心机的方法,包括具有转动轴的转子、用于血液样品容器(container)的至少一个容纳器(receptacle)、用于控制转子的转动速率的控制器装置、用于发送光学信号的至少一个光学发送器、用于记录光学信号的振幅的至少一个光学接收器。
背景
在现代医学中,将来自血液的成分用于治疗疾病或用于诊断用途的趋势不断增加。从血液提取成分(例如凝血细胞(血小板)、白血球(白血细胞)或血浆)的一种方法是通过将全血的容器放在离心机中来使全血分级,在离心机中,血液被分离成其组分部分。
所述组分部分可以用于对人体而言特定的治疗或诊断目的,其中特定的组分可以被施用于可能需要一定剂量的凝血细胞的患者,条件是患者在出血的情况下不具有足够的凝血细胞。全血的组分部分的另一用途可以例如是在伤口治疗中,其中全血可以被引入容器中,在所述容器中全血经诱导以凝结,以及在所述容器中,在特定离心分离方案之后,全血的组分已经被浓缩成血液制品。
WO 2010/020254公开了如何通过血液的离心分离来制备多层的血液制品,其中将血液置于容器中并且在将血液置于容器期间或之后启动血液的凝结。在离心分离期间,血液的组分彼此分离并且产生三层血液制品,其以相继的顺序包含第一层(基本包含纤维蛋白)、第二中间层(基本包含凝血细胞)和第三层(基本包含白血球)。
WO 2012/037942公开了用于通过离心分离制备多层血液制品的容器,其中所述容器包括填料口以及在容器内部可滑动的过滤器装置。该过滤器装置包括平面网和支撑浮力体,其中该过滤装置适于收集在所述网上或以上的多层血液制品。
在WO 2010/020254和WO 2012/037942中,需要全血和/或容纳全血的容器必须以某一速率离心分离某一时间量,从而确保在容器内部已经形成血液制品。
然而,因为用于提供血液制品的一个重要因素是全血在容器内部的凝结,因此已经观察到全血的凝结时间可以在捐赠者之间显著地变化。这种凝结时间的变化影响容纳全血的容器的离心分离过程,因为对于不同的血液捐赠者,血液制品的制备时间可以明显不同。还认知到诸如捐赠者的年龄、药物、饮食和健康的其他因素可以影响使用离心机的血液制品的制备时间。
因此,制备血液制品如WO 2010/020254中公开的血液制品的医学专业人员不具有任何在离心分离过程之前确定在某一速率下确保血液制品即将可以用于伤口愈合所必须的精确时间量的方法。
通常使用台式或桌上离心机(装备有沿着垂直轴转动的转子)进行血液制品的离心分离过程,其中将容器布置在远离转动轴的径向。容器通常以某一角度固定,或者其可以布置成当转子是固定的时与转动轴呈一角度放置并且当转子已经加速成转动运动时以朝向垂直于转动轴的平面的方向转动,即,摆头离心机或摇动(桶)离心机。容器的此类转动运动确保在离心分离期间的离心力可以沿着容器的纵轴指向,确保全血内部的颗粒的颗粒密度处于相继顺序,其中具有较高密度的颗粒在容器的远侧端,而具有较小密度的颗粒则聚集在容器的更近侧的位置。相对于离心机的转动轴来定义术语近侧和远侧,其中容器的远侧端是容器在离心分离期间更加远离转动轴而布置的部分,而近侧端则接近于转动轴而布置。
出于安全原因,台式或桌上离心机装备有盖子,以使转子的转动运动不能伤害或危害到在操作期间位于离心机附近的任何人。因此,这通常意味着在离心分离期间不能检查容器内部的血液样品或全血,因为没有通向容器的内容物的直接视觉通路。此外,因为离心机可以在可高至4000RPM、8000RPM或更高(即,约66–132转/秒或更高)的转动速率下操作,因此即使会存在通向容器的内容物的直接视觉通路,也可能难以或甚至不可能在转动期间由肉眼看到容器的内容物的状态。
此外,因为在某一时段发生凝结(其中由缺少光学密度的变化来表明凝结的终止),因此在该过程期间必须不断地观察该过程,从而得到凝结过程的最佳结果。
因此,制备血液制品的医学专业人员不具有任何认知到容器的离心过程何时已经进行到足以制备足够使用的血液制品的方法或工具。因此,医学专业人员已经尝试计算出足以用于大部分使用者的时间量,并且将这种合格的推测的时间量应用于离心过程。作为实例,如果预定的时间量为10分钟,则该时间量可以足以用于一些捐赠者,而对于其他捐赠者,血液在从离心机移除容器并用眼检查内容物之后必须被再次引入离心过程。对于一些捐赠者,血液制品可能在初始离心分离的2-5分钟内准备好,而对于其他捐赠者,血液制品可能在初始离心分离的15-20分钟内准备好,或甚至更久。
因此,如果必须制备捐赠者的用于伤口治疗的多个血液制品,则每分钟的虚耗的离心分离和/或视觉检查可能由于待由随后的离心分离过程制备的产品的量而倍增。因此,亟需提高离心过程的效率。
概述
根据本发明,提供了离心机,其包括具有转动轴的转子;具有重力轴的用于血液样品容器的至少一个容纳器,其中所述容纳器包括用于接收血液样品容器的顶部端和用于容纳血液样品容器的底部端,其中所述容纳器的位置与离心机的转动轴呈一角度,其中离心力从所述容纳器的顶部端延伸向所述容纳器的底部端;用于控制所述转子的转动速率的控制器装置;用于在与所述容纳器的重力轴呈一角度且穿过所述血液样品容器中的血液样品的上部段和/或血浆的方向发送光学信号的至少一个光学发送器;用于记录所述光学信号的振幅的至少一个光学接收器,其中所述光学信号被设置成指向所述血液样品容器,其中所述光学接收器检测所述光学信号的振幅,其中所述光学信号的振幅反映出所述血液样品的上部段和/或血浆的半透明度,其中所述控制器装置被设置成当光学信号的振幅随着时间已经满足表明至少开始血浆的纤维蛋白聚合段的预定义的图谱时终止所述转子的转动运动。
血液的半透明度的测量是相对因素,取决于光学发送器和光学接收器的选择以及血液样品容器的材质。因此,对于本发明,光学信号的振幅被认为是其中测量适于检测血液样品的随时间的半透明度的变化的相对半透明度的代表。光学发送器可以是基于LED的发送器、激光二极管,其中适当波长的光可以定向发射向光学接收器。光学接收器可以是光电检测器,例如p-n光电二极管、p-i-n光电二极管、雪崩光电二极管或任何类型的能够记录并区分所接受的光的振幅的光电二极管。
离心机可以具有其中容纳器可适于从与离心机的转动轴基本平行的重力轴的位置移动至与离心机的转动轴基本垂直的位置的任何类型。离心机因此可以是具有摇摆桶(容纳器)的桶式离心机,或可以是其中可相对于离心机的转动轴呈某一角度固定该桶(容纳器)的固定角离心机。
容纳器相对于离心机的转动轴的角度可以为30°至90°。已经表明,离心分离的优选方法可以是其中容纳器相对于转动轴呈90°角,或其中容纳器基本垂直于转动轴。一些离心机可以具有容纳器,其中所述容纳器呈固定角度,其中所述角度可以为30°至90°的任何值。
根据本发明的离心机可以是转动式离心机,其提供离心力以通过提高施加于包含全血的容器的重力而沉淀全血。离心机的转子可以适于使容纳器围绕固定轴转动,从而与固定轴垂直地施加离心力。容纳器可以在离心机内部用铰链连接,从而容纳器当停止时处于基本垂直的位置(平行于固定轴),并且在离心分离期间,容纳器会向基本水平的位置(垂直于固定轴)倾斜。因此,容纳器和/或血液样品容器的纵轴可以在离心分离期间基本垂直于固定轴,从而以平行于容纳器和/或血液样品容器的纵轴的方向施加离心力。或者,以与血液样品容器的纵轴呈一角度的方向施加离心力,其中所述角度可以为约1°至60°度。
因此,离心力可以被视为处于在远离离心机的转动轴的方向延伸的方向,从而重力首先与血液样品容器和/或容纳器的顶部相交,随后与血液样品容器和/或容纳器的底部相交。这意味着容纳器/容器的顶部与容器的底部相比更接近离心机的离心轴,其意味着离心力迫使血液分离处于从容器/容纳器朝向容器/容纳器底部的方向。因此,通过离心机而施加于容纳器和/或容器的重力场在容器/容纳器更接近转动轴的区域(即,在容器/容纳器的顶部端)与其在容器/容纳器远离转动轴的区域(在容器/容纳器的底部端)相比更低。重力场可以使用下式计算
其中RCF是转动离心力,R是转动半径(以毫米测量),并且RPM是离心机的转动速率。
在本发明的含义中,容器的上部部分可以是在离心分离期间容器接近于离心机固定轴的部分,而容器的下部部分是容器远离离心机固定轴的部分。
在将全血离心分离成血液制品期间,血液分级的段可以包括当血液样品被离心分离时的以下段:
-血液分离这可以视为血液初始分离成其组分,其中全血分离成在容器的上部部分中的血浆的澄清溶液、包含白血球和血小板的血沉棕黄层的中间部、以及在容器底部的红细胞,因为红细胞具有比白血球和血小板更高的密度。在该段中,血浆包含纤维蛋白原单体。这种分离可以见于三个段,其中该分离可以被视为白血球的分离、血小板的分离。
-纤维蛋白聚合,其中纤维蛋白原单体首尾相连地聚合以形成原纤丝,其侧向缔合以形成纤维蛋白纤维。血浆中的纤维蛋白聚合段导致血浆的半透明度随着形成纤维蛋白而降低。
-纤维蛋白压缩,当完成纤维蛋白聚合时,血浆内部的纤维蛋白纤维由于离心分离而开始在凝血细胞的顶部上压缩,并且血浆的半透明度开始增加。
其他血浆组分的清除,在此段中,已经完成纤维蛋白压缩,并且血浆中的其他组分开始聚集,导致血浆的半透明度甚至进一步增加。其他组分可以包括颗粒、细胞和分子,例如脂肪、纤维蛋白、纤维蛋白原或在血浆中并且在离心分离期间将清除的任何其他组分。血液的分离可以被视为其中分离意欲将血液的不同部分分离到容器的单独的区域中的过程。分离可以是红细胞的分离、白血球的分离和血小板的分离,其中使用利用穿过全血部分的光学信号的测量,可以鉴定该过程的三个分离段。
可以使用血浆的半透明度的测量来认知血液分级的上述段中的每一段,其中在基本恒定的离心分离过程期间半透明度谱的某些变化表明一个段向其后续段的转变。
光学发送器可以适于发送光学信号,其中光学接收器适于测量预定义的尺度的信号的振幅。光学信号行进穿过血液样品容器,并且如果光学信号与液体部分中的组分相交,则光学信号会由于相交而弥散,并且仅部分的光学信号将行进穿过容器以被光学接收器接收,并且信号的振幅将以预定义的尺度降低。因为随着时间记录光学信号,因此可以监视在容器内的液体的澄清度相对于预定义的尺度是否是恒定的、增加的或降低的。
控制器装置可以适于接收来自光学接收器的输入,从而可以利用光学信号的振幅来控制离心机的转动速率。控制器装置可以包括信号比较器,从而当由控制器装置观察到信号的某一阈值、图谱或趋势时,控制器装置会通过控制发送至离心机转子的电信号的电流或电压来调节离心机的转动速率。控制器装置可以为微处理器、微控制器的形式,能够接收从光学接收器发送的电信号、处理所接收的信号并基于所接收的电信号通过发送出输出信号以控制离心机的转动运动以进行某些操作。
可以设置离心机,从而光学信号指向并行进穿过容器的上部部分,从而光学信号在血液的初始分离期间行进穿过血浆。这意味着光学信号的振幅能够记录全血中的组分(血沉棕黄层和红细胞)何时由于在离心分离期间的离心力而被迫使朝向容器的底部。因此,通过将光学信号发送到容器的上部部分中,澄清血浆和全血之间的振幅差被最大化,允许光学信号的振幅的最大变化。光学信号应被发送穿过容器的下部部分,穿过全血的传输会以穿过血液样品的不透明部分为开端,并且传输振幅会在初始血液分离段期间降低,因为血沉棕黄层和红细胞会向容器的底部移动,导致液体变得更不透明。因此,振幅变化会降低,这会导致测量与穿过上部部分的测量相比可靠性降低。因此,能够进行这样的测量,并且能够鉴定单独的段的图谱,但在上部部分中的测量的可靠性被视为更大的,因为液体的不透明度和/或半透明度的变化更大。
或者,光学信号可以是辐照容器的光源,其中光学接收器可以为能够记录从容器反射出的光的振幅的照相机的形式,从而当液体是半透明的时,由照相机接收的光学信号的振幅是低的,其中光学信号在血浆的半透明度降低时增加。因此,在此类测量中,鉴于其中光学信号行进穿过容器的实施方案,可以光学信号的振幅可以是呈反比的(inverted)。因此,可以通过由照相机获得的信号的图像分析或图像处理(例如特征提取)来获得振幅的图谱。照相机可以获得连续的或离散的图像,所述图像被送入图谱识别软件,所述图谱识别软件可以是控制器的一部分或与控制器协同工作。
因此,通过连续记录光学信号随时间的振幅,可以监测离心分离过程,从而适时地评价血液样品在给定时刻是何种状态。当信号已经遵循预定义的图谱时,可以确定血液样品处于期望的状态,允许从血液样品容器收集血液制品。因此,当血液样品已经达到其期望的血液分级的段时可以停止离心分离,确保离心分离在期望的段之前不被终止,或与必要情况相比不再更久地进行离心分离。
预定义的图谱可以通过分析来自多个独立的患者的信号而定义,其中通过试验和误差可以得到光学检测中表明至少开始纤维蛋白压缩的类似图谱。
此外,可以依靠曲线图来监测信号,这允许专业人员分析信号以得到凝结和/或血液分级已经达到足以形成血液产品(blood production)的水平时的正确时间。
可以持续进行离心分离以超出纤维蛋白压缩段的初步部分,从而确保已经压缩在容器的下部部分中的所有纤维蛋白。容器上部部分中的光学信号的振幅会在纤维根聚合段期间降低,因为纤维根分子彼此结合并导致血浆在聚合段期间变得更不透明。随后,当完成纤维根聚合时,纤维蛋白开始在容器的下部部分中被压缩,导致光学信号的振幅在纤维蛋白压缩段增加,因为聚合的纤维根(纤维蛋白)被从血浆中清除。离心分离可以进一步持续进行至血浆组分段的清除,其取代了纤维蛋白压缩段,因为光学信号的振幅增加,甚至进一步因为血浆中的组分由于离心力而移动向容器的底部,或其中组分可以由于它们的密度而移动向容器的顶部,例如,其中脂肪组分漂浮向血浆的表面。
在一实施方案中,预定义的图谱可以表示开始纤维蛋白聚合段。纤维蛋白聚合段可以被视为其中血液制品的组成开始变得做好准备的段。纤维蛋白聚合段允许纤维蛋白在后续段中被压紧,从而剩余的组分,即凝血细胞和白血球,可以粘附于纤维蛋白上。纤维蛋白聚合段当开始凝结过程时在血液样品中发生,并且当已经开始初始血液分离时发生。
在一实施方案中,预定义的图谱指示信号的振幅随着时间已经达到基本稳定状态。在根据本发明的血液分离的一些情况中,血液样品的物理性质可以使得液体或血浆中的纤维蛋白的量不足以使血样样品开始纤维蛋白压缩段。此类情况可以当患者处于降低凝血的药物时、当患者患有降低纤维蛋白原的产生的肝疾病时发生,患者应具有纤维蛋白原的遗传性变异或患者可能具有的其他物理因素。因此,当纤维蛋白原已经完成其聚合时,光学信号的振幅可以随着时间而不变,这表明该过程完成并且纤维蛋白压缩阶段不会开始。因此,可以及时在此时停止离心分离。
在一实施方案中,预定义的图谱指示至少开始血液样品的纤维蛋白压缩。对于基于纤维蛋白的血液制品的产生,可以有利的是,在离心分离期间开始血液离心分离的纤维蛋白压缩段。纤维蛋白压缩段确保全血的特定组分,例如白血球(白血细胞)和凝血细胞(血小板),被压缩以使得组分粘附于纤维蛋白。因此,为了确保离心分离过程持续进行到纤维蛋白压缩段开始为止,预定义的图谱应指示何时开始压缩段,从而使控制剂被设置成图谱的特定部分以准备终止离心分离过程。
在另一实施方案中,当红细胞已经从血浆分离时,但在白血球和血小板已经从血浆分离之前,可以降低离心力。离心力的降低可以在纤维蛋白段聚合期间将白血球和血小板留在血浆内,并且可以由此在聚合之后被纤维蛋白包围,并且可以因此连同纤维蛋白一起被嵌入血浆。因此,当可以进行纤维蛋白的压缩时,白血球和血小板可以与纤维蛋白层缠结。其中血浆包含在血浆中的白血球和血小板的血浆在离心分离期间的光学特征(optical signature)类似于其中白血球和血小板已经分离的光学信号的特征,其中差异是血浆在纤维蛋白聚合之前更不半透明。在纤维蛋白的聚合期间,光学特征遵循类似的图谱,其中血浆的半透明度在纤维蛋白的聚合期间逐渐降低。在本发明的一实施方案中,离心机可以包括至少两个光学发送器和两个光学接收器。通过引入更高数量的光学发送器和光学接收器,可以发送多于一个的光学信号穿过血液样品容器,增加振幅测量的可靠性,因为第二信号可以提供振幅测量的冗余。因此,控制器可以被设置成监测在离心分离期间两个信号随时间的振幅,并且其中预定义的图谱可以施用于两个信号,或者可以对每一信号构建预定义的信号,其中可以基于施用于两个光学信号的技术实验来构建图谱。
在本发明的一实施方案中,两个光学发送器可以适于将光学信号发送到容纳器和/或血样样品容器的两个不同部分中。通过使光学发送器适于发送光学信号穿过容器的不同部分,光学信号可以用于测量不同位置的血液分级的不同段。因此,如果光学测量之一表现出指示血液分级处于何种阶段的某一趋势,而其他光学测量未表现出,则其可以表明该段并未在整个容器中完成,而仅是部分地完成。因此,第二测量用于补充第一测量,从而确保控制器能够基于两个振幅测量的图谱来识别期望的段。
在本发明的一实施方案中,两个光学发送器可以适于发送光学信号穿过容纳器和/或血液样品容器的中心纵轴,其中第一光学信号适于行进穿过容纳器和/或血液样品容器的第一部分,而第二光学信号适于行进穿过远离容纳器和/或血液样品容器的第一部分的部分。因此,光学信号适于测量在容器的两个以上的不同高度处的容器的内容物的半透明度。因此,由于血液分级的段发生在离心力的方向,即,平行于容器和/或容纳器的纵轴的方向,因此每一光学信号可以能够记录处于不同阶段的段。这可以是可见的,即,在纤维蛋白压缩段期间,因为血浆中的纤维蛋白在容器中被向下推行,并且容器顶部中的血浆由此与容器的更远端部分中的血浆相比会更早地变得更加半透明。因此,两个光学信号的振幅由此能够被用于确保控制器能够更可靠地记录在离心分离期间在任何特定时间时血液样品所处的段。
在本发明的一实施方案中,容纳器可以包括贯穿的开口,允许光学信号以径向方向行进穿过容纳器。在诸多离心机中,转子装备有诸多容纳器以接收待被离心分离的容器。因为离心力是实质的力,由此可以有利的是,容纳器适于至少包封容器的底部部分,从而确保容器在离心分离期间于侧向运动或平行于离心力(垂直于固定轴)的运动中不能挣脱容纳器。因此,容纳器可以以这样的方式形成,即,容纳器覆盖容器或至少覆盖容器的可以让光信号有利地行进穿过的部分。因此,容纳器可以装备有至少一个贯穿的开口,其允许光学信号行进穿过容纳器进入容器,并且行进穿过容器的相对侧,从而可以通过光学接收装置测量光学信号。贯穿的开口可以是任何形状,为孔形式、狭缝形式或任何移除材料后的形式,其中唯一要求是光学信号能够行进经过容纳器的壁并且测量容纳器和/或防止在容纳器内的容器内部的液体样品。或者,贯穿的开口可以覆盖有透明覆盖物,确保如果在容纳器内部有泄露物,例如来自血液样品容器泄露物,覆盖物则可以确保容纳器是对流体和/或液体密封的,并且泄露物不从容纳器转移并进入离心机的内容积。
或者,容纳器可以以这样的方式形成,即,其提供从容纳器一侧到另一侧的光学途径,允许光学信号行进穿过其内容积。这可以通过用透明材料如透明聚合物、玻璃或其他类型的合适的材料形成容纳器而实现。
本发明还涉及离心分离血液样品的方法,包括步骤:提供离心机,所述离心机包括具有转动轴的转子、具有重力轴的用于血液样品容器的至少一个容纳器、用于控制转子的转动速率的控制器装置、用于发送光学信号的光学发送器、用于记录光学信号的振幅的光学接收器;将血液样品容器置于容纳器内部,其中血液样品容器包括顶部端和底部端并且具有中心轴,其中容纳器的重力轴基本平行于血液样品容器的中心轴;开始离心过程,其中容纳器的重力轴与离心机的转动轴呈一角度,并且其中离心力在首先与顶部端相交并随后与容器的底部端相交的方向延伸;以与容纳器的重力轴呈一角度的方向发送光学信号穿过血液样品容器,其中光学信号被发送穿过血液样品的上部段和/或血浆;记录光学信号的振幅;当光学信号随着时间的振幅已经满足指示至少开始血浆的纤维蛋白聚合段的预定义的图谱时终止离心过程。
这表明如果在一段时间内离心分离血液样品,并且光学信号被发送进入血液样品,则可以测量信号的振幅并基于随着时间的测量,测量表明在任何给定时间时血液样品为何种血液分级状态。测量表明血液样品的透明度或其不足,其中振幅测量随着时间的比较表明血液样品是否变得更加透明或更不透明,或振幅测量在给定时间内是否是稳定状态。
因此,如上关于根据本发明的离心机的公开内容所讨论的,所述方法可以用于预期或认知到血液样品何时达到其期望状态,例如在离心分离期间何时达到纤维蛋白压缩段。
血液样品容器的顶部端可以具有可被封闭的开口或被闭合的盖子,确保血液样品容器在已经将血液样品引入容器中之后对于环境是密封地封闭的。容器的底部端可以被视为容器适于接收血液样品的致密的部分(即,血液样品在离心分离期间沉降向底部的部分)的部分。当启动离心机时,优选的是血液样品容器在离心分离期间以这样的方式取向,即离心力从容器的顶部端行进向底部端,从而血液样品的分级以这样的方式发生,即,红细胞沉降向容器的底部,血沉棕黄层集中在红细胞上,并且血浆位于血沉棕黄层上。因此,离心力将血液样品中更致密的颗粒推向底部。因此,当根据所述方法放置血液样品时,血浆将总是在血液样品容器的高于容器底部端的部分,并且当使用血液样品填满容器时,更可能在容器的上部部分。
因此,通过发送光学信号穿过血液样品容器的其中在分级期间血浆会出现的部分,可以测量在离心分离期间血浆的半透明度。
离心机可以具有其中容纳器可适于从与离心机的转动轴基本平行的重力轴的位置移动至与离心机的转动轴基本垂直的位置的任何类型。离心机因此可以是具有摇摆桶(容纳器)的桶式离心机,或可以是其中可相对于离心机的转动轴呈某一角度固定该桶(容纳器)的固定角离心机。
根据本发明,离心过程可以在终止离心过程之前发生变化。因此,当已经从血浆分离红细胞时,可以降低离心分离的速率,其中所述方法可以在更低的RPM(速率)下持续进行,直至已经确定纤维蛋白聚合为止。当已经聚合纤维蛋白时,RPM(速率)可以增加,从而提供纤维蛋白的压紧效应。因此,在终止之前,光学信号的振幅可以用于改变离心分离的速率,并且当已经完成纤维蛋白聚合和/或已经完成纤维蛋白压缩时,可以终止离心分离过程。容纳器相对于离心机的转动轴的角度可以为30°至90°。已经表明,离心分离的优选方法可以是其中容纳器相对于转动轴呈90°角,或其中容纳器基本垂直于转动轴。一些离心机可以具有容纳器,其中所述容纳器呈固定角度,其中所述角度可以为30°至90°的任何值。
在一实施方案中,预定义的图谱可以包括随着时间基本不变的振幅测量,其触发离心过程的终止。在血液样品的血液分级期间,血液样品可以在将血液样品离心分离无限时间量的设想下经历至少四个段。所述段可以被视为:血液(血浆、红细胞、白血球、血小板)的分离、纤维蛋白聚合、纤维蛋白压缩和其他血浆组分的清除。当血液样品已经被离心分离足够的时间以使得血液样品处于清除其他血浆组分的段中时,信号的振幅增加,直至血浆中的其他组分已经被迫使离开血浆为止。当所述组分离开血浆时,光学信号的振幅变得基本稳定,即,其中光学信号的振幅不随着时间显著变化(稳定状态)。因此,在信号已经达到稳定状态时,已知纤维蛋白压缩和其他血浆组分的清除二者是完成的。因此,为了确保血液样品已经被离心分离到足以至少开始纤维蛋白压缩段,当完成纤维蛋白组分的清除时可以停止离心分离,即,通过当振幅测量达到稳定状态时终止离心分离。
在一实施方案中,预定义的图谱可以包括光学信号的振幅的第一增加。振幅的第一增加,如本发明中所定义的,是指在血液分级的纤维蛋白压缩段期间光学信号的振幅的增加。当聚合的纤维蛋白开始被迫使离开血浆朝向容器的底部时,开始振幅的增加,导致血浆由此变得更澄清。因此,振幅的第一增加可以被视为光学信号的在纤维蛋白压缩期间随着时间变得更强的测量。
当由控制器记录振幅的第一增加时,由实验已知开始了纤维蛋白压缩段,并且血液制品开始形成为将纤维蛋白压缩至凝血细胞和/或白血球,允许凝血细胞和/或白血球与纤维蛋白粘附在一起。因此,振幅的第一增加可以是为了提供来自血液样品的血液制品而可以停止离心分离的指示。
术语“振幅的第一增加”的使用不表示振幅的第一时序增加,因为振幅的第一增加并未必然是随着时间的振幅的第一次记录的增加。术语第一增加仅表示振幅的某一增加的认定,并且可以使用任何其他装置鉴定。
在一实施方案中,预定义的图谱可以还包括光学信号的振幅的第二增加。振幅的第二增加可以先于振幅的第一增加,并且可以被视为血液样品处于血液的初始分离的血液分级段的指示。当血液的组分被分离时并且当全血被分离成在容器的上部部分中的血浆的澄清溶液时,发生振幅的增加。因此,振幅的增加表示光学信号被传送穿过液体的相对澄清的部分。然而,振幅的第二增加必须在时序上由振幅的增加来接替,从而表明在容器内部开始纤维蛋白压缩段。
在一实施方案中,振幅的第二增加之后是光学信号的振幅的第一降低。振幅的第一降低在振幅的第二增加之后,并且表明澄清血浆中开始纤维蛋白聚合。纤维蛋白聚合导致澄清血浆变得更不透明,这导致光学信号的振幅的降低,因为更少的光学信号行进穿过容器的内容物。这种振幅的降低可以与血浆内部的纤维蛋白密度有关,并且当振幅已经达到预定义的水平、或振幅变化率(增加或降低)已经达到预定义的水平时,可以停止该过程,因为两个信号之一可以用于推断在离心分离期间已经形成足够的纤维蛋白。
在振幅测量的时序视图(temporal view)中,振幅的第一增加在振幅的第一降低之后,因为在纤维蛋白压缩阶段中压缩聚合的纤维蛋白。
应理解,控制器可以以这样的方式设置,即,通过程控该控制器来忽视图谱或通过在完成振幅的第二增加之时仅开始振幅测量,从而该控制器不对振幅的第二增加或振幅的第一降低作出反应。基于本发明的公开内容可以显而易见地以这样的方式程控该控制器,即,其在其测量最初期对振幅的第一增加作出反应。
在一实施方案中,预定义的图谱可以还包括光学信号的振幅的第三增加。振幅的第三增加可以用于表明血液样品处于血液分级的第四段,即,从血浆清除其他组分。因此,当血浆中的颗粒被迫使朝向容器的底部、或升高到血浆表面(例如,脂肪和脂质)时,血浆变得甚至比在纤维蛋白压缩段中更澄清,这导致其中振幅增加的振幅测量。第三振幅增加在第二振幅增加之后,其中可能存在短的临时测量,其中振幅的第二降低和/或振幅的相对缓慢的增加在振幅的第三增加之前。
在一实施方案中,由离心机向血液样品施加的离心力为至少400G,或更优选至少600G,或更优选至少800G,或更优选至少1000G。施加的离心力可以进一步是,施加的离心力为比重力(例如,作用于全血上的)大至少1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍、9000倍、10000倍、1 1000倍、12000倍、13000倍、14000倍、15000倍、16000倍、17000倍、18000倍、19000倍或甚至20000倍,或施加的离心力可以在可由提及的数字的组合定义的任何区间内。施加离心力所用的时间可以取决于振幅测量,其中当离心分离已经产生期望的制品时控制器停止离心分离。对必要的离心力的教导可以在WO 2010/020254和/或WO 2012/037942中找到。
在一实施方案中,当在血液样品容器内部的漂浮装置与光学信号相交时,可以重新开始血液样品的离心分离并且可以持续进行离心分离,直至光学信号记录振幅的降低为止。WO 2012/037942教导了具有漂浮装置的容器,其中漂浮装置适于收集在一表面上的血液制品。根据本发明,离心机或方法可以与类似的装置协同使用,其中在第二离心分离期间释放漂浮装置。当漂浮装置从容器的下部部分释放时,漂浮装置向上行进朝向装置的上部部分,并且向前行进向装置的顶部。因此,光学信号的振幅测量能够记录漂浮装置何时与光学信号相交,因为振幅测量在短时间段内迅速降低。因此,当振幅迅速降低时,这表明漂浮装置处于朝向顶部的进程之中,并且因此可以停止第二离心分离过程。
在本发明的含义中,振幅测量的稳定状态可以被定义为其中信号的振幅不显著变化的随着时间的测量,即,当其看上去似乎振幅的增加或降低的速率非常低。
在本发明的含义内,本发明涉及离心机的公开内容可以等同地施用于涉及方法的公开内容,反之亦然。
关于本发明的离心机所公开的技术特征可以在本发明的方法中实施,反之亦然。
光学信号可以以任何方式获得,条件是发射的光学信号和测量的光学信号是血液样品的内容物的代表,并且尤其是在特定区域中血液样品的半透明度的代表。本发明的目的是获得血液分级状态的测量,从而获得停止离心过程的最佳时间,并且允许获得血液制品。
在本发明的一实施方案中,当使用血液样品容器(即,与WO 2012/037942所示那样类似的)时,所述离心机或方法可以适于在初始终止之后重新开始,从而允许浮力装置漂浮向容器的顶部。
附图简述
参考附图,下文详细地阐述本发明,其中
图1是本发明的离心机的转子的俯视图,
图2是沿着图1的轴ll-ll获得的使用一个光学发送器的离心机的截面图,
图3是沿着图1的轴ll-ll获得的使用两个光学发送器的离心机的截面图,
图4表示使用包括一个光学发送器和接收器的离心机的血液样品的血液分级的测量数据,
图5表示使用包括两个光学发送器和两个光学接收器的离心机的血液样品的血液分级的测量数据,以及
图6表示血液样品的血液分级的测量数据,与图4中公开和图5中表示的类似,其中血液样品不在纤维蛋白压缩段开始。
附图详述
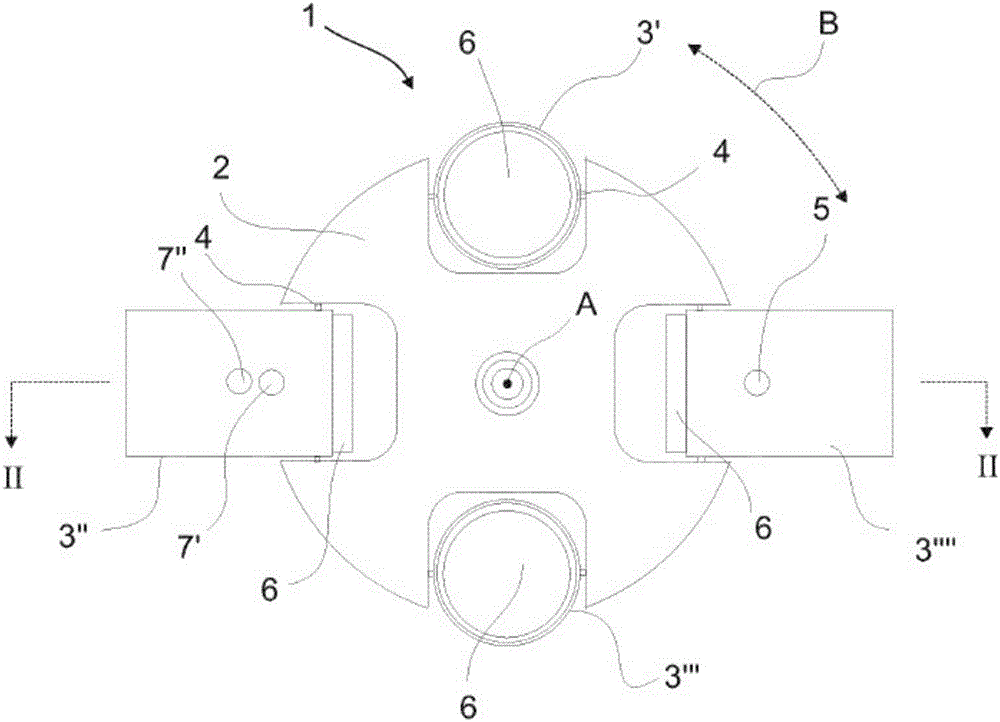
图1是离心机1的转子2的俯视示意图,其中转子能够与固定轴A交叉地旋转。转子装备有四个容纳器3',3",3"',3""(根据本发明可以更多或更少),其连接于转子2。容纳器经由铰链4连接于转子,铰链4允许容纳器与垂直于转子2的径向轴的轴交叉地转动,从而容纳器能够从容纳器的垂直位置(如由3',3"所示的)(当转子是固定的时)转动向容纳器的水平位置(如由3",3""所示的)(当转子在离心分离期间在由箭头B所示的方向之一中沿着轴A转动时)。
在容纳器3""的实施方案中,容纳器3""装备有贯穿的开口5,其允许通向容纳器3的内部容积的通路,其中容纳器3的内部容积适于接收可以用于容纳血液样品的容器6。贯穿的开口5可以提供在径向(垂直于容纳器的纵轴)的通向容纳器3""的内部容积的通路,其中容纳器的相对侧可以装备有第二贯穿的开口(如图2中所示),允许视线经由容纳器3""的内部容积穿过容纳器3""的侧壁7。
在容纳器3"的不同实施方案中,还如图1中所示,容纳器3"可以装备有两个贯穿的开口7',7",允许两个单独的光学信号传输进入容纳器的内部容积,并且穿过在容纳器的相对侧中的匹配的开口,如图3中所示。
图2是沿着图1的轴11-11获得的使用一个光学发送器的离心机的横截面视图。转子2沿着转轴16转动,转轴16平行于固定轴A,其中轮轴旋转地连接于轴承,所述轴承将转轴16连接于旋翼毂15。旋翼毂可以由驱动装置如电动机驱动,其中电动机可以被设置成向旋翼毂15提供可变或恒定的驱动力。当转子2处于移动时,容纳器3从其接收位置(即,垂直位置,如图1中所示)移动到垂直于转动轴A的延伸位置,从而容纳器的近侧端13朝向转动轴的方向,而远侧端14朝向远离转动轴的方向。
离心机1装备有在光学传感器/接收器12的方向中发送光学信号的光学信号源/发送器11,所述光学传感器/接收器12可以位于垂直于光学发送器11的方向。光学信号被发送到离心机的其中容纳器行进穿过光学信号17的区域中。如先前提及的,容纳器可以装备有在容纳器3的侧壁上的贯穿的开口8,允许光学信号进入容纳器的内部容积9并且通过在容纳器3的侧壁的相对侧上的贯穿的开口5离开容纳器3,从而光学信号17行进穿过容纳器3的内部容积9。
因此,如果容器6被液体如血液样品填充满,并且由盖子10封闭,并且随后位于容纳器3的内部容积9的内部,则光学信号17拦截容纳器的其中已经放置容器6的内部容积。通过使得容纳器具有光学信号可渗透的侧壁(例如,通过是透明的),信号17由此将行进穿过容器6以及容器的信号17行进区域中的内容物。因此,当信号与透明的物体相交时,由传感器/接收器12测量的信号的振幅是相对高的,而如果信号与不透明的物体相交时,信号的振幅相对于穿过澄清物体的振幅将会降低。
在离心分离期间,光学信号可以被发送穿过容纳器3和容器6,从而提供离心分离期间容纳器内部的物体的透明度的连续测量。因此,如果物体的透明度随着时间变化,例如在血液分级期间发生,则接收的信号会反映出在任何给定时间时的物体的透明度。通过提供光学信号的振幅的连续光学测量,可以确定内容物是否变得更加透明、更不透明或处于稳定状态。
光学接收器和/或光学发送器的定位可以根据本发明变化,条件是确保允许光学信号行进穿过待测量的液体或血液样品。因此,发送器或接收器的定位可以反转,或光学信号以一角度行进穿过液体,使用镜子反射,或关于本文实施方案以其他方式改变。
图3是沿着图1的轴ll-ll获得的使用两个光学发送器11,11'和两个光学接收器12,12'的离心机的截面图。在该实施方案中,两个光学信号17,17'适于沿着离心力的方向在不同位置行进穿过容纳器3和/或容器6。因此,可以使用单独的传感器/接收器12测量容纳器的不同区域处的光学信号17的振幅,允许控制器利用两个不同的测量来评价血液分级是否在离心分离期间处于最佳的阶段。另外,图3中所示的离心机与图2的离心机类似地操作,其中关于图5公开了信号的输出。
图4表示使用包括一个光学发送器和接收器的离心机(与图2中所示的类似)的血液样品的血液分级的测量数据。图4中的图示显示在横轴上以分钟计的时间尺度、在最左侧纵轴上传输%(光学信号振幅)尺度以及在最右侧纵轴上RPM(转数/分钟)尺度。在图中呈现的数据是光学信号振幅测量X和离心分离速率Z。
光学信号朝向血液样品容器的上部部分,从而处于其中以远离被测量的区域的方向向下推动全血的组分的区域中。测量的区域是其中在离心分离期间出现血浆的区域。
离心分离速率从测量开始(≈0min)直至测量终止(≈19.7min)被维持在约4400RPM。
在第一时段,即,从0min至7.85min,其中该时段的结束以线p为标志,血液样品被分级并且处于分离血液段,如先前所讨论的。根据数据,所测量的血液的澄清度增加,因为凝血细胞、红细胞和白血球被压向容器的下部部分,允许全血/血浆增加澄清度,这由数据的澄清度的增加表示。因此,在第一时段结束时,信号的半透明度具有该时段的峰值,其中由在第二时段中表示的第二段替代第一段。
在第二时段,即,7.85min至11.75min,血浆中的纤维蛋白原开始聚合,导致血浆变得更不澄清(更不透明),这导致传输信号的振幅显著降低,该信号的振幅从约90%降低至20%。当纤维蛋白源已经聚合成纤维蛋白时,血浆的半透明度由于血浆中的纤维蛋白的含量而降低。振幅的改变可以在一个患者与另一患者之间变化,其中血液样品中的脂肪可以降低血浆的半透明度,并且初始纤维蛋白浓缩可能对测量有影响。然而,血液样品在离心分离时段期间变得更加半透明或更不半透明,并且形式为振幅增加、降低或稳定状态的半透明度的代表对于鉴定血液分级的段而言,可以是重要的。
当此段的纤维蛋白聚合已经开始或完成时,可以停止离心分离过程,尤其当在血浆中有降低的纤维蛋白含量时。这样的情形在图6中示出,其中纤维蛋白聚合没有被下一段(即,纤维蛋白压缩段)接替。
当已经在血浆中形成纤维蛋白时,纤维蛋白开始被推向容器的底部,并且启动第三段的纤维蛋白压缩。第三段在约11.75min启动,这是先前段的结束并且以线q为标志,并且该段在约12.5min结束,以线r为标志。在该段中,纤维蛋白被压缩到容器的下部区域中,并且血浆的澄清度迅速增加,因为从血浆移除纤维蛋白。
第四段的血液分级在约12.5min开始,以线r为标志,并且持续进行直至约17.5min(以图中的线s为标记)为止。在该段中,在血浆中的剩余组分中的一些组分被从血浆清除时,血浆变得更澄清,因为离心力迫使组分朝向容器的底部部分或者组分由于密度差而上升向表面。因此,该段可以由发送的信号的振幅增加而识别,因为剩余的组分逐渐从血浆移出。
在第四段之后,振幅测量行进到稳定状态,其中血浆的半透明度保持基本恒定。
图4表示的测量在来自一个受试对象的血液样品上进行。可以见到血液分级的每一段可以由血液样品的半透明度测量表示。然而,由于在一个对象与下一个对象之间关于分级血液所耗费的时间存在着非常高的变化,因此信号可以在一个人与下一个人之间不同。这种变化的原因可以是生理学原因、药学原因、物理学原因或具有其他不同的原因。然而,当分级未经抗凝的血液样品时及在血液能够凝结的情况下,所述段在大部分对象中是类似的。可能存在另外,其中血液样品中的纤维蛋白浓度不够高到允许纤维蛋白压紧段开始。该段可以使用根据本发明的光学测量来识别,从而防止血液样品被离心分离过量时间或者过短时间。
通过将控制器设置成使用预定义的图谱识别算法或使用其他手段识别所述段,可以自动地评价血液样品在任何给定时间处于哪一阶段,并且当血液样品处于期望的段时停止离心分离。
图5表示使用包括两个光学发送器和两个光学接收器的离心机(与图3中所示的类似)的血液样品的血液分级的测量数据。图5中的图示与图4中示出的图示类似,其中X表示来自位于容纳器/容器的上部部分中的光学发送器/传感器的数据,而Y表示来自适于从容纳器/容器的下部部分进行测量的光学传感器的数据,并且Y表示离心速率。
在图5中,可以见到来自上部测量X的数据表现与图4中表示的信号精确相同的趋势,其中该信号与先前信号之间的差异是在更短时间内完成所述段,即便在两个测量中离心力相同,因为血液样品在与图4的样品相同的离心机中、在相同的速率下和再相同的条件下离心分离。以线p为标志的第一段的结束在约4.75min完成,其中第二段在约6.8min结束(以线q为标志),第三段在7.2min结束(以线r为标志),而第四段在7.7min结束(以线s为标志)。
因此,在图5中的血液样品在比图4所示的测量更早的时间到达点s,这意味着如果离心分离已经持续进行与达到图4中以线s为标志的第四段的结束所耗费的时间相当的时段,则已经使用了大量的过量时间。
位于容纳器/容器的下部位置的第二信号Y与信号X基本关联,但似乎适时地偏移。因此,信号Y表明与信号X相同的趋势,但较晚地表示第一段(直至线p)的变化,在第二段中,透明度振幅持续进行至比第一信号更低的振幅(q'),并且第三段的结束(r')和第四段的结束(s')相对于上面的信号X适时地稍微偏移。
然而,第二信号Y表明与第一信号相同的振幅的增加和降低,这意味着此类信号可以用作谱图识别的冗余,或图谱识别可以被设置成当两个信号已经满足预先确定的图谱时终止离心分离。
图6表示使用包括两个光学发送器和两个光学接收器的离心机(与图3中所示的类似)的血液样品的血液分级的测量数据。在该情形中,光学信号X的振幅增加,直至其达到其峰值(其中线p与信号X相交)为止,其中初始血液分离发生并且血浆变得相对澄清。随后,在点p之后,纤维蛋白聚合开始并且信号的振幅降低,直至其达到其中线q与信号X相交的低点。在该情形中,由于血浆样品的物理性质而未开始纤维蛋白压缩的后续段,并且当信号已经达到其中纤维蛋白留在血浆中的稳定状态时,可以停止离心机。因此,为了获得血液制品,开始和/或完成纤维蛋白聚合段可以是足够的,并且其中当纤维蛋白已经聚合时停止离心机。因此,为了获得纤维蛋白的压缩,可以使用WO 2012/037942中公开的过滤器装置“手动”压缩纤维蛋白,其中该过滤器装置漂浮在血液样品上,收集纤维蛋白、凝血细胞和白血球,并且其中其在纤维蛋白在血液样品中上升时压缩纤维蛋白。或者,纤维蛋白压缩可以手动完成。
图4、5或6中示出的测量的具体振幅或尺度与本文的方法无关,因为振幅测量的随着时间的变化反映出所测量的样品的半透明度的变化。
实施例
根据本发明,已经提供以下实施例的离心机和使用离心机的方法。
已经改良Eppendorf离心机,其中白色LED发射器已经置于离心机隔室的底部区域中,并且光传感器已经置于离心机隔室的上部区域中。已经改良离心机杯(容纳器),其中开口已经布置在离心机杯中,当该杯处于其从LED向光传感器延伸位置(水平位置)时允许光行进穿过该杯。
光已经与离心机的转动偶联,从而当杯中的开口处于它们在LED发射器与光传感器之间排列成行的有角度的位置处时,LED发射器发光,从而光行进穿过底部中的开口,穿过杯的内部容积,并且朝向顶部中的开口穿出,朝向光传感器。
因此,从光传感器接收的信号是离散的信号,其表示在离心过程期间行进穿过杯的光。因此,不必采集信号以分离相关部分,因为当光能够行进穿过杯的开口时光才会射出。
离心机装备有四个杯,其成对地、彼此完全相反地横跨转动轴放置,从而四个杯之间的角为约90°,并且因此离心机横跨离心机的转动轴是平衡的。
- 还没有人留言评论。精彩留言会获得点赞!