包含对患病组织具有选择性的药效团的组合物及其制备方法与流程
本发明是在STTR赞助号为No.R41GM099174和来自国家健康研究所(NIH)的VITA合同号为No.HHSN268201400006C的政府支持下进行的。
相关申请
本申请要求于2014年8月6日提交的美国临时申请号为No.62/034,046和于2015年5月13日提交的美国临时申请号为No.62/161,121的优先权,其内容通过引用并入本发明。
技术领域
本发明一般涉及药物发现和开发的领域,特别关注选择性定位、结合和内化入患病细胞和组织的分子。
背景技术:
药效团被定义为分子发挥其生物学活性所必需的治疗性活性分子的保守分子特征。化合物的结构-功能关系研究可以提供对化合物及其特定生物靶标之间的最佳相互作用所需的特定空间和电子特征有价值的提示。
药效团的鉴定有助于设计具有相似生物活性的不同结构的分子。对药效团的理解可以带来关于受体-配体相互作用和未知受体活性位点的其它化学和结构特性的进一步细节。正确鉴定药效团还将允许通过产生具有增强的治疗选择性或更理想的药理学特性的类似物来进行化合物的潜在优化。
治疗疾病的主要障碍是相对缺乏可以选择性靶向患病组织而非健康组织的药剂。需要用于选择性靶向患病组织并减少与全身性治疗相关的副作用的治疗新策略。还需要选择性识别患病组织的诊断试剂。包含具有疾病选择性和内化特性的一类分子的药效团的确定将使开发具有显著治疗和诊断潜力的化合物成为可能。本发明通过确定对患病组织具有选择性的药效团来满足了上述需要。本发明还确定了匹配该药效基团并且可用于治疗或诊断目的的分子。这些化合物还适合作为单独的治疗,在患病组织中作为与治疗相偶联的归巢基团或用于选择性增强联合给药的效果。
败血症是由对感染的强烈免疫应答而引起的危及生命的医学病症。释放于血液中以抵抗感染的天然化学物质触发了全系统的炎症,这可导致多器官衰竭和死亡(National Institute of General Medical Sciences国家综合医学科学研究所,2014)。由于败血症的非特异性症状与许多其他病症重叠使得败血症难以诊断,据估计败血症的发生率被严重低报。即使如此,据估计败血症发生率占所有住院治疗的约2%,并且仅在美国每年便影响约75万人(Martin2012;Lever et al.,2007)。败血症的发病率也在上升,从1979年到2000年,每年的病例数从164,072例增加到659,935例,死亡人数从43,579增加到120,491例(Lever et al.,2007)。此外,败血症通常具有高死亡率,从最温和症状的10%死亡率,增加至败血性休克患者的接近80%的死亡率(Lever et al.,2007)。
目前用于治疗败血症的一种药物治疗是西维来司钠(sivelestat),一种嗜中性粒细胞弹性蛋白酶抑制剂。然而,西维来司钠作为败血症的治疗其功效尚未令人信服地证明。一项系统综述和荟萃分析检查了8项使用西维来司钠的独立试验,发现西维来司钠在随机分组后的28-30天内死亡率没有差异,机械通气天数没有差异,并且可能增加了180天死亡的死亡率(Iwata et al.,2010)。研究结果表明,短期内西维来司钠可能与氧合的改善有关,并且如果西维来司钠有任何效果,其效果并不大(Iwata et al.,2010)。
抗凝血酶III也已被用于败血症的治疗。最近的数据表明,除了其抗凝血功能,抗凝血酶是有效的抗炎剂,且研究已经发现抗凝血酶III显著地降低了动物研究中使用致死剂量的大肠杆菌(Dept.Haematology,Royal Free University College London Medical School,2001)引发的多器官功能衰竭和死亡率。考虑到这些结果,一些临床试验用抗凝血酶治疗了败血症患者。几个较小的研究发现,虽然抗凝血酶治疗确实显示30天死亡率减少,但差异不具备统计学的显著性(Dept.Haematology,Royal Free University College London Medical School,2001)。较大的临床试验没有发现在接受抗凝血酶治疗的组和安慰剂组之间的存活差异,但是使用亚组分析确实发现抗凝血酶治疗在败血性休克——最严重形式的败血症患者中显示出显著的存活效果(Dept.Haematology,Royal Free University College London Medical School,2001)。另一项随机对照试验在超过2000名严重败血症患者的样本中测试了高剂量抗凝血酶III,并发现抗凝血酶III组的死亡率为38.9%,安慰剂组的死亡率为38.7%,而且两组之间次要终点没有显示差异(Warren et al.,2001)。
经常用于治疗败血症的一种最终治疗是类固醇治疗。然而,研究尚未找到显示类固醇治疗有助于败血症的确定结果,在一些情况下,研究发现类固醇治疗实际上导致继发感染,并对生存没有影响。在一项针对败血性休克患者测试低剂量氢化可的松(hydrocortisone)治疗的研究中,结果显示氢化可的松不能改善败血性休克患者的生存,而且氢化可的松治疗组发生更多超感染症状(Spring et al.,2008)。其他研究测试氢化可的松或其他皮质类固醇也未发现有益的存活效果,氢化可的松或皮质类固醇组实际上比安慰剂组经历了更多的并发症(Rakela et al.,1991;Hotchkiss et al.,2003)。
尽管大量使用医疗资源,包括血液动力学支持、液体复苏、血管加压药治疗、增强氧气输送、经验性抗微生物治疗、和皮质类固醇治疗(Claessens et al.,2007;Kilal et al.,2014),败血症的死亡风险为30-80%(Jawad et al.,2012)。对能够改善败血症存活的创新方法有迫切的、未满足的需求。
CAR在广泛的损伤,炎症和纤维化疾病包括伤口愈合方面(Jarvinen et al.,2007),肺动脉高压(Urakami et al.,2011;Toba et al.,2014),急性肺损伤,肺纤维化,慢性肾脏疾病和三阴性乳腺癌诱导的恶病质(Mann et al.,2015)提供和呈现临床前有效性。这些看似不同的疾病具有改变的糖萼的共同特征。败血症的特征还在于改变的糖萼(Chelazzi et al.,2015),使CAR成为通过与现有药物共同给药,作为与治疗剂偶联的归巢部分,或作为通过单独施用CAR治疗而有效降低与败血症相关的死亡率的强有力的候选药物。
发明概述
本发明公开了对于疾病的归巢和内化特性必需的CAR药效团的特征,并且进一步公开了落入CAR药效团范围内的分子实体。
本发明公开了含有确定的CAR药效团的化合物。本发明公开了选择性靶向肿瘤血管系统、再生组织、受伤组织、发炎组织、纤维化组织、重建组织、以升高的乙酰肝素酶水平为特征的组织,并且具有内化入这样的患病细胞的能力的肽。所公开的化合物还可以介导其他偶联的、结合的或联用的化合物的选择性靶向、内化和组织穿透。
本发明公开了含有环状、线性或截短的CAR药效团的化合物。
本发明还公开了含有具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段、相关氨基酸序列或CAR药效团的任何肽或蛋白质。所述肽或蛋白质可以由包含SEQ ID NO:1-8、12和16-33的氨基酸序列或具有一个或多个保守氨基酸取代SEQ ID NO:1-8、12和16-33的氨基酸序列的氨基酸片段组成。
本发明还公开了含有具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段,相关氨基酸序列或CAR药效团的任何肽或蛋白质,其氨基酸序列已经经历取代、插入或缺失修饰。本发明公开了含有具有SEQ ID NO:2-8、12和16-33的序列的氨基酸片段、相关氨基酸序列或CAR药效团的任何保守变种。本发明还公开了具有CAR药效团的偶联化合物,以及含有经历化学衍生化的CAR药效团的化合物。
本发明公开的组合物可以与任何分子模拟、计算化学或计算机辅助药物设计(CADD)技术一起使用,以确定SEQ ID NO:1-33的结构或含有CAR药效团的任何其它化合物。本发明公开了通过使用肽模拟物已经发现或开发的含有CAR药效团的化合物。
本发明公开了具有增强的或理想性能的分子,例如更经济的生产、更大的化学稳定性、降低的毒性或副作用、增强的药理学性质(例如半衰期、吸收、分布、代谢、排泄、效价强度、效能、靶结合或亲和力等)、改变的特异性(例如,广谱的生物活性)、降低的抗原性和其它。本发明还公开了具有增强的或理想性能的分子,例如更经济的生产、更大的化学稳定性、降低的毒性或副作用、增强的药理学性质(例如半衰期、吸收、分布、代谢、排泄、效价强度、效能、靶结合或亲和力等)、改变的特异性(例如,广谱的生物活性)、降低的抗原性和其它。
本发明公开了包含与具有独立功能的第二肽融合的归巢肽的双功能肽。还公开了通过组合技术或筛选技术鉴定的组合物,其中SEQ ID NO:2-33中公开的组合物或其部分被用于组合或筛选方案中的靶标。
本发明进一步公开了确定环状CAR药效团的方法,所述方法包括:
a)对环状CAR肽(SEQ ID NO:1)进行置换以合成至少七个另外的紧密相关的肽(SEQ ID NO:2-8);
b)对SEQ ID NO:1-8进行细胞结合和内化测定;
c)确定来自步骤b)的需要CAR保守以保留生物活性的任何残基和序列模式;
d)对SEQ ID NO:1-8进行计算机模拟以产生小的化合物文库并进一步确定CAR药效团的保守分子特征;
e)将类似物模型叠加到SEQ ID NO:1上;和
f)分析所述叠加的类似物的保守结构模式。
本发明还公开了确定至少一种治疗活性分子的药效团的方法;所述方法包括:
a)对所述至少一种治疗活性分子进行置换以合成所述分子的类似物;
b)对治疗活性分子和合成的类似物进行细胞结合和内化测定;
c)确定需要分子保守以保留治疗活性的来自步骤b)的任何残基和序列模式;
d)对治疗活性分子和类似物进行计算机模拟以产生小的化合物文库并进一步确定药效团的保守分子特征;
e)将类似物模型叠加到治疗活性分子模型上;和
f)分析所述叠加的类似物的保守结构模式。
在一个实施例中,向疾病传达可测量的治疗效果的至少一种治疗分子可以选自一组肽,这组肽选择性靶向肿瘤血管系统、再生组织、受伤组织、发炎组织、纤维化组织、重建组织、受损内皮、以升高的乙酰肝素酶水平为特征的组织,并且具有内化入这样的患病细胞的能力。
在另一个实施例中,所述疾病可以选自一个群组,所述群组由肺部疾病,肺动脉高血压,间质性肺病,急性肺损伤,急性呼吸窘迫综合征,哮喘,败血症,败血性休克,感染,肺结节病,结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎、硬皮病和多发性肌炎、皮肌炎的肺部表现,支气管扩张,石棉肺,铍中毒,矽肺,X组织细胞增多症,肺实变性炎症,肺组织炎症,吸烟性肺炎,闭塞性细支气管炎,肺纤维化,其它纤维化疾病如心肌梗塞、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、尘肺病、肾源性系统性纤维化、瘢痕形成、瘢痕疙瘩、关节纤维化、粘连性囊炎、放射性纤维化、纤维囊性乳腺病症、肝硬化、肝炎、肝纤维化、非酒精性脂肪肝病、急性肝衰竭、非酒精性脂肪性肝炎、淋巴结或其他器官的结节病,炎症性肠病,克罗恩病,恶病质,慢性肾脏疾病,急性肾损伤,急性肾衰竭,多囊肾病,溃疡性结肠炎,原发性胆汁性肝硬化,胰腺炎,间质性膀胱炎,慢性阻塞性肺病,动脉粥样硬化,缺血性心脏病,血管炎,赘生的/转移性/肿瘤性疾病(包括癌症),尘肺病,自身免疫性疾病,血管生成疾病,伤口愈合,感染,外伤损伤和系统性结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎硬皮病、多发性肌炎、皮肌炎,囊性纤维化,勃起功能障碍,α1-抗胰蛋白酶缺乏症,糖尿病,以高乙酰肝素酶水平为特征的疾病,神经炎性病症,中风,中枢神经系统退行性疾病如阿尔茨海默氏病、帕金森病(PD)、亨廷顿舞蹈病、肌萎缩性侧索硬化症,多发性硬化、创伤性脑损伤,组织缺氧,脑老化,湿性黄斑变性,新生血管性老年性黄斑变性,糖尿病性视网膜病,成胶质细胞瘤和衰老相关疾病组成。
在优选的实施例中,所述疾病可以选自由肺动脉高压、败血症、肾脏疾病、癌症和恶病质组成的群组。
本发明还公开了治疗患有疾病的个体的方法,所述方法包括:
a)提供包含与CAR药效团的序列基本上相同的靶向肽,所述序列选自由SEQ ID NO:16-SEQ ID NO:33或其变体组成的群组;
b)提供对疾病传达可测量的治疗效果的至少一种治疗性分子,其疾病选自一个群组,所述群组由肺部疾病,肺动脉高血压,间质性肺病,急性肺损伤,急性呼吸窘迫综合征,哮喘,败血症,败血性休克,感染,肺结节病,结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎、硬皮病和多发性肌炎、皮肌炎的肺部表现,支气管扩张,石棉肺,铍中毒,矽肺,X组织细胞增多症,肺实变性炎症,肺组织炎症,吸烟性肺炎,闭塞性细支气管炎,肺纤维化,其它纤维化疾病如心肌梗塞、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、尘肺病、肾源性系统性纤维化、瘢痕形成、瘢痕疙瘩、关节纤维化、粘连性囊炎、放射性纤维化、纤维囊性乳腺病症、肝硬化、肝炎、肝纤维化、非酒精性脂肪肝病、急性肝衰竭、非酒精性脂肪性肝炎、淋巴结或其他器官的结节病,炎症性肠病,克罗恩病,恶病质,慢性肾脏疾病,急性肾损伤,急性肾衰竭,多囊肾病,溃疡性结肠炎,原发性胆汁性肝硬化,胰腺炎,间质性膀胱炎,慢性阻塞性肺病,动脉粥样硬化,缺血性心脏病,血管炎,赘生的/转移性/肿瘤性疾病(包括癌症),尘肺病,自身免疫性疾病,血管生成疾病,伤口愈合,感染,外伤损伤和系统性结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎硬皮病、多发性肌炎、皮肌炎,囊性纤维化,勃起功能障碍,α1-抗胰蛋白酶缺乏症,糖尿病,以高乙酰肝素酶水平为特征的疾病,神经炎性病症,中风,中枢神经系统退行性疾病如阿尔茨海默氏病、帕金森病(PD)、亨廷顿舞蹈病、肌萎缩性侧索硬化症,多发性硬化、创伤性脑损伤,组织缺氧,脑老化,湿性黄斑变性,新生血管性老年性黄斑变性,糖尿病性视网膜病,成胶质细胞瘤和衰老相关疾病组成;
c)将包含a)和b)的组合物共同施用给有需要的个体;和
d)测量对个体的治疗效果。
本发明还公开了治疗患有疾病的个体的方法,所述方法包括:
a)提供包含与CAR药效团的序列基本上相同的靶向肽,所述序列选自由SEQ ID NO:16-SEQ ID NO:33或其变体组成的群组;
b)提供对疾病传达可测量的治疗效果的至少一种治疗性分子,所述疾病选自由肺动脉高压(PAH),败血症和恶病质组成的群组;
c)将包含a)和b)的组合物联用给予有需要的个体;和
d)测量对个体的治疗效果。
在一个实施例中,至少一种治疗性分子可以选自由伊马替尼、西维来司钠、紫杉醇、抗凝血酶III、氢化可的松组成的群组。
本发明还公开了治疗患有疾病的个体的方法,所述方法包括:
a)提供包含与CAR药效团的序列基本上相同的靶向肽,所述序列选自有SEQ ID NO:16-SEQ ID NO:33或其变体组成的群组;
b)施用a)中的靶向肽,其中所述肽向选自群组的疾病传递可测量的治疗效果,所述群组由:肺部疾病,肺动脉高血压,间质性肺病,急性肺损伤,急性呼吸窘迫综合征,哮喘,败血症,败血性休克,感染,肺结节病,结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎、硬皮病和多发性肌炎、皮肌炎的肺部表现,支气管扩张,石棉肺,铍中毒,矽肺,X组织细胞增多症,肺实变性炎症,肺组织炎症,吸烟性肺炎,闭塞性细支气管炎,肺纤维化,其它纤维化疾病如心肌梗塞、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、尘肺病、肾源性系统性纤维化、瘢痕形成、瘢痕疙瘩、关节纤维化、粘连性囊炎、放射性纤维化、纤维囊性乳腺病症、肝硬化、肝炎、肝纤维化、非酒精性脂肪肝病、急性肝衰竭、非酒精性脂肪性肝炎、淋巴结或其他器官的结节病,炎症性肠病,克罗恩病,恶病质,慢性肾脏疾病,急性肾损伤,急性肾衰竭,多囊肾病,溃疡性结肠炎,原发性胆汁性肝硬化,胰腺炎,间质性膀胱炎,慢性阻塞性肺病,动脉粥样硬化,缺血性心脏病,血管炎,赘生的/转移性/肿瘤性疾病(包括癌症),尘肺病,自身免疫性疾病,血管生成疾病,伤口愈合,感染,外伤损伤和系统性结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎硬皮病、多发性肌炎、皮肌炎,囊性纤维化,勃起功能障碍,α1-抗胰蛋白酶缺乏症,糖尿病,以高乙酰肝素酶水平为特征的疾病,神经炎性病症,中风,中枢神经系统退行性疾病如阿尔茨海默氏病、帕金森病(PD)、亨廷顿舞蹈病、肌萎缩性侧索硬化症,多发性硬化、创伤性脑损伤,组织缺氧,脑老化,湿性黄斑变性,新生血管性老年性黄斑变性,糖尿病性视网膜病,成胶质细胞瘤和衰老相关疾病组成,和
c)测量对个体的治疗效果。
在优选的实施例中,所述疾病可以选自由肺动脉高压、败血症、癌症和恶病质组成的群组。
本发明还公开了偶联物,所述偶联物包含与本发明公开的肽连接的基团。所述基团可以是抗血管生成剂、促血管生成剂、癌症化疗剂、细胞毒剂、抗炎剂、抗关节炎剂、多肽、核酸分子、小分子、荧光团、荧光素、罗丹明、放射性核素、钆、氧化铁、含碘造影剂、硫酸钡、镓、18F-氟脱氧葡萄糖、64Cu-氯化铜(Cuprymina)、3'-脱氧-3'-[18F]氟胸苷、铟111、锝-99、碳-11、碳-13、或其组合。所述基团可以是治疗剂、试剂、可检测试剂、病毒、或噬菌体。本发明公开了偶联物,所述偶联物包含与包含氨基酸片段的肽连接的基团,所述氨基酸片段包含,例如SEQ ID NO:1至SEQ ID NO:33的氨基酸序列。
本发明公开了包含基团和归巢分子的偶联物,例如本发明公开的肽。例如,公开了含有与选择性地归巢于再生组织、伤口组织或肿瘤的归巢分子连接的治疗剂的偶联物。公开的偶联物可以包含,例如,与包含氨基酸片段的肽连接的基团,所述氨基酸片段包含例如SEQ ID NO:1至SEQ ID NO:33的氨基酸序列。
本发明公开的任何形式或类型的归巢分子可用于所公开的偶联物。所述基团可以是任何分子。优选地,所述基团是有效地靶向归巢分子的靶的分子。例如,影响靶的基团,例如具有治疗效果的基团,或促进靶的检测,显像或成像,例如荧光分子,放射性造影剂或放射性核素。本发明公开的归巢于再生组织、伤口组织或肿瘤的公开的肽可以有效地与例如可以促进伤口愈合、治疗炎症或疼痛、或治疗癌症的基团组合。多种治疗剂可用于偶联物,包括但不限于作为抗血管生成剂、促血管生成剂、癌症化疗剂、细胞毒剂、抗炎剂、抗关节炎剂试剂、多肽、核酸分子、小分子、荧光团、荧光素、罗丹明、放射性核素、钆、氧化铁、含碘造影剂、硫酸钡、镓、18F-氟脱氧葡萄糖、64Cu-氯化铜(Cuprymina)、3'-脱氧-3'-[18F]氟胸苷、铟-111、锝-99、碳-11、碳-13的基团、或其组合。
偶联物可以包含,例如,连接到至少两个归巢分子的脂质体或其他聚合物基质。如果需要,脂质体或其它聚合物基质可以与至少10个,至少100个或至少1000个归巢分子连接。脂质体可用于此类偶联物;脂质体由磷脂或其他脂质组成,是无毒的,生理上可接受的和可代谢的载体,其制备和给药相对简单(Gregoriadis,Liposome Technology,第1卷(CRC Press,Boca Raton,Fla.(1984))。脂质体或其它聚合物基质可任选地包括另一种组分例如,但不限于,治疗剂、癌症化疗剂、细胞毒剂、诊断剂、抗血管生成剂、多肽或核酸分子。
在一些实施例中,偶联物可以含有癌症化疗剂。如本发明所用,“癌症化疗剂”是抑制癌细胞的增殖、生长、寿命或转移活性的化学剂。这样的癌症化疗剂可以是,但不限于,紫杉烷,例如多西紫杉醇、蒽环类如阿霉素、烷基化剂、长春花生物碱、抗代谢物、铂剂如顺铂或卡铂、类固醇例如甲氨蝶呤、抗生素如亚德里亚霉素、异丙酰胺、或选择性雌激素受体调节剂、抗体如曲妥珠单抗。
偶联物可用于治疗或诊断本发明公开的任何疾病、病症或失调、例如肺动脉高压、败血症、癌症和恶病质。
所述组合物可以通过口服(例如舌下)、肠胃外(例如静脉内),通过肌内注射、腹膜内注射、经皮、体外、局部或类似的给药,包括局部鼻内给药或通过吸入给药。如本发明所用,“局部鼻内给药”是指将组合物通过一个或两个鼻孔递送到鼻和鼻道中,并且可包括通过喷雾机制或液滴机制递送,或通过核酸或载体的雾化递送。通过吸入剂施用组合物可以通过经由喷雾或液滴机制递送的鼻或口。递送也可以通过吸入或插管直接到达呼吸系统的任何区域(例如肺)。所需组合物的精确的量将根据受试者不同而变化,取决于受试者的物种、年龄、体重和总体情况,所治疗的过敏性疾病的严重性,所用的特定核酸或载体,其给药方式等。因此,不可能为每种组合物指定精确的量。然而,本领域普通技术人员仅使用给出本发明教导的常规实验可以确定适当的量。
本发明还公开了将基团引导至再生组织的方法,包括向受试者施用如本发明所公开的偶联物。公开了其中治疗效果包括炎症减轻、伤口愈合速度增加、瘢痕组织量减少、疼痛减少、肿胀减少、感染减少或坏死减少的方法。
本发明还公开了将基团定向至肿瘤的方法,包括向受试者施用本发明公开的偶联物。所述偶联物可以具有治疗效果,并且受试者可以具有一个或多个待靶向的位点,其中所述基团定向至待靶向的一个或多个位点。所述受试者可以具有癌症,其中所述基团定向至受试者中的肿瘤血管生成。偶联物可对癌症具有治疗作用,例如减小肿瘤的大小或生长。所述基团还可以用于检测癌症,可视化一个或多个肿瘤,或两者兼顾。
在一个实施例中,变体可以具有式CxRxRxR,所述R选自由K或R组成的群组,并且进一步所述X选自由T、S、N、Q、A、I、L或V组成的群组。
在另一个实施例中,本发明提供了分离的多肽,其包含的氨基酸序列至少90%相似于至少一个选自由SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7和SEQ ID NO:8组成的群组。
附图简要说明
附图与说明书一起阐明了所公开的方法和组合物的几个实施例,并用于解释应用于相应方法和/或组合物的原理。
图1.测试环状肽以确定环状CAR药效团。
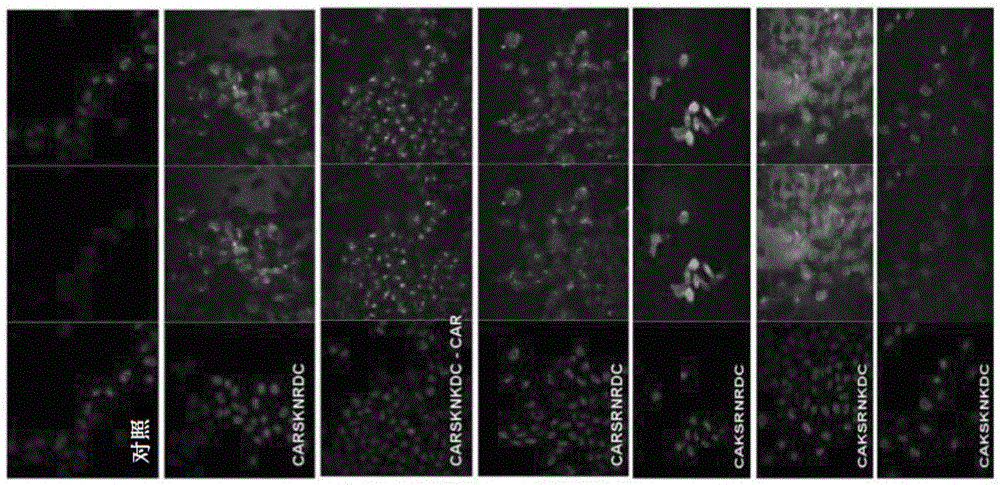
图2. CAR肽的变体结合和内化到CHO-K细胞中。如图所示,FAM偶联的肽以5μM浓度与CHO-K细胞温育2小时。洗涤、固定、并用核染色DAPI染色细胞。原始放大倍数x400。
图3. CAR变体摄入到人肺成纤维细胞(CCL-210)中。将细胞与5μM肽在无血清DMEM中37℃温育24小时。温育后,用含有100μg/ml肝素的冰冷缓冲液将细胞洗涤3-4次,以除去任何非内化的肽。使用胰蛋白酶-EDTA分离细胞,并将细胞悬浮液用7AAD染料染色以确定细胞活力。然后立即使用FACS分析细胞以确定肽内化的水平。
图4.所有8种测试的变体(SEQ ID NO:1-8),包括原始cCAR的叠加。该图叠加SEQ ID NO:1-8以说明CAR药效团的保守特征。
图5.环CAR(SEQ ID NO:1)以及CAR-利福布汀,CAR-雷帕霉素和CAR-伏环孢菌素(Voclosporin)类似物(SEQ ID NO:9-11)。这些化合物已经从现有大环化合物结构修饰以产生含有CAR药效团的化合物并且将具有与SEQ ID NO:1类似的归巢和内化特性。
图6.线性9氨基酸CAR(SEQ ID NO:12),以及线性CAR-利福布汀,线性CAR-雷帕霉素和线性CAR-伏环孢菌素(Voclosporin)类似物(SEQ ID NO:13-15)。此处显示的结构修饰再次阐明了可以对现有分子进行某些修饰,以产生含有CAR药效团的化合物。
图7. cCAR和非天然cCAR类似物(SEQ ID NO:1和16-19)的叠加。在各种位置的取代包括:1)D-氨基酸;2)D-烯丙基甘氨酸;3)二氨基酸(Arg位置的Asn取代-难以看到);4)N-甲基氨基酸。再次,这些化合物已经被结构修饰,以说明对CAR肽进行修饰以产生具有几乎与CAR相同的性质的“新”化合物。
图8. 9个氨基酸的线性CAR(SEQ ID NO:12)连同9个氨基酸的线性CAR类似物(非天然置换;SEQ ID NO:20-23)的叠加。在各种位置的取代包括:1)D-氨基酸;2)D-烯丙基甘氨酸;3)二氨基酸(Arg位置的Asn取代);4)N-甲基氨基酸。
图9. 7个氨基酸线性CAR(SEQ ID NO:24)连同非天然线性7个氨基酸CAR类似物(SEQ ID NO:25-28)的叠加。在各种位置的取代包括:1)D-氨基酸;2)D-烯丙基甘氨酸;3)二氨基酸(Arg位置的Asn取代);4)N-甲基氨基酸。原始线性7氨基酸CAR用较大的“棒”渲染显示,而所有变体以“线”渲染显示。
图10. CAR靶向中心性肾小球肾炎。Masson的毛状体染色(A)。纤连蛋白免疫染色(B)。CAR累积(C)。对照组积累(D)。
图11.在败血症中CAR药效团作用的假设机制。
图12.在西维来司钠中添加CAR药效团对LPS诱导的败血症小鼠的影响。
图13.在ATIII中加入CAR药效团对LPS诱导的败血症小鼠的影响。
图14.在氢化可的松中加入CAR药效团对LPS诱导的败血症小鼠的影响。
图15. A)LPS诱导的败血症小鼠的存活率;B)来自LPS诱导的败血症小鼠的肺、肝和肾组织的组织学。
图16.来自LPS诱导的败血症小鼠的肾组织中CAR药效团的定位。
图17.来自对照、西维来司钠和CAR药效团+西维来司钠治疗的小鼠的肺组织的扫描电子显微照片。
图18.来自对照、西维来司钠和CAR药效团+西维来司钠处理的小鼠的肝组织的扫描电子显微照片。
图19.来自对照、西维来司钠和CAR+西维来司钠治疗的小鼠的肾组织的扫描电子显微照片。
图20. CAR药效团对急性肾损伤标记物(KIM-1)的影响。
图21. CAR药效团对三阴性乳腺癌小鼠中癌症相关性恶病质的影响。
图22. CAR药效团佐剂对右心脏肥大的影响。
图23. CAR药效团佐剂对肺动脉高压模型大鼠体重的影响。
图24.口服CAR药效团对右心脏肥大的作用。
图25.在肺动脉高压模型(PAH)大鼠中CAR药效团对肺动脉(PA)肌型化的影响。
本发明的详细描述
定义
本发明所用的术语“CAR药效团”定义为环状(SEQ ID NO:1)、线性(SEQ ID NO:12)和截短的(SEQ ID NO:24)CAR肽的保守分子特征,其是CAR疾病归巢、靶标结合、内化和生物活性所必需的。我们在本发明中将截短的、线性的和环状的CAR药效团统称为“CAR药效团”。
如本发明采用的,术语“肽”广义地用于表示肽、蛋白质、蛋白质片段等。本发明所用的术语“肽模拟物”是指具有其结构上基于的肽的活性的肽样分子。
I.概述
最近的研究(Jarvinen 2007;Urakami 2011;Toba 2014;美国专利申请公开号2009/0036349A1)已经确定了具有序列CARSKNKDC(CAR;SEQ ID NO:1)的疾病归巢和细胞穿透肽。另外的实验研究已经确定线性CAR(SEQ ID NO:12)和截短的CAR(tCAR;SEQ ID NO:24)也具有相似的生物活性(美国专利申请公开号2012/0034164A1)。尽管我们对于CAR的生物活性有了解,但其精确的受体仍然未知。CAR的药效团的确定不论是在探索CAR的受体,还是在阐明其作用机制(MOA)和设计其它可能更有用的化合物方面都具有非常重要的价值。
为了确定环CAR药效团,对环CAR肽(SEQ ID NO:1)和七个密切相关的肽(SEQ ID NO:2-8)的进行了细胞结合和内化测定。除了环状CAR(SEQ ID NO:1)外,还合成了在Lys或Arg残基上含有置换的七种其他环状肽(SEQ ID NO:2-8),并通过将荧光胺(FAM)基团连接到该分子(图1)。细胞结合和内化测定用作初始测试以将置换的化合物与原始CAR肽进行比较。先前已用于研究CAR结合共聚焦显微镜和中国仓鼠卵巢(CHO-K)细胞被用于研究肽的细胞结合和内化。荧光激活细胞分选(FACS)也用于测定SEQ ID NO:1-8的细胞内化。细胞结合和内化测定确定了保守残基和序列模式的CAR药效团的某些特征,其保守性是化合物保持其生物活性所必须的。
为了进一步确定CAR药效团的保守分子特征,使用计算建模技术在计算机中生成SEQ ID NO:1-8。多种渲染被展示来比较/对比SEQ ID NO:1-8的各种分子特征。叠加的CAR类似物的分析(图4)揭示了已被作为环状CAR药效团确定出的保守的环状CAR结构模式。这是由于SEQ ID NO:1-8的显著的结构、电子、空间和顺序相似性。
计算机模拟用于进一步定义先前确定的CAR药效团,其不仅可以根据精确的序列和残基模式来定义,而且还可以根据如线性、截短和环状CAR肽具有相似的三维,空间和电子模式的更广义的结构来定义。这些结果证实了在细胞结合和内化测定中产生的数据,其中SEQ ID NO:2-8显示与SEQ ID NO:1类似的生物活性。因此,其结论是,SEQ ID NO:2-8将具有与原始CAR序列(SEQ ID NO:1)具有相似的治疗活性,并且所有序列都属于CAR药效团。
CAR药效团已基于实验研究和计算模拟的结果而确定。在分析这些分子时,已经确定了它们各自的生物活性所必需的保守特征。此外,由于tCAR具有与cCAR相似的性质,因此可推断线性和截短的CAR药效团(除了环状CAR药效团外)的同一性。这进一步证明,尽管线性化、CAR药效团的保守特征仍然可以存在于线性和截短的变体中,但仍然可以保留原始环状CAR肽的性质。
在确定了环状、线性和截短的CAR药效团(统称为CAR药效团)之后,获得了保留这些必要分子特征的额外的结构。化合物文库(SEQ ID NO:9-33)利用分子模拟/计算化学、肽模拟物、序列变异技术和计算机辅助的药物设计产生,该文库已被特别设计为含有疾病归巢和选择性内化所需的CAR药效团。产生这些结构以说明可产生具有CAR药效团,以及CAR肽的疾病归巢和内化特性的新化合物多样性。
II.材料
A.肽和蛋白质
本发明公开了包含具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段,相关氨基酸序列或CAR药效团的任何肽或蛋白质。所述肽或蛋白质可以由包含SEQ ID NO:1-8、12和16-33的氨基酸序列或SEQ ID NO:1-8、12和16-33的氨基酸序列具有一个或多个保守氨基酸取代的的氨基酸片段组成。氨基酸片段可以由与SEQ ID NO:1-8、12和16-33的氨基酸序列有60%,70%,80%,90%或100%相似性的氨基酸序列组成,或表示一个或多个氨基酸残基的变化的任何百分比,其变化包括添加、缺失或取代。所述氨基酸片段可以包含具有一个、两个、三个、四个、五个、六个、七个、八个或九个保守氨基酸取代的SEQ ID NO:1-8、12和16-33的氨基酸序列。所述氨基酸片段可以包含氨基酸序列SEQ ID NO:1-8、12和16-33的嵌合体。这种嵌合体可以是添加的,其中一个序列的序列添加到另一个序列,或替换,其中一个序列的序列替换另一个序列的序列,或其组合。
本发明还公开了含有CAR药效团的氨基酸片段,其中所述片段可以是线性(包括截短的线性肽)或环状的。所述氨基酸片段可以通过任何合适的连接,例如二硫键或肽键。所述肽可以具有任何长度。
本发明还公开了含有CAR药效团的肽或蛋白质,其可以选择性地归巢于再生组织、伤口组织、或肿瘤。所公开的肽可以选择性地与再生组织、伤口组织或肿瘤相互作用。
本发明还公开了具有小于100个残基的长度并且包括SEQ ID NO:1-8、12和16-33的氨基酸序列或CAR药效团的分离的肽或蛋白质。如本发明中关于所公开的肽所使用的,术语“分离的”是指肽相对不含材料如污染性多肽、脂质、核酸和通常与细胞中肽或与文库或粗制剂中的肽相关的其它细胞材料。
本发明公开的肽和蛋白质包含具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段、相关氨基酸序列、或CAR药效团,所述肽和蛋白质可以具有任何合适的长度。
B.计算建模
本发明所公开的组合物可以与任何分子模拟、计算化学或计算机辅助药物设计(CADD)技术一起使用,以鉴定SEQ ID NO:1-33的结构或鉴定含有CAR药效团的任何其它化合物。应当理解,当在建模技术中使用所公开的组合物(SEQ ID NO:1-33)时,将确定到具有特别期望的性质例如选择性归巢到疾病部位和细胞内化到疾病部位的化合物。
本发明还公开了通过使用合理设计发现的含有CAR药效团的化合物。这可以通过结构信息和/或计算机建模来实现。计算机建模技术允许所选择分子的三维原子结构的可视化,并且该三维原子结构的知识可以允许在新化合物的合理设计中确定和优化化学官能团的位置。三维构建体可以从含有CAR药效团的分子的X射线晶体学分析或NMR成像中获得。分子动力学和力场数据的使用也可以用于发现含有CAR药效团的化合物。计算机图形系统能够预测化合物如何结合其各自的受体,并且可以进行化合物结构/序列的实验操作以优化结合特异性。还可以进行化合物文库的虚拟筛选,包括合成化学品、肽、蛋白质和其它生物活性材料,以发现含有CAR药效团的新化合物。
C.肽模拟物
本发明还公开了已经通过使用肽模拟物发现或开发的含有CAR药效团的化合物。肽模拟物包括化学修饰的肽,含有非天然存在的氨基酸的肽样分子、以及蛋白质。肽模拟化合物可以具有例如SEQ ID NO:1选择性的疾病归巢活性和/或靶细胞内化能力。
本发明还公开了分离的多价肽,其包括各自独立地含有一个归巢分子(例如,氨基酸序列SEQ ID NO:2-33或其保守性变体或肽模拟物)的至少两个子序列。多价肽可具有例如至少三个、至少五个或至少十个这种子序列,其各自独立地含有一个归巢分子(例如,SEQ ID NO:2-33的氨基酸序列或保守变体或其肽模拟物)。在具体的实施例中,多价肽可以具有两个、三个、四个、五个、六个、七个、八个、九个、十个、十五个或二十个相同或不相同的子序列。在另一个实施例中,多价肽可以包含相同的子序列,其由一个归巢分子(例如,氨基酸序列SEQ ID NO:2-33,或其保守变体或拟肽)组成。在另一个实施例中,多价肽含有连续的相同或不相同的子序列,其不被任何插入氨基酸分开。在另外的实施例中,多价肽可以是环状的或以其他方式构象受限的。在一个实例中,肽可以通过二硫键环化。
已知多种肽模拟物,包括含有受限氨基酸、模拟肽二级结构的非肽组分或酰胺键电子等排体的肽样分子。包含受约束的,非天然存在的氨基酸的肽模拟物可包括,例如,α拟甲基化的氨基酸;α,α-二烷基甘氨酸或α烷氨基环烷烃羧酸;Nα---Cα环化氨基酸;Nα---甲基化氨基酸;β基或γ-氨基环烷烃羧酸;α,β-不饱和氨基酸;β,β-二甲基或β-甲基氨基酸;β-取代-2,3-亚甲基氨基酸;N---Cε或Cα---CΔ环化氨基酸;取代的脯氨酸或另一种氨基酸模拟物。模拟肽二级结构的肽模拟物可以包含,例如,非肽类β化转角模拟物;γ转角模拟;β折叠结构模拟;或模拟螺旋结构,它们中的每一个是本领域公知的。肽模拟物也可以是包含例如酰胺键电子等排体的肽样分子,例如逆-反转修饰;还原酰胺键;亚甲基亚硫醚或亚甲基-亚砜键;亚甲基醚键;乙烯键;硫代酰胺键;反式烯烃或氟烯烃键;1,5-二取代四唑环;酮亚甲基或氟酮亚甲基键或另一酰胺电子等排物。
本发明还公开了用于确定含有CAR药效团的肽模拟物的方法,并且可以包括,例如,筛选含有潜在的CAR药效团肽模拟物的文库的数据库。作为示例,剑桥结构数据库包含具有已知晶体结构的大于300,000种化合物的集合(Allen等人,Acta Crystalloqr.BectionB,35:2331(1979))。当确定新的晶体结构并且可以筛选具有合适形状,例如与所公开的肽相同的形状,以及与靶分子的潜在几何和化学互补性的化合物时,该结构存储不断更新。当没有肽或结合肽的靶分子的晶体结构可用时,可以使用例如程序CONCORD(Rusinko等人,J.Chern.Inf.Comput.Sci.29:251(1989))产生一个结构。另一个数据库,可用化学品目录(Molecular Design Limited,Information Systems;San Leandro Calif。)包含约100,000种市售的化合物,并且还可以用于搜索鉴定,例如,在选择性归巢到肿瘤基质,伤口和血浆凝块中具有活性的肽的潜在肽模拟物。
D.取代变体
本发明还公开了含有具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段,相关氨基酸序列,或CAR药效团的任何肽或蛋白质,其中氨基酸序列已经经历取代、插入或缺失修饰。插入包括氨基和/或羧基末端融合以及单个或多个氨基酸残基的序列内插入。插入通常是比氨基或羧基末端融合的插入更小的插入,例如,大约1至4个残基。缺失的特征在于从蛋白质或肽序列中去除一个或多个氨基酸残基。在蛋白质或肽分子内的任何位点处通常不超过约2至6个残基缺失。这些变体可以通过在编码蛋白质或肽的DNA中的核苷酸的位点特异性诱变来制备,从而产生编码变体的DNA,然后在重组细胞培养物中表达DNA。取代、插入或缺失修饰可以包括但不限于非天然氨基酸,D-氨基酸或任何其它残基,其可导致产生仍然具有CAR药效团的改变或改善的化合物。
在具有已知序列的DNA中的预定位点处产生取代突变的技术是公知的。氨基酸取代通常是单个残基,但可以同时在多个不同位置发生;插入通常将在约1至10个氨基酸残基的数量级;并且缺失将在约1至10个残基的范围内。缺失或插入优选在相邻对中进行,即缺失2个残基或插入2个残基。取代、缺失、插入或其任何组合可以组合以得到含有CAR药效团的最终构建体。取代变体是其中至少一个残基已被除去并且不同残基插入其位置的变体。
E.保守变体
本发明还公开了含有具有SEQ ID NO:1-8、12和16-33的序列的氨基酸片段、相关氨基酸序列或CAR药效团的任何保守变体。保守变体是其中第一氨基酸被具有与第一氨基酸至少一种生物化学性质相似的另一氨基酸或氨基酸类似物替换的序列;相似的性质包括例如相似的大小、电荷、疏水性或氢键结合能力。保守变体可以是这样的序列,其中第一个不带电的极性氨基酸用第二(非同一的)不带电极性氨基酸例如半胱氨酸、丝氨酸、苏氨酸、酪氨酸、甘氨酸、谷氨酰胺或天冬酰胺或其类似物保守取代。保守变体还可以是其中第一碱性氨基酸被第二碱性氨基酸例如精氨酸、赖氨酸、组氨酸、5-羟赖氨酸、N-甲基赖氨酸或其类似物保守性取代的序列。类似地,保守变体可以是其中第一疏水性氨基酸被第二疏水性氨基酸例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、苯丙氨酸或色氨酸或其类似物保守性取代的序列。以相同的方式,保守变体可以是这样的序列,其中第一酸性氨基酸被第二酸性氨基酸例如天冬氨酸或谷氨酸或其类似物保守取代;其中芳族氨基酸如苯丙氨酸被第二芳族氨基酸或氨基酸类似物保守取代的序列,例如酪氨酸;或其中第一相对小的氨基酸如丙氨酸被第二相对小的氨基酸或氨基酸类似物如甘氨酸或缬氨酸或其类似物取代的序列。例如,用生物学和/或化学相似的另一氨基酸残基替换一个氨基酸残基对于本领域技术人员而言是已知的保守取代。例如,保守取代将用一个疏水残基替换另一个疏水残基,或用一个极性残基替换另一个。取代包括组合,例如,Gly,Ala;Val,Ile,Leu;Asp,Glu;Asn,Gln;Ser,Thr;Lys,Arg;和Phe,Tyr。每个明确公开的序列的这种保守取代的变体包括在本发明提供的嵌合多肽内。SEQ ID NO:1-8、12和16-33的保守变体包括相对于SEQ ID NO:1-8、12和16-33包含一个、两个、三个、四个或更多个氨基酸取代的序列,并且这些变体可以包括天然和非天然存在的氨基酸类似物。
本发明还公开了含有CAR药效团的化合物,其中进行了较不保守的氨基酸取代。这可以包括选择在其对保持(a)取代区域中多肽骨架的结构,例如折叠或螺旋构象,(b)靶标位点的分子的电荷或疏水性或(c)侧链的大体积区别更显著的残基。通常期望产生蛋白质性质最大变化的取代将是其中(a)亲水残基,例如丝氨酰或苏氨酰,为(或被)疏水残基,例如,亮氨酰、异亮氨酰、苯丙氨酰、缬氨酰或丙氨酰取代;(b)半胱氨酸或脯氨酸为(或被)任何其它残基取代;(c)具有正电性侧链的残基,例如赖氨酰、精氨酰或组氨酰为(或被)负电性残基取代,例如谷氨酰基或天冬氨酰基;或(d)具有大体积侧链的残基,例如苯丙氨酸,为(或被)不具有侧链的残基,例如甘氨酸取代,在这种情况下,(e)通过增加硫酸化和/或糖基化的位点。
替代或缺失诱变可用于插入N-糖基化(Asn-X-Thr/Ser)或O-糖基化(Ser或Thr)的位点。半胱氨酸或其它不稳定残基的缺失也是可行的。潜在蛋白水解位点的缺失或取代,例如,Arg,通过例如缺失一个碱性残基或者通过谷氨酰胺酰基或组氨酰残基取代实现。
F.衍生化
衍生化是将化合物转化成相似化学结构的产物的过程。某些翻译后衍生化是重组宿主细胞对表达的多肽的作用的结果。谷氨酰胺和天冬酰胺酰残基通常经翻译后脱酰胺成相应的谷氨酰和天冬酰胺残基。或者,这些残基在弱酸性条件下脱酰胺。其他翻译后修饰包括脯氨酸和赖氨酸的羟基化,丝氨酰或苏氨酰残基的羟基的磷酸化,赖氨酸、精氨酸和组氨酸侧链的邻氨基的甲基化(TE Creighton,Proteins:Structure and Molecular Properties,WH Freeman&Co.,San Francisco第79-86页;1983),N-末端胺的乙酰化和在一些情况下C-末端羧基的酰胺化。
应理解,定义本发明公开的蛋白质的变体和衍生物的一种方式是通过在与特定的已知序列的同源性/同一性方面定义变体和衍生物。具体公开的是本发明公开的这些和其它蛋白质的变体,其与所述序列具有至少70%或75%或80%或85%或90%或95%的同源性,或其间的任何百分比表示氨基酸的改变,包括取代、添加或缺失。本领域技术人员容易理解如何确定两种蛋白质的同源性。例如,可以在比对两个序列之后计算同源性,使得同源性处于其最高水平。
应理解,保守突变和同源性的描述可以以任何组合组合在一起,例如与特定序列具有至少70%同源性的实施例,其中所述变体是保守突变。
由于本说明书讨论了各种蛋白质和蛋白质序列,因此可以编码那些蛋白质序列的核酸也被公开了。这将包括与特定蛋白质序列相关的所有简并序列,即,具有编码一个特定蛋白质序列的序列的所有核酸,以及编码所公开蛋白质序列的变体和衍生物的所有核酸,包括简并核酸。因此,虽然每个特定核酸序列可能不在本发明中记载,但应理解每一个序列已经事实上通过公开的蛋白质序列在本发明中公开和描述。
应理解,有许多氨基酸和肽类似物可以掺入所公开的组合物中。例如,存在许多D-氨基酸或具有与上述那些不同的功能性取代基的氨基酸。本发明公开了天然存在的肽相反的立体异构体,以及肽类似物的立体异构体。这些氨基酸可以容易地掺入到多肽链中,其掺入是通过tRNA分子和选择的氨基酸加载,并且利用例如琥珀密码子将氨基酸类似物以位点特异性的方式插入肽链中来构建基因构造(Thorson et al.,Methods in Molec.BioI.77:43-73(1991),Zoller,Current Opinion in Biotechnology,3:348-354(1992);Ibba,Biotechnology&Genetic Engineering Reviews 13:197-216(1995),Cahill et al.,TIBS,14(10):400-403(1989);Benner,TIB Tech,12:158-163(1994);Ibba and Hennecke,Bio/technology,12:678-682(1994)所有这些文献通过引用至少与氨基酸类似物有关的材料而并入本发明)。
本发明还公开了可以产生类似肽但不通过天然肽键连接的分子。例如,氨基酸或氨基酸类似物的键可包括:CH2NH---,---CH2S---,---CH2---CH2---,---CH==CH---(顺式和反式),---COCH2---,---CH(OH)CH2---,和---CHH2SO---(这些和其它可以在Spatola,A.F.in Chemistry and Biochemistry of Amino Acids,Peptides,and Proteins,B.Weinstein,eds.,Marcel Dekker,New York,p.267(1983);Spatola,A.F.,Vega Data(1983年3月),Vol.1,Issue 3,Peptide Backbone Modifications(综述);Morley,Trends Pharm Sci(1980)pp.463-468;Hudson,D.et al.,Int J Pept Prot Res 14:177-185(1979)(---CH2NH---,CH2CH2---);Spatola et al.Life Sci 38:1243-1249(1986)(---CH H2---S);Harm J.Chem.Soc Perkin Trans.I 307-314(1982)(---CH---CH---,顺式和反式);Almquist et al.J.Med.Chem.23:1392-1398(1980)(---COCH2---);Jennings-White et al.Tetrahedron Lett 23:2533(1982)(---COCH2---);Szelke et al.EuropeanAppln,EP45665CA(1982):97:39405(1982)(---CH(OH)CH2---);Holladay et al.Tetrahedron.Lett 24:4401-4404(1983)(---C(OH)CH2---);and Hruby Life Sci31:189-199(1982)(---CH2---S---)被发现;其各自通过引用并入本发明。特别优选的非肽键是---CH2NH---。应当理解,肽类似物可以在键原子之间具有多于一个原子,例如b-丙氨酸,g-氨基丁酸等。
G.偶联物
本发明还公开了具有CAR药效团的偶联化合物。偶联物可以是CAR药效团的线性或环状变体,并且可以使用二硫键,肽键或任何其它类型的共价或非共价化学修饰连接到另一化合物,造成CAR药效团变体连接到一个或多个其它化合物,或造成CAR药物载体的线性或环状变体连接到含有治疗或诊断有效载荷的脂质体、纳米红细胞膜质体(nanoerythrosome)或微团。在一个实施例中,截短的CAR(tCAR;SEQ ID NO:24)已经通过二硫键在人血清白蛋白(HSA)的Cys34残基处与游离巯基偶联(Sugio 1999)。该HSA-tCAR偶联物可以延长tCAR的半衰期(Dennis 2002),并且说明了可以用于增强CAR药效团变体的性质(例如半衰期)的更广泛的方法。
在另一个实施例中,CAR药物载体可以连接到抗纤维化化合物例如核心蛋白聚糖,以产生针对纤维化的抑制,例如瘢痕减少。
将含有CAR药效团的分子偶联到另一分子的想法可以具有延长半衰期、改善对患病组织的亲和力、改善毒性或药代动力学性质、改善选择性、改善结合和/或内化、或改善任一种偶联化合物的治疗效果。在另一个实施例中,环状CAR(SEQ ID NO:1)已经与单克隆抗癌抗体B1的Fv片段共价连接(通过肽键)。该抗体对人癌细胞具有亲和力。这可以导致高度特异的对人癌细胞的偶联,并且阐释了具有改善疾病归巢特性的包含CAR药效团的更广泛的化合物类型。
H.优化的化合物
本发明还公开了具有增强的或期望的性质的氨基酸和肽类似物,例如,更经济的生产、更大的化学稳定性、降低的毒性或副作用、增强的药理学性质(例如半衰期、吸收、分布、代谢、排泄、效力、靶结合或亲和力等)、改变的特异性(例如,广谱的生物活性)、降低的抗原性等。在一个实施例中,D-氨基酸可用于产生更稳定的肽,因为D-氨基酸不被肽酶识别。用相同类型的D-氨基酸(例如,D-赖氨酸代替L-赖氨酸)系统取代共有序列的一个或多个氨基酸可以用于产生更稳定的肽(SEQ ID NO:16、20和25)(Molhoek2011)。在另一个实施例中,亚甲基桥,酰胺(肽)键或半胱氨酸残基(二硫键)可用于将两个或更多个肽环化或连接在一起(SEQ ID NO:29)。这可有利于将肽限制为更稳定的构象(Clark 2005)。这还包括具有改善的靶特异性或结合的肽或蛋白质,例如氨基酸残基的最佳排列以增强配体和受体之间的分子相互作用。在另一个实施例中,碱性残基(Lys、Arg或His)已经排列使得受体和配体之间的相互作用将是最佳的(SEQ ID NO:30)。本发明还公开了具有改善的(降低的)全身毒性的蛋白质和肽。在肽中占主导地位的半胱氨酸残基通常发现相对于其他残基是有毒的(Gupta 2013)。在一个这样的实施例中,SEQ ID NO:1的侧翼半胱氨酸残基已经被侧翼亮氨酸残基取代,并且通过侧翼亮氨酸残基(SEQ ID NO:29)之间的亚甲基桥实现环化。
本发明还公开了氨基酸序列修饰或改变的肽和蛋白质带来更好的生物药理学性质。例如,酸性或碱性侧链的引入,可以改善肽和蛋白质的水性或非水性溶解度,以及增强的配方或药代动力学性质(Rand 2012)。在一个实施例中,具有低分配系数(log D)的残基,如天冬氨酸的置换,可以用具有更大log D值的残基,例如亮氨酸(SEQ ID NO:31)代替。
本发明还公开了具有改善的细胞通透性的肽和蛋白质。向肽或蛋白质添加多聚精氨酸序列可以极大地实现细胞摄取和通透性(Fuchs 2007),并且还包括用精氨酸残基替代非碱性残基。在一个这样的实施例中,SEQ ID NO:1中包含的九个现有残基中的四个已被精氨酸残基取代,使得能够在保留功效的同时增强通透性(SEQ ID NO:32)。
本发明还公开了包含与异源蛋白融合的公开的肽的嵌合蛋白。在一个实施例中,异源蛋白可以具有治疗活性,例如细胞因子活性、细胞毒活性或促凋亡活性。在另一个实施例中,异源蛋白质可以是抗体或其抗原结合片段。在其它实施例中,嵌合蛋白包括与异源蛋白融合的含有氨基酸序列SEQ ID NOs:2-34的肽或其保守性变体或肽模拟物。本发明使用的术语“异源”,即与所公开的肽融合的蛋白质,是指来自除了编码肽的基因之外的来源或者来自于肽模拟物的蛋白质。所公开的嵌合蛋白可以具有多种长度,包括但不限于小于100个残基,小于200个残基,小于300个残基,小于400个残基,小于500个残基,小于800个残基或小于1000个残基。
如本发明所用,“嵌合体”和“嵌合”是指衍生自两种或更多种来源的序列的任何组合。这包括,例如,从亚单位的单个基团(例如,核苷酸、氨基酸)到添加、插入和/或取代入其他序列的全部来源序列。嵌合体可以是例如添加剂,其中一个序列的一个或多个部分被添加到一个或多个其他序列的一个或多个部分;替代的,其中一个序列的一个或多个部分被取代为一个或多个其它序列的一个或多个部分;或其组合。“保守置换嵌合体”可用于指替代嵌合体,其中嵌合体的源序列具有一些结构和/或功能关系,并且其中具有相似或类似结构和/或功能的序列部分彼此替换。典型的嵌合和人源化抗体是保守取代的嵌合体的实例。
I.双功能化合物
本发明还公开了包含与具有单独功能的第二个肽融合的归巢肽的双功能肽。这种双功能肽具有由全长分子的不同部分赋予的至少两种功能,并且除了选择性归巢活性外,还可以显示例如抗血管生成活性或促凋亡活性。
如果需要,如本发明其它地方所讨论的,分离的肽或归巢分子可以是环状或以其他方式构象约束的。如本发明所用,“构象约束的”分子,例如肽,其中三维结构在一段时间内基本上保持在一个空间排列中。构象约束的分子可以具有改进的性质,例如增加的亲和力、代谢稳定性、膜通透性或溶解度。构象限制的方法是本领域公知的,并且包括如本发明其它地方进一步讨论的环化。
如本发明关于肽所使用的,术语“环状”是指包括两个非相邻氨基酸或氨基酸类似物之间的分子内键的结构。所述环化可以通过共价或非共价键影响。分子内键包括但不限于主链到主链,侧链到主链和侧链到侧链键。优选的环化方法是通过在非相邻氨基酸或氨基酸类似物的侧链之间形成二硫键。能够形成二硫键的残基包括,例如,半胱氨酸(Cys),青霉胺(Pen),β,β-环戊烷半胱氨酸(Pmc),β,β-环戊烷-β-巯基丙酸(Pmp)及其功能等同物。
肽还可以例如经由内酰胺键环化,其可以利用一个氨基酸或其类似物的侧链基团形成与氨基末端残基的N-末端胺的共价连接。能够形成内酰胺键的残基包括天冬氨酸(Asp)、谷氨酸(Glu)、赖氨酸(Lys)、鸟氨酸(om)、α,β-二氨基丙酸、γ-氨基己二酸(Adp)和M-(氨甲基)苯甲酸(Mamb)。另外可以影响环化,例如,通过在赖氨酸(Lys)和亮氨酸(Leu)残基之间形成赖氨酸-亮氨酸键或在两个酪氨酸(Tyr)残基之间形成二酪氨酸键。技术人员理解,这些和其它键可以包括在环肽中。
J.组合技术
所公开的组合物可以用作任何组合技术的靶,以确定与所公开的组合物以期望的方式相互作用的分子或高分子的分子。本发明还公开了通过组合技术或筛选技术鉴定的组合物,其中组合物公开为SEQ ID NO:2-33中公开的或其部分,用作组合或筛选方案中的靶。
应理解,当在组合技术或筛选方法中使用所公开的组合物时,具有特定所需性质例如抑制或刺激或靶分子功能的分子,例如高分子的分子将被鉴定。还公开了当使用所公开的组合物例如CAR时鉴定和分离到的分子。因此,使用涉及所公开的组合物例如SEQ ID NO:2-33的组合或筛选方法产生的产物也在本发明中被考虑。
K.疾病
本发明所公开的含有CAR药效团的化合物可用于治疗和/或诊断疾病,例如:肺部疾病,肺动脉高血压,间质性肺病,急性肺损伤,急性呼吸窘迫综合征,哮喘,败血症,败血性休克,感染,肺结节病,结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎、硬皮病和多发性肌炎、皮肌炎的肺部表现,支气管扩张,石棉肺,铍中毒,矽肺,X组织细胞增多症,肺实变性炎症,肺组织炎症,吸烟性肺炎,闭塞性细支气管炎,肺纤维化,其它纤维化疾病如心肌梗塞、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、尘肺病、肾源性系统性纤维化、瘢痕形成、瘢痕疙瘩、关节纤维化、粘连性囊炎、放射性纤维化、纤维囊性乳腺病症、肝硬化、肝炎、肝纤维化、非酒精性脂肪肝病、急性肝衰竭、非酒精性脂肪性肝炎、淋巴结或其他器官的结节病,炎症性肠病,克罗恩病,恶病质,慢性肾脏疾病,急性肾损伤,急性肾衰竭,多囊肾病,溃疡性结肠炎,原发性胆汁性肝硬化,胰腺炎,间质性膀胱炎,慢性阻塞性肺病,动脉粥样硬化,缺血性心脏病,血管炎,赘生的/转移性/肿瘤性疾病(包括癌症),尘肺病,自身免疫性疾病,血管生成疾病,伤口愈合,感染,外伤损伤和系统性结缔组织疾病包括系统性红斑狼疮、类风湿性关节炎硬皮病、多发性肌炎、皮肌炎,囊性纤维化,勃起功能障碍,α1-抗胰蛋白酶缺乏症,糖尿病,以高乙酰肝素酶水平为特征的疾病,神经炎性病症,中风,中枢神经系统退行性疾病如阿尔茨海默氏病、帕金森病(PD)、亨廷顿舞蹈病、肌萎缩性侧索硬化症,多发性硬化、创伤性脑损伤,组织缺氧,脑老化,湿性黄斑变性,新生血管性老年性黄斑变性,糖尿病性视网膜病,成胶质细胞瘤和衰老相关疾病和作为基因治疗佐剂。
实施例
以下实施例旨在为本领域普通技术人员提供如何制备和评价本发明要求保护的一些化合物,组合物和/或方法的披露和说明。这些实施例旨在说明可以使用的更广泛的方法,并且无意以任何方式限制本公开。
实施例1环状CAR药效团的确定
为了确定环CAR药效团,进行CAR肽(SEQ ID NO:1)和七个密切相关的肽(SEQ ID NOs:2-8)的细胞结合和内化测定。
1A.共聚焦显微镜
合成了在赖氨酸或精氨酸残基上具有置换的八个CAR变体(SEQ ID NO:1-8)(图1)。所述肽通过将荧光胺(FAM)基团连接到分子上来标记。
初始测试中用细胞结合和内化测定来比较变体与原始CAR肽。用中国仓鼠卵巢(CHO-K)细胞通过共聚焦显微镜研究了CAR肽变体的细胞结合/内化,所述细胞以前已用于研究CAR结合。
将所示的FAM偶联的肽以5μM浓度与CHO-K细胞温育2小时。洗涤、固定,并用核染色DAPI染色细胞。CHO细胞结合和内化结果(图2)表明将肽的第一个精氨酸变为赖氨酸残基改善了与CHO细胞的结合,且该肽应具有至少一个精氨酸。
1B.荧光激活细胞分选(FACS)
合成了在赖氨酸或精氨酸残基上具有置换的八个CAR变体(SEQ ID NO:1-8)(图1)。肽通过将荧光胺(FAM)基团连接到分子上来标记。
为测定SEQ ID NO:1-8的细胞内化,使用了荧光激活细胞分选(FACS)。选择人肺成纤维细胞(CCL-210)是因为它们似乎是比CHO细胞更好的CAR靶标。与共焦显微镜实验(实施例1A)不同,FACS分析完全集中于肽内化,而不是肽结合。
将细胞与5μM肽在无血清DMEM中在37℃下温育24小时。孵育后,用含有100μg/ml肝素的冰冷缓冲液将细胞洗涤3-4次,以除去任何非内化的肽。使用胰蛋白酶-EDTA分离细胞,并将细胞悬浮液用7AAD染料染色以确定细胞活力。然后立即使用FACS分析细胞以确定肽内化的水平。
FACS结果基于每个序列中存在的氨基酸取代(图3)确定了SEQ ID NO:1-8的肽内化谱的变化。变化发生在肽结合的强度以及肽结合的定位。有趣的是,具有保守氨基酸取代的CAR药效团肽变体显示了在CHO细胞和人肺成纤维细胞之间的差异结合和内化特征(分别如图2和3所示),表明对原始CAR肽的保守氨基酸取代在结合和内化中产生了意想不到的差异。这些结果意外地远离了Ruoslahti在美国专利No.8,188,220中的公开内容的教导,其教导为保守性氨基酸取代被指示对肽内化几乎没有或没有影响。
FACS结果(实施例1B)不同于共聚焦分析(实施例1A),因为双精氨酸,单赖氨酸肽是最有效的(图2)。然而,该测定中的背景高,差异小于50%并且不具有统计学显著性。与共聚焦研究(实施例1A)相比,精氨酸残基的更大需求可能与在FACS实验(实施例1B)中我们仅测量内化,而不测量结合和内化的事实有关。众所周知,多个精氨酸残基促进细胞内化。
1C.计算模型研究以确定环状CAR药效团。
来自实施例1A和1B的实验研究揭示SEQ ID NO:2-8显示与SEQ ID NO:1类似的生物活性。基于SEQ ID NO:2-8与SEQ ID NO:1的结构的相似性,获得了赋予SEQ ID NO:1生物活性的基本特征(药效团)的一些初步线索。
虽然在CAR变体之间存在结合和内化的差异,但是所有变体都是结合和内化的,并且变体之间的差异没有统计学显著性。因此,所有8种变体都具有与原始CAR序列相似的生物活性。接下来,CAR药效团的基本特征将通过计算机模拟确定。
使用PyMOL分子图形系统,1.2r2版(PyMOL 2014),在计算机上产生所有8种CAR类似物(SEQ ID NO:1-8)。研究了所产生的变体的各种特征,例如空间性质、分子量、氢键供体和受体、溶剂可及表面积、序列关系、肽骨架结构和空间中的氨基酸侧链位置。使用自适应泊松-玻尔兹曼解算器(APBS)1.2.1版(Baker 2001)研究SEQ ID NO:1-8之间的电子相似性,该程序是计算分子的大分子静电的程序。计算结果表示为静电势分子表面,并且可用于发现所有八种变体的静电荷分布的相似性。
展示了多种效果图以比较SEQ ID NO:1-8的各种分子特征。特别重要的是SEQ ID NO:1-8的叠加,其证明了CAR肽(SEQ ID NO:1)和CAR肽类似物(SEQ ID NO:2-8)之间的不重要的和微妙的相似性。
在叠加的CAR类似物的分析(图4)中,观察到保守的环状CAR结构模式,其被鉴定为环状CAR药效团。这是由于SEQ ID NO:1-8的显著的结构、电子、空间和顺序相似性。这些结果证实了实施例1中产生的数据,其中SEQ ID NO:2-8显示与SEQ ID NO:1,即原始CAR序列(SEQ ID NO:1)类似的生物活性,并且所有序列都适合于CAR药效团。
实施例2使用肽模拟物创建具有环状或线性CAR药效团的新型非肽化合物
2A.SEQ ID NO:9-11和13-15的计算机生成和虚拟渲染。
为了说明可用于产生具有CAR药效团的新型化合物的肽模拟方法,使用PyMOL分子图形系统,版本1.2r2(PyMOL 2014)在计算机中生成了小化合物文库。已经设计了六种结构以包含疾病归巢和选择性内化所需的CAR药效团。利用合理的方法模拟CAR的分子性质,所有六种类似物均由三种现有的,广泛使用的治疗剂:伏环孢菌素(voclosporin),雷帕霉素和利福布汀产生。产生含有环状CAR药效团(SEQ ID NO:9-11)的三个环状变体,并产生含有线性CAR药效团(SEQ ID NO:13-15)的三个线性变体。
虽然伏环孢菌素(voclosporin),雷帕霉素和利福布汀的某些方面可能不同于CAR的某些方面(例如,雷帕霉素和利福布汀是非肽化合物),但是这些分子可以是生产CAR类似物的肽模拟方法的起点。基于它们的环状性质,分子量(约1kDa)和口服生物利用度等CAR肽的特征来选择这些化合物。
研究了SEQ ID NO:9-11和SEQ ID NO:13-15的各种特征,例如空间特性、分子量、氢键供体和受体、可及溶剂表面积、序列关系、环状环骨架结构和氨基酸侧链/空间中的官能团位置。将观察到的SEQ ID NO:9-11和13-15的特征与环状CAR和线性CAR分别进行比较,以确定这些类似物是否仍然具有CAR药效团和CAR肽的疾病归巢和选择性内化特性。对类似物的修饰将使这些化合物具有与CAR药效团类似的结合,内化和疾病选择性。
2B.结果分析。
当比较环CAR(SEQ ID NO:1)与环状CAR-雷帕霉素(SEQ ID NO:9),环状CAR-利福布汀(SEQ ID NO:10)和环状CAR-伏环孢菌素(voclosporin)(SEQ ID NO:11)可以看出,所有四种化合物之间存在相似性和差异。显然地,SEQ ID NO:9和10的非肽/小分子性质导致其与SEQ ID NO:1之间的大部分可观察到的差异。然而,在仔细检查SEQ ID NO:1和9-11时,可以看出它们之间存在空间特征的保守模式。更具体地,在每个环肽模拟物中明显存在三个全部具有带正电荷末端的特异性官能团。每个类似物的官能团全部以与SEQ ID NO:1类似的方式,从核心主链结构(环状环)突出到空间中。SEQ ID NO:1和SEQ ID NO:9-11之间也存在静电相似性,特别是在扩展官能团的带正电荷的组分。SEQ ID NO:1和SEQ ID NO:9-11之间的其他相似性也存在,包括分子量和包含核心主链结构的保留的环,和环状结构。
分析线性CAR(SEQ ID NO:12),线性CAR-雷帕霉素(SEQ ID NO:13),线性CAR-利福布汀(SEQ ID NO:14)和线性CAR-伏环孢菌素(voclosporin)(SEQ ID NO:15),结果表明所有四种化合物之间均存在相似性和差异。与之前观察到的环状结构(SEQ ID NO:9-11)一样,可以看出,在线性CAR(SEQ ID NO:12)和线性类似物(SEQ ID NO:13-15)之间存在着空间特征的保守模式。都具有带正电荷末端的三个独特的官能团,存在于每个线性肽模拟物中。每个类似物的这些官能团都以与SEQ ID NO:12类似的方式从结构的线性主链突出到空间中。SEQ ID NO:12和SEQ ID NO:13-15之间还可以看到静电相似性,所有四种化合物在延伸的三个官能团的末端具有带正电荷的区域。
来自线性和环状CAR肽模拟物文库的结果可作为非限制性的说明性的方法,其可以在利用肽模拟物产生CAR肽的CAR药效团,疾病归巢和选择性内化特性的化合物,包括小分子时使用。分子还可以具有原始治疗性质,并与CAR药效团的归巢和疾病选择性性质结合。此外,实施例3用于进一步限定先前鉴定的CAR药效团,其不仅根据精确的序列和残基模式来定义,而且还可以根据更广义的具有相似的三维空间、立体、以及作为线性,截短和环状CAR肽的电子模式的结构来定义。
实施例3产生含有环状、线性和截短的CAR药效团的新型肽置换变体
3A.SEQ ID NO:16-19、20-23和25-28的计算机生成和虚拟渲染。
为了说明可用于产生具有CAR药效团的新肽的取代方法,使用PyMOL分子图形系统,1.2r2版(PyMOL 2014)在计算机生成了关注的化合物文库。在该实施例中,产生的所有环状,线性和截短的类似物均包含非天然氨基酸取代。使用的特定非天然氨基酸残基以及它们在CAR肽序列内的位置都是精心选择的,以便产生仍保留CAR药效团的新型类似物。设计SEQ ID NO:16-19以匹配环CAR药效团,设计SEQ ID NO:20-23以匹配线性CAR药效团,并且为截短的CAR药效团设计SEQ ID NO:25-28。
总共产生12个取代变体:4个环状、4个线性和4个截短。对于环状、线性和截短的变体所进行的取代的类型是相同的。更具体地,在每个类别(环状、线性和截短的)内,通过改变CAR氨基酸序列中第一个Lys残基的立体化学产生一个类似物,导致在该位置的D-氨基酸取代。为每个类别制备另一类似物,其含有D-烯丙基甘氨酸残基(一种甘氨酸衍生物)取代正常的Ala残基。在每个类别中也产生二氨基酸取代,其中CAR序列的Arg残基被Asn残基取代。最后,产生取代变体,其中CAR序列的Cys残基(其通常含有带电荷或乙酰化N-末端)取代了N-甲基化的Cys残基。
研究了SEQ ID NO:16-19、20-23和25-28的分子特征,包括空间特性、分子量、氢键供体和受体、可及的溶剂表面积、序列关系、主链结构和氨基酸侧链/官能团在空间中的位置。将SEQ ID NO:16-19、20-23和25-28的观察到的特征与其相应的环状,线性或截短的CAR对应物进行比较,以确定类似物是否仍然具有CAR药效团并因此具有CAR肽的疾病归巢和选择性内化特性。
为传达环状、线性和截短的CAR肽与它们各自的取代类似物的各种分子相似性,创建了几种虚拟渲染。
3B.结果分析。
环状CAR(SEQ ID NO:1)与环状取代类似物(SEQ ID NO:16-19)的叠加,使得所有五种化合物的相似性被观察到(图7)。SEQ ID NO:16-19中的氨基酸取代不会导致环状环结构或带正电荷的碱性残基的空间位置的丢失。所有三个碱性残基(Arg、Lys1和Lys2)具有与SEQ ID NO:1几乎相同的侧链空间布局的事实证明SEQ ID NO:16-19具有环状CAR药效团。另外,可以看到SEQ ID NO:1和SEQ ID NO:16-19之间的静电相似性,特别是延伸侧链的带正电荷的组分。还存在SEQ ID NO:1和SEQ ID NO:16-19之间的其他更细微的相似性,包括分子量和包含核心主链结构的保留的环,环状结构。
当分析线性CAR(SEQ ID NO:12)和线性取代变体(SEQ ID NO:20-23)时,在所有五种化合物之间可以看到大量的相似性(图8)。SEQ ID NO:20-23中的氨基酸取代不导致线性主链结构的损失,其与SEQ ID NO:12的带正电荷的碱性残基(Arg、Lys1和Lys2)的三维空间位置几乎一致。SEQ ID NO:12和SEQ ID NO:20-23之间的静电包括延伸的Arg和Lys侧链的带正电荷的组分的相似性也是明显的。分析结果显示SEQ ID NO:20-23具有线性CAR药效团。
截短的CAR(SEQ ID NO:24)与截短的取代类似物(SEQ ID NO:25-28)的叠加使得所有五种化合物的相似性能被看到(图9)。与产生的线性类似物一样,SEQ ID NO:25-28中的残基取代不导致线性主链结构的损失,其与SEQ ID NO:24的带正电荷的碱性残基(Arg、Lys1和Lys2)的三维空间位置几乎相同。SEQ ID NO:24和SEQ ID NO:25-28之间的静电相似性可以被看到,这包括延伸的Arg和Lys侧链的带正电荷的组分。鉴于SEQ ID NO:25-28和SEQ ID NO:24之间的这些基本相似性,可以推断出SEQ ID NO:25-28具有截短的CAR药效团。
实施例4具有环状和截短的CAR药效团的偶联化合物的开发
4A.偶联化合物(SEQ ID NO:29和30)的计算机生成和虚拟渲染。
使用PyMOL分子图形系统,1.2r2版(PyMOL 2014),在计算机中生成两种包含CAR药效团的新化合物(SEQ ID NO:29和30)。SEQ ID NO:29由已经与截短的CAR肽(tCAR;SEQ ID NO:24)连接(偶联)的人血清白蛋白(HSB)蛋白组成。SEQ ID NO:29由已经与环CAR(SEQ ID NO:1)偶联的单克隆抗癌抗体B1的Fv片段组成。因此,SEQ ID NO:29和30都在其序列内分别具有截短的和环状的CAR药效团。
SEQ ID NO:29通过经由二硫键将tCAR偶联至人血清白蛋白(HSB)的Cys34残基处的游离巯基而产生。此HSA-tCAR偶联物先前已显示可延长tCAR的半衰期(Dennis 2002),且说明可用于增强CAR药效团变体的性质,例如半衰期的更广泛方法。通过将环状CAR肽与单克隆抗癌抗体B1的Fv片段共价连接(通过肽键)产生SEQ ID NO:30。该抗体对人癌细胞具有亲和力。双功能化合物将产生对人癌细胞具有高度特异性的药物偶联物,并且说明包含具有疾病归巢和治疗性质的CAR药效团的更广泛类型的化合物。
实施例5产生具有包含环状CAR药效团的优化性质的肽
5A.SEQ ID NO:31-33的计算机生成和虚拟渲染。
为了说明可用于开发具有环状CAR药效团的新型肽的计算机辅助的优化方法,使用PyMOL分子图形系统,1.2r2版本(PyMOL 2014)在计算机中生成化合物文库。除了具有CAR药效团之外,产生的所有三种类似物(SEQ ID NO:31-33)含有一种或多种化学修饰,其将导致产生具有改善的或增强的性质的结构。所产生的结构可具有由单一类型的序列修改产生的多于一个的改进特征。在产生SEQ ID NO:31-33的过程中,经常使用先前公开的技术,例如置换修饰。
SEQ ID NO:31通过用Leu残基取代SEQ ID NO:1的C末端和N末端的侧翼Cys残基产生氨基酸序列:LARSKNKDL而产生。在这种情况下,环化通过连接与SEQ ID NO:1的正常二硫键相对的两个侧翼Leu残基的亚甲基桥实现。与SEQ ID NO:1中的二硫键相同,修饰用于限制肽成为更稳定的构象。然而,与SEQ ID NO:1中的二硫键不同,两个Leu残基可潜在地减少与SEQ ID NO:1相关的任何全身毒性,这是由于Leu残基通常比Cys残基具有较低水平的全身毒性(Gupta 2013)。
SEQ ID NO:32通过重排和替换SEQ ID NO:1的原始氨基酸序列而产生序列:CAKSRNHDC。更具体地,SEQ ID NO:1的Arg1已经被Lys残基取代;SEQ ID NO:1的Lys1已经被Arg残基取代;并且SEQ ID NO:1的Lys2已经被His残基取代。鉴于未经证实的CAR肽受体的性质和内化的机制,这种重排/置换可以产生氨基酸残基的最佳排列,其将增强配体和受体之间的分子相互作用。这最终可以导致包含环状CAR药效团的该化合物的靶特异性,结合或内化的改善。
通过用疏水性Leu残基取代SEQ ID NO:1的带负电荷的Asp残基产生SEQ ID NO:33,产生氨基酸序列:CARSKNKLC。用具有较大log D值的残基(例如亮氨酸)取代具有低分布系数的残基(log D),例如天冬氨酸,将改善肽的非水溶性,并可潜在地导致产生的能够增强制剂或改善药代动力学性质的类似物(Rand 2012)。
5B.结果分析。
环状CAR(SEQ ID NO:1)与优化的肽类似物(SEQ ID NO:31-33)的叠加允许所有五种化合物(未显示)之间相似性的可视化。SEQ ID NO:31-33中的氨基酸取代不导致环状环结构的损失或带正电荷的碱性残基的空间排列。所有三个碱性残基(Arg、Lys1和Lys2)具有与SEQ ID NO:1几乎相同的侧链空间布置的事实证明SEQ ID NO:31-33具有环状CAR药效团。
另外,可以看到SEQ ID NO:1和SEQ ID NO:31-33之间的静电相似性,特别是延伸侧链的带正电荷的组分。还存在SEQ ID NO:1和SEQ ID NO:31-33之间的其他更细微的相似性,包括分子量和包含核心主链结构的保留的环、环状结构。
实施例6开发潜在的CAR变体
CAR在Basic-X-Basic-X-Basic-X排列中含有3个碱性残基。该基序与许多蛋白质中的肝素结合基序相似。考虑到硫酸乙酰肝素结合CAR的需要(Jarvinen和Ruoslahti,2008),为原始位置保留碱性氨基酸(精氨酸或赖氨酸)而进行了置换。其余位置随机变化。进行噬菌体中的突变分析,因其是进行这种分析的最简便的方式。测试噬菌体克隆与CHO细胞的结合(Jarvinen和Ruoslahti,2010),并且当其活跃时,用于体内归巢。同时,还检查了截短的CAR序列。先前的实验发现,在C末端截短为CARSKNK(来自CARSKNKDC)的线性肽在细胞结合和组织归巢中是高度活跃的。相反,N末端的截短降低了活性。这些结果将药效团定义为XXBXBXB,其中B是碱性氨基酸。随机突变X残基,并测试噬菌体以获得最短和/或最具活性的肽。
结果表明,在基序CXRXRXR中,“R”可以是赖氨酸K残基或精氨酸R残基,即具有正电荷侧基的残基。在“R”为氨基酸残基D、E、H、T、S、N、I、V、G、Q、L和P的情况下,细胞结合和细胞归巢效果未得到改善。更难以解释的是,“X”中的哪些残基导致细胞结合和细胞归巢效果的改善。结果表明“X”代表的氨基酸残基不为脯氨酸P。当“X”为K、H、R、D、E、C、F、W或Y时,通常是静电的差异、而不是其实际结合距离,导致细胞结合和细胞归巢的效果不佳。最终地,结果显示“X”可以是T、S、N、Q、A、I、L或V等具有极性、不带电荷的侧基的氨基酸残基和具有疏水侧基的氨基酸残基。
实施例7CAR药物基团靶向慢性肾脏疾病
使用中心性肾小球的肾炎大鼠模型(抗肾小球基底膜抗体诱导的肾小球损伤)来观察CAR药效团靶向慢性肾脏疾病的效用。在大鼠肾中通过静脉内注射抗肾小球基底膜抗体诱导肾小球肾炎。诱导后14天,静脉注射以3.3mg/kg B.W.CAR药效团肽或对照(CGGGGGGGC)肽,在CAR药效团或对照注射后三小时收获肾脏,并使用Massontrichrome(collogen)染色和纤连蛋白免疫染色来测定肾病和纤维化形成的发展。
图10中显示的结果表明CAR药效团用于靶向慢性肾脏疾病的效用。CAR药效团在病变肾脏的肾小球毛细血管,肾小球腔中的新月体,肾小管上皮和间质(C)中广泛累积(紫色)。CAR药效团在新月及肾管中积累。肾小管蓄积可能与再吸收有关。相比之下,在施药3小时之时,对照肽大部分从肾中清除(D)。
实施例8在野百合碱诱导(MCT)肺动脉高压的大鼠模型中与伊马替尼共施用CAR药效团用于观察CAR靶向肺动脉高压的治疗效用。CAR药效团肽在MCT诱导后4周开始与10mg/kg或50mg/kg伊马替尼静脉内共施用14天。
结果表明,在共同施用CAR药效团和伊马替尼后,MCT诱导的肺动脉高压的严重性不如先前报道的诱导后4周的研究那样大(数据未显示)。CAR药效团的共同施用增强了伊马替尼的作用以减少右心脏肥大。
类似地,当在本实验中测量肺动脉肌化程度时,CAR药效团的共施用增强了伊马替尼的效果(数据未显示)。
令人惊讶的结果是发现CAR药效团对体重的有益效果。右心脏肥大和肺动脉肌化的减少与高血压大鼠的体重恢复改善相吻合。恶病质或消耗综合征在没有主动尝试减肥的个体中出现体重减轻、肌肉萎缩、疲劳、虚弱和食欲不振。恶病质在患有癌症、AIDS、慢性阻塞性肺病、多发性硬化、充血性心力衰竭、结核病、家族性淀粉样多发性神经病、汞中毒(肢端痛)和激素缺乏的患者中见到。CAR药效团对体重的有益效果的发现提供了CAR药效团总体上能改善由MCT注射诱导和甚至恶病质引起的体重减轻能力的初步证据。
实施例9CAR药效团在败血症的脂多糖内毒素(LPS)小鼠模型中改善败血症存活的能力。
败血症中CAR作用的假设机制(图11)。(A)内皮膜的健康糖萼不结合CAR肽。一些药物分子被动扩散通过质膜,但大多数药物保留在血流中。(B)败血症后,肝素酶表达引起硫酸乙酰肝素(HS)链的选择性酶裂解和糖萼的修饰。抗切割的HS变体保持完整,使得CAR能结合其HS受体。(C)CAR的结合引发膜起皱和脂筏形成,引起质膜的内向折叠和对包括CAR和药物分子的细胞外组分的吞噬。(D)含有CAR和药物分子的巨胞囊泡被内化到细胞中。(E)降低的细胞内pH导致巨胞饮小体解离,释放CAR和药物进入细胞。虽然这仍然只是一个假设,它可以解释如何CAR选择性地增强药物在败血症组织中的局部活性,而不增加血管通透性。
50%具有LPS-诱导的败血症的未处理的小鼠在48小时内死亡。当这些LPS小鼠用临床相关剂量的常见和实验性败血症药物氢化可的松,抗凝血酶III或西维来司钠治疗时,存活范围为40-56%,类似于当前的临床结果。相比之下,当LPS小鼠在与氢化可的松,抗凝血酶III或西维来司钠相同的时间共同施用CAR时,实验性败血症存活改善至83-89%。
CAR药效团显著改善了用西维来司钠治疗的败血症小鼠的存活。注射细菌蛋白,脂多糖(LPS),用于在小鼠中诱导败血症。在3、6、9和12小时给予剂量以匹配西韦来特的临床应用。在注射LPS后48小时测量存活。在48小时时,CAR药效团+西维来司钠治疗的动物的存活率为89%,相比之下,在对照和仅西维来司钠(sivelestat)组中为50%,表示用CAR药效团处理的动物的存活率增加了78%(图12)。
CAR药效团显著改善了用抗凝血酶III(ATIII)处理的败血症小鼠的存活。诱导败血症,在3和24小时给予匹配ATIII临床使用的剂量,并测量存活率。在48小时,CAR药效团+ATIII治疗的动物的存活率为83%,相比之下,对照组为50%,仅有ATIII治疗的组为40%,相对于仅ATIII组,CAR药效团处理的动物的存活增加66%(图13)。仅ATIII治疗的动物,其存活降低可能是由于ATIII的抗凝血活性引起的出血。CAR药效团似乎完全逆转了这种效应。
CAR药效团显著提高用氢化可的松类固醇治疗的败血症小鼠的存活率。诱导败血症,在3和24小时给予匹配氢化可的松临床使用的剂量,并测量存活。在48小时时,CAR药效团处理的动物的存活率为83%,相比之下在对照中为50%和仅在氢化可的松组中为56%,表示CAR药效团处理的动物相对于仅使用氢可皮酮组的存活增加57%(图14)。
受该结果的鼓励,随后我们在LPS败血症小鼠中测试CAR药效团,其存活提高至80%。CAR药效团作为败血症中的独立治疗剂,通过以20mg/kg(或500μg/小鼠)单独施用的CAR药效团通过腹腔注射,发现在48小时CAR药效团将LPS小鼠存活率从50%(无治疗)提高至80%。这表明CAR药效团在增强现有的败血症疗法以及其有潜力作为改善败血症存活的独立试剂的效用。所给予的CAR药效团剂量,即500μg/20-25g小鼠,相当于20-25mg/kg体重的CAR药效团,支持CAR药效团本身作为强大的抗炎剂的潜力,诱导发炎组织中的局部微胞饮作用,其特征在于改变的糖萼,导致发炎组织能够以与正常组织更相似的速率吸收细胞外分子,从而使得组织从炎症中愈合。
实施例10CAR药效团靶向败血症和损伤的肺、肝和肾内皮的恢复。
LPS注射用于在10周龄雄性C57BL6大鼠(20mg/kg,腹腔)中诱导败血症。注射后48小时评价动物存活:PBS 100%(n=10),LPS 21.4%(n=28),p<0.05(图15A)。为了确认CAR药效团是否内在于内皮细胞,在接受PBS或LPS后12小时用荧光CAR药效团-FAM(8mg/kg腹腔注射)处理动物。1小时后处死动物、处理肺、肝和肾组织用于组织学。仅在败血症动物肺部血管和肝脏中的门管鞘中观察到CAR阳性染色(图15B,箭头)。在肾脏中,在败血症动物的肾小球中集中了较高水平的CAR药效团(箭头)。如图16所示,CAR药效团与肾脏中的内皮特异性标记凝集素共定位。在败血症动物中,CAR药效团归巢于损坏的内皮细胞并与凝集素共定位(箭头)。
来自对照组,西维来司钠和CAR药效团+西维来司钠治疗的小鼠的肺组织的扫描电子显微照片表明,单独的西维来司钠不阻止连续肺动脉内皮的降解(图17)。当CAR药效团与西维来司钠共同施用时,内皮的降解被阻止,并且其连续外观与对照组相似。
来自对照组,西维来司钠和CAR药效团+西维来司钠治疗的小鼠的肝脏组织的扫描电子显微照片表明,单独的西维来司钠不能防止败血症动物中的筛板的脱离,如对照中所示(图18)。当将CAR药效团与西维来司钠共同施用于败血症动物时,筛板簇的大小和数量恢复几乎至对照组水平。
来自对照组,西维来司钠和CAR药效团+西维来司钠治疗的小鼠的肾组织的扫描电子显微照片表明,单独的西维来司钠不能防止如对照组中所示的总体组织损伤(箭头)(图19),可能是由于嗜中性粒细胞弹性蛋白酶的活化导致蛋白水解关键细胞外基质蛋白的降解。当CAR药效团与西维来司钠共同施用时,西维来司钠的抗弹性蛋白酶似乎通过CAR药效团选择性归巢到肾中的受损内皮糖萼而有效地增强。
在CAR药效团处理的动物中,急性肾损伤标记(KIM-1)表达降低(图20)。在肾脏损伤的近端小管中上调的KIM-1的组织学染色在CAR药效团处理的动物中显著降低。
实施例11CAR药效团在三阴性乳腺癌模型中的作用。
在雌性无胸腺裸鼠(CRL:NU(NCr)-Foxn1nu,11周龄,Charles River)中,通过向右胁皮下注射5中,通过5×106MDA-MB-231细胞来诱导三阴性乳腺癌肿瘤。监测肿瘤生长直到平均肿瘤大小接近100-150mm3。在肿瘤植入后二十一天(研究的第1天,体重范围为20.6至27.3克),将动物分成三组(n=3),接受紫杉醇和CAR药效团(每种3mg/kg),紫杉醇(3mg/kg)或盐水载体。每隔一天静脉内给予动物总共15次剂量。使用卡尺每周两次测量肿瘤体积,在第1-5天每天称重动物,然后每周两次的计划。
CAR药效团与紫杉醇的联合给药与单独的紫杉醇相比减少了超过15天时的平均肿瘤体积(图21),并且提供了改善癌症诱导的体重减轻的额外的益处。在32天后,CAR药效团处理的动物相对于其平均起始体重增加11%,而单独紫杉醇组增加5%,盐水载体对照组增加6%(数据未显示)。
实施例12在肺动脉高血压中的选择性药物功效。
用单次腹腔内注射剂量的野百合碱(60mg/kg)在雄性Sprague-Dawley大鼠(300-330g,10周龄,Harlan)中诱导肺动脉高压。在诱导肺动脉高压之后4周用伊马替尼(50mg/kg或10mg/kg)或伊马替尼(50mg/kg或10mg/kg)+CAR药效团组合(3mg/kg)开始治疗,持续2周,(图22和23)或每日舌下施用。
CAR药效团的共同施用增强了伊马替尼的治疗效果,如通过右心脏肥大(图22和24)和肺动脉肌化(图25)的改善所测量的。值得注意的是,即使在减少80%的伊马替尼(10mg/kg)剂量时,将CAR药效团佐剂加入到治疗中产生的效力等于或大于全剂量50mg/kg伊马替尼单一疗法(图22和25)。长期静脉内施用伊马替尼似乎对体重具有显著的负面影响。CAR药效团肽的共同给药似乎缓解了这种副作用。加入CAR药效团作为伊马替尼治疗的佐剂增加了MCT大鼠的体重,表明动物的整体健康有显著的改善。
词汇表
1、DMEM-Dulbecco's Modified Eagle's培养基-含有氨基酸、盐、葡萄糖和维生素的细胞培养基。
2、FAM-羧基荧光素荧光染料用作示踪剂。
3、DAPI-4',6-二脒基-2-苯基吲哚,在DNA中强烈结合A-T富集区的荧光染料,并广泛用于荧光显微镜。
4、NIH-国家健康研究所。
5、STTR-小型商业技术转移-由NIH赞助的一个计划,旨在增加小型企业在联邦研发中的参与度,并增加私营部门通过联邦研发开发的技术的商业化。
6、CAR-具有序列CARSKNKDC的九个氨基酸肽;可以是环状或线性的。
7、cCAR-具有序列CARSKNKDC的环状,九氨基酸肽。
8、tCAR-具有序列CARSKNK的截短的,线性的,7个氨基酸的肽。
9、SEQ ID NO-序列识别号的缩写,用于识别某些公开的序列。
10、CADD-计算机辅助药物设计。
11、CHO-K1-来自亲本中国Hampster Ovary细胞系的亚克隆衍生物;来源于1957年由T.T.Puck的成年中国仓鼠的卵巢活检。
12、FACS-荧光激活细胞分选。
13、HS-硫酸乙酰肝素
14、HSA-人血清白蛋白。
15、HSA-tCAR-通过二硫键将截短的CAR(tCAR;SEQ ID NO:24)与人血清白蛋白(HSA)的Cys34残基处的游离巯基共价连接产生的偶联化合物。
16、ATIII-抗凝血酶III。
17、AB1-单克隆抗癌抗体B1。
18、CAR-AB1-通过将环状CAR(SEQ ID NO:1)与单克隆抗癌抗体B1的Fv片段共价连接产生的偶联的化合物。
19、CNS-中枢神经系统。
20、Cyclic CAR Rifa-环状CAR-利福布汀肽模拟物。
21、Cyclic CAR-Rapa-环状CAR-雷帕霉素肽模拟物。
22、Cyclic CAR-Voclo-环状CAR-伏环孢菌素(Voclosporin)肽模拟物。
23、Linear CAR-Rifa-线性CAR-利福布汀肽模拟物。
24、Linear CAR-Rapa-线性CAR-雷帕霉素肽模拟物。
25、LinearCAR-Voclo-线性CAR-伏环孢菌素(Voclosporin)肽模拟物。
26、PAH-肺动脉高压。
27、DNA-脱氧核糖核酸。
28、LPS-脂多糖内毒素。
29、MCT-野百合碱。
30、NM-核磁共振。
31、PBS-磷酸盐缓冲盐水。
32、Arg-精氨酸。
33、His-组氨酸。
34、Lys-赖氨酸。
35、Asp-天冬氨酸。
36、Glu-谷氨酸。
37、Ser-丝氨酸。
38、Thr-苏氨酸。
39、Gln-谷氨酰胺。
40、Cys-半胱氨酸。
41、Gly-甘氨酸。
42、Pro-脯氨酸。
43、Ala-丙氨酸。
44、Val-缬氨酸。
45、Ile-异亮氨酸。
46、Leu-亮氨酸。
47、Met-甲硫氨酸。
48、Phe-苯丙氨酸。
49、Tyr-酪氨酸。
50、Trp-色氨酸。
51、LogD-分配系数(P)的对数,其是化合物在亲脂性有机相和极性水相之间分配的趋势的量度。
SEQUENCE LISTING
<110> 血管生物科学;桑福德伯纳姆普利柏斯药物探索研究所;大卫·曼;埃尔基·鲁奥斯拉蒂;小松政信
<120> 含有对患病组织具有选择性的药效团的组合物及其制备方法
<130> P1710116WP
<150> US 62/034,046
<151> 2014-08-06
<150> US 62/161,121
<151> 2015-05-13
<160> 33
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<400> 1
Cys Ala Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 2
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 2
Cys Ala Arg Ser Arg Asn Lys Asp Cys
1 5
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 3
Cys Ala Arg Ser Lys Asn Arg Asp Cys
1 5
<210> 4
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 4
Cys Ala Arg Ser Arg Asn Arg Asp Cys
1 5
<210> 5
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 5
Cys Ala Lys Ser Arg Asn Lys Asp Cys
1 5
<210> 6
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 6
Cys Ala Lys Ser Lys Asn Arg Asp Cys
1 5
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 7
Cys Ala Lys Ser Lys Asn Lys Asp Cys
1 5
<210> 8
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 8
Cys Ala Lys Ser Arg Asn Arg Asp Cys
1 5
<210> 9
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Rapamycin
<400> 9
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 10
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Rifabutin
<400> 10
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 11
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Voclosporin
<400> 11
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 12
Cys Ala Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 13
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Rapamycin
<400> 13
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 14
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Rifabutin
<400> 14
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 15
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Voclosporin
<400> 15
Cys Ala Arg Ser Lys Asn Lys Asp Cys Xaa
1 5 10
<210> 16
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X is equal to D-amino acid K
<400> 16
Cys Ala Arg Ser Lys Asn Xaa Asp Cys
1 5
<210> 17
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X is equal to D-amino acid allylglycine
<400> 17
Cys Xaa Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X is equal to D-amino acid N
<400> 18
Cys Ala Xaa Ser Lys Asn Lys Asp Cys
1 5
<210> 19
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X is equal to N-methylated C
<400> 19
Xaa Ala Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 20
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X is equal to D-amino acid K
<400> 20
Cys Ala Arg Ser Xaa Asn Lys Asp Cys
1 5
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X is equal to D-amino acid allylglycine
<400> 21
Cys Xaa Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 22
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X is equal to D-amino acid N
<400> 22
Cys Ala Xaa Ser Lys Asn Lys Asp Cys
1 5
<210> 23
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X is equal to N-methylated C
<400> 23
Xaa Ala Arg Ser Lys Asn Lys Asp Cys
1 5
<210> 24
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 24
Cys Ala Arg Ser Lys Asn Lys
1 5
<210> 25
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X is equal to D-amino acid K
<400> 25
Cys Ala Arg Ser Xaa Asn Lys
1 5
<210> 26
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X is equal to D-allylglycine
<400> 26
Cys Xaa Arg Ser Lys Asn Lys
1 5
<210> 27
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X is equal to D-amino acid N
<400> 27
Cys Ala Xaa Ser Lys Asn Lys
1 5
<210> 28
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X is equal to N-methylated C
<400> 28
Xaa Ala Arg Ser Lys Asn Lys
1 5
<210> 29
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X is equal to HSA, human serum albumin
<400> 29
Xaa Cys Ala Arg Ser Lys Asn Lys
1 5
<210> 30
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> cyclic peptide
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X is equal to Fv fragment of B1 antibody
<400> 30
Cys Ala Arg Ser Lys Asn Lys Asp Lys Xaa
1 5 10
<210> 31
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 31
Leu Ala Arg Ser Lys Asn Lys Asp Leu
1 5
<210> 32
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 32
Cys Ala Lys Ser Arg Asn His Asp Cys
1 5
<210> 33
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthesized
<400> 33
Cys Ala Arg Ser Lys Asn Lys Leu Cys
1 5
- 还没有人留言评论。精彩留言会获得点赞!