用于处理癌细胞的组合物及其方法与流程
本公开涉及用于处理受试者中的癌细胞的组合物及其方法。
技术实现要素:
本公开的一个方面是用于处理在具有免疫系统的受试者中的癌细胞的组合物。组合物包括具有至少一种突变的亚塔痘病毒(Yatapoxvirus)属中的病毒。至少一种突变通过该病毒导致TNF结合蛋白表达抑制。
本公开的另一方面是用于处理在具有免疫系统的受试者中的癌细胞的组合物,包括亚塔痘病毒属中的病毒,其中病毒具有至少一种突变,所述至少一种突变导致胸苷激酶(“TK”)的表达抑制。
在本公开的又一方面,用于处理在具有免疫系统的受试者中的癌细胞的组合物包括编码表达细菌鞭毛蛋白的转基因的痘病毒。
在本公开的再一方面,一种用于治疗具有癌细胞的受试者的方法包括将组合物给药至受试者,其中组合物包括具有至少一种突变的亚塔痘病毒属中的病毒,至少一种突变通过病毒导致TNF结合蛋白的表达抑制。
根据本公开的另一方面,通过使所述病毒突变来修饰亚塔痘病毒属的病毒将至少一种基因递送至受试者中的癌细胞以抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达。病毒也通过编码病毒中的至少一种基因而被修饰,其中病毒中所编码的至少一种基因导致了癌细胞的凋亡增加或激活了受试者中的免疫应答。将所修饰的病毒给药至受试者。
本文所述的用于治疗癌性肿瘤的药物组合物和方法允许了具有严重感染或副作用的有限风险的对癌细胞潜在有效处理,这些严重感染或副作用可以在传统治疗方法中经历,并且在一些情况下药物组合物和方法可以与传统治疗方法结合使用。与未修饰的痘病毒相比,本文所述的经修饰的痘病毒已经表现出表明增强的肿瘤选择性和增强的肿瘤致死性,并且预期保持优选的OV特性,诸如在所感染的受试者中仅引起轻度和自限发热性疾病(self-limiting febrile illness)。
本领域技术人员在研究以下说明书、权利要求书和附图时将进一步理解和领会本策略(device)的这些和其他特征、优点和目的。
附图说明
图1是说明如通过p2KO方法改变为插入表达的转基因和荧光报告物的重组塔那痘病毒(tanapoxvirus)(TPV)的一种实施方式的示意图。
图2A是说明用HCT 116细胞异种移植的并用仅载体对照溶液处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2B是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV/egfp)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2C是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ66R/mMCP-1)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2D是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ66R/mGM-CSF)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2E是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ66R/fliC)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2F是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ66R)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2G是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ2L)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;
图2H是说明与仅载体对照溶液相比,用HCT 116细胞异种移植的并用重组TPV(TPV-p2KO/Δ2L/Δ66R/fliC)的一种实施方式处理的无胸腺裸小鼠中平均肿瘤体积的图;以及
图3包括通过已被改变为表达荧光报告物的重组TPV的一种实施方式的感染而产生的在2天、4天和6天时病毒斑块(viral plaque)的一种实施方式的视图。
发明内容
出于本文描述的目的,术语“上”、“下”、“右”、“左”、“后”、“前”、“垂直”、“水平”及它们的派生词将涉及如图1所取向的组合物。然而,应当理解,组合物可采取多种替代的取向,并且方法可以包括多种步骤顺序,除非明确地相反指出。还应当理解,在附图中示出的并在下面的说明书中描述的具体装置和过程仅仅是所附权利要求中限定的发明构思的示例性实施方式。因此,与本文公开的实施方式相关的具体尺寸和其他物理特性不被认为是限制性的,除非权利要求另有明确说明。
尽管已经在一些诸如VACV的病毒的溶瘤变体(oncolytic variant)中显示出对癌细胞和/或转化细胞的感染的一些偏好(preference),但是野生型痘病毒诸如亚塔痘病毒(Yatapoxvirus)属中的那些病毒(包括但不限于塔那痘病毒(“TPV”))通常不被认为具有高度的天然肿瘤特异性。在没有显著的天然肿瘤特异性的病毒中,基因工程已经被使用来增加癌细胞选择性。
尽管它们不一定具有高度的肿瘤特异性,但痘病毒,且更特别地是亚塔痘病毒属中的痘病毒,具有几个固有的性质,这些性质使得它们非常适合用作OV的修饰。痘病毒具有能够容纳大量添加的遗传物质的病毒基因组,并且具有进攻能力和防御能力的内置的阵列。痘病毒基因组编码多种免疫调节蛋白,多种免疫调节蛋白专用于隐藏感染相关的细胞表面表位免受宿主的免疫监视,一些宿主免疫和炎症反应的抑制和逃避,以及借助于模拟宿主细胞因子和细胞因子受体的病毒编码的肽的来自细胞外环境的信号的中断。痘病毒还产生两种不同类型的子代病毒粒子(成熟病毒粒子(MV)形式和包膜病毒粒子(EV)形式)。病毒的MV形式被封闭(包裹)在单脂质双层中,并且仅通过细胞溶解从宿主细胞释放。在其已经获得了可能来自宿主细胞反式高尔基体网络的第二外部包膜之后,EV形式从宿主细胞活跃地被输出,并且被称为包裹病毒粒子(wrapped virion)(WV),直至其从已感染的细胞中被输出,在此时间之后它被称为EV形式。痘病毒EV形式是该病毒的特定(specialized)形式,其负责通过经由血流和淋巴网络的通行(traffick)将痘病毒扩散到宿主内的远端位点。EV形式非常适合于该任务,因为其仅具有6个暴露于细胞外环境的跨膜蛋白,而相对于MV形式约为20个。更少的暴露的表位意味着该EV形式比MV形式更能够逃避中和免疫。
另外,TPV(亚塔痘病毒(Yatapoxvirus)属的成员和野生痘病毒)具有有利于发展OV的其他特征,使其成为用于发展OV的亚塔痘病毒属的优选成员。感染有TPV的人仅经历轻度的和自限性的发热性疾病,可能是因为TPV感染通常局限于身体的外周区域。除了赤道非洲地区(在那里它是地方性的),人类对TPV是免疫原性的。此外,TPV从未被观察到从人到人传播,在OV中是非常期望的安全特征。
本文公开了痘病毒的基因工程化的样品,包括亚塔痘病毒(Yatapoxvirus)属的样品,用作OV,以被掺入组合物中来处理癌细胞,以及以被用于处理癌细胞的方法中。本文还描述了若干优选的实施方式,包括掺入重组TPV的若干优选实施方式。
总之,如下文进一步描述的,本公开的一个方面是用于处理在具有免疫系统的受试者中的癌细胞的组合物。在一个方面,组合物包括具有至少一种突变的亚塔痘病毒属中的病毒。至少一种突变通过病毒导致了TNF结合蛋白的表达抑制。本公开的另一方面是一种用于处理在具有免疫系统的受试者中的癌细胞的组合物,包括亚塔痘病毒(Yatapoxvirus)属中的病毒,其中病毒具有至少一种导致胸苷激酶(“TK”)的表达抑制的突变。在另一方面,组合物包括一种编码表达细菌鞭毛蛋白的转基因的痘病毒。如本文所用的,术语“受试者”包括人和动物受试者,并且优选为哺乳动物受试者。
也如下文更详细描述的,治疗具有癌细胞的受试者的方法包括将一种组合物给药至受试者,其中组合物是如本文所述的。例如,在一种实施方式中,组合物包括具有至少一种突变的亚塔痘病毒(Yatapoxvirus)属中的一种病毒,该突变通过病毒导致了TNF结合蛋白的表达抑制。在另一实施方式中,组合物包括亚塔痘病毒(Yatapoxvirus)属中的一种病毒,其中病毒具有至少一种导致TK的表达抑制的突变。在又一实施方式中,组合物包括编码表达细菌鞭毛蛋白的转基因的一种痘病毒。任何的或所有的这些突变可以单独地存在或以任何组合存在于组合物中。另外,组合物可以以靶向方式递送至一组癌细胞,或可以全身地(系统地,systemically)递送至受试者。
根据本公开的另一方面,如下文更详细描述的,通过修饰亚塔痘病毒(Yatapoxvirus)属的一种病毒(该过程通过使病毒突变)将至少一种基因递送至受试者中的癌细胞以抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达。病毒也通过编码病毒中的至少一种基因而被修饰,其中病毒中编码的至少一种基因导致了该癌细胞的增加凋亡或激活了受试者中的免疫应答。将所修饰的病毒被给药至受试者。
在某些实施方式中,痘病毒被遗传修饰(genetically modified)以抑制具有TNF结合活性的宿主范围因子的表达,本文也称为TNF结合蛋白。被抑制的TNF结合蛋白在结构上与MHC-1重链蛋白相似,并且该所编码的TNF结合蛋白可以与MHC-1轻链相互作用。在TPV中,TNF结合蛋白在2L基因中被编码。重组TPV(其中2L基因已经被切除或以其他方式突变以抑制TNF结合蛋白的表达)在本文中有时被称为“2L缺失的”或“Δ2L”。在正常的痘病毒感染中,所分泌的TNF结合蛋白通过结合于存在的TNF并有效地减少存在的TNF的量以与所感染的细胞相互作用来减弱宿主炎症和抗病毒免疫应答。尽管对于痘病毒这是期望的结果,但当痘病毒用作OV时,这对于增加而不是减少由所治疗的肿瘤经历的炎症量可能有利的。在用基于重组TPV作为痘病毒的OV来治疗其肿瘤的人类受试者中,重组TPV中2L基因的切除可以导致处于肿瘤位点的TNF浓度的有效增加(与用携带2L的TPV所感染的肿瘤相比)。TNF的增加水平可最终起作用以增加肿瘤清除率。因为2L基因先前已显示与人TNF结合而不与小鼠TNF结合,所以本文所述的一些重组TPV中的2L基因的切除预期在小鼠实验期间不是肿瘤清除的重要因素,但是预期在灵长类动物和人类中的肿瘤清除中是更重要的因素。在异种移植的无胸腺裸小鼠中使用的重组TPV的特定实例中进行2L基因的切除,其中异种移植物由人类癌细胞组成,正如本文所述的,因为小鼠测试对于在更相关的灵长类动物的癌症病毒疗法(cancer virotherapy)的模型中进一步测试基于痘病毒的OV是重要的步骤。
在某些实施方式中,痘病毒的肿瘤选择性是通过修饰该痘病毒以抑制胸苷激酶(TK)的表达来增加的。在TPV中,TK编码基因被称为66R。其中66R基因已被切除或以其他方式突变以抑制TK表达的重组TPV在本文中有时被称为“66R缺失的”或“Δ66R”。由于细胞TK1在癌细胞中的作用,癌细胞中的TK活性是组成性高的。这与正常的细胞相反,其中TK活性水平在细胞周期的S期期间达到峰值,并且在其他时间几乎检测不到。细胞TK1催化核苷酸合成中的一个步骤(胸苷向胸苷单磷酸的转化)。由于这个原因,癌细胞在整个细胞周期中表达TK1,并因此倾向于具有大量在细胞周期的所有阶段可用的单磷酸胸苷(thymidine monophosphate)的细胞质库。通过抑制该TK编码基因,特别是在亚塔痘病毒(Yatapoxvirus)属中的痘病毒中,相比如果TK编码基因保持完整,痘病毒具有更大的癌细胞选择性。在本文所述的异种移植的无胸腺裸鼠中使用的重组TPV的一些具体实例中进行66R基因的切除,尽管小鼠通常不是TPV的动物宿主。66R基因在这种环境中的切除表明66R基因的切除不会在受纳细胞(诸如人癌性肿瘤细胞)中导致非复制型TPV。
此外,痘病毒的肿瘤致死性可以通过用转基因编码该痘病毒来增加,以增加癌细胞的凋亡或以激活受试者的免疫系统。可用于编码痘病毒的转基因的实例包括但不限于表达细胞因子、趋化因子、抗原呈递多肽或细菌抗原的基因。如本文所用的,细胞因子是指具有免疫细胞或调节作用(诸如刺激免疫细胞、促进免疫细胞生长或将免疫细胞导向特定位点)的系统的蛋白质或多肽。在某些优选的实施方式中,所用的痘病毒是具有粒细胞-单核细胞集落刺激因子(GM-CSF)、巨噬细胞趋化蛋白1(CCL2,也称为MCP-1和MCF-1)或细菌鞭毛蛋白(FliC,肠道沙门氏菌中fliC基因的产物)的重组TPV。当使用用于小鼠的重组TPV进行实验时,这些转基因的小鼠(m)版本(version)被使用,其中在重组TPV(即,mGM-CSF、mCCL2、mMCP1、mMCF-1)中相关。使用这些转基因的适当的或有效的版本(型)用于受试者是优选的,其中在受试者上将要进行测试或治疗。
聚合鞭毛蛋白是根据本公开使用的细菌鞭毛的主要成分。用于本文所述的特定实验的鞭毛蛋白是沙门氏菌肠道血清型(serovar)鼠伤寒沙门氏菌基因fliC的产物。FliC和其他细菌鞭毛蛋白是toll样受体5(TLR5)的同源配体,并且是通过MyD88依赖性的细胞内信号转导(signaling)和最终转录因子NFκB的激活的哺乳动物细胞中先天免疫应答的强激活剂。鞭毛蛋白是有力的和多效的毒力因子,其在细菌发病机理中具有其他的重要作用。
除了上述痘病毒实施方式中基因组的修饰之外,可选地将荧光报告转基因(fluorescent reporter transgene)插入痘病毒的基因组中。通过包含荧光报告转基因,大大地促进了培养的细胞中的病毒感染的可视化,从而促进使用本文所述的痘病毒变体的研究。优选的荧光报告转基因包括报告子mCherry(激发/发射587nm/610nm)和增强的绿色荧光蛋白(GFP,激发/发射475nm/509nm)。
痘病毒的优选的实施方式包括病毒(优选是亚塔痘病毒(Yatapoxvirus)属的),其具有任何的或所有的上述突变或插入,并且突变和插入优选地使用p2KO载体方法进行。在一个优选的实施方式中,重组TPV(亚塔痘病毒(Yatapoxvirus)属的成员)通过本文所用的p2KO方法被改变,其示意图示于图1中。如图所示,两种源自牛痘苗病毒(VACV)的早期/晚期合成启动子被用于驱动所需表达的转基因的表达以编码病毒(例如,mGM-CSF、mCCL2、mMCP1、mMCF-1、fliC)和可选的荧光报告转基因。图1中描述的p2KO载体方法的实施方式包括将p2KO表达盒(cassette)(包括左侧翼和右侧翼,包含所表达的转基因或荧光报道转基因的至少一个插入开放阅读框(ORF)和至少一个启动子)通过在转染/感染过程期间的同源重组双交换事件(double-crossover event)转移至TPV的病毒基因组,如下文更详细描述的。以这种方式,通过使用病毒基因组侧翼序列,p2KO表达盒被引导至TPV的病毒基因组中的特定点,导致所需的一种或多种基因的靶向切除,伴随重组TPV中所需表达的转基因和可选的荧光报告转基因的同时表达。
在如图1所示的TPV p2KO表达盒的实施方式中,多个痘病毒早期/晚期合成启动子允许多种转基因的表达。p2KO表达盒通过使用来源于靶基因的病毒基因组侧翼序列来引导插入病毒基因组中的特定点,导致所需一种或多种基因的靶向切除,伴随荧光报告转基因和该所表达的转基因的同时表达,以装备病毒。在图1所示的实施方式中,显示了荧光报告转基因和所表达的转基因。在可替换的实施方式中,荧光报告转基因或该所表达的转基因中的任一者可以存在于p2KO表达盒中用于插入病毒基因组中。左侧翼和右侧翼被独特的限制性位点(限制性内切位点,restriction site)对限定。将侧翼区连接到5'(左)侧翼上的Sac I限制性位点和Not I限制性位点之间以及3'(右)侧翼上的EcoRI限制性位点和Hind III限制性位点之间的p2KO载体中。待表达的一种或多种基因(荧光报告物和/或所表达的转基因)被独特的5'-BamH I限制性位点和3'-Xma I限制性位点限定。这些允许了由适当的限制性位点所限定的PCR扩增子的简单的和定向的连接。
本文所述实施例的p2KO方法中使用的相关引物示于下面表1中。在每种情况下,所插入的限制性内切核酸酶位点用下划线表示。在适当的情况下,在正向引物中,起始密码子用带灰色阴影的粗体表示,以及在反向引物中,终止密码子用带灰色阴影的粗体表示。本文所述实施例中使用的左侧翼引物和右侧翼引物不包括起始密码子或终止密码子。
表1:用于制备p2KO切除/插入载体的引物
用于所表达的转基因插入位点的p2KO方法的各种实施方式中的ORF包括mCCL2转基因、mGM-CSF转基因和fliC转基因。下面引用的实施例中使用的mCCL2转基因是使用作为携带ORF的质粒所购买的(可从Sino Biological,Incorporated获得)mCCL2cDNA克隆ORF而产生的。下面引用的实施例中使用的mGM-CSF转基因是使用由Grant McFadden博士提供的mGM-CSF的cDNA克隆ORF而产生的。mCCL2、mGM-CSF和fliC ORF通过PCR从它们的载体扩增,并在产物扩增子的5'-和3'-末端上分别给予BamHI限制性序列和XmaI限制性序列。mCCL2、mGM-CSF和fliC ORF被连接到p2KO切除/插入载体中。
如下表2中所示的,以下缩写在本文中用于描述使用p2KO方法产生的重组TPV的各种实施方式。虽然本文描述了p2KO切除/插入方法,但是应当理解,任何已知的用于从基因组切除基因或将转基因插入基因组的方法可用于形成本文所述的重组TPV。
表2:重组TPV缩写
为了选择用于在小鼠宿主中测试重组TPV的合适的细胞系,针对一组人结直肠癌细胞系测试最小改变的重组TPV/egfp,以选择允许最佳病毒复制的细胞系,从而使直接病毒肿瘤细胞裂解的效果最大化。用于TPV/egfp复制所测试的hCRC细胞系包括HCT 116、COLO205、SW1463和WiDr。肿瘤细胞的病毒裂解对于在一些情况下的肿瘤清除是重要的,但是病毒细胞溶解仅是影响肿瘤存活和清除的许多因素之一,并且免疫细胞募集(聚集,recruitment)也可以起作用。虽然HCT 116比对照细胞系OMK产生了更少的子代病毒粒子,但HCT 116是所测试的hCRC细胞系中产量最高的。此外,在用HCT 116诱导的肿瘤中已经表征了许多OV。由于这些原因,HCT 116被用于实验以进一步表征重组TPV在体内的溶瘤潜力。
为了评价重组TPV的各种实施方式,通过将5×106个HCT 116细胞皮下注射到无胸腺裸小鼠的背部表面上,用HCT 116细胞系在无胸腺裸小鼠中诱导肿瘤。当肿瘤大小达到75mm3时,小鼠被随机分为对照组或实验组,每组5只小鼠。在第0天(达到75mm3的肿瘤体积后)给药仅含有100μL的载体(a组)或重组TPV(b-h组)的单次注射,并且之后以三天的间隔来测量肿瘤体积。使用下式计算平均肿瘤体积:
平均肿瘤体积=(长度)×(宽度)×(高度)×π/6 (1)
在用重组TPV治疗期间,HCT 116诱导的肿瘤异种移植物的体积没有增加到预期水平。然而,在用重组TPV治疗的小鼠中发生了多发性继发性肿瘤。此外,在一些体外研究中,包括HCT 116原位异种移植模型,HCT 116细胞已经被报道为是高度运动性(motile)和侵入性的(invasive)。
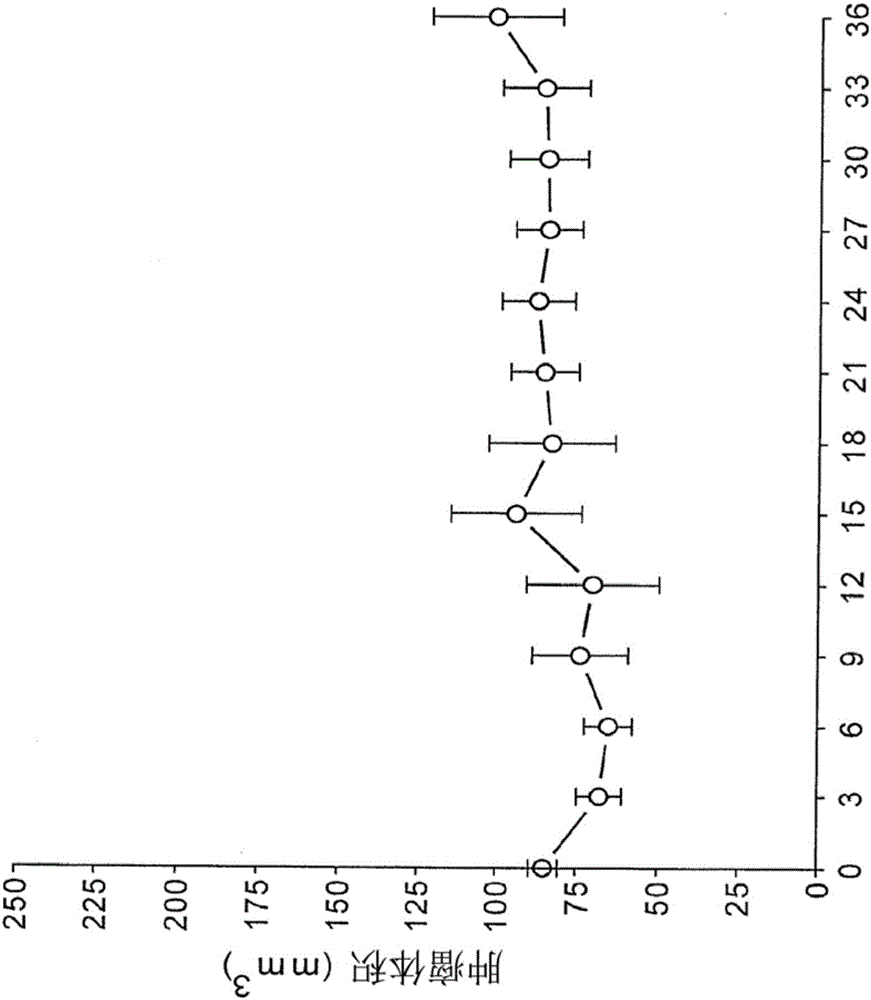
图2A示出了在用5×106个HCT 116细胞异种移植并且随后用仅载体对照(空白对照)溶液处理的无胸腺裸小鼠中,在36天(从肿瘤质量超过75mm3时开始)的时间跨度期间所观察到的平均肿瘤发展。以空心圆圈显示的平均肿瘤体积增加直到约15天,在该时间点其体积稳定在约100mm3持续达剩余的时间跨度。平均值的标准误差以棒(bar)(+/-1SEM)显示。肿瘤体积的稳定与一些先前的研究形成对比,这些研究已经表明,当在初始异种移植物中使用相同或相似数目的HCT 116细胞时,裸鼠中未处理的HCT 116肿瘤的体积在相同的间隔时间期间逐渐增加。例如,已经报道HCT 116诱导的肿瘤具有约8天的倍增时间。此外,检测VACV作为针对裸鼠中HCT 116异种移植物的OV治疗剂的最近研究显示,在类似于图2A中所示的时间跨度的时间间隔中,HCT 116肿瘤生长高达4000mm3。
在图2B中所示的实施方式中,黑色实心方块示出了用TPV/egfp处理的B组中小鼠的平均肿瘤体积和对照组A中小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和B组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2C中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ66R/mMCP-1处理的C组中小鼠的平均肿瘤体积和对照组Aa中小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和C组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2D中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ66R/mGM-CSF处理的D组中的小鼠的平均肿瘤体积和对照组A中的小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和D组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2E中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ66R/fliC处理的E组中的小鼠的平均肿瘤体积和对照组A中的小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和E组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2F中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ66R处理的F组中小鼠的平均肿瘤体积和对照组A中小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和F组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2G中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ2L处理的G组中的小鼠的平均肿瘤体积和对照组A中的小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和G组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2H中所示的实施方式中,黑色实心方块示出了用TPV-p2KO/Δ2L/Δ66R/fliC处理的H组中的小鼠的平均肿瘤体积和对照组H中的小鼠的平均肿瘤体积。棒示出了对于对照组A中的肿瘤体积和H组中的肿瘤体积的平均值的标准误差(+/-1SEM)。
用于本文的重组TPV的一个特别优选的实施方式是具有添加至双敲除背景(Δ66R和Δ2L)的fliC转基因的重组TPV。我们的结果证明表达了fliC转基因的删除了2L和66R的重组TPV对HCT 116肿瘤异种移植物产生了强大和持久的治疗效果。用于本文的重组TPV的另一优选实施方式是具有添加到单敲除病毒(Δ66R)的filC转基因的重组TPV。两种单敲除重组TPV的实施方式(TPV-p2KO/Δ66R和TPV-p2KO/Δ2L)在至少两个时间点都显示了肿瘤体积的统计学上的显著减小,并且在每种情况下所观察到的肿瘤体积的显著减小在时间上远离病毒治疗接种的时刻。两种单敲除重组TPV都似乎趋向于在这些后来的时间点的效果。事实上,除了TPV/egfp病毒之外,所测试的重组TPV的所有实施方式都似乎产生一定程度的肿瘤消融(ablation),同时优选上述重组TPV。由于T细胞依赖性适应性免疫应答在裸鼠中严重受损,本文所述的实施例证明先天免疫应答潜在地能够降低受试者中的肿瘤负荷,因此具有先天免疫应答激活剂的重组TPV被预期在具有免疫缺陷综合征的受试者中是有用的。因此,我们得出结论,具有先天免疫应答激活剂的OV在具有免疫缺陷综合征的个体中也将是有用的。
作为高度保守的病原体相关的分子模式(PAMP),鞭毛蛋白是参与胞质免疫监视的检测分子的靶点。例如,通过Nod样受体NCLR4(也称为Ipaf)的鞭毛蛋白的检测触发了Ipaf炎症小体的活化,其依次激活了半胱氨酸天冬氨酸蛋白酶-1(caspase-1)和巨噬细胞中细胞因子白细胞介素1β(IL-1β)的成熟。尽管在OV感染过程中所产生的FliC的预期量被预期是小的,但在小鼠中,通过尾静脉注射所给药的甚至微量的细菌鞭毛蛋白(≤5μg/动物)引起了细胞因子TNF、IL-1β、IL-6和趋化因子MIP-2(IL-8)的全身的(即,在器官和血浆二者中)升高以及MEK细胞内信号转导途径(signaling pathway)的变化。因此FliC在哺乳动物细胞中的作用部分地不依赖于基于TLR的PAMP检测器,并且尚未完全阐明。然而,基于本文所述的结果,通过表达FliC的重组TPV的先天免疫应答的激活似乎有助于具有完整先天免疫应答的裸鼠中肿瘤质量的减少。
非限制性实施方式的列表
实施方式A是一种用于处理在具有免疫系统的受试者中的癌细胞的组合物,包括:具有至少一种突变的亚塔痘病毒(Yatapoxvirus)属中的病毒,其中至少一种突变通过病毒导致了TNF结合蛋白的表达抑制。
实施方式A的组合物,其中抑制TNF结合蛋白的表达的病毒具有能够结合到MHC-1轻链的结构。
实施方式A或具有一个或多个插入特征(intervening feature)的实施方式A的组合物,其中病毒是编码表达细菌鞭毛蛋白的转基因的亚塔痘病毒(Yatapoxvirus)。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中聚合的鞭毛蛋白是细菌鞭毛蛋白的主要成分。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中转基因是沙门氏菌肠道血清型鼠伤寒沙门氏菌基因(“fliC”)的产物。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒是塔那痘病毒(TPV),并且其中至少一种突变抑制由TPV的2L基因编码的TNF结合蛋白的表达。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒具有第二突变,并且其中第二突变通过病毒导致胸苷激酶的表达抑制。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒是塔那痘病毒(TPV),并且其中第二突变抑制由TPV的66R基因所编码的胸苷激酶的表达。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒进一步编码转基因以增加癌细胞的凋亡。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒进一步编码转基因以激活受试者的免疫系统。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒进一步编码转基因以引入mCherry荧光报告物。
实施方式A或具有一个或多个插入特征的实施方式A的组合物,其中病毒进一步编码转基因以引入绿色荧光蛋白荧光报告物。
实施方式B是一种用于处理在具有免疫系统的受试者中的癌细胞的组合物,包括:具有至少一种突变的亚塔痘病毒(Yatapoxvirus)属中的病毒,其中至少一种突变导致胸苷激酶(TK)的表达抑制。
实施方式B的组合物,其中病毒是编码表达细菌鞭毛蛋白的转基因的痘病毒。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中转基因是沙门氏菌肠道血清型鼠伤寒沙门氏菌基因(“fliC”)的产物。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中病毒是塔那痘病毒(TPV),并且其中至少一种突变抑制由TPV的66R基因所编码的胸苷激酶的表达。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中病毒具有第二突变,并且其中第二突变通过病毒导致TNF结合蛋白的表达抑制。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中病毒是塔那痘病毒(TPV),并且其中第二突变抑制由TPV的2L基因所编码的TNF结合蛋白的表达。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中抑制TNF结合蛋白表达的病毒具有能够结合到MHC-1轻链的结构。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中病毒进一步编码转基因以增加癌细胞的凋亡。
实施方式B或具有一个或多个插入特征的实施方式B的组合物,其中病毒进一步编码转基因以激活受试者的免疫系统。
实施方式C是一种将至少一种基因递送至受试者中的癌细胞的方法,其包括:通过使亚塔痘病毒(Yatapoxvirus)属的病毒突变来修饰病毒,以抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达;以及将所修饰的亚塔痘病毒(Yatapoxvirus)属病毒全身性给药至受试者。
实施方式C的方法,进一步包括:通过编码病毒中的至少一种基因来修饰病毒,其中至少一种基因导致了癌细胞的凋亡增加或激活了受试者中的免疫应答。
实验的详细说明:
使用来自美国典型培养物保藏中心(American Type Culture Collection)的OMK(猫头鹰猴肾)细胞、HCT 116、COLO 205、SW1463和WiDr细胞系(作为美国典型培养物保藏中心产品编号CRL-1556、CCL-247、CCL-222、CCL-234和CCL-218分别可用)。OMK细胞被用于本文所述的病毒扩增和病毒滴定。将细胞系在完全生长培养基中增殖,完全生长培养基由补充有10%(体积/体积)的胎牛血清(可得自Atlanta Biologicals公司)的DMEM(可得自Gibco/生物技术公司)、2mM的L-谷氨酰胺(可得自Sigma-Aldrich公司)和50μg/ml的硫酸庆大霉素(可得自AMRESCO公司)组成。在病毒感染后,将细胞系的细胞单层维持在维持培养基中,除了胎牛血清的浓度降低至2%之外,维持培养基与生长培养基相同。将细胞在37℃下在5%的CO2气氛中孵育。使用改进的Neubauer血细胞计数器,使用0.2%(质量/体积)的台盼蓝进行细胞计数和细胞活力测定。
实验1:对照
野生型TPV(肯尼亚株)由Joseph Esposito博士(疾病控制中心的,亚特兰大,佐治亚州,美国)提供。如本文所述的,修饰野生型TPV以形成表达荧光报道物EGFP的对照重组TPV(没有其他遗传修饰)。简言之,两种相同的痘苗病毒(VACV)衍生的早期/晚期合成启动子被用于驱动在使用p2KO方法的对照重组TPV中的荧光报告基因的表达。在转染/感染过程期间,通过同源重组双交换事件将p2KO表达盒(包括左侧翼和右侧翼,加上插入的开放阅读框(ORF)和启动子)转移到野生型TPV的病毒基因组,以形成对照重组TPV。将用于重组的侧翼区连接到5'-(左)侧翼上的Sac I限制性位点和Not I限制性位点之间以及3'-(右)侧翼上的EcoRI限制性位点和Hind III限制性位点之间的p2KO载体。
实验2:转染/感染过程
转染/感染过程被用于产生在这些实施例中使用的重组TPV。简言之,根据转染试剂制造商的转染方案,使用jetPRIME转染试剂(可得自PolyPlus Transfection SA公司)以每μg纯化的p2KO载体1μl转染试剂的浓度转染OMK细胞。在转染后约5小时,用每个细胞1个斑块形成单位(pfu/细胞)的野生型TPV肯尼亚株(非荧光的)接种OMK单层。在接种后5天,用橡胶细胞刮刀在冰上刮擦所感染的单层,在-80℃下进行三个循环的冷冻和解冻,在4℃下超声处理15秒,连续稀释并以约90%的汇合铺于新鲜接种的OMK单层之上,并用含有0.5%的甲基纤维素的维持培养基覆盖。挑选有荧光的、分离良好的斑块,并对每个挑选(菌落,pick)进行至少三轮的斑块纯化以产生不含可见的野生型(非荧光的)斑块的病毒制备物。仅当在培养物中没有可见的野生型斑块并且通过PCR没有野生型TPV DNA可检测到时,样品才被认为是纯的。
实验3:病毒转基因表达的确认
FliC表达的验证是通过蛋白质免疫印迹法(Western blot)完成的。mCCL2和mGM-CSF表达的验证是通过Luminex多分析物细胞因子检测测定(由马里兰大学细胞因子核心实验室进行)完成的。通过在具有TPV-p2KO/Δ66R/mCCL2、TPV-p2KO/Δ66R/mGM-CSF和TPV-p2KO/Δ2L/Δ66R/fliC的60mm组织培养皿(具有22.1cm2可用于细胞生长的表面积)中使用10pfu/细胞感染半汇合的OMK细胞单层来制备用于分析的样品。在感染后指定的时间制备上清液(3ml/皿)和细胞质提取物。对于FliC检测,通过Western印迹法分析所提取的裂解物。将蛋白质转移到PVDF膜(可得自Millipore公司),并用1:2000稀释度(体积/体积)的抗FliC单克隆抗体(可得自BioLegend公司)进行探测。使用5%(重量/体积)的奶粉作为封闭剂。二级抗体是与辣根过氧化物酶缀合的单克隆抗小鼠IgG(可从Abcam公司获得),以1:2500稀释度使用。可视化是通过ECL(Thermo Scientific/Pierce)。含有p2KO载体但不含fliC、mGM-CSF或mCCL2插入片段的TPV重组体的实施方式作为对照。
实验4:细胞密度测定
将四种人结肠直肠癌细胞系和OMK细胞对照分别接种到12孔板(每种细胞系3个孔)中,使得一天后细胞达到90%的汇合。对每个孔(具有3.8cm2可用于细胞生长的表面积)进行胰蛋白酶化、计数并通过台盼蓝排除对活力进行评分。这样做是为了确保每种细胞系在特定数目的病毒pfu/细胞的实验将是准确的。
实验5:病毒滴定
为了测定样品中存在的可存活的重组TPV病毒颗粒的数量,使用了斑块测定法。简言之,将病毒样品在冰上超声处理15秒,在维持培养基中连续稀释,并接种到6孔板中的几乎汇合的OMK单层上(对于样品的每个稀释度,n=3)。使病毒在室温下轻轻摇动吸附1小时。然后移除接种物,并用1ml的预热的维持培养基将每个孔轻轻洗涤两次。洗涤后,加入2ml的覆盖培养基,并将感染的OMK单层在37℃孵育10天。然后除去该覆盖培养基,并对单层染色(使用在37%的甲醛中的0.1%的结晶紫)。将板用蒸馏水洗涤,在空气中干燥,并计数斑块。
实验6:动物
在四周龄时接受雄性新生儿无胸腺裸(Nude-Foxn1nu/nu)小鼠(可通过Harlan Laboratories获得),并使其在实验开始前适应一周。在12小时/12小时光/暗循环下将小鼠单独地饲养在透明的聚碳酸酯笼中。食物和水随意获得。根据由西密歇根大学的机构动物护理和使用委员会(Institutional Animal Care and Use Committee of Western Michigan University)批准的方案(IACUC方案号13-07-01)进行所有的动物饲养条件、操作和处理。
实验7:对用于裸鼠中肿瘤异种移植物的细胞系的选择
在开始在无胸腺裸鼠中进行体内研究之前,我们确定了当用TPV/egfp感染时,哪种hCRC细胞系具有最高的病毒生产力(生产率,productivity)。测定TPV/egfp在四种hCRC衍生的细胞系:HCT 116、WiDr、SW1463和COLO 205中复制的能力。OMK细胞被用作阳性对照。将每种细胞系接种到12孔组织培养板(具有3.8cm2的可用于细胞生长的表面积)中,并将0.1pfu/细胞的TPV/egfp接种到每个孔中。在感染后4天,收集裂解物并通过斑块测定法测定。
实验8:肿瘤诱导和测量
肿瘤是在无胸腺裸小鼠中通过在背部表面(大约在第一腰椎上方)皮下注射5×106个HCT 116细胞产生的。每次注射后通过台盼蓝排除来评估活力,以确保细胞在注射时及注射后是存活的。一旦可见,使用数字卡尺(匹兹堡模型6ZBTMCO)沿着长轴(长度)、短轴(宽度)和z维度(高度)测量肿瘤。然后使用本文提供的式1估计肿瘤的体积。当肿瘤大小的估计值达到或超过75mm3时,将每只动物随机分入对照组(a组)或7个实验组(b-h组)之一。
实验9:HCT 116异种移植物在裸鼠中的病毒疗法
每个治疗组由5个或6个携带肿瘤的无胸腺裸鼠组成。一旦肿瘤体积达到或超过75mm3,则对每个携带肿瘤的小鼠给药单一病毒疗法注射。病毒疗法注射以单次注射悬浮于稀释在生理盐水中的100μl的原始OMK细胞裂解物5×106pfu在肿瘤内给予。测量每只小鼠的体重和肿瘤体积,然后以三天的间隔记录。在总共39天中收集13个时间点的数据。为了控制由给药重组TPV注射所产生的未预期的炎症或其他注射效应,使用了载体对照组,在本文中表示为a组。该对照组由接受HCT116细胞但仅经历模拟重组TPV注射(仅100μl的载体)的动物组成。将该组称为“模拟病毒疗法”组或A组。将所有实验组与A组进行比较,以评估重组TPV的治疗效果。
为了评估治疗效果,使用Mann-Whitney U检验(有时称为Wilcoxon秩和检验)将每个实验组与对照组a进行比较。如果当与模拟物注射的对照相比时组内的平均肿瘤体积显著减少,则用重组TPV的治疗被判断为产生了显著的治疗效果。在整个研究中使用了p<0.05的显著性水平。
结果:p2KO痘病毒切除/插入载体
设计和构建p2KO痘病毒切除/插入载体以提供一种快速和可靠的方式来同时切除任何所需的一个或多个TPV基因并用所需的所表达的荧光报告物和/或所需的所表达的转基因来取代所切除的一个或多个基因。所培养的细胞中病毒感染的可视化通过包含荧光报告物、mCherry和EGFP而被极大地促进。两种荧光报告物的使用使得鉴定和分离具有fliC插入片段的双缺失重组TPV(TPV-p2KO/Δ2L/Δ66R/fliC)成为可能。在图3中示出了由用OMV细胞单层上的TPV-p2KO/Δ2L/Δ66R/fliC病毒感染所产生的病毒斑块,并证明了分别与mCherry和EGFP相关的亮橙-红色和绿色的同时表达。
通过对M13正向和反向引物结合序列之间的区域进行PCR扩增所产生的扩增子的DNA测序来验证了碱基载体(base vector)(即,具有荧光报告物但不具有待表达的可选的转基因)的总体序列。编码mCCL2、mGM-CSF或fliC的ORF的插入片段通过p2KO载体的DNA测序来验证,以确保在它们用于转染/感染过程之前的正确布置和取向。通过使用重组病毒DNA作为模板的PCR产物的琼脂糖凝胶分析,验证了重组TPV是2L敲除或者66R敲除,或者是二者都敲除。
结果:转染/感染
在接种后4-5天,荧光报告物的表达在OMK细胞单层中是明显的,表明来自野生型TPV感染的细胞的胞质区室(compartment)中的p2KO载体的基因表达。在用p2KO载体转染但没有随后用野生型TPV接种的对照培养物中,未观察到荧光。然后在进一步使用前,使用重组病毒基因组DNA作为模板通过PCR验证了该病毒样品的纯度。探测所有病毒DNA样品中是否存在氨苄青霉素抗性基因,在任何重组TPV中均未检测到。这表明所有的重组TPV由双交换事件而不是单交换事件产生。
结果:病毒转基因表达的确认
为了证明所插入的ORF在用重组TPV(包括TPV-p2KO/Δ66R/mCCL2、p2KO/Δ66R/mGM-CSF和TPV-p2KO/Δ2L/Δ66R/fliC)感染的细胞中被表达,60mm培养皿(具有20cm2生长面积)中的OMK单层用相关的重组TPV接种,并如前所述地测定细胞裂解物和培养上清液中的转基因表达。来自接种了TPV-p2KO/Δ2L/Δ66R/fliC的OMK细胞的裂解物的Western印迹用单克隆抗FliC抗体探测。观察到具有50kDa的表观分子量的单一条带,与FliC阳性对照相同,正如所预期的。该条带的强度在感染后第3天和第6天之间逐渐增加。在模拟感染的细胞中未检测到FliC转基因。所感染的细胞裂解物和它们的培养上清液被测定以确定mCCL2和mGM-CSF的存在。两个转基因都被高度表达,并且大量存在于所感染的细胞上清液中(4.9ng/ml的mCCL2和大于10.0ng/ml的mGM-CSF)。在所感染的细胞或对照未感染的细胞的细胞质提取物中以及用不表达这些转基因的TPV感染的细胞中,mGM-CSF和mCCL2都仅微弱地可检测到或不可检测到。该数据表明mCCL2和mGM-CSF都是从缩感染的细胞分泌的,正如所预期的,而FliC在所感染细胞的细胞质中积累,再次正如所预期的。
结果:细胞密度测定
本研究中使用的每种细胞系具有其在接近汇合时所测定的汇合密度(细胞/cm2)。OMK对照细胞系具有约1.0×105个细胞/cm2的汇合密度。对于结肠直肠癌细胞系确定的密度如下:HCT 116具有约1.4×105个细胞/cm2的汇合密度;COLO205具有约6.9×105个细胞/cm2的汇合密度;SW1463具有约4.5×105个细胞/cm2的汇合密度;WiDr具有约2.5×105个细胞/cm2的汇合密度。这些值用于计算当接种这些细胞系时使用的pfu的数量。
结果:在裸鼠中的病毒疗法HCT 116异种移植物
在开始在无胸腺裸小鼠中的体内研究之前,发现了当用TPV/egfp感染时,OMK细胞是具有最高病毒生产力的hCRC细胞系,如上所述的。OMK细胞是最好的宿主细胞,允许产生约3×106个子代pfu/孔。在所测试的hCRC细胞系中,HCT 116产生了具有约7×105个子代pfu/孔的平均产量(n=3)的最多后代病毒颗粒。因此,我们选择HCT 116用于本研究的体内阶段。
为了评价重组TPV的溶瘤潜力,在无胸腺裸鼠(Nude-Foxn1nu/nu)中诱导肿瘤。HCT 116细胞的活力计数表明>99%在注射时是活的。在注射HCT 116后一至三周内,肿瘤通常达到75mm3。当与模拟注射对照相比时,用TPV/Δ66R(F组)、TPV/Δ2L(G组)和TPV/Δ2L/Δ66R/fliC(H组)的处理在2个或更多个时间点都产生了肿瘤大小的显著减小。在两个时间点(处理后33天(减少47.6%)和36天(减少65.2%)),TPV/Δ2L处理的肿瘤(G组)显著小于模拟注射的肿瘤。在两个时间点(处理后27天(减少34.9%)和36天(减少52%)),TPV/Δ66R处理的肿瘤(F组)显著小于模拟注射的肿瘤。TPV/Δ2L/Δ66R/fliC-处理的肿瘤(H组)显示出强有力且持久的治疗效果,并且在六个时间点(处理后15天(减少56.1%)、21天(减少62.0%)、24天(减少63.8%)、27天(减少59.5%)、33天(减少55.3%)和36天(减少69.6%)),当与模拟注射的肿瘤相比,在体积上显著减小。
尽管使用人类结肠直肠癌细胞系进行了初始测试,但本文所述的药物病毒疗法旨在用于治疗广泛的癌症。将用如本文所述的药物组合物治疗的癌症的非限制性清单包括:基底细胞癌、癌、绒毛膜癌、神经胶质瘤、上皮内肿瘤、白血病、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、黑素瘤、骨髓瘤、神经母细胞瘤、视网膜母细胞瘤(眼癌,retinoblastoma)、横纹肌肉瘤、肉瘤以及胆道、膀胱、骨、脑、乳腺、CNS、子宫颈、结肠和直肠、结缔组织、消化系统、子宫内膜细胞、食道、眼、胃、头和颈、肾、喉、肝、肺、胰腺、前列腺、口腔、卵巢、呼吸系统、皮肤、胃、睾丸、甲状腺、子宫和泌尿系统的癌症。
本文所述的药物组合物以治疗有效剂量给药。本文所用的术语“治疗有效剂量”是指在给药后有效实现所需治疗结果的药物的量。治疗有效剂量可根据诸如个体的疾病状态、年龄、性别和体重、药物的形式以及剂型在个体中引起所需反应的能力等因素而在患者之间变化。治疗有效剂量可以通过以低的、安全的剂量开始并升高至更高剂量,同时监测治疗效果(例如癌细胞生长的减少)连同任何有害副作用的存在来确定。药物组合物可以包括痘病毒、病毒核酸或产生所期望的病毒治疗效应的表达载体。
药物组合物可以通过本领域已知的任何合适的剂型或途径给药,包括但不限于肠胃外的、口服的、肠内的、颊的、鼻的、局部的、直肠的、阴道的、透粘膜的、表皮的、经皮的、真皮的、眼部的、肺部的和皮下的给药途径以提供全身的或局部的治疗有效剂量。药物将以适于特定给药途径的制剂或制备物给药至受试者。适于给药所述药物剂型的制剂可包括但不限于:气溶胶、分散体、乳液(emulsion)、植入物、基于脂质体的制剂、滴鼻剂、贴剂、粉剂、溶液、喷雾剂、栓剂和混悬剂。制剂可以以单位剂型存在,并且可以通过本领域已知的任何方法制备。制备这些制剂或剂型的方法包括将本公开的痘病毒或核酸与一种或多种药学上可接受的载体组合的步骤,并且还可以包含添加剂,例如但不限于:稳定剂、防腐剂和转染促进剂,其有助于药物的细胞摄取。合适的稳定剂可包括但不限于:白蛋白、EDTA、甘氨酸和谷氨酸单钠。合适的防腐剂可包括但不限于:抗生素、羟基苯甲酸甲酯(methyl hydroxybenzoate)、苯酚、2-苯氧基乙醇、山梨酸钾、苯甲酸钠和硫柳汞。
药物组合物可以局部递送到需要治疗的受试者的肿瘤部位的靶组织或器官中。有效剂量的组合物通过受试者的皮肤或在暴露的手术区域使用注射器将被直接注射到肿瘤部位。在某些实施方式中,可以使用可植入剂量装置注射药物组合物。
也重要的是,注意如在示例性实施方式中示出的和描述的组合物的要素(element)的构造和布置仅是说明性的。尽管在本公开中仅详细描述了本发明的几种实施方式,但是审阅本公开的本领域技术人员将容易理解,许多修改是可能的(例如,各种要素的大小、尺寸、结构,形状和比例的变化,参数值的变化,安装布置的变化,材料使用的变化,颜色的变化,取向的变化等),而没有实质上偏离详述主题的新颖性教导和优点。例如,显示为一体形成的元件可以由多个部分构成,或者显示为多个部分的元件可以一体形成,接口的操作可以颠倒或者改变,结构和/或构件或连接器或系统的其他元件的长度或宽度可以改变,在元件之间提供的调节位置的性质或数量可以改变。应当注意,系统的元件和/或组件可以由以很多种颜色、纹理和组合中的任何提供足够强度或耐久性的多种材料中的任一种构造。因此,所有这些修改旨在包括在本发明的范围内。在不脱离本发明的精神的情况下,可以在期望的和其他示例性实施例的设计、操作条件和布置中进行其他替换、修改、改变和省略。
应当理解,所描述的过程中的任何所描述的过程或步骤可以与其他公开的过程或步骤组合以形成本装置(device)的范围内的结构。本文公开的示例性结构和方法是为了说明性目的,而不应解释为限制。
还应当理解,在不脱离本装置的构思的情况下,可以对上述结构和方法进行变化和修改,并且进一步地,应当理解的是,这些构思旨在由下面权利要求覆盖,除非这些权利要求通过其语言明确声明。
以上描述仅被视为所说明的实施方式的描述。本领域技术人员以及制造或使用该装置的人员将会想到该装置的修改。因此,应当理解,附图中所示的和上面所描述的实施方式仅用于说明性目的,并不旨在限制由根据专利法原则解释的所附权利要求限定的装置的范围,包括等同原则。
- 还没有人留言评论。精彩留言会获得点赞!