青藤碱在制备防治心肌肥厚的药物中的应用的制作方法
本发明涉及青藤碱的新用途,具体涉及一种青藤碱在制备防治心肌肥厚的药物中的应用。
(二)
背景技术:
防已科植物青藤Sinomenium acutum(Thunb)Rehd.et Wils及毛青藤Sinomenium acutum(Thunb)Rehd.et Wils.Var Cinerrum Rehd.et wils的干燥藤茎称为清风藤,1000多年以前就已用于风湿性疾病的治疗。青藤碱(sinomenine,Sin)是从中药青风藤Sinomenium acutum Rehd.et Wils中提取的单体生物碱,临床多用其盐酸盐。基础药效学研究结果表明,它具有明显抗炎、抗免疫、镇痛、镇静、镇咳、降血压、促组胺释放、抗心律失常、抗焦虑作用、对阿片类药物依赖的防治作用等药理作用。
我们课题组在原西安医科大学临床药理研究所赵更生教授领导下,对青藤碱进行了长达十余年的应用基础研究,并将其开发为治疗各种风湿病及心律失常药物用于临床,取得显著的社会及经济效益;而且在Sin剂型改造和Sin衍生物合成筛选方面也进行了有益的探索和研究。近年来,我们课题组的研究结果显示,Sin具有抗氧化作用,能清除氧自由基,保护O-2损伤的心肌细胞,对乳鼠心肌细胞A/R损伤具有保护作用(李乐,高晓利,袁秉祥.青藤碱拮抗培养乳鼠心肌细胞的缺氧/复氧损伤.中药药理与临床,2007,23(3):30-32.);Sin对H2O2诱导的乳鼠心肌细胞凋亡有抑制作用,与其抗脂质过氧化、抑制心肌细胞表达NF-κB有关(李乐,高小利,丁宝兴.青藤碱抑制H2O2诱导乳鼠心肌细胞凋亡.中国中药杂志,2008,33(8):938-941);Sin通过抑制肿瘤坏死因子(TNF-a)和白细胞介素(IL-1b)在内皮细胞上的蛋白表达,进而抑制炎症反应。氧化应激、心肌细胞凋亡、细胞因子触发炎症反应、NF-κB过度表达等可能与心肌肥厚的发展和转归密切相关。但将Sin应用于治疗以心肌肥厚为基础的相关疾病国内外未见研究报道。
(三)
技术实现要素:
本发明目的是提供青藤碱在制备防治心肌肥厚或以心肌肥厚为基础的相关疾病的药物中的应用。
本发明采用的技术方案是:
一种青藤碱在制备防治心肌肥厚或以心肌肥厚为基础的相关疾病的药物中的应用,所述的以心肌肥厚为基础的相关疾病具体例如:高血压、风湿性心脏病、肺心病、甲亢、扩张型心肌病、肥厚型心肌病、冠心病或贫血等。
本发明中,所述的青藤碱包括中药单体青藤碱、青藤碱可药用盐(如盐酸青藤碱)或者中药单体青藤碱与常规药用辅料组成的复方。
本发明所述青藤碱(以中药单体青藤碱计)的常规用量推荐为50~300mg/kg/d,优选100~300mg/kg/d,更加优选150~300mg/kg/d,最优选200mg/kg/d。用药途径推荐为口服或注射给药。
本发明所述的青藤碱可制成如下形式的制剂:青藤碱片、青藤碱肠溶片、青藤碱缓释片或青藤碱注射液等。推荐所述青藤碱的药物制剂以单体青藤碱计为100~300mg/单位计量。例如,所述青藤碱的药物制剂为青藤碱片、青藤碱肠溶片或青藤碱缓释片时,所述青藤碱的药物制剂以单体青藤碱计为100~300mg/片;所述青藤碱的药物制剂为注射剂时,所述青藤碱的药物制剂以单体青藤碱计为100~300mg/支。
本发明利用β受体激动剂异丙肾上腺素刺激诱导小鼠心肌,复制小鼠心肌肥厚模型;利用腹主动脉缩窄诱导大鼠心肌肥厚,复制大鼠心肌肥厚模型,应用不同剂量的中药单体青藤碱,经药效学整体动物实验研究,取得了肯定的治疗效果。
本发明的有益效果主要体现在:本发明提供了青藤碱在制备防治心肌肥厚或以心肌肥厚为基础的相关疾病的药物中的应用,为新药筛选提供了基础。
(四)附图说明
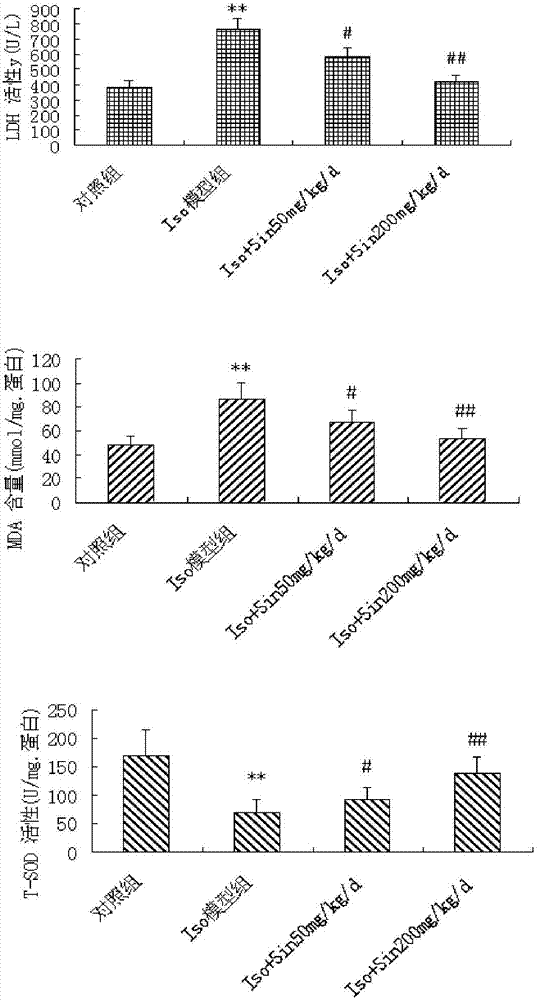
图1为实施例1中各组小鼠血清LDH活性、心肌组织SOD活性、MDA含量的变化;
n=15,与对照组比较,*P<0.01;与Iso模型组比较,#P<0.05,##P<0.01。
图2为实施例1各组小鼠心肌组织学改变(HE染色,×100);
A:对照组;B:Iso模型组;C:Iso+Sin 50mg/kg/d治疗组;D:Iso+Sin 200mg/kg/d治疗组。
图3-I为实施例1各组小鼠心肌细胞病理切片(Masson染色,×400);
A:对照组;B:Iso模型组;C:Iso+Sin 50mg/kg/d治疗组;D:Iso+Sin 200mg/kg/d治疗组。
图3-II为实施例1各组小鼠心肌间质纤维化定量分析;
n=15,与对照组比较,*P<0.01;与Iso模型组比较,#P<0.05,##P<0.01。
图4为实施例1各组小鼠心肌细胞ERK1蛋白表达变化(ERK1,×400);
A:对照组;B:Iso模型组;C:Iso+Sin 50mg/kg/d治疗组;D:Iso+Sin 200mg/kg/d治疗组。
图5-I为实施例1各组小鼠心肌细胞ERK2蛋白表达变化(ERK2,×400);
A:对照组;B:Iso模型组;C:Iso+Sin 50mg/kg/d治疗组;D:Iso+Sin 200mg/kg/d治疗组。
图5-II为实施例1各组小鼠心肌细胞ERK1/2蛋白表达定量变化;
n=15,与对照组比较,*P<0.01;与Iso模型组比较,#P<0.05,##P<0.01。
图6为实施例2各组大鼠心肌组织学改变(HE染色,×400);
A:对照组;B:AAC模型组;C:AAC+Sin 50mg/kg/d治疗组;D:AAC+Sin 200mg/kg/d治疗组;E:AAC+缬沙坦10mg/kg/d治疗组。
图7为实施例2各组腹主动脉缩窄高血压大鼠心肌组织ANP,β-MHC表达的变化;
A:对照组;B:AAC模型组;C:AAC+Sin 50mg/kg/d治疗组;D:AAC+Sin 200mg/kg/d治疗组;E:AAC+缬沙坦10mg/kg/d治疗组。
(五)具体实施方式
下面通过具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
实施例1:青藤碱抑制异丙肾上腺素诱导的小鼠心肌肥厚作用及其机理初步研究
1材料与方法
1.1实验动物:
清洁级昆明种小鼠,雌雄兼有,体重(20±2)g,由浙江省实验动物中心提供,合格证号:SCXK(浙)2013-0001,在浙江省实验动物中心屏障环境动物实验室喂养和实验。
1.2药品与试剂:
青藤碱(sinomenine,Sin,陕西省西安市小草植物科技有限责任公司,批号:XC20141120,纯度≥98%);盐酸异丙肾上腺素(isoprenaline,Iso)注射液(上海禾木制药有限公司,批号140906);乳酸脱氢酶(LDH)、丙二醛(MDA)及总超氧化歧化酶(T-SOD)测试盒、蛋白定量测试盒均购自南京建成生物工程有限公司。兔抗ERK1/2抗体购于美国Santa Cruz有限公司,辣根过氧化物酶山羊抗小鼠抗体IgG购于美国cell signaling有限公司。
1.3主要仪器:
-70℃低温冰箱(美国Forma公司产品);紫外成像扫描仪(美国Bio-Rad公司产品);美国Foeodyne公司产影像分析仪;美国Millipore公司产超纯水系统;低温离心机及低温冰箱(德国Heraeus产品);PCY仪9600(美国PerkinElmer公司);酶标仪(美国Bio-Rad550);稳压稳流定时电泳仪(上海精密仪器厂);722N可见光分光光度计(上海精密科学仪器有限公司);MP200A型电子天平(上海第二天平仪器厂);KDC-2046低温离心机(科大创新股份有限公司中佳分公司);Qwin图象分析软件(德国Leica有限公司)。
1.4动物分组及造模:
取健康昆明种小鼠60只,雌雄各半,随机分为:空白(对照)组、模型组、模型+Sin低剂量治疗组、模型+Sin高剂量治疗组4组,每组15只。除空白组外,其他各组小鼠均皮下注射Iso,每天一次,第一天剂量为40mg/kg,第二天为20mg/kg,第三天为10mg/kg,第四天开始保持10mg/kg,连续14天。自由进食,给水,建立心肌肥厚模型,空白组每天皮下注射等量的生理盐水作为对照。
1.5给药:
给药和造模同时进行,每日上午注射Iso 4h后,分别给予低、高剂量Sin 50mg/kg和200mg/kg灌胃治疗,每天一次。空白组和模型组给予等量生理盐水灌胃,每天一次,连续4周。
1.6心脏重量指数测定:
小鼠末次给药后禁食不禁水12h,称小鼠体重(body weight,BW),眼球取血处死,迅速打开胸腔取出心脏,用预冷的生理盐水洗尽残血,滤纸吸干后称量全心重(heart weight,HW),再分离出左心室,称左心室重量(LVW),分别计算心重指数(HW/BW)和左心室重量指数(LVWI=LVW/BW)。另取心肌组织制作组织病理切片,沿房室环剪去大血管、心房以及右心室游离壁,将余下的室间隔、左心室游离壁置于10%福尔马林溶液中固定24h。取出固定液中的左心室标本,经流水冲洗,梯度乙醇脱水,透明,常规石蜡包埋,沿左心室长轴线每隔1mm横断面连续切取5μm厚切片,进行HE及Masson染色光学显微镜下观察,拍照。观察心肌肥厚、纤维化程度,用Qwin图象分析软件分析心肌纤维化程度,分析比较各组心肌组织病理学变化。
1.7血清LDH活性、心肌组织SOD活性和MDA含量测定:
小鼠眼球取血后于4℃,2000r/min,离心10分钟,分离血清,严格按照LDH试剂盒说明操作,测定LDH活性。取小鼠心肌组织,手工制备组织匀浆,于4℃,2000r/min,离心10分钟,取上清液进行测定,严格按照试剂盒说明操作。
1.8免疫组化检测小鼠心肌细胞ERK1/2蛋白表达
免疫组化染色,ERK1/2蛋白表达采用SP法,其主要步骤:石蜡切片脱蜡水化,3%双氧水浸泡20min,羊血清孵育10min,依次加ERK1/2抗体一抗室温下60min,山羊抗小鼠IgG二抗室温30min,链亲和素-过氧化物酶溶液室温10min,DAB显色,苏木素复染,脱水封片,显微镜下观察。用Qwin图象分析软件,对组织切片免疫组化染色胞浆中阳性表达进行定量分析,计算镜下光密度值。
1.9统计学分析:
所有数据用SPSS13.0统计软件进行分析。结果以均数±标准差表示,多组间比较用单因素方差分析,两组间比较用t检验,以P<0.05认为有统计学意义。
2结果
2.1 Sin对Iso所致小鼠心脏质量参数的影响:
与空白组比较,连续皮下注射Iso后,模型组小鼠的全心和左心室重量指数有明显增加(P<0.01),符合《药理实验方法学》第二版中的心肌肥厚模型标准,说明心肌肥厚模型制备成功。用Sin 50、200mg/kg治疗后,HWI和LVWI都较模型组有所减小,差异有统计学意义(P<0.05),而200mg/kg Sin组变化更为明显。Sin对小鼠心肌肥厚有一定的保护作用。结果见表1。
表1各组小鼠全心和左心室重量指数比较(mg/g,)
与空白组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01
2.2 Sin对Iso所致小鼠心肌肥厚组织中氧化损伤指标的影响:
连续皮下注射Iso后,模型组小鼠血清LDH、心肌组织中MDA含量明显升高,SOD活性明显降低,与空白组比较有显著差异性(P<0.01);用Sin 50、200mg/kg治疗后,各治疗组的LDH、MDA值对比模型组明显下降,SOD明显上升,具有显著差异性(P<0.05);200mg/kgSin组效果更加明显,表明对小鼠心肌肥厚损伤有一定的对抗作用,结果见图1。
2.3心肌组织病理切片观察
各组小鼠心肌组织光镜下切片显示,正常对照组心肌细胞红色,排列整齐、致密,胞质着色均匀,间质细胞无增生。Iso模型组细胞呈心肌肥厚改变,心肌细胞体积增大,呈圆形或类圆形,细胞核体积增大染色加深,血管和心肌细胞之间可见蓝色纤维化增多和炎性细胞浸润。高剂量Sin治疗后,心肌损害的情况较模型组减轻,细胞排列较整齐,增粗不明显,炎性细胞浸润减轻,胞质着色明显,间质纤维化明显减轻。见图2,图3-I,图3-II。
2.4各组小鼠心肌细胞ERK1/2蛋白表达变化
图4,图5-I,图5-II显示,与空白对照组比较,模型组心肌组织中总ERK1/2蛋白相对表达量明显增加,与空白对照组比较差异显著(均P<0.05)。Sin治疗后,心肌组织中总ERK1/2的蛋白表达明显降低,与模型组比较差异显著(均P<0.05)。
结论:
1、Iso诱导的心肌肥厚模型组小鼠心肌细胞体积增大,呈圆形或类圆形,细胞核体积增大染色加深,血管和心肌细胞之间可见蓝色纤维化增多和炎性细胞浸润;模型组中血清LDH水平、心肌MDA含量升高及心肌SOD活性下降,同时ERK1/2蛋白的表达升高,与对照组相比差异显著;
2、应用Sin治疗,可明显改善Iso诱导的小鼠心肌肥厚的纤维化改变,降低Iso诱导的小鼠心肌肥厚模型血清LDH水平、心肌MDA含量、升高心肌SOD活性,抑制其ERK1/2蛋白的表达,显示良好的心肌保护作用,其中大剂量Sin的作用较强;
3、Sin对Iso诱导的小鼠心肌肥厚有保护作用,其发生机制可能与抑制ERK1/2蛋白的表达、降低血清LDH水平、心肌MDA含量、升高心肌SOD活性的水平有关,青藤碱能清除氧自由基和抗脂质过氧化作用,提高机体的抗氧化能力。
实施例2:青藤碱对腹主动脉缩窄诱导的大鼠心肌肥厚的保护作用及其机理研究。
l材料与方法
1.1材料
1.1.1主要试剂及仪器
青藤碱(sinomenine,Sin),陕西省西安市小草植物科技有限责任公司,批号:XC20141120,纯度≥98%;缬沙坦,华润赛科药业有限责任公司,批号:201411012;胞浆内钙离子浓度荧光检测试剂盒(fura-3/AM),上海宝曼生物科技有限公司;山羊抗鼠的心房利钠肽(atrial na triuretic peptide,ANP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC)多克隆抗体、辣根酶标记兔抗羊IgG,武汉博士德生物技术有限公司;大鼠血压计,上海玉研科学仪器有限公司;荧光显微镜,PTll048,日本;紫外分光光度计,Ultmspec-2000型,Pharmacia;电泳数据处理与分析系统,Kodak公司;HP Sonos5500彩色超声诊断仪,美国惠普公司。
1.1.2实验动物
健康SD大鼠50只,雌雄兼有,体重(200±20)g,由浙江省实验动物中心提供,合格证号:SCXK(浙)2014-0036,在浙江省实验动物中心屏障环境动物实验室喂养和实验。
1.2实验方法
1.2.1心肌肥厚模型制备及实验分组
50只大鼠行腹主动脉缩窄术(abdominal aorta coarctation,AAC),术前禁食12h,自由饮水。用3%戊巴比妥钠按30mg/kg腹腔注射麻醉后,仰卧位四肢固定。无菌条件下于左肋缘下0.5cm、腹正中线旁0.5cm处,纵切口2.5cm,逐层分离组织,进入腹腔。钝性分离腹主动脉鞘,剥离腹主动脉。在左右肾动脉分支下方穿1.0号手术缝线,沿血管走行方向放置7号针头与腹主动脉一起结扎(其中10只仅穿线不结扎作为假手术对照组),随后抽出针头。腹腔内滴入青霉素(40万u/mL)适量,然后关腹。关笼饲养,正常饮食。腹主动脉缩窄手术大鼠存活34只,假手术对照组大鼠存活8只;死因主要与术中损伤下腔静脉导致出血及麻醉有关。术后4周测定腹主动脉缩窄手术大鼠尾动脉血压,31只大鼠血压(systolic blood pressure,SBP)≥140mm Hg,作为成功复制高血压模型,并随机抽取28只分为:心肌肥厚组(生理盐水l ml/d,ig)、Sin组(50mg/kg/d/,ig)、Sin组(200mg/kg/d,ig)和缬沙坦组(10mg/kg/d,ig),每组7只。假手术对照组大鼠8只(生理盐水1ml/d,ip)。
1.2.2动物模型的处理
药物治疗8周后,再次测量体重、尾动脉压;心脏彩超测量舒张末期左心室后壁和室间隔厚度;然后处死大鼠,称左心室湿质量(含室间隔),检测左心室质量指数(LVMI)。左心室组织一部分置人10%甲醛缓冲液中固定12~24h,常规脱水、透明、浸蜡、包埋后行切片处理,光学显微镜10×40倍下测量大鼠心肌纤维直径(MFD),分析心肌组织的病理形态学改变并照相。
1.3心肌细胞内游离钙离子([Ca2+]i)浓度的测定
参照相关文献(例如:柯俊,陈锋,肖幸,戴木森,王晓萍,陈兵,陈敏,张存泰.钙调蛋白激酶Ⅱ抑制剂对肥厚心肌细胞的影响.中华急诊医学杂志,2012,doi:10.3760/cma.j.issn.1671-0282.2012.02.011)方法分离左室心肌细胞,将负载fura-3的心肌细胞置于荧光显微镜下(PTll048,日本),钙荧光的激发波长为340/380nm,发射波长为510nm。荧光信号经Felix专用软件处理。
1.4免疫印迹法(Western blot)检测ANP、β-MHC的蛋白表达
取大鼠心肌组织,用Trizol试剂提取组织蛋白质,并用Bradford方法测定蛋白质的含量。将提取的等量蛋白质加入3×加样缓冲液,煮沸3min后上样,在制备好的SDS聚丙烯酰胺凝胶垂直电泳,然后将蛋白质转印到硝酸纤维素滤膜上,按照标准的Western blot方法分别与ANP、β-MHC抗体共同孵育2h,然后洗脱,封闭漂洗后加入稀释的二抗。室温下杂交1h,化学发光剂温浴1min后曝光、显影和定影,最后对结果进行吸光度扫描分析。
1.5统计学方法
所有数据用均数±标准差来表示,采用SPSSl8.0统计软件进行分析。多组间比较用单因素方差分析,两组间比较用t检验,以P<0.05认为有统计学意义。
2结果
2.1对大鼠SBP的影响
与心肌肥厚组比较,50mg/kg Sin组SBP没有显著降低[(25.03±1.64)kPa vs(24.69±1.72)kPa,P>0.05],但是200mg/kg Sin组,缬沙坦组SBP降低明显[(18.11±1.44)kPa,(19.23±1.41)kPa vs(24.8±1.8)kPa,P<0.01],说明大剂量Sin具有降低SBP的作用,大剂量200mg/kg Sin与缬沙坦组相似。
2.2对室间隔、左室后壁厚度、心肌纤维直径(MFD)、左心室质量指数(LVMI)的影响
Sin组和缬沙坦组的室间隔、左室后壁厚度高于对照组(P<0.05),但低于心肌肥厚组(P<0.01);Sin组的室间隔厚度高于缬沙坦组(P<0.05),而二组的左室后壁厚度间差异无统计学意义(P>0.05),见表2。
Sin组和缬沙坦组的MFD均显著低于心肌肥厚组(P<0.01),高于对照组(P<0.05)。提示Sin和缬沙坦有抑制左室肥厚的作用。而Sin组MFD又高于缬沙坦组(P<0.05),说明Sin组的作用不如缬沙坦组明显,见表2。
Sin组的LVMI明显低于心肌肥厚组(P<0.05),提示Sin有抑制左心室肥厚的作用。但与缬沙坦组比较,Sin组的LVMI相对较高,显示其作用弱于缬沙坦,见表2。
2.3心肌组织形态学改变
HE染色显示,对照组心肌细胞直径无明显增大,心肌细胞排列规整;心肌肥厚组可见心肌细胞直径明显增大,体积肥大,心肌细胞排列紊乱。Sin组和缬沙坦组心肌细胞较心肌肥厚组心肌细胞病理组织学改变减轻,见图6。
2.4心肌细胞[Ca2+]i的变化
心肌肥厚组细胞内[[Ca2+]i[(158.21±12.14)nmoL/L]明显高于对照组、50mg/kg Sin组、200mg/kg Sin组和缬沙坦组[(100.12±10.23,134.86±14.65,112.84±9.57,127.45±9.23)nmol/L,P<0.01];Sin组与对照组之间差异有统计学意义(P<0.05);缬沙坦组仍高于200mg/kg Sin组与对照组(P<0.05)。可见,200mg/kg Sin降低心肌细胞[Ca2+]i浓度的作用明显强于缬沙坦(P<0.05)。
2.5 Sin对腹主动脉缩窄高血压大鼠心肌组织ANP、β-MHC的影响
ANP、β-MHC的免疫印迹结果显示(见表3,图7):与对照组相比,心肌肥厚组的ANP、β-MHC蛋白表达明显增高(P<0.01),提示在心肌肥厚时ANP、β-MHC参与了心肌肥厚的病理过程,ANP、β-MHC在心肌肥厚的发病机制中扮演着一定的角色。Sin组和缬沙坦组的ANP、β-MHC表达均显著低于心肌肥厚组(P<0.01),Sin对ANP、β-MHC蛋白表达的下调作用弱于缬沙坦。因此,Sin有可能是通过作用ANP、β-MHC减缓和阻止心肌的肥厚。
表2大鼠各实验组室间隔、左室后壁厚度和心肌组织病理学的变化(n=7-8;)
与对照组比较:aP<0.05,bP<0.01;与心肌肥厚组比较:CP<0.05。
表3各组腹主动脉缩窄高血压大鼠心肌组织ANP,β-MHC表达的变化(n=7-8;)
与对照组比较:aP<0.05,bP<0.01;与心肌肥厚组比较:CP<0.05。
结论:
1、大剂量Sin具有降低SBP的作用;
2、AAC诱导大鼠心肌肥厚,心肌细胞直径明显增大,细胞排列紊乱;Sin和缬沙坦治疗后,可以缓解心肌病理组织学改变,Sin对AAC术后心肌肥厚大鼠有心肌保护作用;
3、Sin对抗AAC术后大鼠心肌肥厚,可能与抑制心肌细胞[Ca2+]i,抑制心肌细胞ANP,β-MHC蛋白表达有关。
- 还没有人留言评论。精彩留言会获得点赞!