一种单唾液酸四己糖神经节苷脂修饰的重组脂蛋白及其应用的制作方法
本发明涉及神经药理学和化学制药领域,尤其涉及单唾液酸四己糖神经节苷脂修饰重组脂蛋白及其在制备药物载体和制备预防和治疗阿尔茨海默病药物中的应用。
背景技术:
阿尔茨海默病(Alzheimer’s Disease,AD)是发生在老年人群中最常见的以进行性痴呆为特征的中枢神经系统退行性病变。临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,伴有各种神经精神症状和行为障碍。目前AD在老年人群中的发病率仅次于心血管病、癌症和脑卒中,已成为排名第四位的致死病因。随着人口老龄化进程的加剧,该类疾病的发病率日益上升。《世界阿尔茨海默病报告》指出,痴呆患者人数预计每20年增长近一倍,将由2010年的3600万增至2050年的1.15亿,且58%的患者居住于中低收入国家,到2050年,这一数字将增至71%;报告称,每年痴呆相关费用总计6040亿美元,约为全球国内生产总值(GDP)的1%。AD已成为人类健康和生存质量的严重威胁,是日益严重的公共卫生问题和经济问题。
目前临床上使用的AD治疗药物本质上为对症治疗,包括乙酰胆碱酯酶(AchE)抑制剂他克林、多奈哌齐、利斯的明、加兰他敏和谷氨酸NMDA受体拮抗剂美金刚,仅能短期内改善胆碱能缺失导致的学习、记忆功能下降,但不能改变AD的病理进程。因此,亟需寻找和建立具有AD疾病修饰作用的新型防治方法。
老年斑和神经元纤维缠结是的重要病理特征。老年斑的主要组成物质是β-淀粉样蛋白(amyloidβ-protein,Aβ),而神经元纤维缠结主要由过度磷酸化的Tau蛋白组成。Aβ是由39~43个氨基酸组成的多肽,Aβ1-40和Aβ1-42是其两种主要类型,来源于淀粉样前体蛋白(APP)。Aβ,尤其是Aβ1-42具有高度聚集能力,经神经元产生分泌后,会迅速聚集,形成可溶状态的寡聚体,而后进一步聚集形成Aβ纤维而沉积在脑内。当前的研究明确Aβ是AD的核心致病物质,其中Aβ寡聚体的神经毒性最强。Aβ在脑内过度产生和沉积,引起其周边神经元突触功能障碍、Tau蛋白过度磷酸化、氧化应激和继发炎性反应,导致神经元变性死亡,最终导致认知功能障碍。这就是目前广泛接受的AD病因假说——Aβ级联假说(amyloidβ-cascade hypothesis)。由此,Aβ及其聚集体特别是寡聚体成为AD最重要的疾病生物标记物,而如何降低脑内Aβ水平也成为防治AD的重点。
Aβ的沉积是由于Aβ的产生—清除平衡被破坏所致,因此减少产生和促进清除是降低脑内Aβ水平的关键手段。自20世纪90年代开始,首先探讨的是通过抑制Aβ产生的关键酶(β分泌酶和γ分泌酶)活性来减少Aβ的产生。但是,由于β分泌酶和γ分泌酶同时参与众多底物的代谢过程,简单地抑制其活性会因干扰神经元的正常生理功能而产生严重不良反应。γ分泌酶抑制剂(包括礼来的semagacestat和施贵宝的avagacestat)在临床试验中相继失败,使得APP代谢调节剂的研发热情跌至冰点。
占AD患者发病率90%-95%的是迟发型病人。这些病人脑内Aβ产生速度与正常人相同,而Aβ清除速率明显低于正常对照。由此,加快脑内Aβ清除成为AD防治最重要的方向。目前针对Aβ的清除策略研究最多的主要为被动免疫治疗法。被动免疫采用与Aβ有着特异性,高亲和力的抗体,通过抗体包含的Fc片段介导抗体与Aβ结合的复合物被巨噬细胞摄取而清除。然而,被动免疫治疗本身存在一些重要的问题:(1)Aβ-抗体免疫复合物诱发的不良反应:Aβ作为自身抗原,与进入脑内的抗体形成免疫复合物后,将可能诱发继发免疫反应而导致中枢神经系统炎症和血管壁的损伤,引起脑内炎症、脑微血管出血和血管源性脑水肿等不良反应;(2)目前有效的抗体都是针对Aβ氨基端的特异性抗体,由于Aβ氨基端的序列位于Aβ前体蛋白(APP)的胞外段,因此这些抗Aβ氨基端的抗体也会与神经元的APP结合而导致正常神经元遭到免疫攻击。同时,包括bapineuzumab等Aβ抗体临床试验的失败表明,尽管Aβ抗体能有效清除Aβ,但对于改善AD患者的认知功能作用较差。可能的原因在于Aβ聚集引发的继发性病理过程例如神经突触功能障碍和神经元丢失等,一旦被触发,便可独立于Aβ而加重AD的病理进程;而临床上,当AD患者出现疾病症状时,其神经系统功能已经受到不可逆性损伤,此时如果只注重于Aβ的清除,也难以改善AD患者的病理表现。因此,亟需探索既具有促进Aβ清除,同时又能保护神经元或者抑制其他继发性病理过程发展的AD多模式治疗策略。
纳米载体被应用于开发针对肿瘤和获得性免疫缺陷症等疾病的多模式治疗策略。对于AD的多模式治疗方法,纳米载体需要有较高的血脑屏障(brain-blood barrier,BBB)穿透性,或者借由绕开血脑屏障的递药方式,和与Aβ的高亲和力以实现靶向递药。
技术实现要素:
本发明的第一个目的在于提供一种提高重组脂蛋白与Aβ的亲和力,提高中枢神经系统中重组脂蛋白和药物的浓度,促进Aβ清除的同时保护神经元的单唾液酸四己糖神经节苷脂(GM1)修饰的重组脂蛋白。
本发明的第二个目的在于提供单唾液酸四己糖神经节苷脂修饰的重组脂蛋白在制备药物载体中的应用。
本发明的第三个目的在于提供单唾液酸四己糖神经节苷脂修饰的重组脂蛋白在制备治疗或预防Aβ沉积有关的疾病的药物中的应用。
为实现以上第一个目的,本发明公开以下技术方案:一种单唾液酸四己糖神经节苷脂修饰的重组脂蛋白,其特征在于,所述重组脂蛋白由单唾液酸四己糖神经节苷脂、脂质和载脂蛋白构成,所述单唾液酸四己糖神经节苷脂占总脂质摩尔数的1%-30%。
作为一个优选方案,所述单唾液酸四己糖神经节苷脂占总脂质摩尔数的1%-20%,更优选1%-18%,1-15%,1-10%,2%-25%,2%-20%,2%-18%,2%-15%,3%-25%,3%-20%,3%-18%,3%-15%,4%-25%,4%-20%,5%-20%。
作为一个优选方案,所述载脂蛋白质量占处方含量的1-60%。
作为一个优选方案,所述载脂蛋白质量占处方含量的1-50%。
作为一个优选方案,所述载脂蛋白质量占处方含量的1-40%,1-30%,1-25%,1-20%,优选2-60%,3-60%,4-60%,5-60%,优选2-50%,3-50%,4-50%,5-50%,更优选2-40%,3-40%,4-30%,5-30%,2-25%,3-25%,4-25%,5-30%,5-25%,5-20%,1-4%。
作为一个优选方案,所述脂质是蛋磷脂、豆磷脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、磷脂酰肌醇、磷脂酸、心磷脂、溶血磷脂、鞘氨醇、神经酰胺、鞘磷脂、脑苷脂、胆固醇、胆固醇酯、甘油酯及其衍生物中的一种或多种。
作为一个优选方案,所述脂质不包含胆固醇或胆固醇酯。
作为一个优选方案,所述载脂蛋白是ApoE及其模拟肽、ApoA-I及其模拟肽、ApoA-II及其模拟肽、ApoC及其模拟肽中的一种或多种。尤其优选ApoE及其模拟肽中的一种或多种,ApoE包括ApoE2,ApoE3和ApoE4。
所述单唾液酸四己糖神经节苷脂修饰重组脂蛋白的粒径范围为1-500nm,优选5-100nm。
所述重组脂蛋白的制备方法采用薄膜水化法、注入法、复乳法、熔融法、冷冻干燥法、逆向蒸发法、高压乳匀法或超声法及Ca2+融合法。
为实现本发明第二个目的,本发明公开以下技术方案:单唾液酸四己糖神经节苷脂修饰的重组脂蛋白在制备药物载体中的应用。所述的药物可以是治疗任何疾病的药物,包括小分子化学药物,大分子多肽、蛋白、基因药物中的一种或者多种。所述的基因药物包含核酸类药物,如核酸、核苷酸、核苷和碱基及其衍生物和类似物等,包括siRNA、microRNA或反义核酸等。
作为一个优选方案,所述药物载体是指经鼻腔给药的载体。鼻腔给药制剂辅料包含水、氯化钠、氯化钾、碳酸钠、磷酸钠、四硼酸钠、醋酸钠、碳酸氢钠、甲基纤维素、乙基纤维素、羟丙甲纤维素、聚乙烯吡咯烷酮、聚乙烯醇、羟乙基纤维素、羟丙基纤维素、羟丙乙基纤维素、羧甲基纤维素钠、聚乙二醇、聚甲基丙烯酸甲酯、聚卡波非、明胶、海藻酸、聚乙烯酸、聚氧化乙烯、硫酸软骨素钠、透明质酸钠、壳聚糖、亚硫酸氢钠、硫酸氢钠、硫代硫酸钠、苯扎氯铵、氯丁醇、硫柳汞、醋酸苯汞、硝酸苯汞、对羟基苯甲酸甲酯、苯乙醇、甘露醇、葡萄糖、甘油、木糖醇中的一种或者几种。
作为一个优选方案,所述药物是指治疗或预防中枢神经系统疾病的药物,比如治疗或预防阿尔茨海默病的药物。
为实现本发明第三个目的,本发明公开以下技术方案:单唾液酸四己糖神经节苷脂修饰的重组脂蛋白在制备治疗或预防Aβ沉积有关的疾病的药物中的应用。
作为一个优选方案,所述Aβ沉积有关的疾病是指阿尔茨海默病。
作为一个优选方案,所述药物是指经鼻腔给药的药物。
本发明所指的单唾液酸四己糖神经节苷脂修饰重组脂蛋白,其中脂质是指除GM1外的其他脂质,总脂质是指包括GM1在内的所有脂质。
本发明所指的Aβ沉积有关的疾病是指阿尔茨海默病、帕金森氏病、亨廷顿氏病、克罗伊茨费尔特-雅各布病和糖尿病、脑中风等疾病引起Aβ沉积并导致的认知障碍。
本发明的优点在于:
1)本发明首次提出采用单唾液酸四己糖神经节苷脂修饰重组脂蛋白,并给出具有优良效果的各组分含量。
2)GM1修饰的重组脂蛋白与未修饰的重组脂蛋白相比,与Aβ的亲和力明显增加,对AD的治疗效果也增加。
3)GM1修饰的重组脂蛋白同时也具有载药特性,能够将药物载带到单唾液酸四己糖神经节苷脂修饰重组脂蛋白上,起到治疗多种疾病,特别是Aβ沉积有关的疾病或者中枢神经系统疾病的作用。
4)特别是GM1修饰的重组脂蛋白与未修饰的重组脂蛋白相比,鼻腔给药时具有更高的鼻粘膜吸收效率和脑内递释特性。
5)GM1使重组脂蛋白更为稳定,不易聚集;在脂质中可以不添加胆固醇,却能实现比常规添加胆固醇同等甚至更好的效果,这样的改进可避免胆固醇在体内酯化引起的重组脂蛋白载药泄漏和脑内过量递送胆固醇可能产生不良反应等缺点。
6)更为重要的是,合适含量的GM1可以使载脂蛋白ApoE在总处方中的用量显著下降,并维持或增强载药、Aβ亲和力和治疗等效果。
附图说明
图1为(A)未修饰单唾液酸四己糖神经节苷脂的重组脂蛋白;(B)单唾液酸四己糖神经节苷脂修饰的重组脂蛋白的透射电镜照片,标尺:20nm。
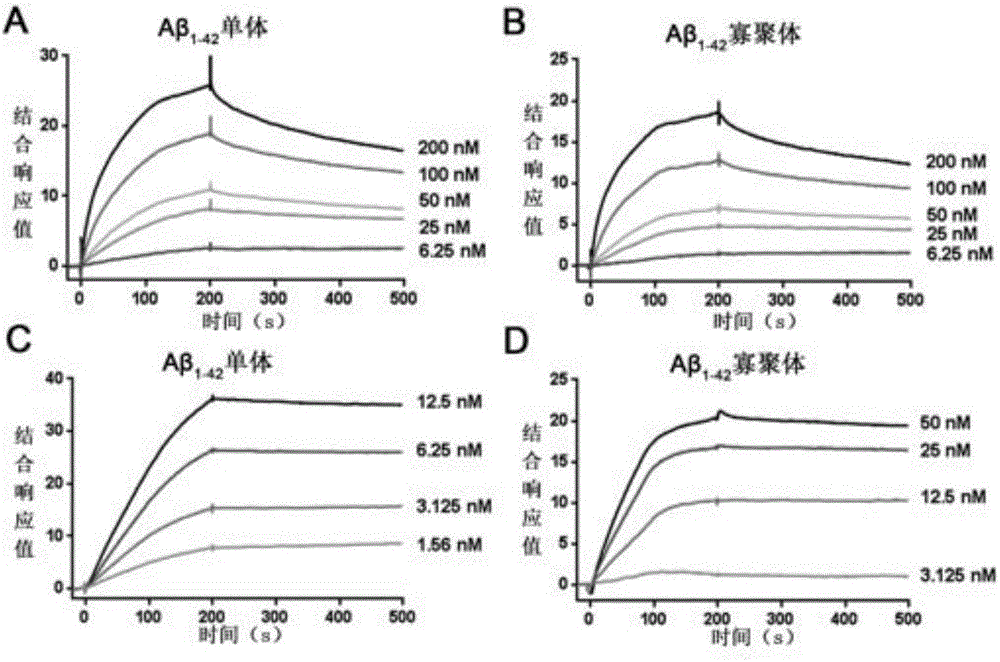
图2为(A)重组脂蛋白与Aβ1-42单体的结合曲线;(B)重组脂蛋白与Aβ1-42寡聚体的结合曲线;(C)单唾液酸四己糖神经节苷脂修饰重组脂蛋白与Aβ1-42单体的结合曲线;(D)单唾液酸四己糖神经节苷脂修饰重组脂蛋白与Aβ1-42寡聚体的结合曲线。
图3为在原代小胶质细胞上重组脂蛋白和单唾液酸四己糖神经节苷脂修饰重组脂蛋白对(A)Aβ1-42摄取情况,(B)Aβ1-42降解情况和(C)重组脂蛋白和单唾液酸四己糖神经节苷脂修饰重组脂蛋白与Aβ1-42的共定位情况。*p<0.05,**p<0.01,****p<0.0001与重组脂蛋白存在显著性差异。
图4为16HBE细胞系对单唾液酸四己糖神经节苷脂修饰重组脂蛋白的细胞摄取情况。
图5为在小鼠脑注射Aβ模型上研究对比重组脂蛋白和单唾液酸四己糖神经节苷脂修饰重组脂蛋白经鼻给药对Aβ脑内清除的作用:(A)小鼠脑内由游离的Aβ1-42量(即被降解的Aβ1-42量)占总注射量的百分比表示;(B)脑注射10min和30min后,小鼠脑内经血脑屏障向外周清除的Aβ1-42量,表示为脑外排指数。n=3-5,*p<0.05,**p<0.01,与对照组存在显著性差异。
图6为在小鼠脑注射Aβ模型上研究对比重组脂蛋白和单唾液酸四己糖神经节苷脂修饰重组脂蛋白静脉注射对Aβ脑内降解的作用,以小鼠脑内由游离的Aβ1-42量(即被降解的Aβ1-42量)占总注射量的百分比表示。
图7为载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白的神经保护作用。原代神经元与Aβ1-42寡聚体以及NAP融合肽溶液,载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白,单唾液酸四己糖神经节苷脂修饰重组脂蛋白或培养液(空白对照)共孵育48h。考察神经元细胞数量(A)、平均神经突起长度(B)以及平均分支点数量(C)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001,与Aβ1-42对照组存在显著性差异。
图8为注射给药2周,Morris水迷宫实验考察重组脂蛋白,单唾液酸四己糖神经节苷脂修饰重组脂蛋白和载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白对AD模型小鼠潜伏期的影响,*p<0.05,***p<0.001表明与空白对照组存在显著性差异;#p<0.05,表明与单唾液酸四己糖神经节苷脂修饰重组脂蛋白组存在显著性差异。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1.单唾液酸四己糖神经节苷脂修饰提高重组脂蛋白的单分散性
(1)制备
占总脂质摩尔百分比5%、10%、20%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比95%、90%、80%的二肉豆蔻酰磷脂酰胆碱中,加氯仿溶解,减压旋转蒸发除去有机溶剂,脂膜加pH7.4磷酸盐缓冲液水化,超声均质得到单唾液酸四己糖神经节苷脂修饰的脂质体(脂质总质量4mg)。加入0.8mg的ApoE,轻轻混匀,置于震荡摇床于100rpm 37℃孵育36h,得到单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
(2)表征
激光粒度仪测定粒径和zeta电位,结果显示,未孵育ApoE的单唾液酸四己糖神经节苷脂修饰脂质体粒径为55.17±5.11nm,经过ApoE孵育形成单唾液酸四己糖神经节苷脂修饰重组脂蛋白(单唾液酸四己糖神经节苷占总脂质摩尔百分比5%、10%和20%),粒径均减小为25nm以下,zeta电势为-14.20±0.66mV、-20.20±0.36mV和-26.41±0.42mV;而未加单唾液酸四己糖神经节苷脂修饰的重组脂蛋白粒径为24.64±3.59nm,zeta电势为-8.06±0.78mV。
磷钨酸负染,透射电镜观察形态,结果显示(图1),未加单唾液酸四己糖神经节苷脂修饰的重组脂蛋白粒径在20nm左右,部分堆叠形成蚕蛹状;而单唾液酸四己糖神经节苷脂修饰的重组脂蛋白粒径同样也在20nm左右,但分散性更好,未观察到多个堆叠的现象。分析原因可能是单唾液酸四己糖神经节苷脂修饰的重组脂蛋白表面zeta电势更负,粒子间因静电排斥,更不容易聚集,单分散性更好。
实施例2.单唾液酸四己糖神经节苷脂修饰提高重组脂蛋白对的Aβ亲合力
(1)制备
占总脂质摩尔百分比5%、10%、20%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比95%、90%、80%的二棕榈酰磷脂酰胆碱中(脂质总质量4mg),ApoE 0.8mg,同实施例1制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
占总脂质摩尔百分比5%的心磷脂掺入到占总脂质摩尔百分比95%的二棕榈酰磷脂酰胆碱中(总脂质质量4mg),ApoE 0.8mg,同上制备心磷脂修饰重组脂蛋白。
占总脂质摩尔百分比10%硫苷脂掺入到占总脂质摩尔百分比90%的二棕榈酰磷脂酰胆碱中(总脂质质量4mg),ApoE 0.8mg,同上制备硫苷脂修饰重组脂蛋白。
(2)表面等离子共振(Surface Plasmon Resonance,SPR)实验验证单唾液酸四己糖神经节苷脂修饰重组脂蛋白的Aβ亲合特性。
CM5芯片采用氨基偶联的方式将Aβ单体或者寡聚体固定:在用0.2M EDC和0.05M NHS对芯片表面进行活化后,将Aβ单体或者寡聚体稀释于pH4.0醋酸钠缓冲溶液中,使Aβ浓度为23μM,以30μl/min的速度注入420s,再用pH 8.5的乙醇胺进行封闭。参比通道活化后直接用乙醇胺封闭。亲和力测试采用双信道模式检测:重组脂蛋白稀释于pH 7.4 10mM PBS中,以30μl/min的速度注入到参比通道以及固定了Aβ的通道。接触时间为100s或300s,解离时间为400s。结果用Biacore T200Evaluation Softeware程序进行分析,运用1:1结合模型计算亲和力值。结果显示,占总脂质摩尔百分比5%、10%、20%的单唾液酸四己糖神经节苷脂修饰的重组脂蛋白与Aβ1-42单体(monomer)、寡聚体(oligomer)均呈高亲和力结合(图2),动态法计算占总脂质摩尔百分比5%的单唾液酸四己糖神经节苷脂修饰的重组脂蛋白与Aβ1-42单体、寡聚体的亲和力常数KD值,分别为(1.7±1.90)×10-10和(1.51±0.02)×10-10M,比未修饰重组脂蛋白与Aβ1-42单体、寡聚体的亲和力(亲和力常数KD值(9.97±2.81)×10-9和(9.47±4.37)×10-9)分别提高了58和62倍,表明单唾液酸四己糖神经节苷脂的修饰提高了重组脂蛋白与Aβ亲和特性。
而同时检测未孵育ApoE的单唾液酸四己糖神经节苷脂修饰脂质体和ApoE蛋白自身与Aβ1-42的单体、寡聚体的亲和力,结果显示,未孵育ApoE的单唾液酸四己糖神经节苷脂修饰脂质体与Aβ1-42的单体以及寡聚体的亲和常数分别为1.50×10-8M以及4.04×10-8M;ApoE蛋白与Aβ1-42单体的亲和常数为2.95×10-8M,而与Aβ1-42寡聚体的结合的信号太弱难以计算。同法制备的5%心磷脂修饰重组脂蛋白与Aβ1-42的单体以及寡聚体的亲和常数分别为(14.96±2.51)×10-9和(6.06±4.66)×10-9M;同法制备的10%硫苷脂修饰重组脂蛋白与Aβ1-42的单体以及寡聚体的亲和常数分别为68.26×10-9×10-9和(18.15±7.34)×10-9M。上述结果表明单唾液酸四己糖神经节苷脂的修饰特异提高了重组脂蛋白对Aβ的亲和力。
表1 不同重组脂蛋白与Aβ的亲和力的比较
实施例3.单唾液酸四己糖神经节苷脂修饰提高重组脂蛋白介导的小胶质细胞对Aβ的摄取和降解
(1)制备
占总脂质摩尔百分比5%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比95%的磷脂酰胆碱和磷脂酸混合物中(脂质总质量4mg),ApoE 0.4mg,同实施例1制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
(2)单唾液酸四己糖神经节苷脂修饰重组脂蛋白促进原代小胶质细胞对Aβ的摄取
将FAM荧光标记的Aβ1-42加入至种植有小胶质细胞的96孔板中,分别将重组脂蛋白、单唾液酸四己糖神经节苷脂修饰重组脂蛋白用DMEM稀释加入至种植有原代小胶质细胞的96孔板中,至终浓度0、0.01、0.05、0.5和2μg/mL,FAM荧光标记Aβ1-42终浓度为2μg/mL。于37℃细胞培养箱中共孵育4h。之后3.7%甲醛于37℃固定10min,Hoechst染核8min,PBS洗3遍后,用高内涵的TargetActivation程序进行拍摄以及定量分析。结果如图3A所示,单唾液酸四己糖神经节苷脂修饰重组脂蛋白显著提高了原代小胶质细胞对FAM荧光标记Aβ1-42的摄取。
(3)ELISA法考察单唾液酸四己糖神经节苷脂修饰重组脂蛋白对原代小胶质细胞降解Aβ的影响
以DMEM稀释Aβ1-42至4μg/ml,加入至种植有小胶质细胞的24孔板中,再加入用DMEM稀释的重组脂蛋白、单唾液酸四己糖神经节苷脂修饰重组脂蛋白至终浓度为0、1、10、100μg/mL,Aβ1-42的终浓度为2μg/ml。37℃孵育4h后,裂解刮取细胞,进行后续检测或-80℃保存。
取储存于-80℃的1mg/ml人Aβ1-42标准储备液,以稀释缓冲液稀释至0,6.25,12.5,25,50,100,200pg/ml作为标准曲线。样品以稀释缓冲液稀释80倍。按照ELISA产品说明书进行实验和结果测定并BCA法检测蛋白总浓度测定细胞裂解液中的蛋白总量。结果表示为细胞裂解液中的Aβ1-42浓度与蛋白总浓度的比值。结果如图3B所示,结果表明重组脂蛋白经单唾液酸四己糖神经节苷脂修饰后,可浓度依赖性增加原代小胶质细胞对Aβ1-42的降解,同时GM1的加入使ApoE的含量可以明显降低。
实施例4.单唾液酸四己糖神经节苷脂修饰重组脂蛋白在体外鼻粘膜细胞模型中的摄取情况
以16HBE细胞系为体外鼻粘膜细胞模型,考察单唾液酸四己糖神经节苷脂修饰重组脂蛋白的细胞摄取情况。
(1)制备
同实施例1制备单唾液酸四己糖神经节苷脂修饰的重组脂蛋白。
(2)16HBE细胞系对单唾液酸四己糖神经节苷脂修饰重组脂蛋白的细胞摄取情况。
16HBE接种于96孔板中,培养24h后可进行实验。用DMEM稀释制剂溶液至50、100、250、500和800μg/ml,加入至上述96孔板中,于37℃孵育4h。孵育结束后,3.7%甲醛固定,PBS洗后用Hoechst染核,用高内涵进行定量分析。结果表明占总脂质摩尔百分比5%的单唾液酸四己糖神经节苷脂修饰的重组脂蛋白的细胞摄取量与未修饰重组脂蛋白相当(图4)。
实施例5.单唾液酸四己糖神经节苷脂修饰重组脂蛋白经鼻腔给药的脑内递送效率
同实施例1制备单唾液酸四己糖神经节苷脂修饰程度从占脂质摩尔百分比5%升高至10%、20%、30%、40%的单唾液酸四己糖神经节苷脂修饰的重组脂蛋白。
采用Bolton-Hunter法将125I标记于单唾液酸四己糖神经节苷脂修饰重组脂蛋白上。ICR小鼠鼻腔给药,结果显示,脂质摩尔百分比占5%的125I标记单唾液酸四己糖神经节苷脂修饰重组脂蛋白在皮层和海马中的制剂达峰浓度浓度(Cmax)为0.0434%ID/g,高出125I标记的未修饰重组脂蛋白75%,AUCall为0.2956%ID/g·h,高出未修饰重组脂蛋白85%;在血中的AUCall为9.8650%ID/g·h,高出未修饰重组脂蛋白80%。而两种制剂的AUCCortex+Hippocampus/AUCblood相近,提示单唾液酸四己糖神经节苷脂修饰重组脂蛋白比未修饰重组脂蛋白具有更高的鼻粘膜吸收效率。然而随着单唾液酸四己糖神经节苷脂修饰程度从5%升高至10%、20%、30%、40%,其制剂的脑内递释特性没有明显升高,反而有一定下降趋势,脂质摩尔百分比占20%的125I标记单唾液酸四己糖神经节苷脂修饰重组高密度脂蛋白的脑内分布量略高于未修饰重组高密度脂蛋白(升高25.9%),脂质摩尔百分比占30%的125I标记单唾液酸四己糖神经节苷脂修饰重组高密度脂蛋白的脑内分布量与未修饰重组高密度脂蛋白相当(102.3%),而脂质摩尔百分比占40%的125I标记单唾液酸四己糖神经节苷脂修饰重组高密度脂蛋白的脑内分布量低于未修饰重组高密度脂蛋白(87.2%)。
表2.未修饰重组脂蛋白、单唾液酸四己糖神经节苷脂修饰的重组脂蛋白经鼻给药后在小鼠体内的药动学参数。
实施例6.单唾液酸四己糖神经节苷脂修饰重组脂蛋白促进Aβ在小鼠脑内的清除
(1)制备
占总脂质摩尔百分比5%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比95%的磷脂酰胆碱和磷脂酰胆碱混合物中(脂质总质量4mg),ApoE0.8mg,同实施例1制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
(2)采用小鼠脑注射Aβ模型研究单唾液酸四己糖神经节苷脂修饰重组脂蛋白对Aβ脑内清除的作用
ICR小鼠随机分为3组,每组分别鼻腔或静脉注射给予重组脂蛋白、单唾液酸四己糖神经节苷脂修饰重组脂蛋白,对照组给予PBS。给药30min后进行脑定位注射:将125I标记Aβ1-42以及含有14C的菊粉([14C]inulin)混合,用人工脑脊液稀释,精确定位注射入小鼠海马区。分别于脑定位注射10min以及30min后处死小鼠,取小鼠大脑进行检测。其中一半脑组织称重后于γ计数仪上检测125I标记Aβ1-42的放射量,之后加入3倍体积的10%三氯乙酸(trichloroacetic acid,TCA)沉淀组织,离心后去除上清,检测未被降解的125I标记Aβ1-42的放射量。图5A表明单唾液酸四己糖神经节苷脂修饰重组脂蛋白鼻腔给药在短时间内显著促进了Aβ1-42的脑内降解;图5B表示鼻腔给药单唾液酸四己糖神经节苷脂修饰重组脂蛋白显著促进小鼠脑内Aβ1-42跨血脑屏障向外周清除。相比之下,单唾液酸四己糖神经节苷脂修饰重组脂蛋白静脉注射短时间(5min)内对Aβ1-42的脑内降解无明显促进作用,而未修饰重组高密度脂蛋白对Aβ1-42的脑内降解有一定促进作用(图6),推测可能是单唾液酸四己糖神经节苷脂修饰重组脂蛋白静脉注射入脑量在短时间内不及未修饰重组高密度脂蛋白所致,需要较长时间(30min)才能起到降解促进作用。而经鼻给药的单唾液酸四己糖神经节苷脂修饰重组脂蛋白短时间内即可增加Aβ1-42降解并促进脑内Aβ1-42跨血脑屏障向外周清除。
实施例7.载药单唾液酸四己糖神经节苷脂修饰重组脂蛋白的神经保护作用
(1)制备
占总脂质摩尔百分比5%、10%、20%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比95%、90%、80%的二肉豆蔻酰磷脂酰胆碱中,加氯仿溶解,减压旋转蒸发除去有机溶剂,脂膜加pH7.4磷酸盐缓冲液水化,超声均质得到单唾液酸四己糖神经节苷脂修饰的脂质体(脂质总质量4mg)。加入0.05-1mg的NAP融合肽,4℃孵育过夜,再加入0.5-5mg ApoE3,继续超声50min。产品冷却至室温,孵育过夜,制备载NAP的单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
(2)载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白的神经保护作用
Aβ1-42寡聚体用神经元培养液稀释至20μM,加入到种植有原代神经元的96孔板中,再加入NAP融合肽溶液、载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白或单唾液酸四己糖神经节苷脂修饰重组脂蛋白,Aβ1-42寡聚体的终浓度为10μM,空白对照组只加入神经元培养液。于37℃共孵育48h后,用含有3.7%甲醛的PBS固定细胞,加入TritonX-100透膜15min,用含有1%BSA的PBS在37℃封闭30min,加入MAP2抗体4℃孵育过夜,加入Alexa Fluor488荧光二抗,于37℃孵育1h,Hoechst染核。用高内涵对原代神经元细胞进行检测,并用NeuroProfiling程序进行分析。结果如图7A-7C所示,载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白显著逆转了Aβ1-42寡聚体诱导的神经毒性,体现在神经元数量、平均神经突起长度以及平均分支点数量的提高。
实施例8.载BACE-siRNA的单唾液酸四己糖神经节苷脂修饰重组脂蛋白减少SH-SY5Y细胞β分泌酶表达
同实施例1制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白,BACE-siRNA连接胆固醇,插入脂膜中。SH-SY5Y细胞培养至80%汇合度,以siRNA浓度为1μM转染细胞。转染48h后,Western blot检测细胞β分泌酶表达,Image J软件统计计算条带灰度值。结果显示,载BACE-siRNA的单唾液酸四己糖神经节苷脂修饰重组脂蛋白转染使SH-SY5Y细胞β分泌酶表达下降40%。
实施例9.载姜黄素的单唾液酸四己糖神经节苷脂修饰重组脂蛋白减轻Cu2+-Aβ复合物引起的小胶质细胞炎症
姜黄素和脂质溶于一定比例氯仿-甲醇混合溶剂中,同实施例1方法制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白。Cu2+-Aβ以1∶1摩尔比例37℃孵育24h制备复合物。原代小胶质细胞加入5μM的Cu2+-Aβ复合物孵育24h,TNF-α含量提高100%,而加入Cu2+-Aβ复合物和载姜黄素的单唾液酸四己糖神经节苷脂修饰重组脂蛋白同时孵育的原代小胶质细胞TNF-α含量与未处理组相当,表明载姜黄素的单唾液酸四己糖神经节苷脂修饰重组脂蛋白有效减轻了Cu2+-Aβ复合物引起的小胶质细胞炎症。
实施例10.单唾液酸四己糖神经节苷脂修饰重组脂蛋白与载带药物协同改善AD模型动物的空间学习记忆能力
(1)制备
同实施例7制备载NAP的单唾液酸四己糖神经节苷脂修饰重组脂蛋白。
(2)单唾液酸四己糖神经节苷脂修饰重组脂蛋白与载带药物协同改善AD模型动物的空间学习记忆能力
采用Morris水迷宫实验考察单唾液酸四己糖神经节苷脂修饰重组脂蛋白和载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白对AD模型动物的空间学习记忆能力的改善作用。AD模型小鼠随机分组,每组7-8只,按如下方式进行鼻腔给药:空白对照组和AD模型组:给予PBS溶液,10μl/只/天;AD模型组:给予PBS溶液,10μl/只/天;药物溶液组:给与NAP融合肽溶液组,24μg/kg/天;重组脂蛋白组:给予重组脂蛋白溶液,5mg/kg/天(脂质浓度);单唾液酸四己糖神经节苷脂修饰重组脂蛋白组:给予单唾液酸四己糖神经节苷脂修饰重组脂蛋白溶液,5mg/kg/天(脂质浓度);载药单唾液酸四己糖神经节苷脂修饰重组脂蛋白组:给予载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白组溶液,即5mg/kg/天(脂质浓度)。每天连续鼻腔给药至14天。
Morris水迷宫,水池直径120cm,高50cm,水深25cm,水温22±1℃。沿水池圆周等分为四个入水点,它们的连接线将圆形水池等分为Ⅰ、Ⅱ、Ⅲ、Ⅳ共4个象限区域,在Ⅰ象限中心放置一个9cm黑色平台。平台低于水面约1cm。水池底、平台及四壁均以食用染料涂成黑色使平台不可见。采用Morris水迷宫视频分析系统2.0监测并记录小鼠的游泳轨迹。定位航行试验(Hidden platform test):用于训练和测量小鼠的空间学习能力,与小鼠连续给药4周后休息2天开始,历时5天。将平台固定于Ⅰ象限中央,按照随机的原则分别从Ⅰ、Ⅱ、Ⅲ、Ⅳ象限的入水点将小鼠面向池壁放入水中,计算机监测并记录小鼠从入水开始寻找至找到并爬上黑色平台的路线、所需时间(潜伏期)及游泳速度等。如果小鼠60s内未找到平台,需将其引领到平台,并停留30s,这时潜伏期记为60s。每天训练4次/只,每次训练间隔30s。
结果如图8所示,药物溶液组和重组脂蛋白在5天的训练过程中,潜伏期未呈现出显著性的下降。单唾液酸四己糖神经节苷脂修饰重组脂蛋白在第5天的训练中潜伏期显著低于AD模型组,表明单唾液酸四己糖神经节苷脂修饰重组脂蛋白对AD模型小鼠的学习记忆能力有一定改善作用。经过14天鼻腔给予载NAP单唾液酸四己糖神经节苷脂修饰重组脂蛋白,AD模型小鼠在空间探索实验中的潜伏期在第3天开始表现出了下降的趋势,在第5天的训练中,相较于AD模型组,潜伏期显著缩短(33.9±2.1s),并且相比于未载药的单唾液酸四己糖神经节苷脂修饰重组脂蛋白,潜伏期缩短了12%。表明载药单唾液酸四己糖神经节苷脂修饰重组脂蛋白可能通过单唾液酸四己糖神经节苷脂修饰重组脂蛋白和神经保护肽的多模式作用进一步增强对AD的疾病修饰作用。
实施例11.单唾液酸四己糖神经节苷脂修饰可在降低重组脂蛋白中载脂蛋白含量情况下保持对Aβ的高亲和力
占总脂质摩尔百分比10%的单唾液酸四己糖神经节苷脂掺入到占总脂质摩尔百分比90%的二肉豆蔻酰磷脂酰胆碱(4mg)中,加入占脂质质量2.5%、5%、10%或20%(0.1、0.2、0.4、0.8mg)的ApoE3,同上制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白。表面等离子共振(Surface Plasmon Resonance,SPR)实验检测单唾液酸四己糖神经节苷脂修饰重组脂蛋白的Aβ亲合特性,发现加入占脂质质量2.5%、5%、10%、20%的ApoE3的单唾液酸四己糖神经节苷脂修饰重组脂蛋白对Aβ的亲和力常数分别为0.19×10-9M、0.64×10-9M、0.80×10-9M和0.52×10-9M,表明在单唾液酸四己糖神经节苷脂掺入情况下,载脂蛋白比例即使大大降低,依然能保持或增强重组脂蛋白对Aβ的亲合特性。
实施例12.单唾液酸四己糖神经节苷脂修饰提高重组脂蛋白介导的Aβ多肽疫苗的脑内递送
同上制备单唾液酸四己糖神经节苷脂修饰重组脂蛋白,加入125I标记的Aβ多肽疫苗共孵育5min。混合物静脉注射,注射后1h后取脑,γ计数器检测脑内125I标记的Aβ多肽疫苗的放射性强度。结果显示,与Aβ多肽疫苗单独注射相比,单唾液酸四己糖神经节苷脂修饰重组脂蛋白共孵育将Aβ多肽疫苗的入脑量提高76.47%,而未修饰重组脂蛋白共孵育仅将Aβ多肽疫苗的入脑量提高11.44%。该结果表明,仅通过简单共孵育,单唾液酸四己糖神经节苷脂修饰重组脂蛋白即可有效提高本身具有脑内转运特性的多肽药物的入脑量,提示其对其他难以入脑的药物可能具有更强的脑内递送促进作用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!