一种喜树碱类药物的纳米晶及其制备方法与流程
本发明涉及药物制剂领域,具体涉及一种无稳定剂及制备过程无有机溶剂的喜树碱类药物的纳米晶、其制备方法及应用。
背景技术:
喜树碱类药物包括喜树碱、10-羟基喜树碱、7-乙基喜树碱、7-乙基-10-羟基喜树碱、9-硝基喜树碱等,均为难溶性药物,均具有内酯环和较好的抗肿瘤活性,其中10-羟基喜树碱(10-HCPT)临床应用最为广泛。
喜树碱类药物是从中国喜树中提取的具备抗癌作用的微量生物碱及其衍生物,属于细胞周期特异性药物,主要作用于DNA合成期(S-期)。HCPT为拓扑异构酶I(Topo I)特异性抑制剂,通过抑制DNA超螺旋结构松弛过程中的再连接步骤,导致单链和双链DNA断裂,触发细胞死亡。临床主要用于原发性肝癌、胃癌、头颈部癌、腺原性上皮癌、白血病、膀胱癌等恶性肿瘤的放化疗;毒性反应主要表现在泌尿系统、消化系统及造血功能的抑制等,但其毒性明显低于喜树碱,特别是泌尿系统反应少,临床上易被接受。
目前,以羟基喜树碱为代表的喜树碱类药物主要以注射液在临床上的应用,注射液在临床应用上存在的主要问题有:(1)半衰期短(静脉注射分布半衰期(t1/2a)为4.5min,消除半衰期(t1/2β)为29min),需反复给药或延长疗程,导致剂量限制性毒性-骨髓抑制和消化道毒性也随之增加。(2)静脉给药后主要分布于胆囊,而癌症常发组织器官如肝、肺、胃等组织的分布并不理想。(3)羟基喜树碱脂溶性水溶性都不好,制成水溶性钠盐的抗癌活性降低90%,毒副作用增大;稳定性差,药物的内酯环对光、pH敏感,抗肿瘤生物学功能较强的闭环内脂结构转化为功能较弱的开环羧酸盐结构,药理活性大大下降。由于上述原因,阻碍了羟基喜树碱充分发挥抗肿瘤作用,限制了其临床应用。
目前国内外已有采用溶剂挥发法制备羟基喜树碱豆磷脂纳米冻干制剂的方法,该方法制备的羟基喜树碱豆磷脂纳米冻干制剂虽在一定程度上能够克服现有注射液的不足,但是该方法需用大量的低沸点的有机溶剂,对环境保护不利,且易导致有机溶剂在制剂中残留,影响药物的治疗效果。
利用喜树碱内酯环可以加碱开环溶于水,加酸环合析出的性质,也可以制备得到喜树碱类药物的纳米晶组合物,但所述工艺均需在制备和最终产品中加入辅料稳定剂,且纳米粒径也较大,冻干后复溶性不好,不利于临床应用。
技术实现要素:
本发明的目的在于提供一种制备方法简便无污染、重复性好、易于实现工业化规模生产、能实现羟基喜树碱和其他喜树碱类药物的体内外缓释、改善其体内分布、增强抗癌疗效的纳米晶组合物及其制备方法和用途。
本发明提供了一种喜树碱类药物的纳米晶组合物,其特征在于:所述的纳米晶组合物仅由喜树碱类药物组成,无任何稳定剂。
所述的喜树碱类药物,是喜树碱或具有喜树碱骨架的衍生物,选自10-羟基喜树碱、7-乙基喜树碱、7-乙基-10-羟基喜树碱、9-硝基喜树碱。
所述的喜树碱类药物纳米晶组合物的粒径为100-500nm,优选粒径范围在100-150nm。
其中,喜树碱类药物基本上以内酯型形式存在;药物具有缓释作用,无突释现象。
本发明还提供了一种制备所述的喜树碱类药物纳米晶组合物的方法,其特征在于,所述制备方法包括以下步骤:
(1)喜树碱类药物溶于碱溶液中,制备成喜树碱盐溶液;
(2)超声条件下,在喜树碱盐溶液中滴加酸溶液,进行梯度酸化;
(3)高速离心,至上清检测不到纳米晶存在,除去制备过程中产生的盐,收集沉淀后加水混悬;
(4)必要时高压匀质进一步减小粒径;
并且,所述步骤中不包括添加稳定剂的步骤。
进一步地,步骤(1)所述的碱溶液可以是氢氧化钠、氢氧化钾无机强碱溶液,也可以是碳酸钠、磷酸钠、碳酸钾、磷酸钾无机弱碱溶液。
步骤(1)所得喜树碱盐溶液的pH可在8-14之间,优选范围在9-12。
步骤(1)药物在碱溶液中的浓度为5-20mg/mL之间,优选范围为10-15mg/mL。
步骤(2)中超声温度为常温,功率为150-300W,酸溶液可以是稀盐酸或者醋酸。
步骤(2)当pH=4时喜树碱类药物会完全转化成内酯型,这时加酸的总体积为V;采用梯度滴加的方法:最初以2mL/min的速度滴加50%V,接着以1.0mL/min的速度滴加25%V,然后0.5mL/min的速度滴加15%V,10000rpm离心10min,后取出上清,继续以0.5mL/min的速度滴加10%V至pH=4。
步骤(3)中高速离心条件为10000-20000rpm离心10~20min,收集沉淀是将两次酸沉后的沉淀一起收集后加水复溶。
步骤(4)中高压匀质条件为温度20~30℃,压力500-4000bar,其中理想匀质条件为25℃、2000~2500bar、≥8次循环。
步骤(3)或步骤(4)之后还可以通过冷冻干燥、喷雾冷冻干燥或喷雾干燥进一步固化,所用冻干保护剂可以是P188、PVP、乳糖、麦芽糖、半乳糖、甘露醇中的一种或两种以上的组合。其中,优选P188为冻干保护剂;冻干保护剂的用量为纳米晶重量的5-50%,优选纳米晶重量的25%是冻干保护剂。
本发明还提供了一种用途,所述的喜树碱类药物纳米晶组合物在制备注射剂中的用途,其特征在于所述的注射剂包括注射液和无菌粉针。
进一步地,水相分散介质可用高浓度的葡萄糖水溶液调成5%葡萄糖生理等渗体系,适应临床应用。
羟基喜树碱纳米晶冻干粉可加入适量的无菌药用5%葡萄糖水溶液稀释,重建成供静脉给药用的分散体系,适应临床使用。
注射给药后,纳米晶可以较传统注射剂获得更好的药物浓度、更长的血浆半衰期和更高的血药浓度-时间曲线下面积(AUC),以及在肝、肺、肿瘤组织更高的药物分布(AUC)。给药后,纳米晶可以获得较市售注射剂更好的抗肿瘤效果。
本发明的纳米晶组合物经荷瘤小鼠药效实验证明,表现出较市售喜树碱注射液好得多的抗肿瘤药效,用于肿瘤治疗是一种很有前途的药物递送系统。
附图说明
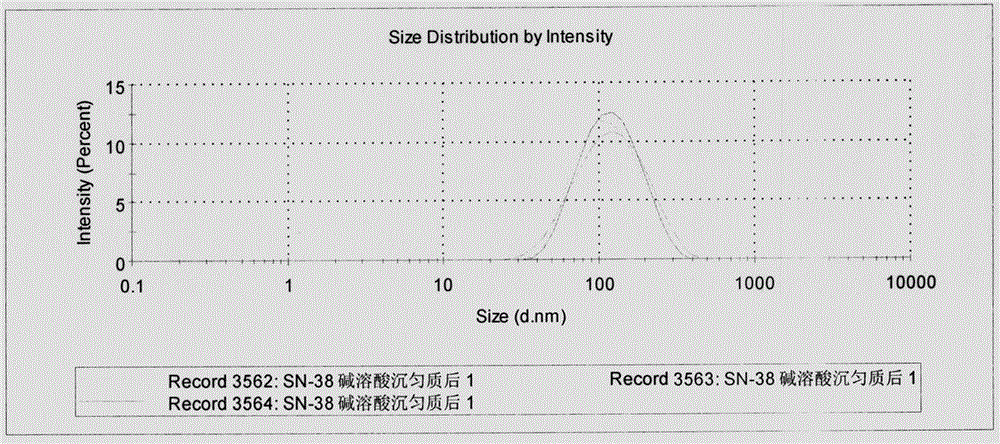
图1为实例1中羟基喜树碱纳米粒高压均质前后及加入冻干保护剂后的平均粒径分布图
图2为实例2中羟基喜树碱纳米粒高压均质后的平均粒径分布图
图3为实例3中7-乙基-10-羟基喜树碱纳米粒高压均质后的平均粒径分布图
图4为实例1中加入冻干保护剂后的投射电镜照片
图5为实例1中X-粉末衍射图谱(从上到下依次为羟基喜树碱纳米晶、羟基喜树碱原药与P188的物理混合物、羟基喜树碱原药)
图6为实例1中羟基喜树碱在水中的体外释放曲线(n=3)
图7为实例1中大鼠血药浓度与时间变化的关系曲线(a图0-24h,b图0-4h)(n=8)
图8为实例1中纳米晶在荷瘤小鼠肿瘤中的分布(n=8)
具体实施方式
下面将描述本发明的几个实施例,但本发明的内容完全不局限于此。
实例1
称取25mg羟基喜树碱溶于2mL氢氧化钠溶液(0.1mol·L-1)中,超声条件(25℃,250W)下用注射泵控制器缓慢滴加稀盐酸溶液(0.1mol·L-1),控制速度:最初2mL/min×0.5min,接着1.0mL/min×0.5min,然后0.5mL/min×0.6min(此时pH=5),离心(离心半径5cm,1000rpm离心10min);取上清,继续以0.5mL/min的速度滴加0.2mL稀盐酸溶液(0.1mol·L-1)至pH=4,然后再次离心(1000rpm离心10min)。合并两次离心后的沉降物,加入5mL纯化水重悬,高压匀质(25℃、2×105KPa)8次。所得纳米晶粒径为133.5±0.3nm(图1),多分散性指数(PDI)为0.13±0.02。
加入占总重量25%的冻干保护剂P188冻干后于4℃保存,半年后再复溶,粒径为140.6±6.3nm,多分散性指数(PDI)为0.20±0.02,长期稳定性良好。
实例2
称取1000.0mg羟基喜树碱溶于40.0mL氢氧化钠溶液(0.2mol·L-1)中,超声条件(25℃,250W)下用注射泵控制器缓慢滴加稀盐酸溶液(0.2mol·L-1),控制速度:最初2mL/min×10min,接着1.0mL/min×10min,然后0.5mL/min×10min(此时pH=5),离心(离心半径5cm,1000rpm离心10min);取上清,继续以0.5mL/min的速度滴加5.0mL稀盐酸溶液(0.2mol·L-1)至pH=4,然后再次离心(离心半径5cm,1000rpm离心10min)。合并两次离心后的沉降物,加入80mL纯化水重悬,高压匀质(25℃、2×105KPa)8次。用粒径/电位仪测得其粒径为(141.0±0.4)nm(图2),PDI值为0.14±0.02,电位为(-26.0±1.1)mV。
实例3
称取25mg 7-乙基-10羟基喜树碱溶于2mL氢氧化钠溶液(0.1mol·L-1)中,超声条件(25℃,250W)下用注射泵控制器缓慢滴加稀盐酸溶液(0.1mol·L-1),控制速度:最初2mL/min×0.5min,接着1.0mL/min×0.5min,然后0.5mL/min×0.6min(此时pH=5),离心(离心半径5cm,1000rpm离心10min);取上清,继续以0.5mL/min的速度滴加0.2mL稀盐酸溶液(0.1mol·L-1)至pH=4,然后再次离心(1000rpm离心10min)。合并两次离心后的沉降物,加入5mL纯化水重悬,高压匀质(25℃、2×105KPa)8次。所得纳米晶粒径为106.7±0.53nm(图3),多分散性指数(PDI)为0.185±0.012,电位为(-35.1±1.0)mV。
实例4
将实例1中制备的羟基喜树碱纳米晶稀释至100μg/mL,吸取6μL滴到300目的铜网上,空气中自然晾干,后用0.1%磷钨酸染色10min,透射电镜下观察粒子的形态(图4)。
实例5
实例1中样品冻干粉的X-粉末射线衍射图谱见图5,样品测量参数:Cu靶管照射,40kV,100mA,步宽:0.01°,扫描范围:3-70°,结果可知羟基喜树碱在纳米晶冻干粉中依然以晶型形式存在。
实例6
羟基喜树碱纳米粒的体外释放实验
方案:实验采用透析袋法对羟基喜树碱纳米粒进行体外释放实验,同时用市售的羧酸盐型羟基喜树碱注射液(Injections)及药物粗粉做对照。取以上样品2mL(含药100μg)于透析袋(截留分子量8000-14000)中,置于100mL释放介质中,于37℃、100rpm条件下恒温搅拌,每个时间点取1mL释放外液HPLC测其中的药物含量,同时补充等温等体积的释放介质,计算累积释放度,释放介质采用纯化水,同一样品平行实验3份。
结果:纳米粒显著增强了药物的缓释效果,在水中均能缓释72h(图6)
实例7羟基喜树碱纳米粒药代动力学研究
实验动物:健康SD大鼠16只,雄性,体重200~220g。
给药方案:随机分成两组。给药前禁食12h,自由饮水。以5mg/kg的剂量分别静脉注射给予羟基喜树碱纳米粒和市售注射剂。
样品采集:给药后15min、30min、1h、2h、4h、8h、12h、24h眼眶后取血0.5mL,5000rpm离心取上清血浆;取收集的血浆200μL于EP管中,加冰醋酸20μL,于暗处转化3h(将羧酸盐型转化成内酯型);加乙酸乙酯1mL,涡旋振荡1min,10000rpm离心10min;取上清,氮气吹干;剩余物加甲醇200μL超声溶解,过0.22μm针头式滤器,取20μL以HPLC检测。
结果:药-时曲线见图7。平均血药浓度数据用Phoenix WinNonlin(version 6.1)拟合,计算药代动力学参数,药代动力学参数如下表(n=8,mean±SD;**P<0.01,***P<0.001vs.市售注射剂):
实施例8
羟基喜树碱纳米晶在H22荷瘤小鼠体内分布
动物模型的建立:
在培养箱体外培养4T1非荧光细胞,将指数生长期的细胞用胰酶消化,用无菌PBS调整细胞悬液浓度为1×107个/mL备用。给70只6周龄的BALB/C雌性小鼠右腋下注射0.2mL的4T1细胞(1×106/mL)的PBS悬液,隔天观察肿瘤生长情况,至体积大于100mm3,筛选肿瘤大小相对一致的72只小鼠进行实验。
给药方案:取荷瘤小鼠72只,随机分为市售注射剂和纳米粒2组,给药前禁食12h,自由饮水,按照8mg/kg剂量尾静脉注射给药。
样品采集:于给药后0.5、1、4、8、12h、24h摘眼球取血后脱颈椎处死小鼠;取心、肝、脾、肺、肾、脑及肿瘤组织,生理盐水洗净浮血,滤纸吸干;各组织称重后加3倍质量生理盐水组织匀浆;离心,取各组织匀浆液200μL加冰醋酸20μL暗处转化3h,加乙酸乙酯1mL,涡旋振荡1min,10000rpm离心10min;取上清,氮气吹干,残余物加甲醇200μL超声溶解,过0.22μm针头式滤器,取20μL以HPLC检测。各参数用Phoenix WinNonlin(version 6.1)拟合计算。
结果:纳米晶组延长了药物在各组织的滞留时间,如肝、肺中的平均驻留时间分别为注射剂组的2.01和2.44倍。这种滞留时间的延长有利于药物在组织蓄积,其中,心、肝、脾、肺、肾组织中的AUC0-24h分别为注射剂的6.71、39.53、6.23、13.45、14.08倍。给药后,纳米混悬剂组肿瘤组织的药物浓度较注射剂组显著提高,AUC0-24h为后者的7.25倍。在肿瘤中的分布图见图8(n=6,mean±SD;***P<0.001vs.市售注射剂)。
羟基喜树碱纳米晶及市售注射剂在各组织中的分布参数如下表:
Ra=AUC(NSps)/AUC(Inj) Rb=MRT(NSps)/MRT(Inj) Rc=Cmax(NSps)/Cmax(Inj)
实例9
羟基喜树碱纳米晶在4T1荷瘤小鼠的抗肿瘤药效研究
动物模型的建立:同实施例8中相同。
给药方案:将筛选出来的荷瘤小鼠随机分为6组,每组10只,除正常饮食外,尾静脉注射给药,每2天给药一次,实验18天。空白组给予生理盐水溶液,注射剂组按照5mg/kg的剂量尾静脉注射市售HCPT注射液(生理盐水稀释),纳米混悬剂组按照5mg/kg、2.5mg/kg、1.5mg/kg的剂量尾静脉注射HCPT纳米晶。考察指标:每日上午9点至10点,用电子秤称量小鼠体重。实验结束后,脱颈椎处死小鼠,完整剥离腋下肿瘤组织称重,计算抑瘤率(%)=(1-治疗组平均瘤重/生理盐水组平均瘤重)×100%。
结果:同样给药剂量下,纳米粒表现出卓越的抗肿瘤治疗,肿瘤抑制率较市售注射剂(74.84%vs.37.93%)有显着性增强,P<0.01。表明本发明方法制备的10-HCPT纳米晶的用于肿瘤治疗是一种很有前途的药物递送系统。纳米粒及注射剂对4T1荷瘤小鼠的抑瘤率如下表(n=8,mean±SD):
注:###p<0.001vs.生理盐水组;*p<0.05,**p<0.01,***p<0.001vs.10-HCPT注射剂组。
本发明内容仅仅举例说明了要求保护的一些具体实施方案,其中一个或更多个技术方案中所记载的技术特征可以与任意的一个或多个技术方案相组合,这些经组合而得到的技术方案也在本申请保护范围内,就像这些经组合而得到的技术方案已经在本发明公开内容中具体记载一样。
- 还没有人留言评论。精彩留言会获得点赞!