2‑羟基雌激素在制备用于治疗与雌激素相关疾病的药物中的应用的制作方法
本发明涉及2-羟基雌激素的医药用途,特别是涉及2-羟基雌激素在制备用于治疗与雌激素相关疾病的药物中的应用。
背景技术:
乳腺增生、多囊卵巢综合症、子宫肌瘤、更年期综合症、经前期综合症等良性疾病均与雌激素相关,其中一个较为突出的危险因素是女性暴露于雌激素时间延长,其原因包括月经初潮时间早、绝经时间晚等。雌激素的功能和状态在这些疾病的发生和发展中起到了重要的作用。
雌二醇(E2)是目前所知雌激素家族生物学活性最强的一种,在很多细胞和器官的正常功能上都发挥着至关重要的作用。雌二醇在体内的代谢方式主要包括氧化的代谢,其中大部分为羟基化,还包括糖脂化、甲基化等。细胞色素P50家族作为主要酶催化还原型辅酶Ⅱ(NADPH)介导的雌激素羟基化为多种代谢产物;其中,数量较多的苯邻二酚雌激素在C2、C4位产生,随后在甲基转移酶(COMT)的介导下代谢为甲基化雌激素,从而形成水溶性的代谢产物,最终通过尿液或排泄物排出体外。
孕激素受体(PR)、早老素2(PS2)、细胞周期蛋白D1(Cyclin D1)等基因均属于雌激素受体下游靶基因;其中,PS2在多种肿瘤中高表达,Cyclin D1也被公认为是一种原癌基因,其过度表达可致细胞增殖失控而恶性化。在多种肿瘤中发现了Cyclin D1基因过表达和基因扩增,包括乳腺癌、膀胱癌、甲状旁腺肿瘤、淋巴瘤、黑色素瘤、肺癌及细胞中心型淋巴瘤等。因此,亟待开发具有拮抗雌激素活性的相关药物用以治疗与雌激素相关疾病。
技术实现要素:
本发明提供2-羟基雌激素在制备用于治疗与雌激素相关疾病的药物中的应用,该药物能够拮抗雌激素活性,从而能够用于治疗与雌激素相关疾病。
本发明提供2-羟基雌激素在制备用于治疗与雌激素相关疾病的药物中的应用,所述2-羟基雌激素为2-羟基雌酮和2-羟基雌二醇中的至少一种。
本发明所述的2-羟基雌酮(2-OH-E1)的结构式如下:
本发明所述的2-羟基雌二醇(2-OH-E2)的结构式如下:
经本发明人大量研究发现,所述2-羟基雌激素具有拮抗雌激素活性的活性;特别是,所述2-羟基雌激素在与雌激素共用时能够降低雌激素活性。
进一步研究发现,所述2-羟基雌激素拮抗雌激素活性是通过拮抗雌激素对雌激素受体-α(ER-α)的激活而实现的。
此外,所述2-羟基雌激素还能够拮抗雌激素相关基因的过表达,例如PR、PS2和Cyclin D1等基因的过表达;特别是,所述雌激素相关基因的过表达是由E2诱导。
进一步地,所述2-羟基雌激素拮抗雌激素活性存在于乳腺癌细胞和子宫内膜细胞。
具体地,所述与雌激素相关疾病为雌激素依赖的良性疾病,所述雌激素依赖的良性疾病为乳腺增生、多囊卵巢综合症、子宫肌瘤、子宫内膜异位症、子痫前期、骨质疏松、更年期综合症、经前期综合征或不孕。
进一步地,所述与雌激素相关疾病为雌激素依赖的恶性疾病,所述雌激素依赖的恶性疾病为乳腺癌、结直肠癌、前列腺癌、子宫癌、子宫内膜癌、卵巢癌或宫颈癌。
此外,所述与雌激素相关疾病还可以为受雌激素调控的基因过表达引起的疾病。其中,所述受雌激素调控的基因包括孕激素受体(progesterone receptor,PR)基因、组织蛋白酶D(Cathepsin D,CD)基因、早老素2(PS2)基因和细胞周期蛋白D1(Cyclin D1)基因中的至少一种。
进一步地,所述与雌激素相关疾病为细胞周期蛋白D1基因过表达引起的良性疾病,所述细胞周期蛋白D1基因过表达引起的良性疾病为乳腺增生、子宫内膜异位症、子宫肌瘤或前列腺增生。
进一步地,所述与雌激素相关疾病为细胞周期蛋白D1基因过表达引起的恶性疾病,所述细胞周期蛋白D1基因过表达引起的恶性疾病为乳腺癌、肺癌、胃癌、宫颈癌、子宫内膜癌、膀胱癌、甲状旁腺肿瘤、淋巴瘤、黑色素瘤、星形细胞瘤或细胞中心型淋巴瘤。
在本发明中,对2-羟基雌激素的具体应用方式不作严格限制。2-羟基雌激素既可以作为单一的主药成分,从而用于治疗与雌激素相关疾病;此外,2-羟基雌激素还可以与其它药物成分(例如雌激素、生长因子等)组成药物组合物,从而用于治疗与雌激素相关疾病。
进一步地,所述药物可以为单位制剂;其中,所述单位制剂为满足一次给药所需有效成分的制剂,如一单位(片)片剂等。
可以理解的是,所述药物还可以包括药学上可接受的辅料,从而使得该药物能够呈现适于给药的形式。对所述辅料无严格限制,本领域技术人员可以根据所述药物的剂型选择适合的辅料。
在本发明的具体方案中,所述药物的剂型可以为口服给药剂型、注射给药剂型或阴道给药剂型。其中,口服给药剂型例如片剂、胶囊剂等;注射给药剂型例如皮下注射剂、静脉注射剂等,特别是皮下缓释注射剂等;阴道给药剂型可以为栓剂等。
进一步研究表明,所述2-羟基雌激素在体外的治疗有效量可以为1nM-100nM。
本发明还提供一种治疗与雌激素相关疾病的方法,包括对患有所述疾病的个体施用所述药物的过程。具体地,施用所述药物的方式可以为口服给药、注射给药、阴道给药等。
本发明的实施,至少具有以下优势:
1、本发明的2-羟基雌激素具有拮抗雌激素活性的活性,因此能够应用于雌激素依赖性疾病的治疗。
2、本发明的2-羟基雌激素能够拮抗E2对ER-α的活化,因此能够应用于与雌激素相关疾病的治疗。
3、本发明的2-羟基雌激素能够拮抗PR、PS2、Cyclin D1等雌激素相关基因的过表达,从而抑制细胞的过度生长,因此能够应用于相关疾病的治疗。
附图说明
图1显示2-OH-E2对ER的活化作用结果;
图2显示2-OH-E2对PR的mRNA表达量的影响;
图3显示2-OH-E2对PS2的mRNA表达量的影响;
图4显示2-OH-E2对Cyclin D1的mRNA表达量的影响;
图5显示2-OH-E2对ER-α的活化作用结果;
图6显示2-OH-E2和E2对ER-α的拮抗作用结果;
图7显示2-OH-E2对MDA-MB-231-ESR1细胞PS2的mRNA表达量的影响;
图8显示2-OH-E2和E2对MDA-MB-231-ESR1细胞PS2的mRNA表达量的影响;
图9显示2-OH-E2对MDA-MB-231-ESR1细胞Cyclin D1的mRNA表达量的影响;
图10显示子宫内膜元代细胞中2-OH-E2对PR的mRNA表达量的影响;
图11显示子宫内膜元代细胞中2-OH-E2对Cyclin D1的mRNA表达量的影响。
图中:*:与空白对照组比较P<0.05;**:与空白对照组比较P<0.01;***:与空白对照组比较P<0.001;#:与E2处理组比较P<0.05;##:与E2处理组比较P<0.01;###:与E2处理组比较P<0.001。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述各实施例中使用的肿瘤细胞、质粒及试剂:
MCF-7人乳腺癌细胞系(简称MCF-7细胞)、MDA-MB-231乳腺癌细胞系来自于ATCC细胞库;
子宫内膜原位细胞:来自安徽医科大学生殖医学中心宫腔镜门诊病人;
2-OH-E2(2-Hydrixy-estrodiol;H3131)、E2(17-β-estrodiol;E2758)、4-OH-TAM(4-OH-Tamoxifen;H6278):均购自Sigma-Aldrich公司,纯度均≥95%。
无酚红DMEM培养基、胎牛血清、活性炭处理胎牛血清(CS-FBS)、青霉素、链霉素、胰蛋白酶-EDTA溶液:均购自美国Invitrogen公司和GIBCO-BRL公司;
磷酸盐缓冲(PBS)粉末、Tris-HCl缓冲盐(TBS)粉末、二甲基亚砜(DMSO):购自Sigma-Aldrich公司;
RNA逆转录试剂盒(Prime Script TM RT reagent Kit);购自日本Takara公司;
荧光定量试剂盒(FastStart Universal SYBR Green Master):购自瑞士Roche公司;
Lipofectamine3000试剂:购自美国Invitrogen公司;
用于检测ER-α转录活性的双荧光素酶报告基因测定试剂盒:购自Promega公司。
下述各实施例的实验分组:
1、空白对照组
以含有DMSO的无酚红DMEM培养液作为空白对照,记作C;
2、2-OH-E2处理组
共四组,各组浓度依次为1nM、10nM、100nM、1μM,并且依次记作2-OH-E2-1、2-OH-E2-2、2-OH-E2-3、2-OH-E2-4;
3、E2处理组
浓度为1nM,记作E2;
4、E2与2-OH-E2联合处理组
共四组,第一组为E2(1nM)+2-OH-E2(1nM),记作E2+2-OH-E2-1;第二组为E2(1nM)+2-OH-E2(10nM),记作E2+2-OH-E2-2;第三组为E2(1nM)+2-OH-E2(100nM),记作E2+2-OH-E2-3;第四组为E2(1nM)+2-OH-E2(1μM),记作E2+2-OH-E2-4;
5、E2与他莫昔芬(TAM,阳性对照药)联合处理组
E2(1nM)+4-OH-TAM(1μM),记作E2+TAM;
6、2-OH-E2与TAM联合处理组
2-OH-E2(100nM)与TAM(1μM),记作2-OH-E2+TAM;
上述各处理组的药物(受试物)采用DMSO溶解后,以无酚红DMEM培养液稀释成所需浓度,作为各处理组在下述各试验中的培养液。
实施例1 2-OH-E2对ER的活化作用
1、构建含有雌激素反应元件(Estrogen Response Element,ERE)的荧光素酶报告质粒
采用常规方法将雌激素反应元件克隆至荧火虫荧光素酶基因(Firefly Luciferase)的上游,构建成含有ERE的荧光素酶报告质粒(pERE3-Luc,上海吉玛制药技术有限公司)。
2、对ER的活化作用
将上述构建的含有ERE的荧光素酶报告质粒与海肾荧光素酶基因(renilla luciferase)质粒(内参质粒pRL-SV40-Luc,作为转录活力的内对照,以提高实验准确性)共转染ER阳性的MCF-7人乳腺癌细胞系,转染后的MCF-7细胞分别在上述含有各处理组受试物的无酚红DMEM培养液(含10%CS-FBS)培养24h后,分别采用双荧光素酶检测系统(Dual Luciferase Assay System,Promega)检测pERE3-Luc和pRL-SV40-Luc荧光素酶活性,取其比值作为荧光素酶的相对活性(relative luciferase activity),用以判定活化ER的强弱,比值越大,则认为受体配体复合物与雌激素反应元件结合越强,即雌激素活性越强。
2、结果
图1显示2-OH-E2对ER的活化作用结果;由图1可知,经浓度为100nM以上的2-OH-E2处理后,ER的活性相对于空白对照组C显著升高(P<0.001),并且明显弱于E2处理组;此外,TAM能够拮抗E2和2-OH-E2对ER的活化作用。
实施例2 2-OH-E2对PR的调节作用
1、提取总RNA
将MCF-7细胞在上述含有各处理组受试物的无酚红DMEM培养液培养24h(受试物处理24h),随后提取各组细胞的总RNA,测定260nm、280nm、320nm处的吸光值,计算浓度。
2、逆转录
调整各组细胞的总RNA浓度至50mg/L,取2μL,使用RNA逆转录试剂盒(Prime Script TM RT reagent Kit,TaKaRa公司)配制20μL的反应体系,将其逆转录为cDNA,37℃15min,4℃forever,-20℃保存。
3、Real-time PCR检测
采用StepOnePlus Real-time PCR系统(Applied Biosystems,USA)
PCR引物:
正向引物:TTATGGTGTCCTTACCTGTGGG(SEQ ID NO.1)
反向引物:GCGGATTTTATCAACGATGCAG(SEQ ID NO.2)
PCR反应体系(20μL):
SYBR Green Master:10μL
正向引物(10μM):0.6μL
反向引物(10μM):0.6μL
cDNA模板(50ng/μL):2μL
RNase Free水:6.8μL
PCR反应条件:
95℃预变性15min;94℃变性15s,60℃退火15s,40个循环。
Real-Time PCR数据分析处理采用ΔΔCt法进行。
4、结果
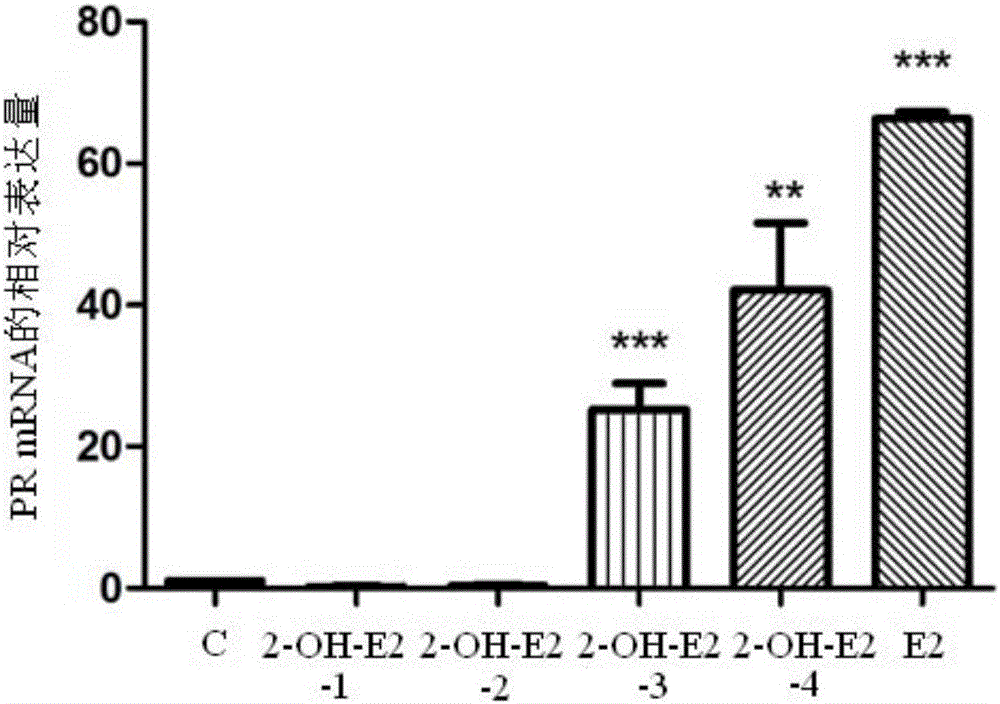
图2显示2-OH-E2对PR的mRNA表达量的影响;由图2可知,经浓度为100nM以上的2-OH-E2处理后,PR的相对表达量(relative mRNA expression of PR)相对于空白对照组C显著升高(P<0.001),并且较低于E2处理组,由此说明2-OH-E2具有弱雌激素的生物学活性。
实施例3 2-OH-E2对PS2的调节作用
1、提取总RNA
将MCF-7细胞在上述含有各处理组受试物的无酚红DMEM培养液培养24h(受试物处理24h),随后提取各组细胞的总RNA,测定260nm、280nm、320nm处的吸光值,计算浓度。
2、逆转录
调整各组细胞的总RNA浓度至50mg/L,取2μL,使用RNA逆转录试剂盒(Prime Script TM RT reagent Kit,TaKaRa公司)配制20μL的反应体系,将其逆转录为cDNA,37℃15min,4℃forever,-20℃保存。
3、Real-time PCR检测
采用StepOnePlus Real-time PCR系统(Applied Biosystems,USA)
PCR引物:
正向引物:CCCCGTGAAAGACAGAATTGT(SEQ ID NO.3)
反向引物:GGTGTCGTCGAAACAGCAG(SEQ ID NO.4)
PCR反应体系(20μL):
SYBR Green Master:10μL
正向引物(10μM):0.6μL
反向引物(10μM):0.6μL
cDNA模板(50ng/μL):2μL
RNase Free水:6.8μL
PCR反应条件:
95℃预变性15min;94℃变性15s,60℃退火15s,40个循环。
Real-Time PCR数据分析处理采用ΔΔCt法进行。
4、结果
图3显示2-OH-E2对PS2的mRNA表达量的影响;由图3可知,经浓度为100nM以上的2-OH-E2处理后,PS2的相对表达量(relative mRNA expression of PS2)相对于空白对照组C显著升高(P<0.001),并且较低于E2处理组,由此说明2-OH-E2具有弱雌激素的生物学活性。
实施例4 2-OH-E2对Cyclin D1的调节作用
1、提取总RNA
将MCF-7细胞在上述含有各处理组受试物的无酚红DMEM培养液(含10%CS-FBS)培养24h(受试物处理24h),随后提取各组细胞的总RNA,测定260nm、280nm、320nm处的吸光值,计算浓度。
2、逆转录
调整各组细胞的总RNA浓度至50mg/L,取2μL,使用Prime Script TM RT reagent Kit(TaKaRa公司)配制20μL的反应体系,将其逆转录为cDNA,37℃15min,4℃forever,-20℃保存。
3、Real-time PCR检测
采用StepOnePlus Real-time PCR系统(Applied Biosystems,USA)
PCR引物:
正向引物:GCTGCGAAGTGGAAACCATC(SEQ ID NO.5)
反向引物:CATGGAGGGCGGATTGGAA(SEQ ID NO.6)
PCR反应体系(20μL):
SYBR Green Master:10μL
正向引物(10μM):0.6μL
反向引物(10μM):0.6μL
cDNA模板(50ng/μL):2μL
RNase Free水:6.8μL
PCR反应条件:
95℃预变性15min;94℃变性15s,60℃退火15s,40个循环。
Real-Time PCR数据分析处理采用ΔΔCt法进行。
4、结果
图4显示2-OH-E2对Cyclin D1的mRNA表达量的影响;由图4可知,经浓度为100nM以上的2-OH-E2处理后,Cyclin D1的相对表达量(relative mRNA expression of Cyclin D1)相对于空白对照组C显著升高(P<0.05),并且较低于E2处理组,由此说明2-OH-E2具有弱雌激素的生物学活性。
实施例5 2-OH-E2对ER-α的活化作用
1、对ER-α的活化作用
采用过表达ER-α的慢病毒(上海吉玛制药技术有限公司),用Lipofectamine3000转染野生型三阴性的乳腺癌MDA-MB-231细胞,得到稳定过表达ER-α的MDA-MB-231-ESR1细胞系,其中ER-α将上述构建的含有雌激素反应元件的荧光素酶报告质粒,与内参质粒pRL-SV40-Luc共转染MDA-MB-231-ESR1细胞。
转染后的MDA-MB-231-ESR1细胞分别在上述含有各处理组受试物的无酚红DMEM培养液培养24h后,分别检测pERE3-Luc和的pRL-SV40-Luc荧光素酶活性,取其比值作为荧光素酶的相对活性(relative luciferase activity),用以判定活化ER-α的强弱。
2、结果
图5显示2-OH-E2对ER-α的活化作用结果;由图5可知,经浓度为10nM以上的2-OH-E2处理后,ER-α的活性相对于空白对照组C显著升高(P<0.01),并且明显弱于E2处理组;此外,TAM能够拮抗2-OH-E2对ER-α的活化作用。
实施例6 2-OH-E2对MDA-MB-231-ESR1雌激素调节基因PS2的调节作用
将MDA-MB-231-ESR1细胞在上述含有各处理组受试物的无酚红DMEM培养液培养24h(受试物处理24h),随后提取各组细胞的总RNA,测定260nm、280nm、320nm处的吸光值,计算浓度;按照实施例3中的方法进行逆转录和PCR检测。
图7显示2-OH-E2对MDA-MB-231-ESR1细胞PS2的mRNA表达量的影响;图8显示2-OH-E2和E2对MDA-MB-231-ESR1细胞PS2的mRNA表达量的影响。
由图7可知,经浓度为100nM以上的2-OH-E2处理后,MDA-MB-231-ESR1细胞PS2的相对表达量相对于空白对照组C显著升高(P<0.01),并且明显低于E2处理组;由图8可知,在2-OH-E2与E2共同作用下,2-OH-E2显示出拮抗雌激素的作用,且在2-OH-E2浓度为100nM时,拮抗作用达到最大。
实施例7 2-OH-E2对MDA-MB-231-ESR1雌激素调节基因Cyclin D1的调节作用
将MDA-MB-231-ESR1细胞在上述含有各处理组受试物的无酚红DMEM培养液培养24h(受试物处理24h),随后提取各组细胞的总RNA,测定260nm、280nm、320nm处的吸光值,计算浓度;按照实施例4中的方法进行逆转录和PCR检测。
图9显示2-OH-E2对MDA-MB-231-ESR1细胞Cyclin D1的mRNA表达量的影响。
由图9可知,经浓度为10nM以上的2-OH-E2处理后,MDA-MB-231-ESR1细胞Cyclin D1的相对表达量相对于空白对照组C显著升高(P<0.01),并且明显低于E2处理组。
实施例8子宫内膜异位症患者体内雌激素代谢产物的检测及分析
人体对性激素的代谢经肝脏一相及二相代谢,在血液中,各代谢产物呈不稳定的游离状态,检测血液中各项代谢产物的指标,极易产生较大误差。尿液中,各项代谢产物为稳定的共轭结合状态,检测尿液中代谢产物的指标,准确度将更高。
本发明人收集了9例临床确诊的子宫内膜异位症患者(来自安徽医科大学生殖医学中心宫腔镜门诊病人)尿液标本,基于GC-MC/MC的原理和技术手段,利用干燥尿液试纸,全面而准确的检测出子宫内膜异位症患者及正常女性体内雌激素代谢产物种类、含量及各产物之间比值,比对分析代谢产物之间表达差异,从而获取子宫内膜异位症患者雌激素代谢组学数据,如表1所示。
表1子宫内膜异位症患者较正常女性雌激素代谢产物分析
由表1的分析结果发现,相较于正常女性,2-OH-E2/E2的比值比正常女性降低明显(P<0.05),并且2-OH-E2/2-甲基雌二醇(2-Methoxy-E2)的比值也显著降低(P<0.001)。
由此说明,子宫内膜异位症患者体内雌激素2位羟基化产物2-羟基雌二醇的相对含量减低,而2-羟基雌二醇具有弱雌激素活性及拮抗雌激素的作用,以上患者体内雌激素代谢在C-2位代谢降低,这些改变进一步导致子宫内膜异位症患者体内整体雌激素活性较正常女性升高,从而促进了子宫内膜异位症疾病的发生和进展。
实施例9 2-OH-E2对于子宫内膜细胞的作用
本发明人收集并培养了数例子宫内膜原位细胞,经过2-OH-E2及E2处理后,Real-time PCR检测各雌激素调节基因表达变化(参见实施例2-4方法)。
子宫内膜元代细胞培养方法:将挑取的子宫内膜组织在无菌生理盐水中反复涮洗去除血污,剪成1mm3(肉眼成糊状)左右的小块,置于无菌离心管中,加入2-3ml复合消化酶(0.25%胰蛋白酶/0.1%EDTA、0.1%胶原酶),充分混匀后置37℃恒温静置消化约30分钟。加入含20%胎牛血清的DMEM/F12培养液终止消化,离心400r/min,7分钟。弃上清,加入约1ml左右培养液,用巴氏吸管吹打成细胞悬液,接种于盛有含20%胎牛血清的DMEM/F12培养液的25cm2无菌培养瓶中,置37℃、5%CO2的培养箱中培养。每1-2天观察细胞生长情况。
图10和图11结果显示,2-OH-E2在子宫内膜细胞中与E2共同作用,能够拮抗E2诱导的PR、Cyclin D1基因的过表达(与E2处理组相比,P<0.05),证明2-OH-E2在子宫内膜细胞中依然具有拮抗雌激素的作用。
从以上实验结果可以看出,2-OH-E2在雌激素依赖的子宫内膜元代细胞中能够拮抗E2的作用,降低E2诱导的PR及Cyclin D1的过表达。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!