一种具有肝脏保护功效的组分及其在非酒精性脂肪肝防治中的应用的制作方法
本发明涉及一种具有保护肝脏的黑枸杞提取物,及其在非酒精性脂肪肝的抑制方面的应用,属于生物医药和食品领域。
背景技术:
随着人们生活水平的不断提高和劳动方式的转变,脂肪肝已成为一种常见代谢疾病。脂肪肝是指由于各种原因引起的肝细胞内脂肪堆积过多的病变,并伴随多种并发症,如糖尿病、心血管疾病、激素紊乱和某些类型的肿瘤等。脂肪性肝病正严重威胁国人的健康,脂肪生成是造成非酒精性脂肪肝重要原因。脂肪生成的促进或者抑制对于个体生理机能都有着十分重大的影响。而药物对人体有不同程度的副作用,因此,从天然食物源中寻找能够有效降低非酒精性脂肪肝的功能性成分已经成为非酒精性脂肪肝预防与治疗研究领域的热点。
黑果枸杞(Lycium Ruthenicum Murr.)是我国西北特有的抗盐抗旱野生植物种。分布于新疆、西藏、青海、甘肃、宁夏、陕西北部,中亚、高加索和欧洲。黑果枸杞味甜多汁,含丰富的维生素、有机酸及糖类,民间常生食或榨汁做饮料;黑果枸杞也具有一定的医疗保健功能,其味甘、性平、清心热,藏医用于治疗心热病、心脏病、月经不调、停经等病症。
黑枸杞主要是纯天然保健品,其中含有苦丁皂甙、氨基酸、维生素C、多酚类、黄酮类、咖啡碱、蛋白质等200多种成分,具有降压、抑癌防癌、抗衰老、活血脉等多种功效,素有“植物软黄金”的美称。近十年来,对黑枸杞生理活性的研究表明其具有显著的抗氧化、增强心血管功能等生理活性。实验研究表明黑枸杞对于高血压病有较好的疗效等,研究也表明黑枸杞在降血糖、提高免疫和抗衰老抗疲劳方面和体外脂质的抗氧化都有一定的疗效。
对于消费者来说,可广泛得到来自不同产地、不同种属或加工方式的各种食品,但这些物质对于肝脏脂肪累积作用的效果以及潜在的机制尚不清楚。在实践中,通常利用不同食品、医药产品处理脂肪细胞和/或动物和/或人,然后检测其对肝脏细胞脂滴积累和/或动物非酒精性脂肪肝的作用及机理,从而确证不同食品、医药产品对非酒精性脂肪肝抑制的生理效应。
本发明旨在提供一种基于纯天然植物的具有保护肝脏的食品或医药产品,检测其在非酒精性脂肪肝的抑制方面的作用,评估该食品或医药产品对肝脏保护的作用效果。
技术实现要素:
鉴于上述目的,本发明采用传统的黑枸杞为原料,通过醇提法提取其活性组分。通过检测和评估该组分在抑制非酒精性脂肪肝方面的效果和应用机制,发掘该组分在防治非酒精性脂肪肝和保护肝脏方面的应用,既进一步扩充了黑枸杞对人体健康保护作用,促进了活性植物资源的开发利用,又可实现传统药食两用资源的高值转化。
本发明的技术方案如下所述:
本发明提供一种具有肝脏保护功效的组分,该组分是天然食物黑枸杞的提取物。
所述具有保护肝功效的黑枸杞提取物的制备方法为:称取黑枸杞,以1:1-1:20的料液比,用体积分数为50-70%的乙醇进行浸提,浸提温度30-100℃,浸提时间大于15分钟,过滤后取滤液,浸提1-5次,合并所有滤液进行低温真空浓缩至凝膏状,移除几乎全部的乙醇和水分后,获得黑枸杞的提取物。
在使用该黑枸杞的提取物时,可用水稀释为提取物的水溶液,每克黑枸杞的提取物加1.5-2.0毫升的水进行稀释。
本发明还提供上述具有肝脏保护功效的组分的应用,该组分是天然食物黑枸杞的提取物,所述黑枸杞的提取物可用于制备具有肝脏保护功效的食品、医药产品中,服用或食用所述提取物制备的产品,可以明显抑制非酒精性脂肪肝进程,降低并发代谢疾病的发生。
食用所述具有肝脏保护功效的产品时,所述提取物的效果是多种有效成分共同起作用而不是单一物质的作用。
所述具有护肝功效的黑枸杞提取物的制备方法为:称取黑枸杞,以1:1-1:20的料液比,用体积分数为50-70%的乙醇进行浸提,浸提温度30-100℃,浸提时间大于15分钟,过滤后取滤液,浸提1-5次后,合并所有滤液进行低温真空浓缩至凝膏状,待移除几乎全部的乙醇和水分后,获得该黑枸杞的提取物。
在使用该黑枸杞的提取物时,可用水稀释为提取物的水溶液,每克黑枸杞的提取物加1.5-2.0毫升的水进行稀释。
所述具有保护肝脏功效的提取物对非酒精性脂肪肝抑制效果的评估方法是:采用高脂饲料喂食小鼠8周,构建非酒精性脂肪肝模型。将所述提取物灌注喂食高脂的小鼠4周,实验过程中监测小鼠体重和饮食变化,实验结束后检测小鼠血清中血脂以及肝功能的变化,肝脏组织的病理学改变和肝细胞的脂滴累积情况,以及PPARγ、MAPK信号通路变化情况中的至少一种,来评估所述提取物料对小鼠非酒精性脂肪肝的影响,以确定所述提取物能否抑制非酒精性脂肪肝的发生。
当检测结果为小鼠肝脏内脂肪变得到缓解以及肝脏细胞脂滴积累抑制时,则所述提取物有益于非酒精性脂肪肝的抑制;当检测结果为小鼠肝脏内脂肪变和肝脏细胞脂滴积累不被抑制时,则所述提取物对非酒精性脂肪肝的抑制无益或有害。
所述小鼠为C57BL/6或/和APOE-/-雄鼠。
所述肝脏组织的病理学改变情况通过石蜡包埋H&E染色显微镜拍照、观察。
所述肝脏细胞脂滴积累情况可以通过油红O染色显微镜观察、拍照。
每周检测小鼠的体重和进食量,实验结束,取小鼠血液,分离血清进行血脂、肝功能指标测定。
所述PPARγ、MAPK信号通路变化情况是指PPARγ和p38蛋白质活性、基因表达变化情况,通过Western Blot和/或Q-PCR方法来检测。
在本发明的实施方式中,将所述提取物灌胃高脂饲养的小鼠,检测小鼠实验过程中的体重和进食量,实验后测定肝体比和脂体比,通过小鼠体重和进食量、肝体比和脂体比等来评估食品和/或营养补充剂对小鼠脂肪代谢作用。
在本发明的一种实施方式中,将所述提取物灌注高脂饲养的小鼠,实验结束取小鼠血液,分离血清进行血脂、肝功能指标测定。以评估所述食品对于小鼠血脂和肝功能的作用效果,是否对高脂喂养的小鼠肝脏损伤具有一定的抑制作用。
在本发明的一种实施方式中,将所述提取物灌喂高脂饲养的小鼠,实验结束后解剖小鼠,取肝脏组织制作石蜡/冷冻切片,观察肝脏病理变化和肝脏细胞的脂肪滴积累情况,以评估黑枸杞对于非酒精性脂肪肝的病理改变的作用和肝脏细胞的脂肪累积的影响。
在本发明的一种实施方式中,将所述提取物灌喂高脂饲养的小鼠,实验结束后取小鼠肝脏组织,通过实时定量基因扩增荧光检测系统(QPCR)和/或免疫印迹技术(Western Blot)检测PPARγ和/或MAPK信号通路的活性变化来评估食品和/或营养补充剂对小鼠肝脏细胞脂肪生成和炎症相关信号通路的作用,以检测所述食品对非酒精性脂肪肝的作用机制。
非酒精性脂肪肝是以肝脏细胞脂肪过度贮积和脂肪变性为特征的临床综合征。非酒精性脂肪肝严重时几乎所有的肝细胞均发生脂肪变,伴有肝脏肿大,可有轻度压痛及肝功能异常。非酒精性脂肪肝严重后也会引起肝功能异常。谷草转氨酶(AST),又名天门冬氨酸氨基转移酶,是转氨酶中比较重要的一种。它是医学临床上肝功能检查的指标,用来判断肝脏是否受到损害。当肝脏发生严重坏死或破坏时,才能引起谷草转氨酶在血清中浓度会偏高。非酒精性非酒精性脂肪肝的病理改变以大泡性或以大泡性为主的肝细胞脂肪变性为特征。根据肝内脂肪变性的程度分为:单纯性脂肪性肝病、脂肪性肝炎、脂肪性肝硬化。
本发明中,通过对实验鼠血清肝功能检测,肝脏组织外观以及肝组织病理切片观察,非酒精性脂肪肝相关基因和蛋白等分子水平的检测,评估黑枸杞的提取物成分对肝脏保护功效及其在非酒精性脂肪肝防治中的应用。
在本发明中,正常组肝脏呈鲜红色,有光泽,质地柔软。模型组小鼠肝脏肉眼可见肝脏均匀肿大,呈谈黄色,包膜紧张,边缘较钝,质地略软,触之油腻感。经药物和黑枸杞处理的小鼠肝脏肉眼观察几乎接近正常,肝脏边缘较薄,未见肿胀和包膜紧张,质地柔软。关于肝功能的检测发现,黑枸杞提取物能够显著降低高脂饮食导致的血清AST的升高,提示肝脏损伤的程度降低。
本发明中,关于小鼠肝脏H&E染色和油红染色的观察中,我们发现,黑枸杞明显能够抑制高脂进食导致的小鼠肝脏组织脂肪变性和脂肪空泡的数目,未见炎性细胞的浸润和肝细胞坏死,油红染色进一步证实肝脏细胞中脂滴的累积缓解,黑枸杞一定程度上能够延缓非酒精性脂肪肝的进程。
p38丝裂原活化蛋白激酶(MAPK)信号通路和炎性反应有着密切关系,致炎细胞因子肿瘤坏死因子TNF-α在非酒精性脂肪肝的形成过程中也起着重要作用。p38MAPK可以调节TNF-α等致炎因子等抗炎因子的生成,影响生物体内致炎与抗炎因素的平衡。
本发明中,在基因水平上的探索发现,黑枸杞的提取物可以下调P38蛋白的激活和肝脏组织中TNF-αmRNA的转录水平,降低肝脏中炎性信号通路的活性,同时有利于脂酶活性增加和胰岛素抵抗缓解,改善肝细胞内脂类积聚和脂肪变性的状况。
本发明原料黑枸杞为我国传统的野生植物资源,来源广泛,成本低廉,本发明关于黑枸杞的提取物对于小鼠高脂诱导的非酒精性脂肪肝的作用的探索,对药食两用资源的开发具有重要意义,而且实现了活性植物资源的高值转化,促进了农产品的精深加工利用。通过评估其对非酒精性脂肪肝的抑制功效,发现黑枸杞提取物可用于非酒精性非酒精性脂肪肝的防治,对预防或治疗非酒精性非酒精性脂肪肝的活性成分的开发利用具有指导意义。所述具有保护肝脏功效的组分,可广泛应用于食品及医药等领域,具有显著的社会效益和经济效益。
附图说明
图1给枸杞提取物制备的工艺流程
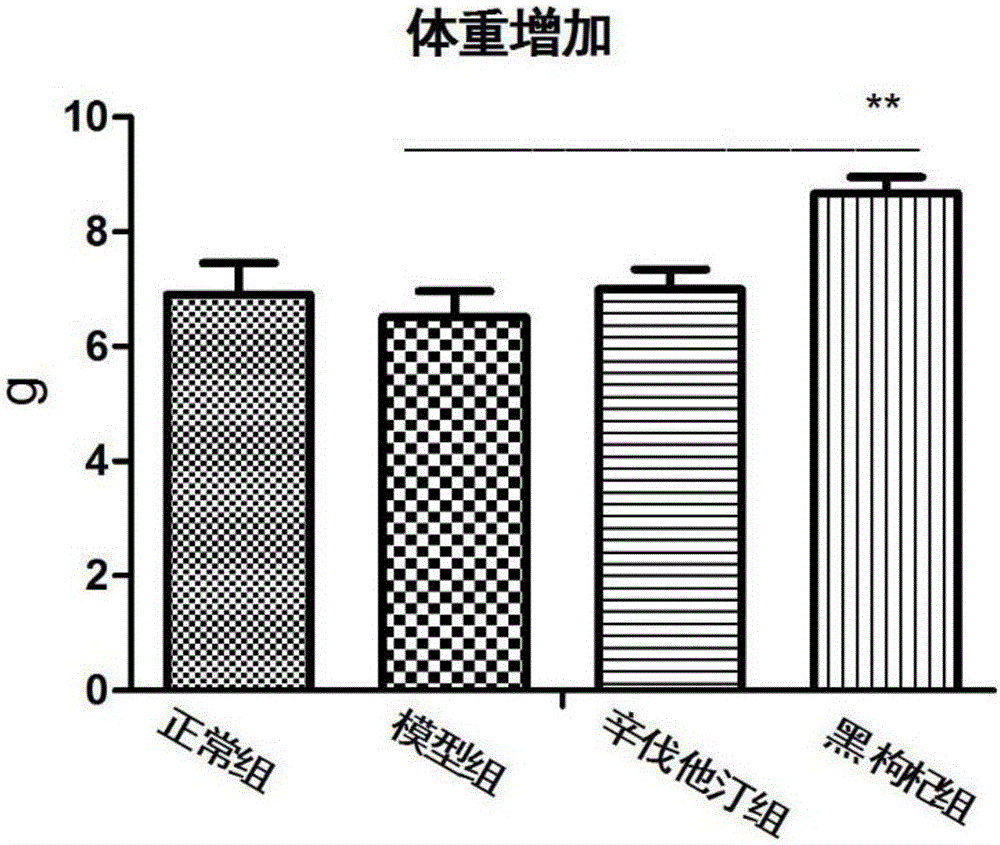
图2黑枸杞提取物对小鼠体重增长的影响
图3黑枸杞提取物对小鼠进食量的影响
图4黑枸杞提取物对小鼠肝脏组织形态的影响
图5黑枸杞提取物对小鼠肝体比的影响
图6黑枸杞提取物对小鼠脂体比的影响
图7黑枸杞提取物对小鼠总胆固醇的影响
图8黑枸杞提取物对小鼠低密度脂蛋白的影响
图9黑枸杞提取物对小鼠高密度脂蛋白的影响
图10黑枸杞提取物对小鼠甘油三酯的影响
图11黑枸杞提取物对小鼠谷草转氨酶的影响
图12黑枸杞提取物对小鼠谷丙转氨酶的影响
图13黑枸杞提取物对小鼠碱性磷酸酶的影响
图14黑枸杞提取物处理后,肝脏H&E染色细胞形态的影响
图15黑枸杞提取物处理后,肝脏油红染色细胞脂滴积累的影响
图16黑枸杞提取物处理后,肝脏细胞中PPARγmRNA的表达情况
图17黑枸杞提取物处理后,肝脏细胞中SREBP mRNA的表达情况
图18黑枸杞提取物处理后,肝脏细胞中FAS mRNA的表达情况
图19黑枸杞提取物处理后,肝脏细胞中TNF-αmRNA的表达情况
图20黑枸杞提取物处理后,肝脏细胞中PPARγ、FAS、P38的蛋白表达情况
具体实施方式
下面结合实施例来具体说明本发明。
实施例1一种具有肝脏保护功能的提取物,主要原料为天然食物源黑枸杞。
制备方法为:称取黑枸杞,以1:1-1:20的料液比,用体积分数为50-70%的乙醇进行浸提,浸提温度30-100℃,浸提时间大于15分钟,过滤后取滤液,浸提1-5次,合并所有滤液进行低温真空浓缩至凝膏状,移除全部的乙醇和几乎全部的水分,然用水稀释为提取物的水溶液,每克黑枸杞的提取物加1.5-2.0毫升的水进行稀释。
图1是黑枸杞提取物制备的工艺流程,对上述制备方法进行了概括。
在下述实施例2-10中使用的黑枸杞提取物的工艺条件为:称取黑枸杞20g,用体积分数为70%的乙醇400ml进行浸提,浸提温度60℃,浸提时间30分钟,过滤后取滤液,重复3次,合并所有滤液进行低温真空浓缩至凝膏状,移除全部的乙醇和几乎全部的水分,然用水稀释为提取物的水溶液。每克黑枸杞的提取物加水1.5毫升,加水30ml充分溶解后得到黑枸杞的提取物水溶液,水溶液颜色为紫红色,色泽鲜艳。以芦丁为对照物,紫外分光光度法测定提取物类黄酮浓度。
实施例2黑枸杞提取物对小鼠体重和进食量的作用效果
6-8周龄的雄性小鼠,随机分成4组:正常对照组、模型对照组、黑枸杞组、辛伐他汀组。每组10只小鼠。除空白对照组喂食普通饲料外,其他3组均喂食高脂营养饲料,黑枸杞组和辛伐他汀组分别在高脂饲料同时灌胃浓缩的黑枸杞提取物和辛伐他汀的水溶液,测量小鼠的体重和饮食。
小鼠体重、进食量测量方法:用电子天平进行监测,计算差值。
图2是黑枸杞提取物喂食小鼠后,小鼠体重增长的变化比较。图3是黑枸杞提取物喂食后,小鼠进食量的变化。由图2和图3的结果可以看出,保证同样的能量摄入的情况下,高脂进食量较普通进食量小。在同样的高脂进食量的情况下,黑枸杞处理组的小鼠的体重较模型组显著增加。
实施例3黑枸杞对小鼠肝脏形态和肝体比以及脂体比的作用效果
肥胖与脂肪肝有着密切的关系,有报道肝内轻度脂肪浸润可见于约半数的肥胖患者,在重度肥胖者中脂肪肝的发病率可达61%~94%。肝内脂肪的堆积与体重的超标程度呈正相关。肥胖患者的体形特点对脂肪肝的形成也有一定的影响。本发明通过对肝重、附睾脂肪重和体重的称量计算肝体比和脂体比进行验证,并对小鼠组织形态拍照。
图4是黑枸杞处理小鼠后组织的形态,可以看出,体重变化以及与肝脏病变相以及肝脏颜色变化并不一致。黑枸杞处理后小鼠的肝脏边缘较薄,没有发生模型组类似的肿胀现象。肝脏颜色较为正常,肝脏表面没有油腻感。图5是黑枸杞处理小鼠后肝体比的变化。图6黑枸杞处理小鼠后脂体比的变化。由图5和图6可以看出,虽然黑枸杞处理的小鼠的体重较模型组增加,但是相应的肝体比和脂体比并没有发生明显的变化。
实施例4黑枸杞对小鼠血脂指标的作用效果
图7是黑枸杞水提物处理小鼠后的总胆固醇(CHOL)水平的变化。图8是黑枸杞水提物处理小鼠后,低密度脂蛋白(LDL)水平的变化。图9是黑枸杞水提物处理小鼠后,高密度脂蛋白(HDL)水平的变化。图10是黑枸杞水提物处理小鼠后,血清血脂(TG)水平的变化。黑枸杞水提物作用后,小鼠总胆固醇含量稍微增加,而高、低密度脂蛋白水平没有受到影响,甘油三酯的水平较模型组下降,但是没有显著性差异。
实施例5黑枸杞对小鼠肝功能的作用效果
本发明从小鼠血清肝功能指标进行验证黑枸杞提取物对于小鼠肝脏的作用效果。
谷草转氨酶(AST)是医学临床上肝功能检查的指标,用来判断肝脏是否受到损害。肝细胞病变时,AST释放入血,故血清AST活性随肝细胞损害的程度增高。谷丙转氨酶(ALT)主要存在于肝脏、心脏和骨骼肌中,当肝细胞或某些组织损伤或坏死,都会使血液中的谷丙转氨酶升高。碱性磷酸酶(ALP)主要用于阻塞性黄疸、原发性肝癌、继发性肝癌、胆汁淤积性肝炎等的检查。患这些疾病时,肝细胞过度制造ALP,经淋巴道和肝窦进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清碱性磷酸酶明显升高。图11-13分别是黑枸杞处理小鼠后,血清谷草转氨酶、谷丙转氨酶和碱性磷酸酶水平的变化。在黑枸杞处理组谷草转氨酶的含量降低,提示肝脏损伤的程度降低/得到恢复。而谷草转氨酶和碱性磷酸酶则没有发生显著的变化。
实施例6黑枸杞对肝脏病理改变的作用
本发明采用石蜡切片后H&E染色的方法对黑枸杞处理后小鼠肝脏病理学改变进行验证。图14黑枸杞处理后,肝脏H&E染色细胞形态的改变。高脂诱导后,小鼠肝脏细胞体积变大,伴有脂肪空泡的出现,大部分细胞出现水泡样变性和脂肪变性,以中小型空泡为主,同时伴有炎性细胞的浸润,黑枸杞处理后小鼠肝脏细胞的水泡样变和脂肪变性的程度明显减轻,脂肪空泡的数目明显减少,呈现少数气球样肝细胞。因而黑枸杞提取物能够延缓高脂小鼠诱导的非酒精性脂肪肝的进程,减轻肝脏脂肪病变的轻度。
实施例8黑枸杞对肝脏细胞脂滴积累的作用
本发明采用冰冻切片后油红染色的方法对黑枸杞处理后小鼠肝脏脂肪滴的积累情况进行验证。图15黑枸杞处理后,肝脏油红染色细胞脂滴积累的改变。可以看见黑枸杞处理后的小鼠肝脏细胞中的脂肪滴数目明显少于模型组小鼠,黑枸杞体提取物的处理可以减少肝脏中脂肪的累积,其肝脏细胞中脂肪滴的数目和体积明显小于模型组小鼠。
实施例9黑枸杞对脂肪生成和炎性相关基因mRNA水平的作用
本发明采用QPCR的方法对PPARγ、FAS、SREBP-1c等与脂肪生成相关和炎性因子TNF-α的基因表达进行验证。
图16是黑枸杞作用细胞后的PPARγ基因水平的变化。图17是黑枸杞作用细胞后,SREBP-1c基因水平的变化,图18是黑枸杞作用细胞后,FAS基因水平的变化。图19是黑枸杞作用后炎性因子TNF-α基因水平的变化。由图16、图17、图18和图19可以看出,黑枸杞处理后,PPARγ、FAS的转录水平均未发生明显的改变,但是与脂肪生成相关的PPARλ的变化趋势与血清甘油三酯的含量变化具有一致性。介导胆固醇生成相关的SREBP-1c的表达量下降。炎性因子TNF-α的表达量显著降低,表明黑枸杞处理后对小鼠肝脏细胞中脂肪生成相关的基因的表达的影响较小,并能够抑制炎性因子TNF-α基因的表达。
实施例10黑枸杞对肝脏中脂肪生成相关基因蛋白质表达水平的作用效果
本发明采用western blotting的方法对MAPK和PPARγ信号通路进行验证。
图20是黑枸杞作用细胞后的MAPK磷酸化和PPARγ表达水平的变化。由图可看出,黑枸杞处理后,p38的磷酸化水平增加,FAS的表达量上升,PPARγ的表达没有发生显著性的变化,表明黑枸杞可以上调p-p38抑制肝细胞炎性反应的发生,同时上调FAS的合成促进TG的生成。
结果表明黑枸杞可以抑制高脂进食的小鼠肝脏细胞中脂滴的积累,降低肝脏细胞空泡化的产生,降低肝脏细胞水泡样变和脂肪变的发生,缓解非酒精性脂肪肝的进程,有一定的护肝作用。在基因表达水平上探索发现,黑枸杞对脂肪生成相关基因PPARγ、FAS基因的表达的影响较小,在信号转导水平上探索发现,黑枸杞通过下调p-p38蛋白的表达和下调TNF-αmRNA的转录水平,降低肝脏细胞中炎性信号通路的活性,抑制炎性反应,同时黑枸杞处理后AST的含量降低,表明肝脏损伤减轻。本发明提供一种具有护肝功能的黑枸杞提取物,并评估其非酒精性脂肪肝的抑制效果,从而给药食两用资源的开发提供理论依据。然而,黑枸杞处理的小鼠的体重有一定程度的增加,这可能与FAS在蛋白水平的表达的增加有关,同时,黑枸杞处理后,血清中总胆固醇的含量增加,其中的更深层次的机制还需要进一步的验证和探讨。而黑枸杞对其他并发症的作用,还需要进一步被验证。
石蜡切片H&E染色的步骤如下:
1、固定 组织样品用生理盐水洗一下,立即投入中性多聚甲醛固定液中固定。
2、洗涤 流水冲洗或浸泡数小时或过夜(控制好固定时间,一般不需要洗涤)。
3、脱水 样品依次经70%、80%、90%各级乙醇溶液脱水,各30min,再放入95%、100%各2次,每次20min。
4、透明 1/2纯酒精+1/2二甲苯混合液15min、二甲苯Ⅰ15min、Ⅱ15min(至透明为止)。
5、浸蜡 将样品放入石蜡Ⅰ、石蜡Ⅱ透蜡各1h。
6、包埋 以最大的面在底层,使切出的面组织面所占最大;另外,注意包埋方向,夹样品时要注意不要太用力,切片是也要尽量避开被夹的部分。
7、切片
9.展片、贴片
10.脱蜡复水 将烘箱温度调至60℃,并控制在60℃时,将切片连同切片架放入30min至蜡熔化。之后,石蜡切片经二甲苯Ⅰ、Ⅱ脱蜡各5min,然后放入100%、95%、90%、80%、70%各级酒精溶液中各3-5min,再放入蒸馏水中3min。
11.染色 切片放入苏木精中染色约7s。
12.水洗 用自来水流水冲洗约15min。
13.分化 将切片放入1%盐酸乙醇液中褪色,约2秒至数十秒钟。
14.漂洗 切片再放入自来水流水中使其恢复蓝色。
15.脱水Ⅰ 切片入50%乙醇→70%乙醇→80%乙醇中各3-5min。
16、复染 用0.5%伊红乙醇液对比染色1-3min。
17.脱水Ⅱ 将切片放入95%乙醇中洗去多余的红色,然后放入无水乙醇中3-5min。最后用吸水纸吸干多余的乙醇。
18.透明 切片放入二甲苯Ⅰ、Ⅱ中各3-5min。
19.封藏:中性树胶封存
冰冻切片油红染色步骤如下:
1 取新鲜组织于4%多聚甲醛固定24小时
2 -25度包埋(冰冻切片机内)
3 冰冻切片
4、油红O染色10分钟。
5、蒸馏水洗30分钟;
6、甘油明胶封片
实时定量基因扩增荧光检测(QPCR)实验如下:
(一)RNA的提取:
1.仪器、材料与试剂:
(1)仪器:冷冻离心机、紫外分光光度计;制冰机、恒温水浴锅
(2)材料:eppendorf管、枪头、eppendorf管架、冰盒;移液枪
(3)试剂:Trizol;氯仿、异丙醇、DEPC水;75%乙醇
2.具体步骤如下:
(1)加1ml TRizol(预冷)试剂,然后转移至1.5ml离心管中,室温静置10min;
(2)加入200μl(或1/5体积)的氯仿,用力颠倒离心管混合30s,室温静置5min,分层。4℃12000rpm离心15min。离心管中液体分为3层:上层为水相,RNA在此相中,蛋白质在下层黄色的有机相中,DNA保留在上下两层的界面处的中间层中;
(3)小心吸取上层水相约0.4ml于新的塑料离心管中(切勿吸取中间层和下层液体)。加入1倍体积的4℃预冷的异丙醇,室温放置20min(或-20℃静置30min以上);
(4)4℃12000rpm离心15min,沉淀RNA,弃上清;
(5)用1ml预冷的75%乙醇(DEPC水配制)洗涤沉淀,12000rpm 4℃离心10min,弃尽上清;
(6)重复步骤5,然后室温中自然干燥约10min,至RNA呈半透明状即可;
(7)根据RNA提取量加20-100μl DEPC处理的水溶解沉淀,56℃水浴10min,立即置于冰上,得到所提取的RNA溶液;
(8)RNA纯度、浓度测定及分子完整性的鉴定:测定样品260nm/280nm光吸收比值。(二)反转录合成cDNA:
1.仪器、材料与试剂:
(1)仪器:PCR热循环仪、离心机
(2)材料:PCR管、枪头;移液枪
(3)试剂:反转录试剂盒
2.具体步骤如下:
(1)在PCR管中加20μl反应体系:反转录试剂盒中的①号试剂4μl,模板RNA2μg,②号试剂补充到20μl;
(2)离心后,37℃30min,85℃10s;
(3)测定cDNA浓度,并用无菌水稀释成50ng/μl,-20℃保存。
(三)PCR:
(1)在灭菌ep管中配制20μl反应体系:mix 10μl,ddH2O 6μl,上、下游引物各1μl,cDNA2μl;
(2)离心,混匀,离心,加入96孔板,设3个复孔;
(3)PCR扩增反应条件为:
1)95℃预变性 5min
2)95℃变性 15s
3)62℃退火 30s
4)65℃延伸 5s
5)重复步骤(2)-(4) 39次
6)95℃延伸 5min
免疫杂交(Western blotting)实验如下:
1.溶液配制:
(1)10%(w/v)十二烷基硫酸钠SDS溶液:0.1gSDS,1mlH2O去离子水配制,室温保存。
(2)分离胶缓冲液:1.5mol/LTris-HCL(pH8.8):18.15gTris用80ml水溶解,用HCL调节pH到8.8,加水稀释到100ml终体积。
(3)浓缩胶缓冲液:0.5mol/LTris-HCL(pH6.8):6.05gTris溶于80ml水中,用HCL调至pH6.8,加水稀释到100ml终体积。
(4)SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris缓冲液8ml,甘油6.4ml,10%SDS 12.8ml,巯基乙醇3.2ml,0.05%溴酚蓝1.6ml,H2O 32ml混匀备用。
(5)Tris-甘氨酸电泳缓冲液:30.3gTris,188g甘氨酸,10gSDS,用蒸馏水溶解至1000ml,临用前稀释10倍。
(6)转膜缓冲液:称取14.4g甘氨酸、6.04gTris碱,并加入200ml甲醇,加水至总量1L。
(7)Tris缓冲盐溶液(TBS):20mmol/LTris/HCL(pH7.5),500mmol/LNaCl。
2.具体步骤如下:
加入裂解液,超声破碎,冰上冷却后,12000rpm离心2min,取上清,-20保存备用。
(一)SDS-PAGE凝胶电泳
(1)清洗后的玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上准备灌胶。
(2)配10%分离胶,加入TEMED后立即摇匀即可灌胶,随即用乙醇液封,胶充分凝固就可倒去胶上层乙醇并用吸水纸吸干。
(3)配4%的浓缩胶,加入TEMED后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。待到浓缩胶凝固后,竖直向上轻轻将其拔出。
(5)将其放入电泳槽中,加足够的电泳液后开始准备上样。蛋白质样品测完蛋白含量后,加入5×SDS上样缓冲液至终浓度为1×,在沸水中煮5min混匀后上样,总蛋白量50μg。
(6)恒压80V电泳跑胶,当样品进入下层胶后恒压120V电泳直至溴酚蓝达到凝胶底部为止,进行转膜。
(二)转膜:
(1)切胶:将玻璃板撬掉,除去小玻璃板后,将浓缩胶刮去,根据实验需要按照蛋白的分子量,以Marker为对照进行切胶。
(2)备膜:裁剪PVDF膜和滤纸,将切好的PVDF置于甲醇溶液中激活30s。
(3)装膜:将转膜用的夹子打开使黑的一面(负极)保持水平。在上面垫一张海绵垫,加入转膜液浸湿,在垫子上垫上中浸泡好的滤纸,随后按照凝胶—硝酸纤维素膜—滤纸—海绵垫的顺序依次叠放。最后将白色板(正极)盖好装入转膜槽中。
(4)转膜:将夹子放入转移槽槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面。4℃转膜,恒流400mA。
(5)转完后将膜取下,标记一角。
(三)免疫反应
(1)封闭:将膜用TBST中漂洗3次,每次5min。漂洗后将硝酸纤维素膜放入5%脱脂奶粉中,室温下摇床1h。
(2)加一抗:将封闭后的硝酸纤维素膜放入含有TBST的洗缸中摇床上漂洗3次,每次5min。放入加有一抗的平皿中4℃过夜孵育。
(3)加二抗:回收一抗,将硝酸纤维素膜在TBST洗缸中室温摇床漂洗3次,每次5min,然后将漂洗过的硝酸纤维素膜放入加有二抗的平皿中,避光室温孵育1h。孵育后将硝酸纤维素膜在TBST洗缸中洗3次,每次5min。
(四)化学发光
(1)将A和B两种试剂在小离心管里按照发光试剂盒说明书操作将其混合,加到硝酸纤维素膜上,用化学发光成像仪显色。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!