一种稳定的胰岛素解聚体超分子复合物及其制备方法与流程
本发明属于医药领域,具体涉及一种胰岛素解聚体环糊精超分子复合物及其制备方法。
背景技术:
近年来,由于生活水平的提高、饮食结构的改变、日趋紧张的生活节奏以及少动多坐的生活方式等诸多因素,全球糖尿病发病率增长迅速,糖尿病已经成为继肿瘤、心血管病变之后第三大严重威胁人类健康的慢性疾病。目前全球糖尿病患者已超过1.2亿人,我国患者人群居世界第二,1994年就已达2000万。据世界卫生组织预计,到2025年,全球成人糖尿病患者人数将增至3亿,而中国糖尿病患者人数将达到4000万,未来50年内糖尿病仍将是中国一个严重的公共卫生问题。因此,糖尿病的治疗已引起世界各国高度重视。
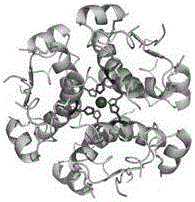
胰岛素是哺乳动物的消化腺体——胰脏中的内分泌细胞β-胰岛细胞产生的唯一能降血糖的激素。胰岛素的主要作用是调节糖代谢,控制血糖平衡。胰岛素是在1921年由Frederick Banting和John Macleod首次成功提取,随后成功地应用于糖尿病的临床治疗。自发现以来,已经有两个领域的三个诺贝尔奖与它有关。时至今日,胰岛素依然是治疗糖尿病的最有效的药物。胰岛素的分子量为5807.69,在水、乙醇、氯仿或乙醚中几乎不溶;在稀盐酸和稀氢氧化钠溶液中易溶。等电点为5.35-5.45。在强酸、强碱性溶液中易被破坏。胰岛素分子由A、B两条肽链组成,人胰岛素的A链有11种21个氨基酸,B链有15种30个氨基酸,共16种51个氨基酸组成。其中A7(Cys)-B7(Cys)、A20(Cys)-B19(Cys)四个半胱氨酸中的巯基形成两个二硫键,使A、B两链连接起来。此外A链中A6(Cys)与A11(Cys)之间也存在一个二硫键(如图1所示)。
胰岛素最有效的给药途径是注射给药。胰岛素具有自我缔合的特性,能随着浓度的增加,形成二聚体、四聚体、六聚体及更高状态的聚集体,当存在Zn2+离子时,它主要以含二个Zn2+离子的六聚体形式存在如图2。但胰岛素必须以单体的形式与其专一受体结合,然后发挥生物学功能。临床上使用的胰岛素制剂是以六聚体的形式存在,这和胰岛素的自我缔合特性以及单体的不稳定性有关,这使得其临床应用变得复杂并且具有一些副作用。胰岛素这种六聚体的制剂皮下注射吸收后才慢慢解聚成单体,约120min血中才出现胰岛素高峰,并且此峰值一直保持到180-240min,造成病人一些时间内外周血中胰岛素浓度过低而出现高血糖症状,随后又因外周血胰岛素浓度过高而表现为低血糖。另外科研工作者也一直致力于研制非注射剂型的胰岛素制剂。但胰岛素这种六聚体分子量大,更难以通过胃肠道粘膜被吸收。另外,胰岛素在肠胃内易于被胃酸及消化酶所降解,不能直接口服,目前最主要的给药方式是饭前注射。国内己有开发出粘膜吸收胰岛素制剂的报道,但其中的胰岛素仍主要以六聚体形式存在,其生物利用度仍有待提高。因此,研究开发具有生物活性并能以单体形式稳定存在的胰岛素具有重要的意义。
目前,有促使胰岛素的缔合程度降低乃至得到单体的方法。定点基因突变和化学修饰是两种较常使用的方法,已有一些很好的报导。国际上已有用基因突变方法制备的单体胰岛素上市。比如:1996年礼来公司的Lispro Insulin[(LysB28,Pro B29),Humalog],丹麦诺和诺德公司的诺和锐(NovoRapid,aspart insulin)。但采用化学修饰和基因工程手段制备的单体胰岛素周期长、价格昂贵等因素。尤其对于胰岛素这样一个含有3对二硫键的蛋白质。由于构象变化,在用点突变的方法基因工程表达筛选新的单体速效胰岛素的过程中必须摸索很多的实验条件,致使周期延长。而且所得到的这些胰岛素类似物都改变了原有的组成,使其应用得到了限制。
由于胰岛素六聚体需要有一定比例的Zn2+存在才能稳定,如果利用一种合适的配体与Zn2+配位,将可能得到胰岛素单体。这方面的文献也有报道,目前一般选取卜琳(陈益超等人)或者EDTA做为配位剂,但是这种强的配位剂的安全性还有待研究。另外螯合以后得到的单体胰岛素是不稳定的。因此,寻找安全的配位剂,并通过弱相互作用来稳定胰岛素解聚体是急需解决的问题之一。
技术实现要素:
本发明的目的是在于提供一种稳定的胰岛素解聚体超分子复合物及其制备方法,所述复合物中单体胰岛素含量比较高,具有速效胰岛素的功效。其中六聚体的胰岛素在合适的配体与Zn2+配位后,解聚成单体或二聚体,然后用环糊精材料超分子包合,阻止胰岛素分子之间的疏水作用力,防止胰岛素分子之间的聚合,得到比较稳定的胰岛素解聚体,其中胰岛素单体含量明显增加。含有该单体结构的胰岛素的药物组合物还可以用于注射以外的给药途径。
为了实现上述目的,本发明采用的技术方案为:
一种胰岛素解聚体超分子复合物,该复合物的质量比组成为,
胰岛素 1份
有机酸 10-20份
环糊精 30-60份。
所述复合物为冻干粉末。
所述有机酸为柠檬酸、水杨酸等安全的有机酸。
所述环糊精选自β-环糊精、羟丙基-β-环糊精或者磺丁基-β-环糊精等中的至少一种。
该复合物的质量比组成优选为,胰岛素1份,有机酸10份,环糊精30份,有机酸优选为柠檬酸。
本发明提供了胰岛素解聚体的制备方法,通过加入一定比例的Zn2+的配合物——有机酸(例如柠檬酸),使六聚体的胰岛素解聚成单体或者二聚体。
胰岛素1份,有机酸10-20份,采用如下方法:
(1)胰岛素水溶液:将注射用水添加至胰岛素中,逐滴滴加盐酸(每滴体积约为1/20毫升),使pH为3-5,然后搅拌溶解;
(2)有机酸胰岛素水溶液:将有机酸慢慢添加到胰岛素的水溶液中使其溶解并过夜,得到胰岛素解聚体溶液。
所述有机酸的滴加速度为1~3毫升/分钟,优选为2毫升/分钟。
本发明提供制备胰岛素解聚体环糊精超分子复合物的制备方法,该方法包括以下步骤:
(1)在制备好的胰岛素解聚体溶液中,慢慢添加环糊精,使胰岛素:环糊精的质量比为1:30-60;
(2)在不超过37℃的温度下对上述制得的溶液进行多次间隔超声,接着按照冻干曲线操作,冷冻干燥成白色粉末。
所述间隔多次超声,每次超声20分钟,间隔30分钟,超声2-5次,优选超声3次。
本发明的胰岛素解聚体和超分子复合物的制备是关键技术。其中解聚步骤中有机酸的选择是关键,其次是滴加速度。超分子复合物的制备的关键技术为3次超声、每次超声20分钟、间隔30分钟。与市售的速效胰岛素相比,没有改变胰岛素的原有组成,其安全性和病人依从性将更好。本发明建立了一种制备单体率增加的速效胰岛素的方法,且具有安全无毒,技术路线简单、产物回收率高和制备成本低廉等优点。
以下说明本发明技术特点:
胰岛素单体含量增多:胰岛素通常以六聚体的形式稳定存在,二锌胰岛素六聚体由三个等价的二聚体组成,它的稳定在很大程度上依赖位于六聚体三重轴上的二个Zn2+,而我们把Zn2+去掉以后,六聚体的胰岛素开始解聚成二聚体或者单体,而二聚体主要是靠疏水作用力维持的,这说明了两单体在形成二聚体时,单体一单体之间能形成较强的疏水性相互作用。而环糊精包合以后,能够减弱分子之间的疏水作用力,胰岛素的单体含量增多。从透膜实验,我们可以看出解聚后分子量大大降低,基本上能全部透过3万的膜,透过1万的膜的比例也大大增加。见表1.
包合性能好:胰岛素是蛋白大分子药物,在276nm有明显的吸收峰。加入无紫外吸收的环糊精后,药物吸光度随着环糊精浓度的增加呈规律性增加,表明环糊精与胰岛素存在明显的包合作用。但用环糊精包合普通胰岛素,包合常数偏低,但与胰岛素的解聚体包合常数明显增加,如表2。
试验表明,胰岛素解聚体有较高的包合常数,更易形成稳定的包合物,这对提高其稳定性,改善药剂学性质十分有利。
稳定性好:一般情况下,单体胰岛素是不稳定的,在酸性介质中,胰岛素容易发生脱氨基反应导致失活。脱氨基发生在A链的21号天冬酰胺残基上(Asn 21)。这就使得它们非常不稳定。在碱性环境中(pH>9),胰岛素会分解成单体并发生结构变化而失活。在胃肠道蛋白酶的作用下,胰岛素很快就降解成氨基酸。实验中也发现胰岛素解聚体的稳定性没有普通胰岛素好,但用环糊精包合后,稳定性得到改善,甚至比普通胰岛素还要略稳定。(见表3,4,5,6和图3,4,5,6)
起效作用快:通常胰岛素是以六聚体的形式存在,但在体内起作用的是单体胰岛素,所以在体内存在一个慢慢解聚的过程,这样起效作用慢,而一般速效胰岛素,以单体含量高,起效迅速。从我们实验结果显示,空白对照组大鼠的血糖发生波动,但是其变化范围始终不超过初始血糖水平的5%,而且血糖在实验初期有所升高,有可能取血的过程对动物引起的应激反应。在60分钟以后,对照组的血糖水平趋于平稳。标准组动物的血糖在30分钟也已经开始下降,血糖值是原来的67.6%,而胰岛素解聚体的处理组,在30分钟血糖值下降的比较快,是注射前的41.2%。胰岛素解聚体环糊精超分子包合物处理组为38.2%。而且我们从图7也可以明显的看出解聚后的处理组比对照组血糖值下降的快,这说明解聚后的胰岛素起效快。这一结果也证实了我们这个胰岛素解聚体中单体胰岛素的量确实增加了。因此该复合物具有速效胰岛素的性能。
细胞内转运高:蛋白质大分子药物不能非注射给药的一个很大的原因就是因为分子量大,很难透过生物膜。我们选用Caco-2细胞作为模型,发现胰岛素解聚体的超分子复合物透过细胞膜的能力大大增强,见图8。单体胰岛素增多,分子量降低,有利于透膜。另一方面,大量文献报道环糊精能增加大分子蛋白类药物的生物转运,提高生物利用度。因此含有该单体结构的胰岛素的环糊精超分子复合物还可以用于注射给药的原料药。
有益效果:本发明与现有技术相比,具有如下优势:
1、制备的胰岛素解聚体超分子复合物中单体胰岛素含量高,具有速效胰岛素的功能;
2、用环糊精超分子包合后,胰岛素解聚体的稳定性大大提高;
3、该胰岛素聚合体超分子复合物的冻干粉末,应用范围广,既可以用于胰岛素的注射粉针,也可以做为非注射胰岛素的原料药;
4、制备方法简单、操作简便、成本低且安全无毒。
附图说明
图1:胰岛素的一级结构;
图2:胰岛素的六聚体;
图3:酸性溶液中解聚后胰岛素的残留随时间的变化曲线;
图4:碱性溶液中解聚后胰岛素的残留随时间的变化曲线;
图5:α-糜蛋白酶处理后胰岛素的残留随时间的变化曲线;
图6:胰蛋白酶处理后胰岛素的残留随时间的变化曲线;
图7:各组处理的降血糖的能力;
图8:穿透Caco-2细胞单分子层的胰岛素的量。
具体实施方式
实施例1胰岛素解聚体超分子复合物的制备
称取胰岛素300mg(白色粉末,纯度99%,提供单位徐州万邦生物技术有限公司),加注射用水10ml,振荡呈混悬液。缓慢滴加0.1mol/L的盐酸,边加边磁力搅拌,直至混悬液全部溶解,测定pH值大约在4左右。
称取柠檬酸3g(提供单位:北京化学试剂公司,含量99%),慢慢加入上面溶液中,定容到200ml。在4℃过夜(冻干的粉末称为胰岛素解聚体)。
称取羟丙基-β-环糊精9g,慢慢加入上述溶液中,在不超过37℃的温度下对上述制得的溶液3次超声、每次超声20分钟,间隔30分钟。然后真空冷冻干燥,得到约12.5g白色粉末。
实施例2
称取胰岛素300mg(白色粉末,纯度99%,提供单位徐州万邦生物技术有限公司),加注射用水10ml,振荡呈混悬液。缓慢滴加0.1mol/L的盐酸,边加边磁力搅拌,直至混悬液全部溶解,测定pH值大约在4左右。
称取水杨酸1.5g(提供单位:北京化学试剂公司,含量99%),慢慢加入上面溶液中,定容到200ml。在4℃过夜。
称取羟丙基-β-环糊精9g,慢慢加入上述溶液中,在不超过37℃的温度下对上述制得的溶液3次超声、每次超声20分钟,间隔30分钟。然后真空冷冻干燥,得到约11.0g白色粉末。
实施例3
称取胰岛素300mg(白色粉末,纯度99%,提供单位徐州万邦生物技术有限公司),加注射用水10ml,振荡呈混悬液。缓慢滴加0.1mol/L的盐酸,边加边磁力搅拌,直至混悬液全部溶解,测定pH值大约在4左右。
称取柠檬酸3g(提供单位:北京化学试剂公司,含量99%),慢慢加入上面溶液中,定容到200ml。在4℃过夜。
称取磺丁基-β-环糊精6g,慢慢加入上述溶液中,在不超过37℃的温度下对上述制得的溶液3次超声、每次超声20分钟,间隔30分钟。然后真空冷冻干燥,得到约9.5g白色粉末。
实施例4透膜实验
购买的赛多利斯的超滤膜包(分子量分别为1万和3万的两种),把上述制备的溶液超滤,同时拿买来的普通胰岛素(购买自徐州万邦生物技术有限公司,下同)做对照,发现透膜率如表1。这结果说明通过分子量为1万的膜时,胰岛素解聚体为35.6%,胰岛素解聚体/环糊精的复合物(实施例1的方法制备)36.8%,按实施例2和实施例3的方法制备的复合物分别为16.2%和36.3%。而普通的胰岛素却不能透过。透过3万的膜时发现,胰岛素解聚体和胰岛素解聚体/环糊精的复合物均能全部透过,但普通胰岛素还是不能透过。这说明,胰岛素解聚体中六聚体已经解开成单体或者二聚体了,且实施例1制备的复合物中透过率最高,以下实验中的复合物均为按实施例1的方法制备。
实施例5表观包合常数测定
测定了pH6.86混合磷酸盐缓冲液体系下普通胰岛素、胰岛素解聚体与HP-β-CD的表观包合常数。具体步骤如下:配制胰岛素饱和溶液,因为中性条件下胰岛素溶解度比较低,直接把它作为稀溶液。用此稀溶液配制环糊精的浓溶液。取胰岛素稀溶液紫外扫描得胰岛素分子在276nm附近的最大吸收(吸收值A0),改变环糊精浓度,当体系中存在高浓度的环糊精时,胰岛素的紫外吸收随环糊精浓度的增加而明显增强,根据环糊精浓度和胰岛素吸光度的变化,可测得表观包合常数Ka(见表2)。
实施例6酸碱稳定性试验
分别用pH1的盐酸,pH13的NaOH配制胰岛素和胰岛素/HP-β-CD包合物(按实施例1方法制备)溶液,最终获得胰岛素浓度为0.1mg/mL的溶液。HCl组和NaOH组分别置于37℃水浴中保温,分别在0h,4h,8h,12h和16小时取样。用液相色谱法测定胰岛素的含量。
实施例7蛋白酶稳定性试验
把胰岛素用0.05mol/L的磷酸缓冲液(pH 7.0)溶解,加入少量稀盐酸助溶。用Tris-HCl缓冲液(pH 8.0)配制α-胰糜蛋白酶(5mg/mL)和胰蛋白酶(12mg/mL)。使胰岛素终浓度为0.5mg/mL,在37℃下保温15分钟。在加入酶溶液消化之前,取各组样品,分别加入50μl冰冷的0.5%的四氟乙酸,把这些样品作为0小时。把α-胰糜蛋白酶和胰蛋白酶分别加入各组胰岛素溶液,使两种酶的终浓度分别为8mg/L和600mg/L。将各组溶液在37℃下保温。于15,30,45和60分钟时取样,加入50μl冰冷的0.5%的四氟乙酸终止酶解。分别用高效液相色谱检测。其中的胰岛素/HP-β-CD包合物按实施例1方法制备。
实施例8动物降糖实验
正常大鼠实验前正常饲养,即每日三次(8、12、18时分别进食)、定量进食,自由饮水。在实验前一晚上小鼠禁止喂食。将动物分成三组,空白组皮下注射生理盐水溶液,一组注射胰岛素对照品,另外一组注射胰岛素解聚体及其超分子包合物(按实施例1方法制备)。从给药开始每30分钟取血,葡萄糖氧化酶法测定血糖浓度,绘制时间一血糖百分率曲线图。
实施例9胰岛素转运实验
将胰岛素解聚体包合物(按实施例1方法制备)用pH 7.2的Hank's平衡盐溶液(HBSS)稀释至15IU/ml溶液,将同浓度的普通胰岛素溶液作为对照。细胞接种在12孔Transwell(1.12cm2,0.4μm),密度为2×105个/ml,加在顶端和基底端的培养基分别为0.5、1.5ml,培养细胞约21d,达到融合分化。试验前用HBSS洗去黏附在细胞表面的代谢物,取荧光素钠渗透量不超过4.8μg/(h·cm2),同时TEER值在500Ω/cm2左右的Transwell;在膜上方的Apical侧室(简称A侧)分别加入15IU/ml胰岛素、包合物溶液,在膜下方的Basolateral侧室(简称B侧)加入1.5ml HBSS,置于37℃转速为50r/min的空气摇床孵育,分别于30、60、90、120、150min从BL池取样0.5ml,并立即补加等量的HBSS;用HPLC法测定样品中胰岛素含量。每组重复3次。以胰岛素渗透量(单位为IU)对时间(t)作图,可得胰岛素的渗透曲线。
表1.体外透膜率的检测
表2:胰岛素的表观包合常数Ka(276nm,15±5℃)
表3.酸处理后解聚后胰岛素的残留量(%)
表4碱处理后胰岛素的残留量(%)
表5.糜蛋白酶处理后胰岛素的量(%)
表6.胰蛋白酶处理后胰岛素的量(%)
表7:注射以后小鼠血液的葡萄糖浓度(mmol/L)
- 还没有人留言评论。精彩留言会获得点赞!