过氧化物酶体增殖剂激活受体α对肉毒碱棕榈酰基转移酶1C的直接调控作用及抗肿瘤应用的制作方法
本发明属于医药技术领域,具体地,涉及一种过氧化物酶体增殖剂激活受体α(PPARα)对肉毒碱棕榈酰基转移酶1C(CPT1C)的直接调控作用在抗肿瘤中的应用。
背景技术:
肉毒碱棕榈酰基转移酶1C(CPT1C)是一种催化脂肪酸进行β-氧化初始阶段的线粒体转移酶,它在体内的能量代谢,食物摄取,脂肪酸氧化功能等多方面发挥重要作用。近年来的新发现表明,CPT1C作为一个肿瘤细胞老化的新型调控因子,为肿瘤的诊断和治疗提供了一个基于线粒体功能异常和细胞老化的潜在新靶点。
而过氧化物酶体增殖剂激活受体α(PPARα)是一种配体激活型转录因子,与人体内的脂肪酸氧化相关基因的表达与氧化过程的进程密切相关。近年来相关PPARα与人类肿瘤发生发展关系的研究日益增多,某些PPARα特异性配体被证明有抗肿瘤活性。但是关于PPARα是如何在抗肿瘤的过程中发挥作用的,还有待进一步研究。
在现阶段的研究中,有关PPARα和人类肿瘤的发生发展的关系尚未阐明,有报道显示抑制PPARα的表达会导致肾癌细胞周期被阻止,促进了细胞的凋亡;PPARα激动剂对胃癌细胞的增殖呈现剂量依赖效应。然而无论是通过分子生物学手段下调PPARα的表达或是使用其特异性抑制剂,都会使得肿瘤细胞的生长增殖受到抑制,并且诱导肿瘤细胞的衰老。那么究竟抑制PPARα是通过什么因子,如何产生的抗肿瘤效应有待我们进一步探索。
技术实现要素:
本发明所要解决的技术问题是克服现有过氧化物酶体增殖剂激活受体α(PPARα)及肉毒碱棕榈酰基转移酶1C(CPT1C)在抗肿瘤应用中的缺陷和不足,提供PPARα对CPT1C的直接调控作用在抗肿瘤中的应用。
本发明的上述目的是用过以下技术方案给予实现的:
本发明利用一系列分子生物学实验工具,经过大量的研究和探索,证明了PPARα对CPT1C的表达有着直接的调控作用,即PPARα可以通过直接结合在CPT1C的启动子区域激活其转录翻译过程。
因此,以下应用在本发明的保护范围之内:
过氧化物酶体增殖剂激活受体α在调控肉毒碱棕榈酰基转移酶1C的表达方面的应用。
过氧化物酶体增殖剂激活受体α在制备肉毒碱棕榈酰基转移酶1C的表达调控制剂方面的应用。
具体地,上述调控是指正调控。
另外,本发明进一步利用BrdU细胞增殖实验、β-gal细胞衰老实验、肿瘤细胞集落形成实验等,证明了抑制PPARα的抗肿瘤细胞增殖及诱导肿瘤细胞老化作用是通过其对CPT1C的直接调控作用完成的。
综上所述,结果表明抑制PPARα能通过其对CPT1C的调控作用起到抑制肿瘤细胞增殖,诱导肿瘤细胞老化的作用,为临床的抗肿瘤新靶点以及药物研究提供了新的启示,方法和手段。
因此,以下应用也在本发明的保护范围之内:
过氧化物酶体增殖剂激活受体α或过氧化物酶体增殖剂激活受体α抑制剂在制备抗肿瘤药物中的应用。
肉毒碱棕榈酰基转移酶1C或肉毒碱棕榈酰基转移酶1C抑制剂在制备抗肿瘤药物中的应用。
过氧化物酶体增殖剂激活受体α抑制剂和肉毒碱棕榈酰基转移酶1C抑制剂联用在制备抗肿瘤药物中的应用。
其中,优选地,所述肿瘤为人乳腺癌或人胰腺癌。
更优选地,所述人乳腺癌为人乳腺癌细胞株MDA-MB-231。
更优选地,所述人胰腺癌为人胰腺癌细胞株PANC-1。
本发明与现有技术相比,具有如下有益效果:
(1)本发明首次发现过氧化物酶体增殖剂激活受体α(PPARα)可以在mRNA和蛋白水平调控肉毒碱棕榈酰基转移酶1C(CPT1C)的表达量,可以通过结合在CPT1C的启动子区域上直接激活其转录和翻译;
(2)抑制PPARα进而诱导肉毒碱棕榈酰基转移酶1C(CPT1C)的表达可以抑制肿瘤细胞的增殖能力,诱导肿瘤细胞的衰老。
附图说明
图1为过氧化物酶体增殖剂激活受体α(PPARα)可以在mRNA和蛋白水平调控肉毒碱棕榈酰基转移酶1C(CPT1C)的表达量;
图2为过氧化物酶体增殖剂激活受体α(PPARα)可以通过结合在肉毒碱棕榈酰基转移酶1C(CPT1C)的启动子区域上直接激活其转录和翻译;
图3为抑制过氧化物酶体增殖剂激活受体α(PPARα)表达可以抑制肿瘤细胞的增殖能力;
图4为抑制过氧化物酶体增殖剂激活受体α(PPARα)表达可以诱导肿瘤细胞的衰老;A~B为肿瘤细胞的集落能力,A中左图为siControl,右图为siRNA PPARα;B中左图为pGST,右图为pGST-PPARα;C~D为细胞β-gal活性,C为siControl,D为siRNA PPARα。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1
1、实验材料
(1)实验细胞:人乳腺癌细胞株MDA-MB-231,人胰腺癌细胞株PANC-1由广州赛库生物技术有限公司进行细胞株品系鉴定。
(2)药品和试剂:Pgst-PPARα表达质粒(addgene),siRNA PPARα(广州锐博生物技术有限公司),染色质-免疫共沉淀ChIP试剂盒(Thermo),BrdU细胞增殖试剂盒(罗氏),β-gal细胞衰老染色试剂盒(碧云天),Trizol试剂、RT-PCR试剂盒、RT-qPCR试剂盒(Takara公司);引物(上海Invitrogen 公司);RIPA裂解液(上海博彩生物科技有限公司);BCA蛋白浓度测定试剂盒(美国Thermo公司);PPARα一抗,CPT1C一抗,Ki67一抗、GAPDH一抗(abcam)和兔二抗( Cell Signaling Technology 公司);ECL发光液(北京英格恩生物科技公司)。
实验仪器:5417-R低温高速离心机(德国Eppendorf公司);多功能酶标仪(美国Molecular device);梯度PCR仪(德国Eppendorf公司);7500 Real Time PCR System(美国Applied Biosystems公司),荧光倒置显微镜,双荧光报告基因检测系统,DNA-琼脂糖凝胶电泳系统。
2、实验方法
(1)细胞的培养与转染:用含有10%胎牛血清的DMEM高糖培养基培养两株肿瘤细胞,进行传代。用lipo2000转染试剂转染siRNA PPARα或Pgst-PPARα表达质粒构建低表达或者高表达PPARα的细胞株。
(2)按照Trizol试剂的说明书从培养细胞中得到总RNA;其次,按照RT-PCR试剂盒说明书得到cDNA;再按照RT-qPCR试剂盒说明书检测PPARα,CPT1C的mRNA表达量。提取细胞总蛋白,western-blot检测PPARα,CPT1C的蛋白表达量。
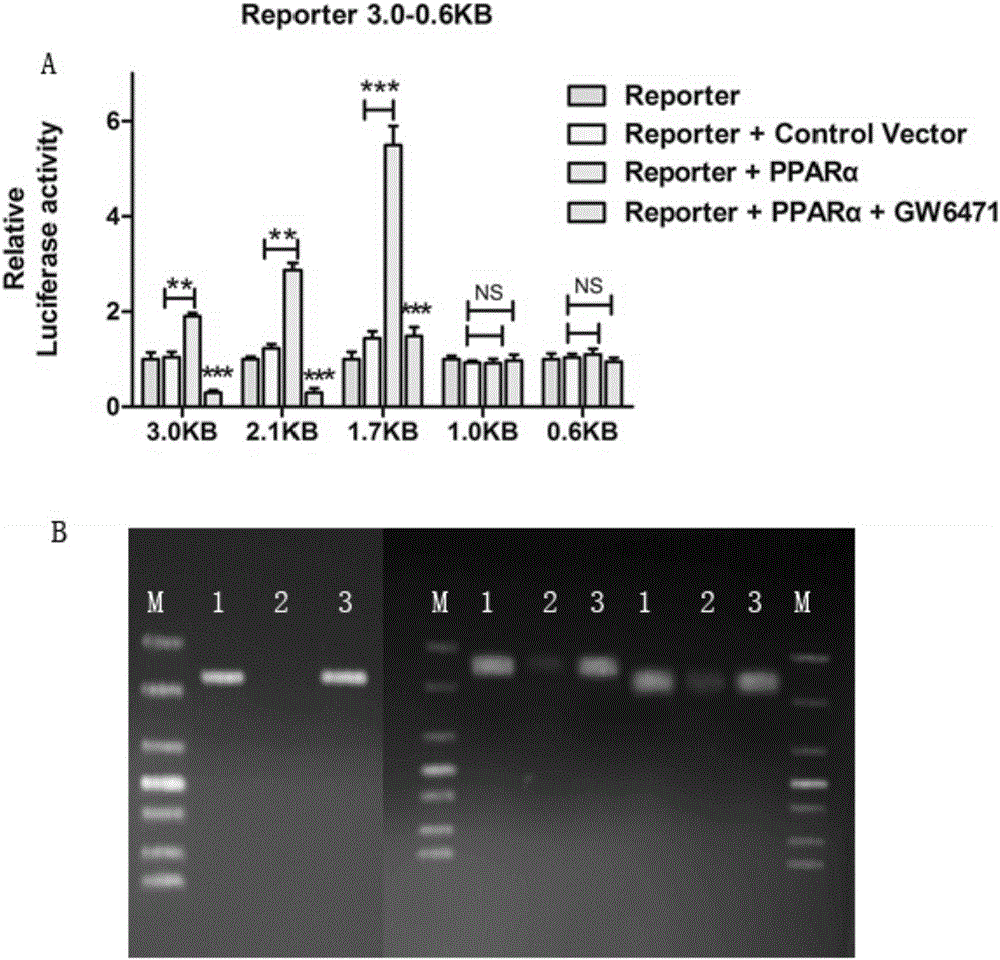
(3)构建CPT1C不同长度启动子区域报告质粒进行双荧光素酶报告基因实验检测PPARα对CPT1C是否有直接调控作用,并用染色质-免疫共沉淀实验进行进一步确证。
(4)BrdU细胞增值实验和细胞周期实验证明PPARα的表达对肿瘤细胞的增殖能力的影响。
(5)细胞集落形成实验和β-gal染色实验证明PPARα对肿瘤细胞的衰老进程的影响。
(6)抑制PPARα进而抑制CPT1C的表达对肿瘤细胞增殖能力和肿瘤细胞的衰老进程的影响。
3、数据统计
实验数据均以mean±S.E.M.表示,采用Graphpad Prism 5软件进行统计分析。采用unpaired Student’s t test进行两组间比较,P<0.05被认为有显著性差异。
4、实验结果
(1)PPARα在mRNA和蛋白水平调控CPT1C的表达
如图1所示,在上调或下调PPARα表达后,检测CPT1C在mRNA和蛋白水平的表达量,均会和PPARα表达呈现一致趋势。
其中,图A-D为上调或下调PPARα表达后,CPT1C mRNA水平的变化。图E-H为为上调或下调PPARα表达后,CPT1C 蛋白水平的变化。(siRNA PPARα为小RNA干扰其表达,PGST-PPARα为其过表达质粒,WY14643和GW6471 为特异性的PPARα诱导剂和抑制剂)
(2)PPARα直接调控CPT1C的转录活性
如图2所示,PPARα可以激活不同长度CPT1C启动子区域的报告质粒的荧光活性,说明PPARα对CPT1C有着转录水平的直接调控作用,即CPT1C是PPARα的下游靶基因之一。染色质免疫共沉淀实验再次验证了这一结果。
(3)抑制PPARα的表达抑制肿瘤细胞的增殖能力
如图3所示,BrdU细胞增殖实验说明,下调PPARα表达后,肿瘤细胞的增殖能力降低,其细胞周期被阻滞。说明抑制PPARα的表达抑制肿瘤细胞的增殖能力。
(4)抑制PPARα的表达有道肿瘤细胞衰老
如图4所示,抑制PPARα表达后,肿瘤细胞的集落形成能力降低,β-gal活性升高,衰老分泌表型因子的表达升高。说明下调PPARα可以诱导肿瘤细胞的衰老。
- 还没有人留言评论。精彩留言会获得点赞!