一种竹柳皮抗炎活性提取物的制备方法和应用与流程
本发明涉及一种竹柳皮抗炎活性提取物的制备方法和应用,该提取物分离自竹柳皮乙酸乙酯部位,具有抗炎镇痛活性,属于天然产物有效成分的提取、分离纯化领域。
背景技术:
竹柳(Salix ssp.)又称美国竹柳,为杨柳科(Saliaceae)柳属(Salix)植物,是美国寒柳、朝鲜柳和筐柳杂交的优良品系(王子成,2008),其在继承传统柳属植物众多的优良品性的同时表现出生长快、材质好、抗性强等优点(张健等,2009),是常用的速生用材林树种和生物质能源树种(徐克顺,2011)。
近年来,竹柳种植面积在我国迅速扩大,据统计,其成片林已超过1300hm2(胡国涛等,2016),竹柳的储备量丰富,但目前竹柳的产业化尚不成熟,鲜有深加工产品和高附加值产品。而同属柳树作为药用的历史悠久,明代《本草纲目》中就记载“柳为本经下品,其性苦寒、无毒,可治疗风水黄疽,疮痈肿痛,痰热淋疾,湿痹等疾症”,且其各部分都可入药,可谓“全身都是宝”。现代有关柳属植物的化学和药理活性的研究表明,其化学成分包括黄酮类、酚苷类、苯丙素类、醌类、甾体类、萜类、有机酸类等,具有抗炎、止痛、抗氧化、抗菌、抗诱变、降压、利尿等药理作用(刘墨祥等,1997;封士兰等,2001;赵红娟等,2010;毛竹君等,2013)。故作为同属的竹柳,虽然目前与其化学成分和生物活性方面相关的研究鲜有报道。但已有研究表明竹柳表现出与同属植物相似的生物活性,有巨大的潜力可开发成高附加值的药品。
CN105237594A公开了一种从竹柳皮中提取水杨苷的制备方法,该方法是:将竹柳树皮粉碎后,采用连续微波干燥法,制得竹柳树皮粉,用无离子水超声逆流提取后得提取液,提取液经纯化、浓缩、干燥后获得水杨苷。该发明中仅就竹柳中的水杨苷进行了提取,而未对竹柳中其他有效成分进行提取研究。且现有技术中也未有将柳或竹柳乙酸乙酯提取物用于银屑病治疗的相关报道。
技术实现要素:
本发明的目的是针对现有的竹柳化学成分、生物活性等相关研究的不足以及以竹柳为原料开发的医药产品的空白,提供一种从竹柳皮中提取抗炎镇痛活性组分的方法,即,竹柳皮抗炎活性提取物的制备方法,并研究了该活性组分在医药产品领域中的应用。
为了实现上述目标,
本发明的第一个方面在于提供一种竹柳皮抗炎活性提取物的制备方法,其特征是,将竹柳皮粉末,用5至20倍乙醇超声提取1~5次,每次30-120min,得提取液;将提取液减压浓缩至无乙醇残留,加入蒸馏水溶解,用乙酸乙酯萃取,经两次纯化后既得。
具体步骤如下:
A)提取:竹柳皮粉末,粒度10~40目,按照料液比1:5~1:20加入乙醇溶液,超声提取条件为,频率9~18KHz,温度20~50℃,时间30~120min,超声次数1~5次,获得提取液;提取液减压浓缩至无乙醇残留,加入适量蒸馏水溶解,用1~3倍量乙酸乙酯萃取1~3次,萃取液减压浓缩,真空干燥(600~1000Pa,40~50℃,120~180min);得到粗提物粉末;
B)VLC(减压硅胶柱层析)纯化:100~300目硅胶湿法装柱,径高比1:5,步骤A)所得粉末干法上样,以石油醚为洗脱剂,除去乙酸乙酯萃取物中的低极性杂质;以石油醚和乙酸乙酯体积比为2:8的混合液为洗脱剂,洗脱液减压浓缩至一定体积,真空干燥(600~1000Pa,40~50℃,120~180min),得到初次纯化的竹柳皮抗炎活性提取物粉末;
C)Sephadex LH-20纯化:凝胶柱径高比1:18,步骤B)所得粉末用少量氯仿-甲醇混合液溶解,湿法上样,以氯仿-甲醇(1:1)为洗脱剂,流速为0.3~0.5BV·h-1,等度洗脱,HPLC检测合并,得到除去色素的具有抗炎镇痛活性的竹柳皮活性提取物溶液;
D)干燥及保存:步骤C)的溶液减压浓缩至一定体积,真空干燥(600~1000Pa,40~50℃,120~180min),经消毒、杀菌后,得竹柳皮抗炎活性提取物粉末。
优选的,所述步骤A)中乙醇溶液的体积分数为70%,原料粒度为24目,料液比为1:10,超声频率18KHz,超声温度30℃,超声时间60min,超声次数3次。萃取剂(乙酸乙酯)的用量与溶解提取物所用蒸馏水的用量相同,萃取3次,于800Pa,45℃条件下真空干燥150min;
优选的,所述步骤B)中硅胶粒度为200~300目;以石油醚为洗脱剂洗脱2BV,除去低极性杂质;以体积比为2:8的石油醚和乙酸乙酯混合液为洗脱剂洗脱3BV,合并洗脱液,于40℃条件下减压浓缩,于800Pa,45℃条件下真空干燥120min;
优选的,所述步骤C)的湿法上样样品浓度为50mg/mL,流速为0.4BV·h-1,洗脱3BV,收集2h后的洗脱液;HPLC检测的色谱条件为0-20min,20-45%甲醇水,20-70min,45-80%甲醇水,70-80min,80-100%甲醇水,80-90min,100%甲醇,流速为1ml/min,检测波长为220nm,柱温:25℃,YMC-pack ODS A色谱柱(250×4.6mm,5μm);
优选的,所述步骤D)真空干燥条件为1000Pa,40℃,120min;所述的消毒、灭菌包括辐射灭菌、水蒸气灭菌、热空气灭菌、80%乙醇溶液中的一种或几种组合。
本发明研究发现竹柳皮抗炎活性提取物对二甲苯致小鼠耳肿胀、大鼠棉球肉芽肿慢性炎症以及小鼠醋酸扭体均有较好的抑制活性。通过人体试验表明该提取物可以直接作为单方制剂或是与其他组分复配用于急、慢性炎性疾病的治疗,特别是由慢性炎症导致的银屑病的治疗。
因此,本发明第二个方面提供含有竹柳皮抗炎活性提取物的制剂,由竹柳皮抗炎活性提取物和药学上可接受的载体或稀释剂组成。所述制剂为片剂、糖衣丸、胶囊、注射剂、溶液、乳液、油膏、乳膏、气雾剂或栓剂。
本发明第三个方面提供了竹柳皮抗炎活性提取物或含有竹柳皮抗炎活性提取物的制剂,在医药产品领域中的应用。优选的,在制备防治银屑病的药物中的应用。
所述药学上可接受的载体或稀释剂是指药学领域常规的药物载体,选自填充剂、粘合剂、崩解剂、润滑剂、助悬剂、润湿剂、溶剂、表面活性剂或矫味剂中的一种或几种。所述填充剂选自淀粉、蔗糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素或葡萄糖等;所述粘合剂选自纤维素衍生物、藻酸盐、淀粉、糊精、明胶或聚乙烯吡咯烷酮等;所述崩解剂选自微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙基纤维素或交联羧甲基纤维素钠;所述润滑剂选自硬脂酸、聚乙二醇、碳酸钙、碳酸氢纳、微粉硅胶、滑石粉或硬脂酸镁;所述助悬剂选自微粉硅胶、蜂蜡、纤维素、固态聚乙二醇;所述润湿剂选自甘油、吐温80、乙氧基氢化蓖麻油或卵磷脂;所述溶剂选自乙醇、液态聚乙二醇、异丙醇、吐温-80、甘油、丙二醇或植物油,所述植物油选自大豆油、蓖麻油、花生油、调和油等;所述表面活性剂选自十二烷基苯磺酸钠、硬脂酸、聚氧乙烯一聚氧丙烯共聚物、脂肪酸山梨坦或聚山梨酯(吐温)等;所述矫味剂选自阿斯巴甜、蔗糖素、香精、柠檬酸或糖精钠。
本发明具有如下有益效果:
1.本发明创造性的以速生用材林树种和生物质能源树种的竹柳为研究对象,首次对竹柳皮进行乙酸乙酯提取方法进行探索研究,获得竹柳皮进行乙酸乙酯提取物,即本发明竹柳皮抗炎活性提取物。为竹柳在医药产品领域中的应用奠定基础,有助于竹柳附加值的提高。
2.本发明对竹柳皮乙酸乙酯提取物进行了药理及毒性研究,证明该提取物可以直接作为单方制剂或是与其他组分复配用于急、慢性炎性疾病的治疗,特别是由慢性炎症导致的银屑病的治疗。
3.本发明竹柳皮乙酸乙酯提取物抗炎镇痛活性高,无毒副作用,安全性好,且采用全程低温操作工艺保证提取物化学稳定性,所用溶剂可以循环使用,适合工业化生产。
附图说明
图1为本发明竹柳皮抗炎活性提取物制备方法中的步骤A所得样品HPLC色谱图。
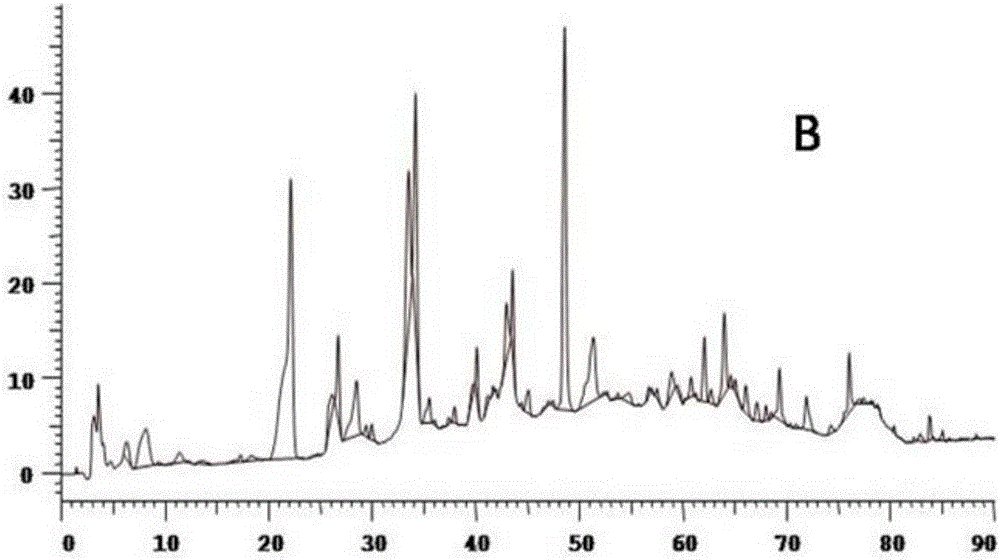
图2为本发明竹柳皮抗炎活性提取物制备方法中的步骤B所得样品HPLC色谱图。
图3为本发明竹柳皮抗炎活性提取物制备方法中的步骤C所得乙酸乙酯提取物的HPLC色谱图。
图4为实施例1、对比实施例1和对比实施例2的竹柳皮抗炎活性提取物对小鼠耳肿胀、大鼠棉球肉芽肿以及小鼠扭体反应抑制率结果。
具体实施方式
下面结合具体试验方法和附图对本发明的技术方案及其所产生的技术效果进行进一步的阐述,下述说明仅是为了解释本发明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
实施例1
A)提取:精密称取粉碎后过24目筛的竹柳皮粉末100g,加入十倍量的70%乙醇溶液作为提取溶剂,超声波提取3次,每次60min,超声温度为30℃,过滤,提取液合并,45℃减压浓缩至无乙醇残留,加入80mL蒸馏水溶解制成100mg/mL的样品溶液,用相同体积的乙酸乙酯萃取3次,萃取液合并,40℃减压浓缩至一定体积,于800Pa,45℃条件下真空干燥150min;样品色谱图如图1所示。
B)VLC(减压硅胶柱层析)纯化:采用200-300目硅胶湿法装柱,径高比1:5,将A步骤所得粉末干法上样,以石油醚为洗脱剂洗脱2BV,除去低极性杂质;以体积比为2:8的石油醚和乙酸乙酯混合液为洗脱剂洗脱3BV,合并洗脱液,于40℃条件下减压浓缩,于800Pa,45℃条件下真空干燥120min;样品色谱图如图2所示。
C)Sephadex LH-20纯化:凝胶柱径高比为1:18,将B步骤所得粉末用石体积比为1:1的氯仿和甲醇溶液溶解制成50mg/mL样品溶液,以体积比为1:1的氯仿和甲醇的混合液为洗脱剂,按0.4BV·h-1的流速洗脱3BV,收集2h后的洗脱液,HPLC检测(色谱条件为0-20min,20-45%甲醇水,20-70min,45-80%甲醇水,70-80min,80-100%甲醇水,80-90min,100%甲醇,流速为1ml/min,检测波长为220nm,柱温:25℃,YMC-pack ODS A色谱柱(250×4.6mm,5μm)),得到除去色素的竹柳乙酸乙酯提取物溶液;色谱图如图3所示。
D)干燥及保存:溶液减压浓缩至一定体积,1000Pa,40℃,真空干燥120min,辐射灭菌,最终以粉末形式保存竹柳乙酸乙酯提取物。
实施例2
A)提取:精密称取粉碎后过40目筛的竹柳皮粉100g,加入5倍量的70%乙醇溶液作为溶剂,超声波提取4次,每次45min,超声温度为40℃,过滤,提取液合并,45℃减压浓缩至无乙醇残留,加入80mL蒸馏水溶解制成100mg/mL的样品溶液,用2倍量的乙酸乙酯萃取3次,萃取液合并,40℃减压浓缩至一定体积,于1000Pa,40℃条件下真空干燥120min;
B)VLC(减压硅胶柱层析)纯化:采用200-300目硅胶湿法装柱,径高比1:5,将A步骤所得粉末干法上样,以石油醚为洗脱剂洗脱2BV,除去低极性杂质;以体积比为2:8的石油醚和乙酸乙酯混合液为洗脱剂洗脱3BV,合并洗脱液,于40℃条件下减压浓缩,于1000Pa,40℃条件下真空干燥120min;
C)Sephadex LH-20纯化:凝胶柱径高比为1:18,将B步骤所得粉末用石体积比为1:1的氯仿和甲醇溶液溶解制成50mg/mL样品溶液,以体积比为1:1的氯仿和甲醇的混合液为洗脱剂,按0.5BV·h-1的流速洗脱3BV,收集1.6h后的洗脱液,HPLC检测(色谱条件为0-20min,20-45%甲醇水,20-70min,45-80%甲醇水,70-80min,80-100%甲醇水,80-90min,100%甲醇,流速为1ml/min,检测波长为220nm,柱温:25℃,YMC-pack ODS A色谱柱(250×4.6mm,5μm)),得到除去色素的竹柳乙酸乙酯提取物溶液;
D)干燥及保存:溶液减压浓缩至一定体积,1000Pa,40℃,真空干燥120min,辐射灭菌,最终以粉末形式保存竹柳乙酸乙酯提取物。
实施例3
A)提取:精密称取粉碎后过15目筛的竹柳皮粉100g,加入20倍量的70%乙醇溶液作为溶剂,超声波提取3次,每次45min,超声温度为50℃,过滤,提取液合并,45℃减压浓缩至无乙醇残留,加入80mL蒸馏水溶解制成100mg/mL的样品溶液,用相同体积的乙酸乙酯萃取3次,萃取液合并,40℃减压浓缩至一定体积,于600Pa,40℃条件下真空干燥180min;
B)VLC(减压硅胶柱层析)纯化:采用200-300目硅胶湿法装柱,径高比1:5,将A步骤所得粉末干法上样,以石油醚为洗脱剂洗脱2BV,除去低极性杂质;以体积比为2:8的石油醚和乙酸乙酯混合液为洗脱剂洗脱3BV,合并洗脱液,于40℃条件下减压浓缩,于600Pa,40℃条件下真空干燥150min;
C)Sephadex LH-20纯化:凝胶柱径高比为1:18,将B步骤所得粉末用石体积比为1:1的氯仿和甲醇溶液溶解制成50mg/mL样品溶液,以体积比为1:1的氯仿和甲醇的混合液为洗脱剂,按0.5BV·h-1的流速洗脱3BV,收集1.6h后的洗脱液,HPLC检测(色谱条件为0-20min,20-45%甲醇水,20-70min,45-80%甲醇水,70-80min,80-100%甲醇水,80-90min,100%甲醇,流速为1ml/min,检测波长为220nm,柱温:25℃,YMC-pack ODS A色谱柱(250×4.6mm,5μm)),得到除去色素的竹柳乙酸乙酯提取物溶液;
D)干燥及保存:溶液减压浓缩至一定体积,1000Pa,40℃,真空干燥120min,辐射灭菌,最终以粉末形式保存竹柳乙酸乙酯提取物。
对比实施例1
按实施例1中的A)和D)步骤制得相应粉末。
对比实施例2
按实施例1中的A)、B)和D)步骤制得相应粉末。
实验例1
本发明竹柳皮抗炎活性提取物抑制二甲苯致小鼠耳肿胀试验:
取体重18~22g雄性昆明种小鼠50只,随机分为5组,每组10只,包括实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例2组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),阳性对照组(阿司匹林,以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),空白组(10%DMSO)。各组按20mL·kg-1的剂量灌胃给药,每日1次,连续7d,末次给药30min后,在小鼠右耳涂20μL二甲苯致炎,左耳为空白。2h后将小鼠断颈椎处死,剪下两耳,用直径9mm打孔器切下双耳片称重,以右耳重量减去左耳重量的差值作为炎性肿胀程度的评价标准,并按下述公式计算各组小鼠耳肿胀抑制率。
各组对二甲苯所致小鼠耳肿胀的影响的实验结果见表1和图4。由实验结果可知,与空白对照组相比,各给药组均表现出较强的抑制小鼠耳肿胀活性,且呈现显著性差异,表明竹柳乙酸乙酯部位活性组分能显著抑制二甲苯所致小鼠耳肿胀;实施例1的抑制率与阳性对照组相比,未见显著性差异,但较对比实施例1和对比实施例2的抑制率显著升高(P<0.01),且对比实施例1的抑制率与对比实施例2相比,也呈现显著性差异(P<0.01),表明竹柳乙酸乙酯萃取物经上述纯化步骤后可显著提高其对二甲苯所致小鼠耳肿胀的抑制活性,也表明本发明所述的竹柳皮抗炎活性提取物制备方法的科学性和合理性。
表1各组对二甲苯所致小鼠耳肿胀的影响(n,)
注:*代表与空白对照组相比,P<0.01;代表与阳性对照组相比,P<0.01;代表与实施例1相比,P<0.01;Δ代表与对比实施例1相比,P<0.01。
实验例2
本发明竹柳皮抗炎活性提取物抑制大鼠棉球肉芽肿慢性炎症试验:
取体重180±10g SD大鼠50只,雌雄各半,随机分为5组,每组10只,包括实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例2组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),阳性对照组(醋酸地塞米松,以10%DMSO溶解,制成浓度为1mg/mL供试样品溶液)和模型组(10%DMSO)。
模型组大鼠用乙醚麻醉,无菌条件下在腹部切开一个小口,用镊子将20mg的灭菌棉球从小切口处植入大鼠两侧腹股沟下,随即缝合并用碘液对缝合处进行消毒。其余样品组均以相同的方式造模。各给药组在手术次日按20mL·kg-1的剂量灌胃给药,每日1次,连续10d,末次给药60min后,断颈椎处死大鼠,在原切口出切开皮肤,将棉球连同周围结缔组织同时取出,剔除周围脂肪,于50℃烘箱烘干24h,称重。以肉芽肿重量作为炎症程度的评价标准,并按下述公式计算各组棉球肉芽肿抑制率。
各组大鼠棉球肉芽肿结果见表2和图4。由实验结果可知,与空白对照组相比,各给药组均表现出较强的抑制大鼠棉球肉芽肿的活性,且呈现显著性差异,表明竹柳乙酸乙酯部位的活性组分能抑制大鼠棉球肉芽肿的活性;实施例1的抑制率与阳性对照组相比,未见显著性差异,但与对比实施例1和对比实施例2相比,实施例1组的大鼠棉球肉芽肿重量明显减少,且呈现显著性差异(P<0.01),表明本发明竹柳皮抗炎活性提取物能显著抑制大鼠棉球肉芽肿引起的慢性炎症,也表明本发明所述的竹柳皮抗炎活性提取物制备方法的科学性和合理性。
表2各组大鼠棉球肉芽肿重量的比较(n,)
注:*代表与空白对照组相比,P<0.01;代表与实施例1相比,P<0.01。
实验例3
本发明竹柳皮抗炎活性提取物抑制小鼠醋酸扭体试验:
取体重18~22g昆明种小鼠50只,雌雄各半,随机分为5组,每组10只,包括实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例1组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),对比实施例2组(以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),阳性对照组(阿司匹林,以10%DMSO溶解,制成浓度为10mg/mL供试样品溶液),空白组(10%DMSO)。各组按20mL·kg-1的剂量灌胃给药,每日1次,连续7d,末次给药30min后,按0.2mL·10g-1的剂量向每只小鼠腹腔注射0.6%醋酸溶液(临用前现配制),观察并记录注射醋酸溶液15min内的各组小鼠出现扭体反应(腹部收缩内凹、伸展后肢、臀部抬高等)的次数,并按照下述公式计算扭体反应抑制率。
各组对小鼠醋酸扭体反应的影响的实验结果见表3和图4。由实验结果可知,与空白对照组相比,各给药组均表现出较强的抑制小鼠扭体的活性,且呈现显著性差异,表明竹柳乙酸乙酯部位活性组分能显著抑制醋酸引起的小鼠疼痛;实施例1的抑制率与阳性对照组相比,未见显著性差异,但较对比实施例1和对比实施例2的抑制率显著升高(P<0.01),且对比实施例1的抑制率与对比实施例2相比,也呈现显著性差异(P<0.01),表明竹柳乙酸乙酯萃取物经上述纯化步骤后可显著提高镇痛活性,也表明本发明所述的竹柳皮抗炎活性提取物制备方法的科学性和合理性。
表3各组对小鼠醋酸扭体反应的影响(n,)
注:*代表与空白对照组相比,P<0.01;代表与阳性对照组相比,P<0.01;代表与实施例1相比,P<0.01;Δ代表与对比实施例1相比,P<0.01。
实验例4
本发明竹柳皮抗炎活性提取物急性毒性试验:
取体重18~22g昆明种小鼠20只,雌雄各半,随机分为2组,每组20只,包括实施例1组(以10%DMSO溶解,制成浓度为200mg/mL供试样品溶液)和空白组(10%DMSO)。试验前12h小鼠禁食不禁水,各组按20mL·kg-1的剂量灌胃给药,对给药后15d内小鼠的体重、行为、四肢活动、进食、呼吸、排泄、死亡等情况进行观察,与空白组相比,样品组未见明显异常,15d后脱颈椎处死,对小鼠心、肝、脾、肥、肾等器官进行观察,与空白组相比,样品组未见明显异常,表明在观察期间未观察到竹柳乙酸乙酯提取物的明显毒副作用。
实验例5
本发明竹柳皮抗炎活性提取物临床应用-治疗银屑病的人体试验
①竹柳乙酸乙酯提取物片剂的制备
称取按实施例1制备的竹柳乙酸乙酯提取物粉末80g,粉碎,过80目筛,加入12g玉米淀粉(稀释剂)、8g微晶纤维素(粘合剂和崩解剂),混合45min,将混合物加入制粒机中加热造粒,预混合5min,当出风温度达到40℃时,喷90wt%乙醇溶液,于50℃下干燥使物料含水量控制在5.0wt%以下,然后过14目尼龙筛进行整粒,向整粒后的颗粒中加入0.5g硬脂酸镁(润滑剂),混合10min,压片,得片重为0.5g的竹柳乙酸乙酯提取物片剂。
②一般资料
银屑病患者100例,年龄18~65岁,病程在1个月到10年之间。
③主要症状
红色丘疹或斑丘疹,针头至绿豆大小,边界清楚,上覆银白色或云母样鳞屑,可刮除,伴有不同程度的瘙痒,多发于四肢身侧、肘部、膝部、腰背部及头皮。
④实验分组
将患者随机分为两组,包括治疗组和对照组,每组50例。治疗组服用按上述方法制备的竹柳乙酸乙酯提取物片剂进行治疗,每日3次,每次1~2片,一个月为一个疗程,对照组外涂维A酸软膏,每天3次,连涂一个月为一个疗程。3个疗程后观察患者病情变化。
⑤疗效判断标准
痊愈:服药后症状消失;
有效:服药后症状减轻;
无效:症状略有减轻或无变化。
各组对银屑病的治疗效果见表4。由实验结果可以看出,本发明片剂对银屑病具有较好的治疗效果(总有效率>90%),且其治疗效果优于阳性对照的治疗效果(总有效率>64%),且治疗组患者,在服药观察期间未出现任何不良反应或毒副反应,表明该片剂在临床上可用于银屑病的治疗。
表4各组对银屑病的治疗效果
- 还没有人留言评论。精彩留言会获得点赞!