一种奥沙利铂和伊立替康共载载药脂肪乳及其制备方法与流程
本发明涉及脂肪乳制剂技术领域,尤其涉及一种奥沙利铂和伊立替康共载载药脂肪乳及其制备方法。
背景技术:
结直肠癌发病率在各种肿瘤疾病中位列第三位,传统化学治疗药物仍是目前临床结直肠癌治疗中不可或缺的手段。由于癌症的异质性和基因复杂性,单一化疗药往往治疗效果有限且易产生多药耐药,因此常需采用联合用药或多重治疗的方式。其中,奥沙利铂与伊立替康的联用方案在美国NCCN(National Comprehensive Cancer Network,美国国家癌症综合网络)公布的《结肠癌临床治疗指南》中,推荐用于治疗首次化疗失败后进展性的转移性结直肠癌。奥沙利铂是继顺铂、卡铂之后的第三代铂类抗癌药,铂原子可与DNA形成Pt-DNA结合物,导致DNA修复和复制受阻,从而诱导细胞凋亡。伊立替康是喜树碱类细胞毒性药物,其作用于DNA拓扑异构酶I,抑制DNA重排并导致DNA链断裂,从而诱导细胞凋亡。两种药物联用时,能够以不同作用机制同时作用于细胞DNA,从而产生协同治疗效果。
同传统化疗药物一样,奥沙利铂和伊立替康均存在一系列的缺点,如:低的药物耐受,非特异性,多药耐药,非期望的药代动力学和生物分布,在杀死肿瘤细胞时对正常组织也会造成严重损害,而二者的联合使用则会进一步加剧对机体的毒副作用。另外,在奥沙利铂与伊立替康联合治疗结直肠癌中,临床上的传统方法只是简单的将两种药物联合使用,但不能控制药物在体内的释放;由于每种药物的药代动力学不同,而不同药物比例对疾病的治疗可能起到协同、相加甚至是拮抗作用,必然会产生治疗的不确定性,影响治疗效果。
纳米载体递送抗肿瘤药物能够有效提高抗肿瘤效果,降低毒副作用等。目前已有多种载药纳米粒上市或进入临床试验阶段。其中,脂肪乳作为药物递送载体,具有靶向、高效和低毒等优点,具有广阔的应用前景。脂肪乳,也称作脂质纳米乳或脂质微球,是一种均匀的水包油体系。早在上世纪90年代即有多种产品上市,如前列腺素、氟比洛芬等。但目前并没有报道以奥沙利铂和伊立替康为治疗药物的共载脂肪乳。
技术实现要素:
针对上述现有技术,本发明提供了一种奥沙利铂和伊立替康共载脂肪乳,采用脂肪乳共载奥沙利铂和伊立替康的形式,能够控制两种药物的同步释放、实现两种药物的共递送,从而提高结直肠癌的治疗效果。本发明还提供了该脂肪乳的制备方法。
本发明是通过以下技术方案实现的:
一种奥沙利铂和伊立替康共载脂肪乳,包括以下组分:治疗药物、注射用油、磷脂、普朗尼克F68、稳定剂、甘油和水,所述治疗药物为奥沙利铂和伊立替康类药物,奥沙利铂与伊立替康类药物质量比为1:1-5;其中,奥沙利铂浓度0.5-2mg/ml,伊立替康类药物浓度0.5-10mg/ml,注射用油质量分数为5-20%,磷脂质量分数0.5-2.5%,普朗尼克F68质量分数0.1-2%,稳定剂质量分数0.01-0.5%,甘油质量分数0.1-2.5%,剩余为水。
本领域技术人员知晓,药物的作用是受药物组分及其各组分含量影响的,经过试验可得,含有上述各配比量原料的奥沙利铂和伊立替康共载脂肪乳,物理性质稳定,并且两种药物具有优异的协同作用。若是不合适的原料配比量,共载脂肪乳物理性质不稳定,两种药物不能发挥最优的协同效果。
优选的,所述伊立替康类药物可以是伊立替康、其活性代谢物7-乙基-10-羟基喜树碱(SN-38),以及伊立替康与酸所成的盐中的一种或多种。所述的伊立替康与酸所成的盐可选用盐酸伊立替康。
所述的奥沙利铂和伊立替康共载脂肪乳中,奥沙利铂和伊立替康类药物首先与磷脂形成药物脂质复合物,再进行负载。包括两种方法:一是奥沙利铂与伊立替康类药物分别与磷脂制备奥沙利铂-脂质复合物、伊立替康-脂质复合物;二是奥沙利铂与伊立替康类药物同时与磷脂制备得到奥沙利铂/伊立替康-脂质复合物。其中,优选的,奥沙利铂与形成的奥沙利铂-脂质复合物中磷脂的质量比1:5-1:30,伊立替康类药物与形成的伊立替康-脂质复合物中磷脂的质量比1:2-1:10。
疏水性的伊立替康类药物不经制备药物脂质复合物而直接进行负载,在工艺上也是可以实现的。
所述注射用油为长链油酯或中链甘油三酯(MCT),以及两者任意比例的混合物。其中,长链油酯可以是大豆油、花生油、麻油、蓖麻油等。优选的,所述注射用油为中链甘油三酯(MCT)。
所述磷脂可以是天然磷脂如:大豆磷脂、蛋黄磷脂、氢化大豆磷脂等;也可以是合成磷脂如:二油酰磷脂酰胆碱(DOPC)、二棕榈酰磷脂酰胆碱(DPPC)、磷脂酰丝氨酸(DOPS)、二油酰基磷脂酰乙醇胺(DOPE)、二棕榈酰磷脂酰甘油酯(DPPG)、(2,3-二油酰基-丙基)-三甲胺(DOTAP)等。
为了控制所形成的水包油颗粒在适宜的粒径范围,本发明优先选择普朗尼克F68作为水相中的乳化剂。另外,普朗尼克F68被批准可用于静脉注射,具有较高的安全性。
所述稳定剂为油酸、胆酸、脱氧胆酸、甘氨胆酸的一种或任几种的混合物,也可以是所述酸的金属钠盐形式。优选的,所述稳定剂为油酸。
所述的甘油即可作为助乳化剂,控制粒径大小、提高制剂稳定性;又可以作为一种等渗调节剂,调节体系的渗透压。
所述的奥沙利铂和伊立替康共载脂肪乳,其平均粒径在100-200nm之间,粒径分布范围窄。
所述的奥沙利铂和伊立替康共载脂肪乳的制备方法,包括如下步骤:
(1)首先制备奥沙利铂、伊立替康或奥沙利铂和伊立替康混合的药物脂质复合物或奥沙利铂-脂质复合物:分别将奥沙利铂、伊立替康类药物与磷脂混合,或者将奥沙利铂、伊立替康类药物同时与磷脂混合,或者只将奥沙利铂与磷脂混合,然后加入合适的有机溶剂溶解并反应设定时间,抽真空除去有机溶剂,得到均匀药物脂质膜,即药物磷脂复合物;
(2)药物脂质复合物使用有机溶剂复溶后,与注射用油、稳定剂混合,或者加入伊立替康类药物、注射用油和稳定剂混合(此时适用于步骤(1)中只将奥沙利铂与磷脂混合),并抽真空除去有机溶剂,得到油相;
(3)普郎尼克F68、甘油用水溶解,得到水相;
(4)将油相与水相预热后,在高速剪切下混合,得到初乳;所得初乳通过高压乳匀机控制粒径,即得到共载脂肪乳,并经过滤除菌后冷藏保存。
以上步骤只要不影响制备,可互换。
步骤(1)中,本发明使用药物脂质复合物技术制备奥沙利铂和伊立替康共载脂肪乳,药物脂质复合物是利用药物和磷脂分子之间弱的作用力形成较为稳定的化合物或络合物。由于药物脂质复合物能够改善药物的油水分配系数,从而提高药物在制剂中的包封效果。此外,在共递送不同药物时,药物脂质复合物能够减小不同药物之间的疏水差异,因此能够协调不同药物的释放行为,从而更好地控制不同药物的同步释放,从而保证不同药物的优化治疗比例。
奥沙利铂及伊立替康类药物可以分别与磷脂反应制备奥沙利铂-脂质复合物、伊立替康-脂质复合物,也可同时与磷脂反应制备奥沙利铂/伊立替康-脂质复合物;奥沙利铂与形成的奥沙利铂-脂质复合物中磷脂的质量比1:5-1:30,伊立替康类药物与形成的伊立替康-脂质复合物中磷脂的质量比1:2-1:10;有机溶剂可以是甲醇、二氯甲烷、氯仿、乙醚的一种或几种混合,反应温度20-60℃。
步骤(2)中,复溶有机溶剂优选二氯甲烷、氯仿、乙醚的一种或两种混合,注射用油在最终处方中所占比例为5-20%(w/v);稳定剂所占比例为0.01-0.5%(w/v)。
步骤(3)中,普郎尼克F68在最终处方中所占比例为0.1-2%,甘油比例为0.1-2.5%。优选的,普郎尼克F68在最终处方中所占比例为0.5-1%;甘油比例为2-2.25%。
步骤(4)中,水相与油相预热温度在40-80℃,混合时剪切速率为3000-10000r/min,高压乳匀条件为5-10Mpa、循环10-20次。经过试验验证,以上条件可以得到良好的物理稳定性的共载载药脂肪乳。
上述技术方案具有如下有益效果:
本发明中的奥沙利铂和伊立替康共载载药脂肪乳,具有良好的物理稳定性、生物兼容性和生物可降解性,由于脂肪乳将药物包封在内油相中,能够有效避免药物的泄露,因此可实现完全负载,从而精确控制两种药物的比例。此外,奥沙利铂和伊立替康共载载药脂肪乳能够延缓两种药物在体内的释放,且可利用EPR效应增加在肿瘤组织的聚集,因此可以提高其抗肿瘤效果。
更重要的是,使用药物脂质复合物技术制备的共载脂肪乳取得了意想不到的效果,能够协调两种药物在体内的同步释放,确保两种药物在到达肿瘤部位仍保持优化的剂量比,从而实现最佳协同效果,这比现有技术中的两种药物的协同效果都要突出。
本发明采用的脂肪乳制备方法,工艺稳定,简单可行,易于工业化生产。
所选用乳化剂磷脂和普郎尼克F68均为批准可用于静脉注射的辅料,具有良好的安全性。
附图说明
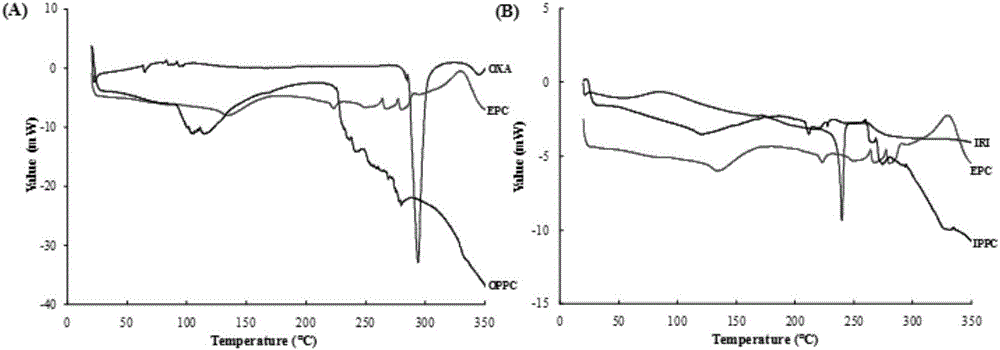
图1为本发明制备的药物脂质复合物的差示扫描量热(DSC)表征结果。OXA表示奥沙利铂,IRI表示伊立替康,EPC表示蛋黄卵磷脂,OPPC表示奥沙利铂-磷脂复合物,IPPC表示伊立替康-磷脂复合物。
图2为本发明制备的共载脂肪乳的透射电镜照片。
图3为本发明制备的共载脂肪乳的粒径分布图。
图4为本发明制备的共载脂肪乳的电位分布图。
图5为本发明制备的共载脂质体的体外释放情况。
图6为本发明制备的共载脂质体的3个月稳定性情况。
具体实施方式
下面结合实施例对本发明进一步说明。
实施例1:奥沙利铂与伊立替康分别制备药物脂质复合物。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂20mg与蛋黄磷脂300mg溶解于甲醇/二氯甲烷20ml(体积比9:1),伊立替康50mg与蛋黄磷脂200mg溶解于二氯甲烷5ml,反应一定时间后,二者分别抽真空得到奥沙利铂-脂质复合物、伊立替康-脂质复合物;两种药物脂质复合物用二氯甲烷4ml复溶,加入MCT 2g、油酸50mg,抽真空后得到油相。将普郎尼克F68 200mg、甘油800mg溶解于水中,得到水相。油相和水相分别60℃预热后,在剪切速率6000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在8Mpa下高压乳匀循环15次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为0.5mg/ml、1.25mg/ml;MCT所占比例为5%;磷脂和普郎尼克F68比例分别为1.25%、0.5%;油酸和甘油的比例分别为0.125%、2%。测定其平均粒径为126.9nm,如图3所示。图1A分别为奥沙利铂(OXA)、蛋黄卵磷脂(EPC)以及奥沙利铂-药物脂质复合物(OPPC)的DSC曲线,OPPC表现出与OXA及EPC均不同的吸热放热峰,表明OPPC的形成;图1B同样表明伊立替康-药物脂质复合物(IPPC)的形成。图2为所制备共载脂肪乳的透射电镜图片,可看到脂肪乳粒子形态圆整,呈较好的球形。图4所示共载脂肪乳zeta电位在-20mV左右,该电位下粒子之间具有一定的排斥力,能够有效避免纳米粒团聚,有利于制剂的稳定。图5所示为共载脂肪乳中两种药物的释放,一方面两种药物具有相似的释放速率,表明在释放过程中两种药物能够保持稳定的药物比例,从而保证二者的协同增效作用;另一方面两种药物在脂肪乳中均表现出显著的缓释效果,可以延长药物的作用时间。图6所示共载脂肪乳冷藏储存下放置三个月后,外观、粒径均无明显变化,表明该制剂具有较高的物理稳定性。
实施例2:奥沙利铂与伊立替康同时制备药物脂质复合物。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂20mg、伊立替康50mg与大豆磷脂500mg溶解于甲醇/二氯甲烷20ml(体积比9:1),反应一定时间后,抽真空得到奥沙利铂/伊立替康-脂质复合物;将药物脂质复合物用二氯甲烷4ml复溶,加入MCT 4g、油酸50mg,抽真空后得到油相。将普郎尼克F68 200mg、甘油900mg溶解于水中,得到水相。油相和水相分别60℃预热后,在剪切速率8000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在10Mpa下高压乳匀循环15次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为0.5mg/ml、1.25mg/ml;MCT所占比例为10%;磷脂和普郎尼克F68比例分别为1.25%、0.5%;油酸和甘油的比例分别为0.125%、2.25%。测定其平均粒径为160.2nm。
实施例3:奥沙利铂制备药物脂质复合物、伊立替康直接进行负载。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂20mg与氢化大豆磷脂300mg溶解于甲醇/氯仿20ml(体积比9:1),反应一定时间后,抽真空得到奥沙利铂-脂质复合物。将药物脂质复合物用氯仿4ml复溶,并加入伊立替康50mg、MCT 2g、胆酸50mg,抽真空后得到油相。将普郎尼克F68 300mg、甘油800mg溶解于水中,得到水相。油相和水相分别50℃预热后,在剪切速率10000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在10Mpa下高压乳匀循环10次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为0.5mg/ml、1.25mg/ml;MCT所占比例为5%;磷脂和普郎尼克F68比例分别为1.25%、0.75%;胆酸和甘油的比例分别为0.125%、2%。测定其平均粒径为140.4nm。
实施例4:增加药物及乳化剂用量。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂60mg、伊立替康120mg与蛋黄磷脂1000mg溶解于甲醇/氯仿60ml(体积比5:1),反应一定时间后,抽真空得到奥沙利铂/伊立替康-脂质复合物(为了区分,单独形成的复合物写为:奥沙利铂-药物脂质复合物、伊立替康-药物脂质复合物;而混合后形成的复合物写为:奥沙利铂/伊立替康-药物脂质复合物);将药物脂质复合物用二氯甲烷10ml复溶,加入MCT 4g、油酸100mg,抽真空后得到油相。将普郎尼克F68 600mg、甘油800mg溶解于水中,得到水相。油相和水相分别60℃预热后,在剪切速率10000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在10Mpa下高压乳匀循环20次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为1.5mg/ml、3mg/ml;MCT所占比例为10%;磷脂和普郎尼克F68比例分别为2.5%、1.5%;油酸和甘油的比例分别为0.25%、2%。测定其平均粒径为163.5nm。
实施例5:改变注射用油的种类。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂40mg与蛋黄磷脂200mg溶解于甲醇/二氯甲烷40ml(体积比8.5:1.5),伊立替康50mg与蛋黄磷脂400mg溶解于甲醇/二氯甲烷5ml(2:3),反应一定时间后,二者分别抽真空得到奥沙利铂-脂质复合物、伊立替康-脂质复合物;两种药物脂质复合物用二氯甲烷5ml复溶,加入注射用大豆油4g及花生油2g,油酸160mg,抽真空后得到油相。将普郎尼克F68 300mg溶解于水中,得到水相。油相和水相分别70℃预热后,在剪切速率5000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在8Mpa下高压乳匀循环15次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为1mg/ml、1.25mg/ml;注射用油所占的总比例为15%;磷脂和普郎尼克F68比例分别为1.5%、0.75%;油酸比例为0.4%。测定其平均粒径为197.8nm。
实施例6:改变稳定剂种类。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂40mg与蛋黄磷脂200mg溶解于甲醇/二氯甲烷40ml(体积比8.5:1.5),伊立替康50mg与蛋黄磷脂200mg溶解于甲醇/二氯甲烷5ml(2:3),反应一定时间后,二者分别抽真空得到奥沙利铂-脂质复合物、伊立替康-脂质复合物;两种药物脂质复合物用二氯甲烷5ml复溶,加入MCT 4g、脱氧胆酸40mg,抽真空后得到油相。将普郎尼克F68 300mg溶解于水中,得到水相。油相和水相分别70℃预热后,在剪切速率5000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在8Mpa下高压乳匀循环15次,得到共载脂肪乳。
奥沙利铂和伊立替康浓度分别为1mg/ml、1.25mg/ml;MCT所占比例为10%;磷脂和普郎尼克F68比例分别为1%、0.75%;脱氧胆酸比例为0.2%。测定其平均粒径为167.8nm。
对比例1不采用药物脂质复合物
制备油相:取蛋黄磷脂500mg、MCT 2g、油酸50mg混合,抽真空后得到油相;将奥沙利铂20mg、伊立替康50mg加入油相中,药物无法溶解,油相呈浑浊。
后续制备脂肪乳操作无法进行。
结论:奥沙利铂及伊立替康直接在油相溶解不可行。而药物磷脂复合物能够改善药物的亲疏水性,从而实现药物在油相均一稳定的存在。也表明形成药物磷脂复合物能够大大提高制剂的稳定性。
对比例2改变注射用油及稳定剂含量比例
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂20mg与蛋黄磷脂300mg溶解于甲醇/二氯甲烷20ml(体积比9:1),伊立替康50mg与蛋黄磷脂200mg溶解于二氯甲烷5ml,反应一定时间后,二者分别抽真空得到奥沙利铂-脂质复合物、伊立替康-脂质复合物;两种药物脂质复合物用二氯甲烷4ml复溶,加入MCT 12g,但不加入稳定剂油酸,抽真空后得到油相。将普郎尼克F68 200mg、甘油800mg溶解于水中,得到水相。油相和水相分别60℃预热后,在剪切速率6000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在8Mpa下高压乳匀循环15次,得到共载脂肪乳。
结论:MCT占处方最终比例为30%,所得脂肪乳表面有油滴,放置过夜后分层,已破乳。表明注射用油含量应在合适范围,以保证乳化剂能够将油相和水相完全乳化。而稳定剂的存在,能够增加药物与油相的亲和力,从而改善制剂的稳定性。
对比例3水相中不加乳化剂普郎尼克F68。
一种奥沙利铂与伊立替康共载脂肪乳,取奥沙利铂20mg与蛋黄磷脂300mg溶解于甲醇/二氯甲烷/乙醚20ml(体积比8.5:1:0.5),伊立替康50mg与蛋黄磷脂200mg溶解于甲醇/二氯甲烷5ml(1:1),反应一定时间后,二者分别抽真空得到奥沙利铂-脂质复合物、伊立替康-脂质复合物;两种药物脂质复合物用二氯甲烷4ml复溶,加入MCT 2g、油酸钠25mg,抽真空后得到油相。将甘油800mg溶解于水中,得到水相。油相和水相分别60℃预热后,在剪切速率6000r/min下混合,得到初乳,并加水定容至终体积40ml;随后在10Mpa下高压乳匀循环20次,得到共载脂肪乳。
结论:不使用普郎尼克F68也可得到均一的脂肪乳,但粒径均匀度较差,有大颗粒存在。测定其平均粒径为180.1nm、多分散系数(PDI)为0.354。制剂冷藏放置7天后出现破乳,稳定性大大降低。说明普郎尼克F68的存在能够改善制剂的稳定性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!