用于治疗疼痛的药物组合物和装置的制作方法
本发明涉及疼痛管理领域,包括基于可具有呼吸抑制副作用的活性成分的疼痛管理领域。
在可具有呼吸抑制作用的活性成分中,本发明特别地涉及阿片样激动剂和苯二氮
阿片样激动剂是其作用类似于阿片(opium)但化学上不相关的物质。阿片样激动剂通过刺激阿片样受体发挥其作用。相对于阿片样受体(也称为阿片受体)的类型,阿片样激动剂/受体复合物的形成引起药理学响应。
阿片样激动剂治疗性地用于治疗疼痛,并且还可用作戒毒治疗期间的替代物。
许多阿片样激动剂是常用的。例如,非穷举式列表包括阿芬太尼、阿尼利定、阿朴吗啡、丁丙诺啡、布托啡诺、卡芬太尼、可待因、二乙酰吗啡(“海洛因”)、右丙氧芬(dextropropoxyphène)、二氢吗啡、芬太尼、氢可酮、氢吗啡酮、左洛啡烷(lévallorphane)、左芬啡烷、左啡诺、美沙酮、吗啡、纳布啡、纳洛芬(nalorphine)、去甲左啡诺(norlevophanol)、羟考酮、羟吗啡酮、喷他佐辛、哌替啶、丙氧芬、瑞芬太尼、舒芬太尼、曲马多等。
此外,许多内源性物质可归类为阿片样激动剂:强啡肽、内吗啡肽(endomorphine)、内啡肽、脑啡肽、伤害感受肽(nociceptine)。
阿片样激动剂可具有许多不期望的副作用,包括嗜睡、呼吸抑制、便秘、恶心/呕吐等。其使用应当小心对待,尤其是在医院或任何医疗设施中。
用阿片样激动剂的治疗造成了许多滥用的问题,因为其可以是硬性毒品(droguesdures)的替代品。因此,供应诊所需要昂贵的安全系统。最后,与长期治疗相关的这种治疗类型的迅速成瘾导致剂量提高,可使患者依赖,尤其是当“需要”施用时。因此,基于阿片样激动剂的治疗需要医务人员的严格管理和大力参与,这在成本优化的背景下是有问题的。
有三种主要类型的阿片样受体,μ、δ和κ。这些受体广泛地分布在脑和一些外周区域。
与阿片样激动剂不同,阿片样拮抗剂的特征在于对至少一种阿片样受体的抑制活性。它们可分成两大类:特异性阿片样拮抗剂(仅某些阿片样受体)和非特异性阿片样拮抗剂。特别地,非特异性阿片样拮抗剂是纳洛酮、纳曲酮和纳美芬。
在阿片样中毒的情况下,为了限制某些副作用,阿片样激动剂可与阿片样拮抗剂联合。
对于阿片样物质的施用,现今主要使用可注射溶液,尤其是在医院环境中。这种施用形式具有许多优点,例如,作用非常快并且生物利用度相当好控制。然而,注射施用并不完美。事实上,除了注射的不适和需要专业人员进行施用外,一些副作用非常明显,包括但不限于呼吸抑制。
苯二氮
许多苯二氮
苯二氮
不像苯二氮
在苯二氮
在本申请的上下文中,术语“来自dr组的活性成分”是指具有至少一种呼吸抑制(dépresseurrespiratoire)副作用的活性成分。
在本申请的上下文中,术语“来自adr组的活性成分”是指对抗由dr组的活性成分引起的呼吸抑制的活性成分。
例如,阿片样激动剂和苯二氮
例如,阿片样拮抗剂和苯二氮
根据所附权利要求和本文中提供的公开内容,以下术语用以下含义定义。
“活性制剂”包括包含一种或更多种活性药物成分的制剂。活性成分可配制成溶液或非分子分散体。活性成分也可以以改变其性质的形式配制,特别是与膜的通过和生物利用度相关的那些性质;微胶囊、脂质体、快速作用形式等。
“鼻内施用”是在患者的鼻腔中施用活性成分。活性成分可以是不同的形式:气体、蒸气、微滴、悬浮粉末等。在一个实施方案中,所述活性成分为气溶胶形式,例如液体或气体中的细固体颗粒的混悬液形式,其中颗粒每秒下降低于50cm。鼻内施用的特征还在于大多数活性成分被患者的鼻黏膜所吸收的事实。
“依次施用”是由数次相继施用构成的施用。
“呼吸抑制”是施用一种或更多种活性成分后的副作用,其可导致出现一种或更多种呼吸抑制体征:组织缺氧、呼出气体中二氧化碳水平升高、呼出气体中氧气水平降低、呼吸速率降低、呼吸幅度降低等。
“不期望的副作用”是其不是直接期望的活性成分作用。可通过施用一定量的对抗不期望的副作用的活性成分来限制不期望的副作用。
“独立施用”是指当患者自己进行施用时没有医疗专业人员的干预。当在动物中进行施用时,可以理解,施用由饲养者实施。
“能源”是独立的能源,其可用于允许如上所述的独立施用。能源通常是便携式的,并且优选并入鼻内递送装置的便携式系统中。例如,能源可以是电池、光伏能源的来源、从患者回收的能量,例如产生的热量或产生的运动等。
“没有任何医疗设施的施用”意指一个或更多个相继施用的顺序可在没有医疗专业人员的任何监管下进行。任选地,治疗可由医疗卫生人员规定,而施用本身可以发生在这样的专业人员不在场且不必要的地方。
“初始阶段”是进行治疗的第一次施用的时间段。
“后续阶段”是指进行治疗的第一次施用后的任何施用的时间段。
“同时地施用/同时施用”是同时施用至少两种活性成分。或者,可施用每种活性成分,使得其药理作用在同一时间开始和/或一般地同时开始。另一方面,活性成分可以配制成混合物。
“施用的选择”是当患者由于想要而接受施用的时候。
“信息部件(moyenderenseignement)”是其功能是获取和传输用于决策的信息(例如施用的选择)的元件。其可以是计时部件(moyendecomptagedetemps)或用于测量至少一个生物学参数的部件。
“计时部件”是指测量时间间隔的任何部件。其可包括时钟、秒表、倒数计时器、以已知频率运作的微处理器等。
“生物学参数”是指患者的生物学特征,其为数值或可量化值的形式。例如,其可以是氧饱和度或呼吸速率。
“用于测量至少一个生物学参数的装置”是产生对应于患者生物学参数之数值的装置。
“用于测量至少一个同时引入的生物学参数的装置”是其中至少一部分至少在施用开始时位于鼻腔中的装置。
“患者信号部件(dispositifdesignalpatient)”是在激活控制部件的情况下发出患者可感知的信号,从而允许患者获得关于施用选择的信息的元件。信号可以是光信号。当信号为正时,这意指可放出含有来自dr组的活性成分但不含来自adr组的活性成分的活性制剂。当信号为负时,这意指可放出含有来自adr组的活性成分但不合来自dr组活性成分的活性制剂。总而言之,当至少一个信息部件将信息传送至含有dr组的活性成分但不含adr组的活性成分的活性制剂与分配部件(moyensdedistribution)之间的连接相反的信息处理单元时,则患者信号部件向患者传送负信号。
“液体喷雾”是能够转变成小滴和/或微滴的液体。
“活性成分的混合物”是在单个存储空间内存在的活性成分。混合物可以是液体、固体或气体。在液体或气体混合物的情况下,不同活性成分的分子可以分散在相同的存储空间内,这被称为分子混合物。
“阿片样激动剂”是以类似于阿片的方式作用于至少一种阿片样受体的活性成分。
“阿片样拮抗剂”是与阿片相反地作用于至少一种阿片样受体的活性成分。
“系统的初始启动”是指由希望接收初始施用的患者实现的治疗施用系统的第一次启动。在单次治疗期间,可只存在一次系统的初始启动。
“后续的系统启动”是指由希望接受施用的患者实现的治疗施用系统的后续启动。在单次治疗期间,可存在一次或更多次后续的系统启动。
“用于鼻内施用的便携式装置”是可由患者携带但不是限制其移动性的负担的装置。特别地,该装置可如此容易地运输,使得只要有使用它的可能性(例如在紧急情况下),这使得有理由将其纳入单独的设备中。它可以放置在口袋、手、袋、汽车手套箱(boiteàgantdevoiture)、手提包、耐水和/或沙等的小容器中。
“存储空间”是包含活性制剂的封闭空间。在封闭的空间内,与外界的气体交换较低或不存在,而在短期运行内不能造成制剂定性和/或定量的变化。在使用期间,封闭的空间可与外部相连通。
“连接部件(moyensdemiseenrelation)”是指允许在存储空间与分配部件之间相连通的所有元件。其可以特别地是机械屏障,例如阀。
“信号处理单元”是与信息部件和连接部件二者相关的元件。信息部件发送由信号处理单元评价的信息。信号处理单元的操作允许信号处理单元基于所做的评估向连接部件发送操作控制信号。
“过度呼吸抑制”是呼吸抑制的状态,其中同时施用dr组的至少一种活性成分(含有或不含有adr组的至少一种活性成分)的风险/效益是不期望的。例如,当测量的生物学参数是氧饱和度时,当氧饱和度值低于85%时,可认为呼吸抑制是过度的。例如,当生物学参数是呼吸速率时,当呼吸速率的值小于每分钟12个循环的吸气/呼气时,可认为呼吸抑制是过度的。
“可移除存储空间”是可以从装置移除而不使其永久不可用的存储空间。
“可更换存储空间”是根据现行规定可以独立于装置获取的存储空间。可更换的存储空间可被移出并用新的包含相同的活性成分的存储空间替换以便为装置重新加载。
“适用于通过鼻黏膜传送的活性制剂的分配部件”是使活性制剂与鼻黏膜接触所需的元件或元件组。
“电源”是向便携式装置供应电流。该电流可由例如电池、电容器、太阳能收集部件、用于收集患者能量(例如,机械能或身体热量)的部件等产生。
尽管强烈需要用镇痛活性成分(例如阿片样激动剂和苯二氮
-从治疗的工效学角度:安全管理变得更容易、无创施用、限制治疗后的伤害等。
-从财务角度:限制护理人员的干预、缩短住院持续时间、降低对医疗系统造成的滥用、降低分销网络(desréseauxdedistribution)的成本等。
-从公共卫生的角度:降低呼吸抑制、限制滥用等。
特别地,长期感到需要这样的技术方案,其用于以独立受控的方式由患者本人在没有任何医疗设施的情况下递送用于治疗疼痛的活性成分,同时管理这种治疗的不良副作用。远离任何医疗人员或治疗中心(例如,医院、诊所、保健中心等)的人(例如士兵、记者、冒险家、探险家、猎人、徒步旅行者、登山者)对这种需求感受尤其明显。事实上,经常发现这些人处于涉及维持人身健全的客观危险性相当显著的地方,并且造成创伤性损伤的风险相当高。因此,这些人需要单一的治疗方案,使他们能够通过适当地施用合适的产品来管理存在疼痛表现的多种情况,同时避免遭受不期望的副作用。
已经进行了多种努力来改善阿片样治疗,但尚未获得令人满意的结果。
例如,中国申请cn102068697描述了将阿片样激动剂与阿片样拮抗剂组合以试图限制阿片样激动剂的不良作用而不影响其作用。具体地,该申请教导了包含芬太尼/纳曲酮混合物的鼻喷雾剂。然而,该申请没有描述限制施用次数或一旦阿片样拮抗剂被代谢后控制潜在副作用的任何方法。
转让给acelrxpharmaceuticals的美国专利公开no.2007/0186923描述了用于在口腔黏膜中施用阿片样激动剂的药物递送装置。该装置具有在当试图回收阿片样激动剂溶液时防止阿片样拮抗剂溢出的安全性组分。因此,该申请是确保在试图转移(détournement)情况下,中和阿片样激动剂组合物的作用、使得该组合物不可用的安全系统。在正常条件下,阿片样激动剂与阿片样拮抗剂之间不发生混合,并且不发生拮抗剂施用。
转让给universityofflorida的wo2012024106描述了由药物代谢动力学和药物效应动力学数据的获取、算法分析组成的复杂系统,其中响应可以是可变的。该申请指明不认为血氧计是用于检测异常的可靠装置,而优选其他探针。此外,该装置不是便携式的。
转让给gomedical的wo1996040332描述了用于鼻内施用阿片样激动剂的医疗装置。该装置包含阿片样激动剂溶液和除阿片样拮抗剂以外的其他活性分子,因此不考虑阿片样拮抗剂的并入。该申请没有描述限制滥用,而仅描述了其中患者使用“诚信”的控制系统。
美国专利4,464,378描述了鼻内施用拮抗剂和相应制剂(例如以凝胶形式)的方法。该专利中所表达的目的是为了规避在口服施用期间使用生物利用度不足的某些已知产品遇到的困难。该专利描述了配制用于鼻内施用的包含阿片样激动剂-拮抗剂的溶液剂、凝胶剂、混悬剂和软膏剂。
美国专利no.5,629,011描述了与在黏膜中发挥作用的吸收促进剂组合的阿片样激动剂极性代谢物的鼻内制剂。
美国专利no.5,767,125描述了阿片样激动剂与阿片样拮抗剂共施用的方法。阿片样激动剂选自:吗啡、可待因、芬太尼类似物、喷他佐辛、丁丙诺啡、美沙酮、脑啡肽、强啡肽、内啡肽,以及以相同方式发挥作用的生物碱和阿片样肽。阿片样拮抗剂选自:纳曲酮、纳洛酮、埃托啡、二丙诺啡、二氢埃托啡,以及以相同方式发挥作用的生物碱和阿片样肽。该产品通过腹膜内注射施用于小鼠,但该专利提出了制备用于口服、舌下、静脉内、肌内、皮下和经皮施用的制剂的可能性。
wo2001058447描述了可配制用于鼻内施用的含有阿片样激动剂和阿片样拮抗剂的组合物。应注意,此处阿片样拮抗剂包被有基质(例如多糖)以形成微球来控制其在黏膜上的释放,以便确保阿片样拮抗剂在起效期间的作用。
美国专利no.6,948,492描述了关于控制多个单位剂量的药物组合物的鼻内自施用之间的最少时间的系统和鼻内递送装置。容纳在瓶中的单位剂量沉积在围绕中心的支撑星(supportenétoile)上,其可在每次使用之后旋转以推进单位剂量,但是仅在经过一定的预定时间之后。支撑星被不断地偏置以旋转并推进瓶,其进展由金属弹簧和形状记忆合金线保持。锁定由在每次施用之间向下计数的微处理器控制。该专利没有描述共施用阿片样激动剂和阿片样拮抗剂,或者是防止组合物不适当施用的其他形式的对照。实际上,尽管所公开的装置可自施用后续剂量的阿片样组合物,但是所述剂量不处于经受此类施用的生理条件中。
总之,以上提到的解决方案都没有解决上述的所有问题。
如以下将讨论的,根据本发明的装置解决了上述问题。
本发明涉及用于管理疼痛的用途、系统、并入此类系统的装置和施用方法。以下将更详细地描述本发明的多个方面。
本发明的实施将具有以下优点:
-关于治疗的工效学:安全管理更加容易、无创施用、限制治疗后伤害等。
-关于财务方面:限制护理人员的干预、缩短住院时间、降低影响医疗系统的滥用、降低分销网络的成本等。
-从公共卫生的角度:降低呼吸抑制、限制滥用等
本发明还涉及用于在动物中管理疼痛的用途、系统、并入此类系统的装置以及施用方法。在这种情况下,可以理解的是,施用由动物的主人/饲养员进行,而不是作为动物的患者/对象。
本发明涉及依次鼻内施用具有至少一种呼吸抑制副作用的来自dr组中的至少一种活性成分和对抗可由dr组的活性成分引起的呼吸抑制的adr组的至少一种活性成分的方法。所述方法可由患者在没有任何医疗设施的情况下独立地实施,并且包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分或鼻内施用来自dr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,依次鼻内施用方法包括:
-鼻内施用与来自adr组的至少一种活性成分组合的来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分或者同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,依次鼻内施用方法的初始阶段还包括与来自dr组的至少一种活性成分同时施用来自adr组的至少一种活性成分。
在一个实施方案中,当来自dr组的至少一种活性成分是阿片样物质,并且来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如,纳洛酮)时,预期当施用来自dr组的阿片样物质时,可同时施用adr组的活性成分(例如,纳洛酮)。
在一个实施方案中,当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,所述依次鼻内施用方法包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述依次鼻内施用方法包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述依次鼻内施用方法包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组中的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述依次鼻内施用方法包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,初始阶段还受一个或更多个信息部件控制。
在一个实施方案中,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件是至少一个血氧计,和/或呼吸速率传感器,和/或计时部件。
在一个实施方案中,信息部件是至少一个血氧计、呼吸速率传感器和计时部件。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括施用来自dr组的至少一种活性成分。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分。
本发明还提供了来自具有至少一种呼吸抑制副作用的dr组的至少一种活性成分和来自对抗由dr组的活性成分引起的呼吸抑制的adr组的至少一种活性成分用于治疗疼痛的用途。所述用途可以是由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用的一部分,其中依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独或者与来自dr组的至少一种活性成分组合的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
本发明还提供了用于鼻内施用来自具有呼吸抑制副作用的dr组的活性成分用于治疗疼痛的方法,其特征在于其可根据在任何医疗设施以外独立实施的鼻内施用方法与对抗由来自dr组的活性成分引起的呼吸抑制的来自adr组的至少一种活性成分一起或依次施用,并且包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独或者与来自dr组的至少一种活性成分组合的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,用于治疗疼痛的方法中的活性成分的特征在于,来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,用于治疗疼痛的方法中的活性成分的特征在于,来自dr组的至少一种活性成分是舒芬太尼,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,当来自dr组的至少一种活性成分是阿片样物质,并且来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如,纳洛酮)时,预期当施用来自dr组的阿片样物质时,可同时施用来自adr组的活性成分(例如,纳洛酮)。
在一个实施方案中,当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,在用于治疗疼痛的方法中来自具有至少一种呼吸抑制副作用的dr组的活性成分的特征在于,其可根据在任何医疗设施以外独立鼻内实施的方法与来自对抗由dr组的活性成分引起的呼吸抑制的adr组的至少一种活性成分依次鼻内施用,并且包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分或同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,用于治疗疼痛的方法的来自具有至少一种呼吸抑制副作用的dr组的活性成分的特征在于,其可根据在任何医疗设施以外独立实施的鼻内施用方法与来自对抗由dr组的活性成分引起的呼吸抑制的adr组中的至少一种活性成分依次鼻内施用,并且包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组中至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,施用剂量的方法包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,施用剂量的方法包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,施用剂量的方法包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,初始阶段还受一个或更多个信息部件控制。
在一个实施方案中,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件是至少一个血氧计和/或呼吸速率传感器和/或计时部件。
在一个实施方案中,信息部件是至少一个血氧计、呼吸速率传感器和计时部件。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括施用来自dr组的至少一种活性成分。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分。
在一个实施方案中,由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分或同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,来自dr组的所述至少一种活性成分和来自adr组的所述至少一种活性成分当在同时施用时处于混合物中。
在一个实施方案中,当来自dr组的至少一种活性成分是阿片样物质时,来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如,纳洛酮),来自dr组的阿片样物质与来自adr组的活性成分(例如,纳洛酮)同时施用。
在一个实施方案中,来自dr组的所述至少一种活性成分和来自adr组的所述至少一种活性成分当在同时施用时处于混合物中。
在一个实施方案中,当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分的初始阶段,以及
-鼻内施用来自dr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-鼻内施用单独的来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,由患者自己在没有任何医疗设施的情况下实施的依次鼻内施用包括:
-鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的初始阶段,以及
-同时鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分的至少一个后续阶段,
其中鼻内施用的至少一个后续阶段的施用的选择受一个或更多个信息部件控制。
在一个实施方案中,初始阶段还由多个信息部件控制。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件是至少一个血氧计,和/或呼吸速率传感器和/或计时部件。
在一个实施方案中,信息部件是至少一个血氧计、呼吸速率传感器和计时部件。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括施用来自dr组的至少一种活性成分。
在一个实施方案中:
-当计时部件指示低于阈值的剂量间隔时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,鼻内施用的后续阶段包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况下,鼻内施用的后续阶段包括同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分。
本发明还涉及依次鼻内施用系统。
在类似于上述情况的情况下,该施用系统可特别地可用于孤立的人。
特别地,本发明涉及用于依次鼻内施用具有至少一种呼吸抑制副作用的来自dr组的至少一种活性成分和对抗由所述dr组的活性成分引起的呼吸抑制的来自adr组的至少一种活性成分的系统,所述系统包含:
-(a)响应于希望接受药物施用的患者对所述系统的初始启动,同时施用来自dr组的至少一种活性成分,该施用构成被所述系统记录的初始施用;
-(b)响应于希望接受后续药物施用的患者对所述系统的至少一次后续启动,初始施用的至少一次后续施用来自adr组的至少一种活性成分或来自dr组的至少一种活性成分,该施用构成被所述系统记录的后续施用;
其中后续施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述系统包含:
-(a)响应于希望接受药物施用的患者对所述系统的初始启动,同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,该施用构成被所述系统记录的初始施用;
-(b)响应于希望接受后续药物施用的患者对所述系统的至少一次后续启动,初始施用的至少一次后续施用来自adr组的至少一种活性成分,或者同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,该施用构成被所述系统记录的后续施用;
其中后续施用的选择受一个或更多个信息部件控制。
在一个实施方案中,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中。
在一个实施方案中,当来自dr组的至少一种活性成分是阿片样物质,并且来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如,纳洛酮)时,dr组的阿片样物质可与来自adr组的活性成分(例如纳洛酮)同时施用。
在一个实施方案中,当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,所述系统包含:
-初始鼻内施用来自dr组的至少一种活性成分,以及
-初始施用的至少一次后续鼻内施用单独的来自adr组的至少一种活性成分,
其中后续鼻内施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述系统包含:
-初始鼻内施用来自dr组的至少一种活性成分,以及
-至少一次后续鼻内施用来自dr组的至少一种活性成分,
其中后续鼻内施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述系统包含:
-初始鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,以及
-初始施用的至少一次后续鼻内施用单独的来自adr组的至少一种活性成分,
其中后续鼻内施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述系统包含:
-初始鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,以及
-同时至少一次后续鼻内施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,
其中后续施用的选择受一个或更多个信息部件控制。
在一个实施方案中,所述施用(a)还受至少包括测量生物学参数的一个或更多个信息部件控制。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件是至少一个血氧计和/或呼吸速率传感器和/或计时部件。
在一个实施方案中,信息部件是至少一个血氧计、呼吸速率传感器和计时部件。
在一个实施方案中:
-当定时器指示小于阈值的给药间隔时,后续施用包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,后续施用包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况中,后续施用包括施用来自dr组的至少一种活性成分。
在一个实施方案中:
-当定时器指示小于阈值的给药间隔时,后续施用包括施用来自adr组的至少一种活性成分;
和/或
-当用于测量至少一个生物学参数的至少一种装置指示过度呼吸抑制时,后续施用包括施用来自adr组的至少一种活性成分;
和
-在所有其他情况中,后续施用包括同时施用来自dr组的至少一种活性成分和来自adr组的至少一种活性成分。
本发明还涉及具有根据本公开内容的用于依次鼻内施用的便携式装置的鼻内施用系统。
在一个实施方案中,具有根据本公开内容的用于依次鼻内施用的便携式装置的鼻内施用系统包含:
-至少第一存储空间,其含有第一活性可喷雾制剂,所述第一活性可喷雾制剂包含来自dr组的至少一种活性成分;
-至少第二存储空间,其含有不同于第一活性制剂的第二活性可喷雾制剂,所述第二活性可喷雾制剂包含来自adr组的至少一种活性成分;
-信号处理单元;
-具有的第一和第二活性制剂的第一和第二存储空间分别与分配部件的连接部件,其与信号处理单元有效连接;
-一个或更多个信息部件,其与信号处理单元有效连接;
-允许患者在没有任何医疗设施的情况下通过自施用接受活性制剂的控制部件;
-用于通过鼻黏膜传送活性制剂的分配部件;以及
-自主电源,
其中信号处理单元、连接部件、信息部件和控制部件配置成允许基于信号处理单元接收的来自信息部件的一个或更多个信号将第一存储空间内的第一活性制剂与分配部件连接,或者将第二储存空间内的第二活性制剂与分配部件连接。
在一个实施方案中,具有根据本公开内容的用于依次鼻内施用的便携式装置的鼻内施用系统包含:
-至少第一存储空间,其含有第一活性可喷雾制剂,所述第一活性可喷雾制剂包含混合的来自dr组的至少一种活性成分和来自adr组的至少一种活性成分;
-至少第二存储空间,其具有不同于第一活性制剂的第二活性可喷雾制剂,所述第二活性可喷雾制剂包含来自adr组的至少一种活性成分;
-信号处理单元;
-第一和第二存储空间的第一和第二活性制剂分别与分配部件的连接部件,其与信号处理单元有效连接;
-一个或更多个信息部件,其与信号处理单元有效连接;
-允许患者在没有任何医疗设施的情况下通过自施用接受活性制剂的控制部件;
-用于通过鼻黏膜传送活性制剂的分配部件;以及
-自主电源,
其中信号处理单元、连接部件、信息部件和控制部件配置成允许基于信号处理单元接收的来自信息部件的一个或更多个信号将第一存储空间内的第一活性制剂与分配部件连接,或者将第二储存空间内的第二活性制剂与分配部件连接。
当来自dr组的至少一种活性成分是阿片样物质,并且来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如纳洛酮)时,具有设置在其中的第一活性制剂的第一存储空间可包含选自阿片样物质的来自dr组的活性成分和来自adr组的活性成分(例如纳洛酮)二者。
在一个实施方案中,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中。
当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,能源是电能。
在一个实施方案中,信号处理单元包含微处理器。
在一个实施方案中,信号处理单元与配置成存储从信息部件接收的数据的一个或更多个存储区有效连接。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件是至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件是至少一个血氧计和/或呼吸速率传感器和/或计时部件。
在一个实施方案中,信息部件是至少一个血氧计、呼吸速率传感器和计时部件。
在一个实施方案中,活性制剂的分配部件是鼻条(emboutnasal),并且血氧计和呼吸速率传感器位于鼻条上用于测量和/或计算接受活性制剂的患者的生理值。
在一个实施方案中,计时部件被集成到信号处理单元的微处理器中。
在一个实施方案中:
-用于测量和/或计算至少一个生物学参数的装置将信息发送至具有配置成存储生理值的存储区的信号处理单元;
-信号处理单元当接收来自用于测量至少一个生物学参数的装置的信息时,询问计时部件以获得当前时间值,并将时间值存储在存储区中。
在一个实施方案中:
-信号处理单元进行从用于测量至少一个生物学参数的装置中获得的生理值与存储在存储区中的阈值之间的比较;
-信号处理单元进行存储在存储区中的时间值与在比较时从计时部件中接收的更新时间值之间的比较,以计算自先前施用以来经过的时间间隔;
-根据这些比较的确定,信号处理单元向连接部件发送信号,以允许患者接受施用活性制剂,从而启动控制部件并自施用一种活性制剂。
在一个实施方案中:
-如果信号处理单元确定生理值大于阈值,并且自先前施用以来已经经过了足够的时间间隔,则信号处理单元向连接部件发送信号以能够后续施用第一活性制剂;或者
-如果信号处理单元确定生理值小于阈值,或者自先前施用以来已经经过了不足的时间间隔,则信号处理单元向连接部件发送信号以能够后续施用第二活性制剂。
在一个实施方案中,存储空间是可移除的。
在一个实施方案中,存储空间是可变的。存储空间是“可变的”在于其可被移除并且被包含相同活性成分的新存储空间替换。
在一个实施方案中,存储空间是可移除且可变的。
实际上,如上所述,医疗装置可以并入多种活性制剂,其每一种的定性和定量组合物可适用于给定的患者。剂量的选择以及使用的活性成分可由医务人员来决定。另外,时间间隔可由医务人员预先确定。
在一个实施方案中,医疗装置还包含患者信号部件。
在一个实施方案中,患者信号部件是光信号。
阅读下面附图说明将更好地理解本发明。
图1:根据本发明的示例性装置
图1举例说明了根据本公开内容的原理用于鼻内施用的便携式装置1。第一存储空间2可含有第一活性制剂12,其包含来自dr组的活性成分12a和来自adr组的活性成分12b。第二存储空间3可含有第二活性制剂11,其包含来自adr组的至少一种活性成分11a。
信号处理单元4连接至连接部件5。连接部件5包含给药室5a、具有阀轴5b的阀5c以及分别与第一和第二存储空间3和2连接的导管5d和5e。信号处理单元4还连接至信息部件6。信息部件6还包含时钟6a、呼吸速率传感器6b和/或血氧计6c。
当使用装置1时,使用者将鼻条7a插入患者的鼻腔(未示出)中。信息部件(例如血氧计6c和/或呼吸速率传感器6b)可以测量和确定值,并将所述值传达给信号处理单元4。信号处理单元4还可以与6a时钟进行通信,以计算自最后施用活性制剂12以来所经过的时间。或者,信号处理单元4可以具有时钟(例如pstn电路或与其集成的其他计时器)以避免提供单独的时钟。
当使用者激活控制部件8时,如图1所示,为按钮8a,基于由信息部件6提供的信息,信号处理单元4通过将第一存储空间2或第二存储空间3的连接部件5与分配部件7(例如,鼻条7a)相连接来控制连接,具体地通过分配导管5f。
如图1所示。连接包括在给药室5a内安装在阀轴5b上的致动阀5c。阀5c可以切换到阀轴5b的任一侧以压靠给药室5a的侧壁,并且因此可以基于由信号处理单元4决定施用的活性制剂关闭导管5d或导管5e中的一个。
选择的待从装置1施用的活性制剂在与鼻黏膜接触之前流过分配管5f并且从出口13中出来。
在任何时候,使用者可以获得关于从激活按钮8a通过患者信号部件9(例如灯9a)施用的活性制剂的信息。
然后,用户可以决定是否激活按钮8a。
自主电源10向装置1供电,并且可以是可再充电电池、光伏电池或其他合适的来源。
图2:根据本发明的装置的功能图
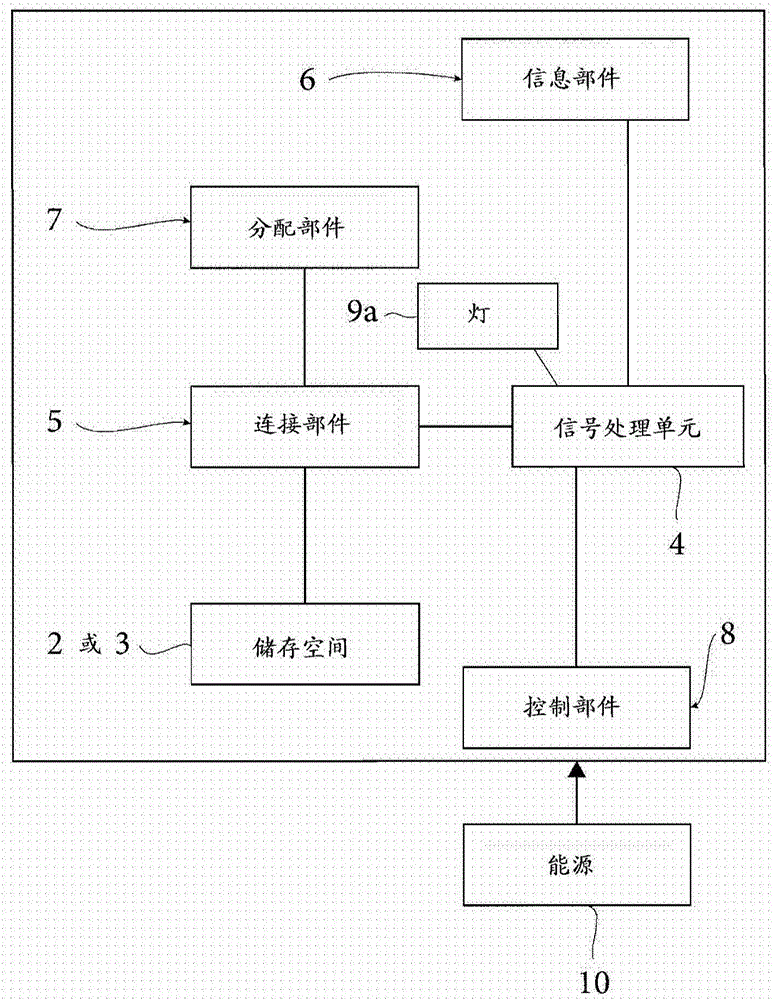
图2是示出根据本公开内容原理的装置1的多种特征的示意性框图。
图2示出了信号处理单元4连接至:
-信息部件6;
-连接部件5;
-控制部件8;和
-灯9a
连接部件5进一步连接至
-第一和第二存储空间2和3;
-分配部件7。
当使用装置1时,信息部件6将信息提供给信号处理单元4。
当使用者激活控制部件8时,基于由信息部件6提供的信息,信号处理单元4通过第一存储空间2或第二存储空间3与分配部件7的连接部件5控制连接。
自主电源10向装置1供电,并且可以是可再充电电池、光伏电池或其他合适的来源。
装置1可由希望进行鼻内施用治疗的患者使用。装置1可能由上述处于孤立情况的人使用。为了使用装置1,患者可从例如背包或其任选的箱中快速地找出装置1。然后,使用者定位分配部件7,例如鼻条7a。患者信号部件9(例如灯9a)可向患者传达在激活控制部件8后将施用两种活性制剂中的哪一种。最后,为了使用装置1,患者激活控制部件8,例如按钮8a。控制部件8也可以是能够接收激活机械应力、语音等的任何装置。作为治疗的一部分,患者可以进行尽可能多的鼻内施用。虽然这种疗法可以是“按需”治疗,但它是完全安全且可靠的。
装置1可并入多种活性制剂,例如活性制剂11和12,其每一种的定性和定量组合物可适用于给定的患者。剂量的选择以及使用哪种活性成分可以由医务人员决定。时间间隔(例如由计时部件(例如时钟6a)计算的来自dr组和/或adr组的活性成分的施用之间的最小持续时间)可由医务人员预先确定。
因此,装置1可以简化困难的情况,尤其是在武装冲突、自然灾害等的使用环境中。
在一个实施方案中,具有根据本公开内容原理的用于依次鼻内施用的便携式装置1的鼻内递送系统包含:
-至少第一存储空间2,其含有第一可喷雾活性制剂12,所述第一可喷雾活性制剂12包含来自dr组的至少一种活性成分12a;
-至少第二存储空间3,其含有不同于第一可喷雾活性制剂12的第二可喷雾活性制剂11,所述第二可喷雾活性制剂11含有来自adr组的至少一种活性成分11a;
-信号处理单元4;
-第一和第二存储空间2和3的活性制剂12和11分别与分配部件7的连接部件5,其与信号处理单元4有效连接;
-一个或更多个信息部件6,其与信号处理单元4有效连接;
-配置成允许接受活性制剂的患者在没有任何医疗设施的情况下进行活性制剂的自施用的控制部件8;
-用于通过鼻黏膜传送活性制剂的分配部件7;以及
-自主电源10,
其中信号处理单元4、连接部件5、信息部件6和控制部件8配置成允许基于来自信息部件6的由处理单元4接收的一个或更多个信号将第一存储空间2内的第一活性制剂12与分配部件7连接,或者将第二存储空间3内的第二活性制剂11与分配部件7连接。
在一个实施方案中,具有根据本公开内容原理的用于依次鼻内施用的便携式装置1的鼻内递送系统包含:
-至少一个第一存储空间2,其含有第一可喷雾活性制剂12,所述第一可喷雾活性制剂12包含来自dr组的至少一种活性成分12a和来自adr组的至少一种活性成分12b;
-至少一个第二存储空间3,其含有不同于第一活性制剂12的第二可喷雾活性制剂11,所述第二可喷雾活性制剂11包含来自adr组的至少一种活性成分11a;
-信号处理单元4;
-第一和第二存储空间2和3的活性制剂12和11分别与分配部件7的连接部件5,其与信号处理单元4有效连接;
-一个或更多个信息部件6,其与信号处理单元4有效连接;
-配置成允许接受活性制剂的患者在没有任何医疗设施的情况下进行活性制剂的自施用的控制部件8;
-用于通过鼻黏膜传送活性制剂的分配部件7;以及
-自主电源10,
其中信号处理单元4、连接部件5、信息部件6和控制部件8配置成允许基于来自信息部件6的由信号处理单元4接收的一个或更多个信号将第一存储空间2内的第一活性制剂12与分配部件7连接和/或将第二储存空间3内的第二活性制剂11与分配部件7连接。
在一个实施方案中,当来自dr组的至少一种活性成分是阿片样物质,并且来自adr组的至少一种活性成分是对抗由阿片样物质引起的呼吸抑制的活性成分(例如纳洛酮)时,具有设置在其中的第一活性制剂12的第一存储空间2可包含选自阿片样物质的来自dr组的活性成分和来自adr组的活性成分(例如纳洛酮)二者。
在一个实施方案中,当来自dr组的至少一种活性成分是苯二氮
在一个实施方案中,能源10是电能。
在一个实施方案中,信号处理单元4包含微处理器。
在一个实施方案中,信号处理单元4有效连接至配置成存储从信息部件6接收的数据的一个或更多个存储区。
在一个实施方案中,信息部件6包含至少一个用于测量至少一个生物学参数的装置和/或计时部件。
在一个实施方案中,信息部件6包含至少一个用于测量至少一个生物学参数的装置和计时部件。
在一个实施方案中,信息部件6包含至少一个血氧计6c和/或呼吸速率传感器6b和/或计时部件。
在一个实施方案中,信息部件6包含至少一个血氧计6c、呼吸速率传感器6b和计时部件。
在一个实施方案中,分配部件7包含鼻条7a,使得血氧计6c和呼吸速率传感器6b位于鼻条6a上用于测量和/或计算接受活性制剂施用的患者的生理值。
在一个实施方案中,计时部件被集成在信号处理单元4的微处理器中。
在一个实施方案中:
-用于测量和/或计算至少一个生物学参数的一种或更多种装置将信息发送至具有配置成存储生理值的存储区的信号处理单元4;和
-信号处理单元4当接收来自用于测量至少一个生物学参数的装置的信息后,询问计时部件以获得当前时间值,并将时间值存储在存储区中。
在一个实施方案中:
-信号处理单元4进行从用于测量至少一个生物学参数的一种或更多种装置中获得的生理值与存储在存储区中的阈值之间的比较;
-信号处理单元4进行存储在存储区中的时间值与在比较时从计时部件中接收的更新时间值之间的比较,以计算自先前施用以来经过的时间间隔;
-根据这些比较的确定,信号处理单元4向连接部件5发送信号,以使患者接受施用,从而启动控制部件8以自施用一种活性制剂。
在一个实施方案中:
-如果信号处理单元4确定生理值大于阈值,并且自先前施用以来已经经过了足够的时间间隔,则信号处理单元4向连接部件5发送信号以允许后续施用第一活性制剂12;或者
-如果信号处理单元4确定生理值小于阈值,其中自先前施用以来已经经过了不足的时间间隔,则信号处理单元4向连接部件5发送信号以允许后续施用第二活性制剂11。
在一个实施方案中,存储空间是可移除的。
在一个实施方案中,存储空间是可变的。存储空间是“可变的”表明其可以被移除并且被包含相同活性成分的新存储空间替换。
在一个实施方案中,存储空间2和存储空间3是可移除且可变的。
实际上,如上所述,装置1可包含多种活性制剂,其每一种的定性和定量组合物可适用于给定的患者。剂量的选择以及使用的活性成分可由医务人员来决定。另外,时间间隔可由医务人员预先确定。
在一个实施方案中,装置1还包含患者信号部件9。
在一个实施方案中,患者信号部件9可以是灯9a。
关于来自dr组和adr组的活性成分的剂量,对于约70kg(其代表平均体重)的患者估计所有剂量。这些剂量会不同,尤其是对于不同重量的患者。剂量也可以适用于特定动物。剂量可如本领域中所公知的进行调整。
以下实施方案可应用于根据本公开内容的原理的施用用于治疗疼痛的活性成分的方法、施用系统和便携式装置。
在一个实施方案中,通过用于测量与每次施用相伴随的引入鼻腔的至少一个生物学参数的装置来获得生物学参数的测量结果。
在一个实施方案中,计时部件的阈值为1至10小时。
在一个实施方案中,计时部件的阈值为4至8小时。
在一个实施方案中,计时部件的阈值为约6小时。
在一个实施方案中,所测量的生物学参数选自氧饱和度、呼出氧气的鼻内速率、呼出二氧化碳的鼻内速率或呼吸速率中的至少一种。
在一个实施方案中,所测量的生物学参数是氧饱和度。
在一个实施方案中,氧饱和度测量结果的阈值为70%至90%。
在一个实施方案中,氧饱和度测量结果的阈值为80%至90%。
在一个实施方案中,氧饱和度测量结果的阈值为约85%。
在一个实施方案中,所测量的生物学参数是呼吸速率。
在一个实施方案中,所测量的呼吸速率的阈值为8至14个循环/分钟。
在一个实施方案中,所测量的呼吸速率的阈值为8至12个循环/分钟。
在一个实施方案中,所测量的呼吸速率的阈值为约12个循环/分钟。
在一个实施方案中,所测量的生物学参数是氧饱和度和呼吸速率。
在一个实施方案中,活性成分为可喷雾液体的形式。
在一个实施方案中,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中。
在一个实施方案中,使用仅一个来自dr组的活性成分和仅一个来自adr组的活性成分。
在一个实施方案中,初始阶段期间使用的来自dr组的活性成分和至少一个后续阶段期间使用的来自dr组的活性成分相同。
在一个实施方案中,初始阶段期间使用的来自dr组的活性成分和至少一个后续阶段期间使用的来自dr组的活性成分不同。
在一个实施方案中,初始阶段期间使用的来自adr组的活性成分和至少一个后续阶段期间使用的来自adr组的活性成分相同。
在一个实施方案中,初始阶段期间使用的来自adr组的活性成分和至少一个后续阶段期间使用的来自adr组的活性成分不同。
在一个实施方案中,来自dr组的活性成分由阿片激动剂组成,并且来自adr组的活性成分由阿片样拮抗剂组成。
在一个实施方案中,来自dr组的至少一种活性成分选自阿芬太尼、阿尼利定、阿朴吗啡、丁丙诺啡、布托啡诺、卡芬太尼、可待因、二乙酰吗啡(“海洛因”)、右丙氧芬、二氢吗啡、芬太尼、氢可酮、氢吗啡酮、左洛啡烷、左芬啡烷、左啡诺、美沙酮、吗啡、纳布啡、纳洛芬、去甲左啡诺、羟考酮、羟吗啡酮、喷他佐辛、哌替啶、丙氧芬、瑞芬太尼、舒芬太尼、曲马多等。
在一个实施方案中,来自dr组的至少一种活性成分选自舒芬太尼、芬太尼、二乙酰吗啡、丁丙诺啡和卡芬太尼。
在一个实施方案中,来自dr组的至少一种活性成分是舒芬太尼。
在一个实施方案中,来自adr组的至少一种活性成分选自纳洛酮和纳曲酮。
在一个实施方案中,adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,来自dr组的至少一种活性成分是舒芬太尼,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,舒芬太尼的剂量为2至50μg并且纳洛酮的剂量为2至50mg。
在一个实施方案中,舒芬太尼的剂量为5至30μg并且纳洛酮的剂量为5至30mg。
在一个实施方案中,舒芬太尼的剂量为10至20μg并且纳洛酮的剂量为10至20mg。
在一个实施方案中,舒芬太尼的剂量为10μg并且纳洛酮的剂量为10mg。
在一个实施方案中,舒芬太尼的剂量为15μg并且纳洛酮的剂量为15mg。
在一个实施方案中,舒芬太尼的剂量为20μg并且纳洛酮的剂量为20mg。
在一个实施方案中,舒芬太尼与纳洛酮的重量比为0.00004至0.025。
在一个实施方案中,舒芬太尼与纳洛酮的重量比为约0.001。
在一个实施方案中,dr组的至少一种活性成分是舒芬太尼,并且adr组的至少一种活性成分是纳洛酮,并且任意施用舒芬太尼伴随着同时施用氯胺酮。
在一个实施方案中,舒芬太尼、纳洛酮和氯胺酮是混合物。
在一个实施方案中,舒芬太尼的剂量为1至60μg,氯胺酮的剂量为1至60mg,并且纳洛酮的剂量为1至60mg。
在一个实施方案中,舒芬太尼的剂量为10至55μg,氯胺酮的剂量为10至55mg,并且纳洛酮的剂量为10至55mg。
在一个实施方案中,舒芬太尼的剂量为17至50μg,氯胺酮的剂量为17至50mg,并且纳洛酮的剂量为17至50mg。
在一个实施方案中,舒芬太尼的剂量为17μg,氯胺酮的剂量为17mg,并且纳洛酮的剂量为17mg。
在一个实施方案中,舒芬太尼的剂量为37.5μg,氯胺酮的剂量为37.5mg,并且纳洛酮的剂量为37.5mg。
在一个实施方案中,舒芬太尼的剂量为50μg,氯胺酮的剂量为50mg,并且纳洛酮的剂量为50mg。
在一个实施方案中,舒芬太尼与纳洛酮的重量比和氯胺酮与纳洛酮的重量比分别为0.00034至0.0029和0.34至2.9。
在一个实施方案中,舒芬太尼与纳洛酮的重量比为约0.001并且氯胺酮与纳洛酮的重量比为约1。
在一个实施方案中,来自dr组的至少一种活性成分是芬太尼,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,芬太尼的剂量为10至150g并且纳洛酮的剂量为2至50mg。
在一个实施方案中,芬太尼的剂量为30至120μg并且纳洛酮的剂量为5至30mg。
在一个实施方案中,芬太尼的剂量为50至100μg并且纳洛酮的剂量为10至20mg。
在一个实施方案中,芬太尼的剂量为50μg并且纳洛酮的剂量为10mg。
在一个实施方案中,芬太尼的剂量为75μg并且纳洛酮的剂量为15mg。
在一个实施方案中,芬太尼的剂量为100μg并且纳洛酮的剂量为20mg。
在一个实施方案中,芬太尼与纳洛酮的重量比为0.0002至0.075。
在一个实施方案中,芬太尼与纳洛酮的重量比为约0.005。
在一个实施方案中,来自dr组的至少一种活性成分是二乙酰吗啡,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,二乙酰吗啡的剂量为0.1至20mg并且纳洛酮的剂量为2至50mg。
在一个实施方案中,二乙酰吗啡的剂量为1至10mg并且纳洛酮的剂量为5至30mg。
在一个实施方案中,二乙酰吗啡的剂量为2至4mg并且纳洛酮的剂量为10至20mg。
在一个实施方案中,二乙酰吗啡的剂量为2mg并且纳洛酮的剂量为10mg。
在一个实施方案中,二乙酰吗啡的剂量为3mg并且纳洛酮的剂量为15mg。
在一个实施方案中,二乙酰吗啡的剂量为4mg并且纳洛酮的剂量为20mg。
在一个实施方案中,二乙酰吗啡与纳洛酮的重量比为0.02至10。
在一个实施方案中,二乙酰吗啡与纳洛酮的重量比为约0.2。
在一个实施方案中,来自dr组的至少一种活性成分是丁丙诺啡,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,丁丙诺啡的剂量为0.1至30mg并且纳洛酮的剂量为0.1至5mg。
在一个实施方案中,丁丙诺啡的剂量为1至15mg并且纳洛酮的剂量为0.3至3mg。
在一个实施方案中,丁丙诺啡的剂量为2至8mg并且纳洛酮的剂量为0.5至2mg。
在一个实施方案中,丁丙诺啡的剂量为2mg并且纳洛酮的剂量为0.5mg。
在一个实施方案中,丁丙诺啡的剂量为4mg并且纳洛酮的剂量为1mg。
在一个实施方案中,丁丙诺啡的剂量为6mg并且纳洛酮的剂量为1.5mg。
在一个实施方案中,丁丙诺啡的剂量为8mg并且纳洛酮的剂量为2mg。
在一个实施方案中,丁丙诺啡与纳洛酮的重量比为0.02至300。
在一个实施方案中,丁丙诺啡与纳洛酮的重量比为约4。
在一个实施方案中,来自dr组的至少一种活性成分是卡芬太尼,并且来自adr组的至少一种活性成分是纳洛酮。
在一个实施方案中,卡芬太尼的剂量为70至1900μg并且纳洛酮的剂量为0.3至3.7mg。
在一个实施方案中,卡芬太尼的剂量为140至1400μg并且纳洛酮的剂量为0.5至3.0mg。
在一个实施方案中,卡芬太尼的剂量为350至1000μg并且纳洛酮的剂量为0.7至2.0mg。
在一个实施方案中,卡芬太尼的剂量为350μg并且纳洛酮的剂量为0.70mg。
在一个实施方案中,卡芬太尼的剂量为700μg并且纳洛酮的剂量为1.4mg。
在一个实施方案中,卡芬太尼的剂量为1000μg并且纳洛酮的剂量为2mg。
在一个实施方案中,卡芬太尼与纳洛酮的重量比为0.019至6.6。
在一个实施方案中,卡芬太尼与纳洛酮的重量比为约0.5。
在一个实施方案中,在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是纳洛酮并且纳洛酮的剂量为1至40mg。
在一个实施方案中,在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是纳洛酮并且纳洛酮的剂量为5至20mg。
当来自dr组的至少一种活性成分是丁丙诺啡时,在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是纳洛酮并且纳洛酮的剂量为3至7mg。
在一个实施方案中,dr组由苯二氮
在一个实施方案中,苯二氮
在一个实施方案中,苯二氮
在一个实施方案中,苯二氮
在一个实施方案中,劳拉西泮的剂量为2至5mg。
在一个实施方案中,苯二氮
在一个实施方案中,咪达唑仑的剂量为3.5至10mg。
在一个实施方案中,苯二氮
在一个实施方案中,氟硝西泮的剂量是2至10mg。
在一个实施方案中,在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是氟马西尼,并且氟马西尼的剂量为0.1至1mg。
在一个实施方案中,在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是氟马西尼并且氟马西尼的剂量为0.6至1mg。
在一个实施方案中,来自dr组的所述活性成分选自苯二氮
在一个实施方案中,来自dr组的所述至少一种活性成分是劳拉西泮并且包含劳拉西泮的活性制剂不包含氟马西尼。
在一个实施方案中,来自dr组的所述至少一种活性成分是咪达唑仑并且包含咪达唑仑的活性制剂不包含氟马西尼。
在一个实施方案中,来自adr组的所述至少一种活性成分是氟硝西泮并且包含氟硝西泮的活性制剂不包含氟马西尼。
在一个实施方案中,来自dr组的活性成分由阿片样激动剂组成,并且来自adr组的活性成分由阿片样拮抗剂组成,并且当施用来自dr组的至少一种活性成分时,其与来自adr组的活性成分同时施用。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的至少一种活性成分是舒芬太尼,并且来自adr组的至少一种活性成分是纳洛酮,其中舒芬太尼的剂量为17至50μg,并且纳洛酮的剂量为17至50mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分,当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是舒芬太尼,来自adr组的所述至少一种活性成分是纳洛酮,舒芬太尼的剂量为17至50μg并且纳洛酮的剂量为17至50mg,任意施用舒芬太尼伴随着同时施用氯胺酮,其中舒芬太尼和氯胺酮处于混合物中,并且氯胺酮的剂量为17至50mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是芬太尼,并且来自adr组的所述至少一种活性成分是纳洛酮,其中芬太尼的剂量为50至100μg,并且纳洛酮的剂量为10至20mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是二乙酰吗啡,并且来自adr组的所述至少一种活性成分是纳洛酮,其中二乙酰吗啡的剂量为2至4mg,并且纳洛酮的剂量为10至20mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是丁丙诺啡,并且来自adr组的所述至少一种活性成分是纳洛酮,其中丁丙诺啡的剂量为2至8mg,并且纳洛酮的剂量为0.5至2mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是卡芬太尼,并且来自adr组的所述至少一种活性成分是纳洛酮,其中卡芬太尼的剂量为350至1000μg,并且纳洛酮的剂量为0.7至2.0mg。
在一个实施方案中,来自dr组的活性成分由阿片样激动剂组成并且adr组的活性成分由阿片样拮抗剂组成,并且当施用来自dr组的至少一种活性成分时,没有施用来自adr组的活性成分。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是舒芬太尼,并且来自adr组的所述至少一种活性成分是纳洛酮,其中舒芬太尼的剂量为17至50μg,并且纳洛酮的剂量为17至50mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是舒芬太尼,来自adr组的所述至少一种活性成分是纳洛酮,舒芬太尼的剂量为17至50μg并且纳洛酮的剂量为17至50mg,任意施用舒芬太尼伴随着同时施用氯胺酮,其中舒芬太尼和氯胺酮处于混合物中,并且氯胺酮的剂量为17至50mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是芬太尼,并且来自adr组的所述至少一种活性成分是纳洛酮,其中芬太尼的剂量为50至100μg并且纳洛酮的剂量为10至20mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是二乙酰吗啡,并且来自adr组的所述至少一种活性成分是纳洛酮,其中二乙酰吗啡的剂量为2至4mg并且纳洛酮的剂量为10至20mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是丁丙诺啡,并且来自adr组的所述至少一种活性成分是纳洛酮,其中丁丙诺啡的剂量为2至8mg并且纳洛酮的剂量为0.5至2mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是卡芬太尼,并且来自adr组的所述至少一种活性成分是纳洛酮,其中卡芬太尼的剂量为350至1000μg,并且纳洛酮的剂量为0.7至2.0mg。
在一个实施方案中,来自dr组的活性成分由苯二氮
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是咪达唑仑,其中咪达唑仑的剂量为3.5至10mg,并且当活性制剂不包含来自dr组的活性成分时,来自adr组的所述至少一种活性成分是氟马西尼,其中氟马西尼的剂量为0.6至1mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是劳拉西泮,其中劳拉西泮的剂量为2至5mg,并且当活性制剂不包含来自dr组的活性成分时,来自adr组的所述至少一种活性成分是氟马西尼,其中氟马西尼的剂量为0.6至1mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,来自dr组的至少一种活性成分和来自adr组的至少一种活性成分当同时施用时处于混合物中,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是氟硝西泮,其中氟硝西泮的剂量为2至10mg,并且当活性制剂不包含来自dr组的活性成分时,来自adr组的至少一种活性成分是氟马西尼,其中氟马西尼的剂量为0.6至1mg。
在一个实施方案中,来自dr组的活性成分由苯二氮
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是咪达唑仑,其中咪达唑仑的剂量为3.5至10mg,并且当活性制剂不包含来自dr组的活性成分时,来自adr组的所述至少一种活性成分是氟马西尼,其中氟马西尼的剂量为0.6至1mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是劳拉西泮,其中劳拉西泮的剂量为2至5mg,并且在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是氟马西尼,并且氟马西尼的剂量为0.6至1mg。
在一个实施方案中,通过用于测量每次施用相伴随引入鼻腔的至少一个生物学参数的装置来测量生物学参数,计时部件的阈值为4至8小时,所测量的生物学参数是氧饱和度和呼吸速率,初始阶段期间使用的来自dr组的活性成分和所述至少一个后续阶段期间使用的来自dr组的活性成分相同,来自dr组的所述至少一种活性成分是氟硝西泮,其中氟硝西泮的剂量为2至10mg,并且在不含来自dr组的活性成分的活性制剂中,来自adr组的所述至少一种活性成分是氟马西尼,其中氟马西尼的剂量为0.6至1mg。
在一个实施方案中,活性制剂中的至少一种包含被配置成改变膜通过性质和生物利用度的至少一种活性药物成分。
实施例
该实施例举例说明了根据本公开内容原理的装置1的用途。
装置1的规格:
-两个可移除的存储空间;
-具有设置在其中的第一活性制剂12的第一存储空间2:
每个剂量中使用的活性制剂的量为0.2ml,因此活性制剂12包含约50个剂量:舒芬太尼(37.5μg/剂量)/氯胺酮(37.5mg/剂量)/纳洛酮(37.5mg/剂量)。
-第二存储空间3包含活性制剂11:
每个剂量中使用的活性制剂的量为0.2ml,因此活性制剂11包含约50个剂量:纳洛酮(15mg/剂量)。
-测量生物学参数的两种装置:6c血氧计(测量氧饱和度,阈值85%)和呼吸速率传感器6b(阈值:每分钟12个吸气/呼气循环);
-计时部件:时钟6a(阈值:6小时);
-患者信号部件9:当血氧计传感器6c、呼吸速率6b或时钟6a的阈值之一不利于再次施用舒芬太尼时,灯9a在装置1上发光。
因此,患者将知道在启动控制部件8后将施用什么。患者随后可决定是否激活控制部件8。
治疗过程:
-在t=0,患者在没有任何医疗设施的情况下第一时间启动装置1的控制部件8:患者施用活性制剂12。
-在t=3小时,患者将装置1的鼻条7a引入一个鼻孔中。在约20秒之后,灯9a发光,表明时钟(和潜在地生物学参数)禁止活性制剂12的施用:患者已经选择是否施用活性制剂11。
-在t=6.1小时,患者将装置1的鼻条7a引入一个鼻孔中。在约20秒之后,灯9a发光,表明其两个生物学参数(氧饱和度和呼吸速率)中的至少一个禁止活性制剂12的施用:患者已经选择是否施用活性制剂11。
-在t=8小时,患者将装置1的鼻条7a引入一个鼻孔中。在约20秒之后,灯9a保持关闭:患者可施用活性制剂12。
- 还没有人留言评论。精彩留言会获得点赞!