党参果胶多糖CPP1c的应用及其药物和保健品的制作方法
本发明涉及生物医学工程领域,且特别涉及党参果胶多糖CPP1c的应用及其药物和保健品。
背景技术:
党参为桔梗科植物,包括党参(Codonopsis pilosula(Franch.)Nann.f),素花党参(Codonopsis pilosula Nann.f var.modesta(Nann.f)L.T.Shen)和川党参(Codonopsis tang shen O.liv)的干燥根。性味甘平,有补中益气,健脾益肺,生津和胃的功效。现代药理研究证实,党参具有增强机体免疫力、改善胃肠功能、调节血糖、清除自由基、抗炎、抗氧化等功能。植物化学研究表明,党参主要含有生物碱、苯丙素类、三萜类、聚乙炔类、甾醇、挥发油、黄酮类及多糖类化合物等多种化合物;其中,党参多糖是党参的主要活性成分之一。
近年来,多糖作为一种无毒副作用且免疫活性较强的天然药物日益得到人们的广泛关注。
目前,对党参多糖,尤其是党参果胶多糖CCP1c的药用及保健价值的了解还很少。
技术实现要素:
本发明的目的在于提供党参果胶多糖CPP1c的在制备促进淋巴细胞增殖的药物中的应用。
本发明的第二目的在于提供党参果胶多糖CCP1c在制备改善淋巴细胞活性的药物中的应用。
本发明的第三目的在于提供党参果胶多糖CCP1c在制备促进免疫相关分子分泌的药物中的应用。
本发明的第四目的在于提供党参果胶多糖CCP1c在制备促进免疫相关基因表达的药物中的应用。
本发明的第五目的在于提供党参果胶多糖CCP1c在制备促进免疫相关蛋白分子表达量的药物中的应用。
本发明的第六目的在于提供党参果胶多糖CCP1c在制备促进淋巴细胞归巢的药物中的应用。
本发明的第七目的在于提供党参果胶多糖CCP1c在制备增强免疫力的保健品中的应用。
本发明的第八目的在于提供一种药物。
本发明的第九目的在于提供一种保健品。
本发明解决其技术问题是采用以下技术方案来实现的。
党参果胶多糖,包括党参果胶多糖CPP1c,党参果胶多糖CPP1c由鼠李糖Rha、阿拉伯糖Ara、半乳糖Gal和半乳糖醛酸GalA按照摩尔比2.99:1.154:1.94:33.29构成;党参果胶多糖CPP1c的糖链为1→4连接的鼠李糖Rha、1→5连接的阿拉伯糖Ara、1→4连接的半乳糖醛酸GalA和1→6连接的半乳糖Gal;其结构单元具有以下结构式:
本发明中提到的党参果胶多糖主要指党参果胶多糖CPP1c,党参果胶多糖CPP1c药用和保健价值较为突出。
上述党参果胶多糖CCP1c在制备促进淋巴细胞增殖的药物中的应用。
上述党参果胶多糖CCP1c在制备改善淋巴细胞活性的药物中的应用。
上述党参果胶多糖CCP1c在制备促进免疫相关分子分泌的药物中的应用。
上述党参果胶多糖CCP1c在制备促进免疫相关基因表达的药物中的应用。
上述党参果胶多糖CCP1c在制备促进免疫相关蛋白分子表达量的药物中的应用。
上述党参果胶多糖CCP1c在制备促进淋巴细胞归巢的药物中的应用。
一种药物,其活性成分为党参果胶多糖CPP1c。
一种保健品,其活性成分为党参果胶多糖CPP1c。
与现有技术相比,本发明的有益效果是:本发明提供的党参果胶多糖CPP1c在促进淋巴细胞增殖,改善淋巴细胞活性,促进免疫相关分子分泌,促进免疫相关基因表达,促进免疫相关蛋白表达和促进淋巴细胞归巢的药物中的应用,增强机体的免疫能力,具有较高的药用价值和保健功能,用于制备的药品和保健品,具有良好的增强免疫的效果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例1中的党参果胶多糖CPP1c促进淋巴细胞增殖结果图;
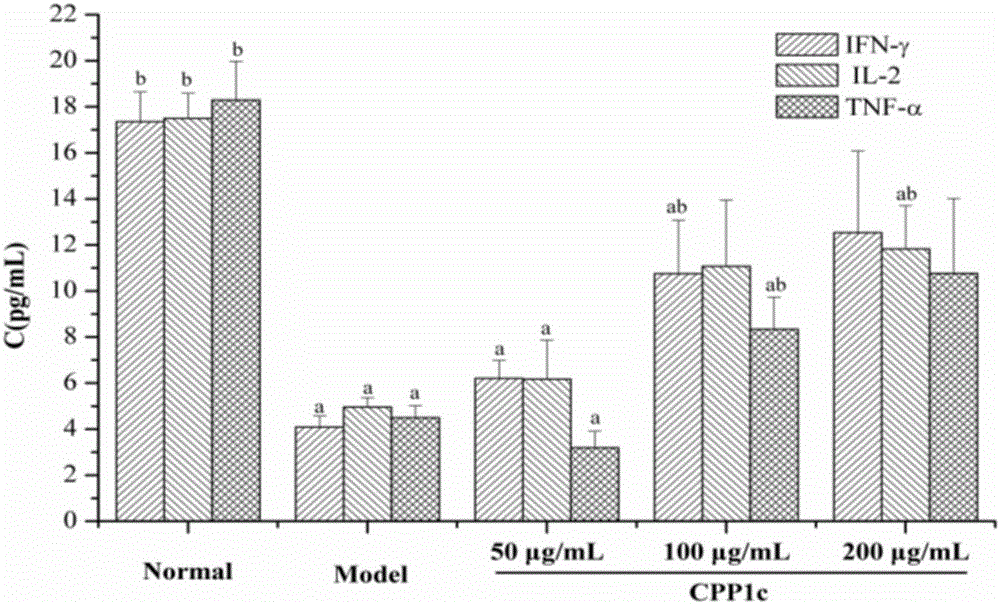
图2为本发明实验例3中的党参果胶多糖CPP1c对免疫相关因子分泌影响的结果图;
图3为本发明实验例3中的党参果胶多糖CPP1c对免疫相关因子分泌的影响结果图;
图4为本发明实验例4中的党参果胶多糖CPP1c对体外淋巴细胞免疫相关基因的mRNA表达的影响结果图;
图5为本发明实验例4中的党参果胶多糖CPP1c对体内淋巴细胞免疫相关基因的mRNA表达的影响结果图;
图6为本发明实验例5中的党参果胶多糖CPP1c对体外淋巴细胞免疫相关蛋白的表达的影响结果图;
图7为本发明实验例5中的党参果胶多糖CPP1c对体内淋巴细胞免疫相关蛋白的表达的影响结果图;
图8为本发明实验例6中的党参果胶多糖CPP1c对体内淋巴细胞的迁移和归巢的影响结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实验动物雄性昆明小鼠,购于兰州大学实验动物中心(许可证号:SCXK(甘)2013-0002);雄性SAMP8小鼠(6月龄),购于北京华阜康生物科技股份有限公司(许可证号:SCXK(京)2014-0004)。
实验试剂MTT(Sigma,美国),ConA/LPS(Sigma,美国),PE-CD3、FITC-CD3、FITC-CD4、Percp/cy5.5-CD8、PE-CD28、APC-CD152(美国Biolegend公司),单克隆抗体PI3K、p38MAPK、CD28(美国Biolegend公司),IL-2、IFN-γ、TNF-α等ELISA检测试剂盒(深圳达科为生物技术有限公司),总RNA提取试剂盒(上海Promega公司),反转录试剂盒、PCR扩增试剂盒(南京诺唯赞公司),PI3K、p38MAPK、CD28引物(上海生工生物工程股份有限公司)。
下面对本发明实施例提供的党参果胶多糖CCP1c在制备增强免疫的药物中的应用作进一步的说明。
免疫系统由免疫器官、免疫细胞和免疫分子组成,是机体执行免疫应答及免疫功能的重要系统。其中,免疫细胞是免疫系统发挥免疫功能的基础。淋巴细胞是免疫细胞的重要组成部分,在体内分布广泛,包括T细胞、B细胞和NK细胞等亚类,分别介导机体的细胞免疫、体液免疫及对肿瘤细胞和病毒感染细胞的杀伤作用等重要免疫学功能。机体免疫功能的高低直接影响机体的抗病能力。提高机体免疫力在很多疾病的治疗中发挥重要作用。许多疾病都需要通过增加免疫细胞数量来提高机体免疫力。研究表明,一些免疫复方可以通过激活免疫细胞而增强机体免疫力。
多糖作为一种无毒副作用且免疫活性较强的天然药物日益得到人们的广泛关注。
党参果胶多糖,包括党参果胶多糖CPP1c;党参果胶多糖CPP1c由鼠李糖Rha、阿拉伯糖Ara、半乳糖Gal和半乳糖醛酸GalA按照摩尔比2.99:1.154:1.94:33.29构成;党参果胶多糖CPP1c的糖链为1→4连接的鼠李糖Rha、1→5连接的阿拉伯糖Ara、1→4连接的半乳糖醛酸GalA和1→6连接的半乳糖Gal;其结构单元具有以下结构式:
上述党参果胶多糖CPP1c在制备促进淋巴细胞增殖的药物中的应用。
淋巴细胞在免疫系统中有着极其重要的作用,是机体免疫功能的主要承担者。检测中药单体或相关化合物是否具有促进淋巴细胞增殖的能力是评价该化合物是否具有增强免疫功能性质的重要依据。MTT实验是检测淋巴细胞体外增殖的经典实验,是一种可靠、简便的检测细胞增殖的技术,在判定药物影响机体免疫功能的研究中被广泛应用。
上述党参果胶多糖CPP1c在制备改善淋巴细胞活性的药物中的应用。
进一步地,上述党参果胶多糖CPP1c促进CD28+T细胞的增加,并减少CD152+T细胞。
在外周血淋巴细胞中,CD28+T细胞占54%-86%,增加CD28+T细胞有助于提高机体免疫能力。淋巴细胞中,CD28分子与CD152分子竞争性的与B7结合;如果分泌CD28分子的CD28+T细胞增多,即相对的减少CD152分子的数量,即达到增强免疫的效果。
上述党参果胶多糖CPP1c在制备促进免疫相关分子分泌的药物中的应用。
进一步地,免疫相关分子包括干扰素γ、白介素-2和肿瘤坏死因子α。
白介素2(IL-2)主要由活化的T淋巴细胞产生,是机体免疫调节网络中重要的调节分子,在抑制肿瘤细胞生长及免疫调节方面发挥着重要的作用。IL-2具有促进T细胞增殖分化、活化B淋巴细胞、增强T细胞和NK细胞活性、诱导干扰素生成的作用。
干扰素γ(IFN-γ)主要由活化的T淋巴细胞产生,是机体免疫调节网络中重要的调节分子,在抑制肿瘤细胞生长及免疫调节方面发挥着重要的作用。IFN-γ可增强抗原提呈细胞与T淋巴细胞的相互作用,进而增强T淋巴细胞辅助抗体产生。IFN-γ水平的高低是机体细胞免疫的重要标志。
肿瘤坏死因子α(tumor necrosis factorα)是一种主要由巨噬细胞和单核细胞产生的促炎细胞因子,并参与正常炎症反应和免疫反应。α肿瘤坏死因子在许多病理状态下产生增多,包括败血症、恶性肿瘤、心脏衰竭和慢性炎性疾病。在重症类风湿关节炎患者的血液及关节中都可发现肿瘤坏死因子增多。
上述党参果胶多糖CPP1c在制备促进免疫相关基因表达的药物中的应用。
进一步地,免疫相关基因包括PI3K基因、CD28基因、p38MAPK基因。
PI3K的聚集与活化在协同刺激信号过程中占据重要位置。CD28与B7的结合,使CD28的胞浆区基序YMNM中Tyr173磷酸化,活化PI3K,促使PIP2转化成PIP3,PIP3与AKT相结合,使其磷酸化而被活化。活化的AKT诱导下面的级联反应,从而调控T细胞的功能。
不同类型的细胞(包括免疫细胞)的增殖和分化的必要而充分的条件是Ras蛋白,而Ras蛋白参与的细胞调控信号通路中,p38MAPK基因参与表达MAPK是很重要的一环,MAPK蛋白加入细胞核,使许多底物蛋白活化,从而调节细胞(包括免疫细胞)的增殖和分化。
上述党参果胶多糖CPP1c在制备促进免疫相关蛋白分子表达量的药物中的应用。
进一步地,免疫相关蛋白包括PI3K、CD28、p38MAPK。
上述党参果胶多糖CPP1c在制备促进淋巴细胞归巢的药物中的应用。
淋巴细胞归巢是以淋巴细胞表面的归巢受体与血管内皮细胞表面的黏附分子——血管地址素的相互作用为基础定向移动的一种迁移活动,在淋巴细胞的成熟、再循环以及向炎症部位渗出过程中均会发生,淋巴细胞在动物体内的迁移、流动和归巢是产生免疫功能的前提。
党参果胶多糖CPP1c能够促进淋巴细胞定向移动并归巢,即提高机体的免疫能力。
上述党参果胶多糖CPP1c在制备增强免疫力的保健品中的应用。
一种药物,其活性成分为党参果胶多糖CPP1c。
一种保健品,其活性成分为党参果胶多糖CPP1c。
以下结合具体实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供党参果胶多糖CPP1c的制备和检测方法。
党参果胶多糖CPP1c的提取方法,包括以下步骤:
1.1党参多糖CPP1的制备提取:党参药材粉碎后,经95%乙醇脱脂处理后,于90℃以上温度的热水中进行提取,提取液浓缩后,提取液用终浓度为10-40%乙醇沉淀,过滤,沉淀为粗党参多糖CPP1,并除蛋白和色素。
1.2称取除蛋白脱色素后的CPP1样品100mg,溶于100mL经0.45μm滤膜过滤的水,离心(3000rpm,3min),取上清液。DE-52纤维素柱在用0.45μm滤膜过滤的水进行平衡后(大约12h),将上述制得溶液上样,流速为25mL/h。
1.3上样结束后,用0.45μm滤膜过滤的水洗脱,洗脱速度设置为25mL/h,并用配套的试管收集洗脱液。采用苯酚硫酸法对每管中的洗脱液的吸光度进行测定,做管号(横坐标)与吸光度值(纵坐标)的洗脱曲线,至几乎没有糖出现时,停止洗脱;将洗脱液合并,浓缩并透析后,冷冻干燥得水洗脱部分。
1.4水洗收集结束后,分别用0.1mol/L、0.2mol/L和0.4mol/L的NaCl溶液以1.2的方法进行洗脱及之后的操作,收集用0.4mol/L的NaCl溶液洗脱所得产物并命名为党参果胶多糖CPP1c。
本发明的发明人通过结合多种化学分析方法及仪器分析方法等,解析了党参果胶多糖CPP1c的结构;通过HPGPC测得上述制备方法制备的党参果胶多糖CPP1c产物纯度为99.02%,表明CPP1c为均一性多糖。通过HPGPC以右旋糖酐系列标准葡聚糖右旋糖酐对照品,测得CPP1c的相对分子量为1.259×105Da;在0.9%NaCl和0.2%NaN3溶液中均是呈现高度分支的聚合物。
党参果胶多糖CPP1c和党参果胶多糖CPP1a的单糖组成测定:
单糖的测定:
2.1准确称取CPP1c 10mg,准确移入新鲜配制的2mol/L三氟乙酸2mL,密封好,置于120℃完全酸水解3h。3h后,取出,减压旋干。
2.2反复加入甲醇(1-2mL),继续旋干,以达到将三氟乙酸完全除去的目的。向上述残渣中继续加入盐酸羟胺10mg,吡啶0.5mL,同时加入肌醇六乙酰酯4mg(作为内标),充分混合后,置于90℃条件下继续反应半小时。
2.3放至室温后,移取乙酸酐0.5mL于上述反应液中,充分混合,同样置于90℃条件下继续反应半小时,减压旋干。将残渣溶于适量氯仿溶液中,用0.45μm有机滤膜进行过滤后,采用GC法对样品进行分析。各单糖的混合对照品(包含有Rha、Ara、Xyl、Man、Glu、Gal)按照2.1和2.2处理样品的方法进行相同操作。
2.4上述操作结束后,用气相色谱GC就行测定;GC的条件为,色谱柱:OV-101(50m×0.25mm i.d.),进样量1μL,程序升温,以15℃/min从175℃升到190℃,保留5min,再以5℃/min升到250℃,保留1.5min。
糖醛酸测定:
3.1准确称取CPP1c 10mg,移入新鲜配制的2mol/L三氟乙酸2mL,密封好,置于120℃完全酸水解3h。3h后,取出,减压旋干。
3.2反复加入甲醇(1-2mL),继续旋干,以达到将三氟乙酸完全除去的目的。移入78μL新鲜配制的Na2CO3溶液(0.5mol/L),于30℃条件下继续反应45min,加入500μL新鲜配制的NaBH4溶液(W/V,4%),常温下继续反应1.5h后。
3.3为除去未反应的NaBH4,向3.2溶液中慢慢加入新鲜配制的25%乙酸,一直到不再有气泡产生为止。将反应液过已处理的732型阳离子交换树脂,并用6mL水进行洗脱。收集洗脱液,并于45℃条件下,旋转蒸发仪旋干后,反复加入适量甲醇,继续旋干,以达到将硼酸盐完全除去的目的。
3.4将3.3残渣密封后,置于85℃反应2h后,用1mL吡啶将残渣溶解,并加正丙胺1mL后,混匀并密封,于55℃继续反应0.5h。放冷后,55℃水浴条件下,氮气吹干。向残渣中相继滴入吡啶及乙酸酐各500μL,密封后,95℃继续反应1h。放冷,0.45μm有机滤膜过滤除杂后,采用GC法分析样品。各单糖的混合对照品(包含有Rha、Ara、Xyl、Man、Glu、Gal、GluA、GalA)按照3.1-3.3处理样品的方法进行相同操作。
上述操作结束后,通过气相色谱GC进行测定,气相色谱色谱柱:OV-101(50m×0.25mm i.d.);进样量:2μL;程序升温:160℃保留4min,以5℃/min升到190℃保留4min,再以3℃/min升到210℃保留15min,以10℃/min升到260℃保留5min。
核磁测定:
称取20mg干燥的党参果胶多糖CPP1c和党参果胶多糖CPP1a,反复用D2O(0.5mL)溶解并冷冻干燥三次后,进行1H NMR及13C NMR分析。
通过上述方法测得党参果胶多糖CPP1c由鼠李糖Rha、阿拉伯糖Ara、半乳糖Gal和半乳糖醛酸GalA按照摩尔比2.99:1.154:1.94:33.29构成;党参果胶多糖CPP1c的糖链为1→4连接的鼠李糖Rha、1→5连接的阿拉伯糖Ara、1→4连接的半乳糖醛酸GalA和1→6连接的半乳糖Gal;其结构单元具有以下结构式:
实施例2
本实施例提供党参果胶多糖CPP1c在制备促进淋巴细胞增殖的药物中的应用。
体外实验
第一部分,淋巴细胞的制备
将在无菌条件下获得的SAMP8小鼠或正常小鼠的脾脏用淋巴细胞分离液进行分离,将其转到离心管中,并小心沿着管壁加入1640培养基,使其与分离液形成界面。3000rpm离心0.5h。用吸管小心将呈雾状的脾细胞层吸出,用培养基进行清洗后,将细胞调整为所需浓度。
第二部分,淋巴细胞增殖实验
1.1实验分组,正常组:普通小鼠脾淋巴细胞+空白培养基;模型组:SAMP8小鼠脾淋巴细胞+空白培养基;党参果胶多糖CPP1c给药组:SAMP8小鼠脾淋巴细胞+CPP1c(CPP1c的终浓度为50μg/mL、100μg/mL、200μg/mL)。
1.2细胞悬液,按照1.1分组情况,分别将普通小鼠或SAMP8小鼠脾淋巴细胞悬液种板,每孔50μL(约含细胞1×104个),设9个平行孔。
1.3给药,按1.2平行孔分组,向正常组和模型组加空白培养基,向党参果胶多糖CPP1c给药组加入梯度浓度的党参果胶多糖CPP1c;每个组中的3个孔加入刀豆蛋白ConA(5μg/mL)100μL,3个孔加入LPS(10μg/mL)100μL,另3孔加入空白培养基100μL。
1.4细胞培养,于培养箱中孵育48h,每个孔加入20μL浓度为5mg/mL的MTT,继续置于培养箱中4h后,加入SDS,小心吹打,使其充分混匀。
1.5孵育,继续孵育12h后,测OD值(570nm)。
按照公式计算刺激指数:刺激指数(SI)=ConA诱导孔OD均值/无ConA诱导孔OD均值;或刺激指数(SI)=LPS诱导孔OD均值/无LPS诱导孔OD均值;刺激指数与细胞增殖呈正相关的相关,即刺激指数大细胞的增殖能力强。
结果如图1所示,与正常组小鼠比较,模型组的刺激指数明显降低;党参果胶多糖CPP1c给药组在ConA或LPS的的诱导下,刺激指数较模型组高,而且随着给药浓度的提高刺激指数增加明显。由于刺激指数与增殖能力正相关。所以可以得出:模型组小鼠脾淋巴细胞在ConA或LPS诱导增殖能力明显减低,而党参果胶多糖CPP1c给药组与模型组相比较,且呈现剂量依赖性,从而表明党参果胶多糖CPP1c具有促进淋巴细胞增殖的能力。
实施例3
本实施例提供党参果胶多糖CPP1c在制备改善淋巴细胞活性的药物中的应用。
体外实验
参考实施例2制备的小鼠淋巴细胞和分组。
进行体外淋巴细胞活性的实验;方法如下:
1.1分别将普通小鼠或SAMP8小鼠脾淋巴细胞悬液种于24孔板中,每孔500μL(约含1×107个)。
1.2按正常组:普通小鼠脾淋巴细胞+空白培养基;模型组:SAMP8小鼠脾淋巴细胞+空白培养基;党参果胶多糖CPP1c给药组:SAMP8小鼠脾淋巴细胞+CPP1c(CPP1c的终浓度为50μg/mL、100μg/mL、200μg/mL)分组;分别向正常组和模型组加空白培养基,向党参果胶多糖CPP1c给药组加入梯度浓度的党参果胶多糖CPP1c,每组设置2个平行孔。于培养箱培养48h后,将细胞分别收集在离心管中,离心,轻轻吸出细胞上方的培养上清液,冷冻保存备用。
1.3加入PBS洗去培养基后,再次加入500μL的PBS重悬细胞。取每组细胞悬液100μL两份,其中一份分别加FITC-CD3 1μL,PE-CD28 2.5μL,APC-152 5μL,混合均匀后,4℃避光反应0.5h。另一份加1.25μL的PE-CD3,5μL的PE/CY7-CD8,0.5μL的FITC-CD4,混合均匀后,4℃避光反应0.5h。离心,收集各组细胞,分别用PBS将其重悬,流式细胞仪测定。
体内实验
本实验共设4组,即正常组、模型组、CPP1c给药组以及胸腺肽阳性对照组。其中,正常组小鼠为普通小鼠,模型组、给药组以及阳性对照组小鼠均为SAMP8小鼠,每组10只。给药组小鼠灌胃党参多糖CPP1c(200mg/kg),阳性对照组小鼠灌胃胸腺肽(10mg/kg)、正常组及模型组均灌胃等量的生理盐水,灌胃14天后,进行实验。
按照实施例2提供的淋巴细胞制备的方法,制备上述各组小鼠的脾淋巴细胞悬液,并根据本实施例体外实验的细胞重悬方法重悬体内实验组的淋巴细胞并进行观察。
体外实验测得CPP1c对T细胞亚群比例的影响,如表1所示,相较于正常组,模型组小鼠CD8+T细胞比例降低(P<0.05),CD4+T细胞的比例升高,且CD4+/CD8+比值较高(P<0.05),偏离正常值(1.5-2.5);同时,模型鼠中,促进T细胞活化的CD28+T的比例降低(P<0.05),抑制T细胞活化的CD152+T细胞表达升高(P<0.05)。相较于模型组,CPP1c给药组小鼠CD8+T细胞比例升高,CD4+T细胞的比例降低,使得CD4+/CD8+比值具有降低趋势,接近正常值;另外,给药组小鼠的CD28+T细胞比例升高,CD152+T细胞比例降低。
表1 CPP1c对体外培养的淋巴细胞T细胞亚群比例的影响(n=3)
a表示与Normal组相比有显著性差异,即P<0.05;b均表示与Model组有显著性差异,即P<0.05。
体内实验结果如表2所示,相较于正常组,模型组小鼠脾淋巴细胞CD8+T细胞比例降低(P<0.05),CD4+T细胞的比例升高,且CD4+/CD8+比值偏离正常值(P<0.05);同时,CD28+T细胞的比例减少(P<0.05),CD152+T细胞的比例升高(P<0.05)。相较于模型组,CPP1c给药组小鼠及胸腺肽阳性对照组小鼠,CD8+T细胞比例升高,CD4+T细胞的比例降低,使CD4+/CD8+比值接近正常值;另外,给药组小鼠CD28+T细胞比例升高,CD152+T细胞比例降低。
表2 CPP1c对体内培养的淋巴细胞T细胞亚群比例的影响(n=3)
a表示与Normal组相比有显著性差异,即P<0.05;b均表示与Model组有显著性差异,即P<0.05。
因此,CPP1c能促进小鼠CD28+T细胞比例升高,CD152+T细胞比例降低。
实施例4
本实施例提供党参果胶多糖CPP1c在制备促进免疫相关分子分泌的药物中的应用。
体外实验
采用ELISA法对细胞培养上清液中IL-2、IFN-γ、TNF-α含量进行测定。具体实验步骤如下:
1.1实验前,将所有需要用到的试剂充分混合均匀,混合过程中避免泡沫的产生,并将其放在室温中平衡0.5h。
1.2将稀释后的不同浓度的Cytokine standard及样品加入实验孔中,每孔100μL,同时设置只加Dilutionbuffer R(1×)的空白孔,均设复孔3个。
1.3每孔加入稀释后的Biotinylated antibody,孵育1.5h后,进行清洗。随后,每孔加入稀释后的Streptavidin-HRP并孵育0.5h,清洗后,加入TMB,37℃避光温育20min左右,加入Stop solution终止反应,测OD值(450nm)。
1.4制作标准品的浓度与OD值间的线性曲线,并计算样品浓度。
体内实验
取小鼠全血,放置2h后,离心,取血清,按照上述的ELISA方法操作,检测血清中IL-2、IFN-γ、TNF-α含量。
在体外实验中,结果如图2所示,模型组小鼠的IL-2、IFN-γ及TNF-α含量较正常小鼠显著降低(P<0.05)。相较于模型组,CPP1c给药组的IL-2、IFN-γ及TNF-α分泌量均明显升高且呈剂量依赖型。
在体内实验中,如图3所示,模型组小鼠的IL-2、IFN-γ及TNF-α含量较正常小鼠显著下降(P<0.05)。相较于模型组,CPP1c组及胸腺肽阳性对照组的IL-2、IFN-γ及TNF-α含量均显著升高。
因此,CPP1c可能以促进脾细胞分泌IFN-γ、IL-2及TNF-α的方式,增强机体的免疫功能,从而发挥免疫作用。
实施例5
本实施例提供党参果胶多糖CPP1c在制备促进免疫相关基因表达的药物中的应用。
体外实验
参考实施例2的细胞培养、分组和重悬的步骤,设置待测组和对照组;分别收集各组细胞,并提取样本的总RNA,测定其浓度并将各样本RNA浓度调整一致,进行逆转录和荧光定量qRT-PCR,并以β-actin作为内参基因,测定各组PI3K基因、CD28基因、p38MAPK基因mRNA的相对表达量。反应结束后,根据扩增曲线及溶解曲线和Ct值,用相对定量的方法,计算相对表达量。
相对表达量F=2-{[待测组基因Ct平均值-待测组内参基因Ct平均值]-[对照组基因Ct平均值-对照组内参基因Ct平均值]}
逆转录反应体系为:2×RT Mix 10μL,HiSCRIPT Enzyme Mix 2μL,Oligo(dT)18(50μM)1μL,Random hexamers(50ng/μL),1μL,Total RNA 10pg-1μg,RNase free ddH2O补足到20μL。反应程序,25℃,5min;50℃,15min;85℃,5min。
荧光定量qRT-PCR反应体系,AceQTM qPCR SYBR Green Master Mix,10μL;primer F,0.4μL,primer R,0.4μL,ROX Reference Dye 1,0.4μL;cDNA,2μL;ddH2O补足到20。反应程序为:预变性,95℃,5min;循环反应,95℃,10s,60℃,30s;循环40次;溶解曲线,95℃,15s;60℃,60s,95℃,15s。
体内实验
按照实施例2提供的淋巴细胞制备的方法,取实施例3提供的体内实验组小鼠的脾淋巴细胞。按照本实施例体外实验提供的实验方法,检测各组细胞中的PI3K基因、CD28基因、p38MAPK基因mRNA的相对表达量。
扩增反应所用引物对如表3所示。
表3 PCR反应所用引物
本实验中,以β-actin为内参基因,以模型组为对照组,采用相对定量法2-ΔΔCt,测各基因的mRNA的表达量。
体外实验结果如图4显示,与模型组小鼠相比,CPP1c组小鼠脾淋巴细胞中PI3K、CD28、p38MAPK基因的mRNA的表达量均呈升高趋势(P<0.05),且呈剂量依赖型;而在体内实验结果如图5显示,与模型组小鼠相比,CPP1c组及胸腺肽阳性对照组小鼠脾脏淋巴细胞中PI3K、CD28、p38MAPK基因的mRNA的表达量明显升高(P<0.05)。
因此,CPP1c可通过促进p38MAPK、CD28及PI3K基因的mRNA的表达,发挥增强免疫的作用。
实施例6
本实施例提供了党参果胶多糖CPP1c在制备促进免疫相关蛋白分子表达量的药物中的应用。
体外实验
参考实施例3的细胞培养、分组和重悬的步骤,设置待测组和对照组;分别收集各组细胞,加入裂解液进行裂解,离心并取上清液。测上清液中所含蛋白量,将各样品调整为相同的蛋白浓度后,加入上样缓冲液(细胞蛋白溶液:上样缓冲液=3:1)并煮沸10min,所得即为样品溶液。将样品上样,电泳,转膜,封闭后,分别用一抗(PI3K、p38MAPK及CD28)及相应二抗孵育,TBST清洗后,加入ECL发光液,并用凝胶成像仪分析。
体内实验
按照实施例2提供的淋巴细胞制备的方法,取实施例3体内实验组小鼠的脾淋巴细胞。按照本实施例体外实验提供的实验方法,检测各组PI3K、CD28、p38MAPK蛋白的含量。
在体外实验中,结果如图6所示,图中,左图为蛋白质印迹结果图,右图为目的蛋白现对于内参的表达量比值图;相较于模型组,不同剂量浓度的CPP1c对SAMP8小鼠的脾淋巴细胞p38MAPK、CD28及PI3K蛋白表达量均呈现增加趋势。
在体内实验中,结果如图7所示,图中,左图为蛋白质印迹结果图,右图为目的蛋白相对于内参的表达量比值图;与模型组比较,CPP1c组及胸腺肽阳性对照组小鼠的脾淋巴细胞p38MAPK、CD28及PI3K蛋白表达量均增加。
因此,可以看出,CPP1c可以通过促进小鼠的脾淋巴细胞p38MAPK、CD28及PI3K蛋白表达量增加;从而提高免疫能力。
实施例7
本实施例提供党参果胶多糖CPP1c在制备促进淋巴细胞归巢的药物中的应用。
本实验中,保证所有操作均在25℃条件下进行
1.1取未给药的正常小鼠脾淋巴细胞悬液(含2×107个细胞)于离心管中,离心后,细胞用无血清培养基洗1次。弃上清,使离心管中剩余液体小于25μL。
1.2加1mL稀释液C,轻轻重悬细胞。
1.3染液的配制:向1mL稀释液C中加入4μL PKH26的乙醇溶液。
1.4将1mL淋巴细胞悬液迅速加入到1mL上述染液中,染色5min。
1.5加入2mL血清终止染色,并培养1min。离心,用完全培养基洗1.4转染的细胞2次后,重悬细胞。
1.6小鼠射尾静脉注射PKH26染色的淋巴细胞悬液,0.5mL/只(约含细胞5×105个),活体成像仪追踪,并拍照。
实验结果如图8所示,在注射PKH26标记小鼠淋巴细胞1h后,可以看到淋巴细胞广泛分布于小鼠体内。而7、21及24h后,在正常小鼠中,淋巴细胞逐渐移向淋巴组织(如胸腺、脾脏),并最终(24h)归巢于脾脏。在模型鼠中,淋巴细胞虽然也逐渐移向淋巴组织(如胸腺、脾脏),但由于模型鼠胸腺的萎缩及淋巴细胞功能的下降,而使大部分淋巴细胞最终(24h时)归巢于胸腺。在SAMP8鼠灌胃给药CPP1c或胸腺肽后,大部分淋巴细胞出现向脾脏及胸腺归巢的现象,从而表明CPP1c具有促进淋巴细胞归巢的功能。
实施例8
本实施例提供了党参果胶多糖CPP1c在制备增强免疫力的保健品中的应用。
该保健品具有促进淋巴细胞增殖、改善淋巴细胞活性、促进免疫相关分子及相关基因表达和促进淋巴细胞归巢的作用。
实施例9
本实施例提供了一种药物,该药物的活性成分为党参果胶多糖CPP1c,该药物还包括其他的常规增强免疫的药物。
该药物具有增强机体免疫的作用。
实施例10
本实施例提供了一种保健品,该保健品的活性成分为党参果胶多糖CPP1c,该保健品还包括其他常规的增强免疫的保健药。
该保健品具有增强机体免疫的作用。
综上所述,本发明实施例的党参果胶多糖CPP1c在制备增强免疫的药物及保健品中的应用;党参果胶多糖CPP1c能促进促进淋巴细胞增殖、改善淋巴细胞活性、促进免疫相关分子及相关基因表达和促进淋巴细胞归巢,具有较好的医药价值和保健功能,值得推广和应用。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!