海藻低聚糖在制备抗禽白血病病毒制剂中的应用的制作方法
本发明涉及生物医学技术领域,具体涉及海藻低聚糖在制备抗禽白血病病毒制剂中的应用。
背景技术:
禽白血病(Avian leucosis)是由反转录病毒科(Retroviridae)禽白血病/肉瘤病毒群(Avian leukosis/Sarcoma virus, ALV)引起的以造血细胞恶性增生为主的多种肿瘤性疾病的总称。根据临床症状可分为淋巴细胞性白血病、成红细胞性白血病、成髓细胞白血病、髓细胞样白血病、结缔组织性肿瘤、骨硬化病等。自1908年首次报道并分离到ALV以来,已在世界上许多国家流行和发生,给养殖业造成巨大的经济损失。目前,仍没有合适的药物和疫苗来预防和治疗ALV的发生和流行,主要通过检疫净化、淘汰阳性鸡,建立无ALV的种禽群等手段来预防。因此,迫切需要寻找天然无毒的新型药物来治疗或抵抗ALV。
天然海藻多糖来源广泛,储存量巨大,制备简单,目前已被发现具有多种生物活性:抗氧化、抗炎、抗菌、抗肿瘤、抗凝血等。更重要的是,近20年来,人们发现海藻多糖显示出对病毒的广谱抑制性,如单纯疱疹病毒、牛免疫缺陷病毒、萨科齐病毒等。但天然海藻多糖粘度高、水溶性差,不能穿越各种屏障甚至是细胞膜,直接作为药物开发存在很大限制。海藻低聚糖与天然海藻多糖相比,具有水溶性好,稳定性高等特点,经报道,其在促植物生长、抗氧化、免疫调节等方面的效果优于海藻多糖。但其在抵抗禽白血病病毒方面的用途尚未见报道。
技术实现要素:
本发明的目的是提供海藻低聚糖在制备抗禽白血病病毒制剂中的应用。
本发明实现目的的方案如下:
海藻低聚糖在制备抗禽白血病病毒制剂中的应用。
优选的;所述禽白血病病毒包括可致畜禽淋巴细胞性白血病、成红细胞性白血病、成骨髓细胞性白血病、髓细胞样白血病、结缔组织性肿瘤和骨硬化病的A-J亚群病毒。
优选的;所述海藻低聚糖的平均分子量为1KDa-50KDa。
优选的;所述海藻低聚糖的硫酸根含量为5-40%。
优选的;所述海藻低聚糖是从蜈蚣藻、麒麟菜、龙须菜、孔石莼、裙带菜、浒苔、羊栖菜、海带、马尾藻中的一种或几种大型海藻中提取的粗多糖通过降解的方法获得的低聚糖。
本发明的优点:
1)本发明涉及的海藻低聚糖来自天然大型海藻,资源丰富,天然无毒,同时具有抗禽白血病病毒和提高畜禽机体免疫力的功能。
2)利用本发明中的海藻低聚糖作用于吸附细胞时的病毒,通过IDEXX禽白血病P27抗原ELISA检测试剂盒检测(检测方法参考:王广文, 牛玉娟, 胡东方, 王彤彤, 张振东, 吕传卫, 屈亚锦, 李宁, 刘思当. 利巴韦林、病毒灵、黄芪多糖体外抗ALV-J的活性实验. 中国兽药杂志[J], 2014, 48(5): 36-39)可反映出海藻低聚糖的抗病毒效果。另外通过荧光定量PCR、蛋白质免疫印迹实验(实验方法参考:Zhang Limei, CaiDongjie, Zhao Xiaona, Cheng Ziqiang, GuoHuijun, Qi Chunhua, Liu Jianzhu, XuRuixue, Zhao Peng, Cui Zhizhong. Liposomes containing recombinant gp85 protein vaccine against ALV-J in chickens. Vaccine[J], 2014, 32(21), 2452-2456)从基因和蛋白质水平评价海藻低聚糖的抗病毒作用,结果显示海藻低聚糖显著抑制病毒RNA的复制以及蛋白质的生成,抗病毒效果显著(见实施例2),在禽畜动物抗病毒制剂领域具有潜在应用价值。
附图说明
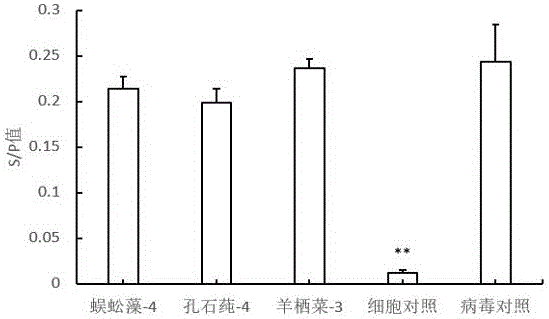
图1为本发明实施例提供的海藻低聚糖样品筛选图,其中“*”表示和对照间存在显著差异(P<0.05,以下同),“**”表示和对照间存在极显著差异(P<0.01,以下同);
图2为本发明实施例提供的海藻低聚糖样品对ALV预防作用图;
图3为本发明实施例提供的海藻低聚糖样品对ALV吸附抑制作用图;
图4为本发明实施例提供的海藻低聚糖样品对ALV治疗作用图;
图5为本发明实施例提供的海藻低聚糖样品体外抗ALV病毒ALV相对表达量图;
图6为本发明实施例提供的海藻低聚糖样品体外抗ALV病毒ALVgp-85蛋白表达量图。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
分别以蜈蚣藻、孔石莼和羊栖菜为例提取海藻多糖:
将蜈蚣藻(Grateloupia filicina)洗净、50℃烘干至恒重,破碎,取破碎后的蜈蚣藻10g,加入600mL蒸馏水,于100℃水浴中浸提4小时;分别用100目,200目和300目筛绢将滤渣滤出,滤液透析除盐后减压浓缩为原体积的1/10,加入浓缩液3倍体积的无水乙醇醇沉24小时,离心,沉淀冻干,即得蜈蚣藻多糖,待用。
将孔石莼(Ulva Pertusa)洗净、50℃烘干至恒重,破碎,取破碎后的孔石莼10g,加入400mL蒸馏水,于125℃水浴中浸提4小时;分别用100目,200目和300目筛绢将滤渣滤出,滤液透析除盐后减压浓缩为原体积的1/10,加入浓缩液3倍体积的无水乙醇醇沉24小时,离心,沉淀冻干,即得孔石莼多糖,待用。
将羊栖菜(Sargassumfusiforme)洗净、50℃烘干至恒重,破碎,取破碎后的羊栖菜10g,加入300mL蒸馏水,于70℃水浴中浸提4小时;分别用100目,200目和300目筛绢将滤渣滤出,滤液透析除盐后减压浓缩为原体积的1/10,加入浓缩液3倍体积的无水乙醇醇沉24小时,离心,沉淀冻干,即得羊栖菜多糖,待用。
分别以上述制得的蜈蚣藻多糖、孔石莼多糖、羊栖菜多糖为原料进一步制备海藻低聚糖。将上述各海藻多糖分别溶于水,配成质量浓度为2%的水溶液,加入30%的过氧化氢溶液使过氧化氢终浓度为0.3-3%,调节pH值至1-4,在70-100℃的条件下水浴加热,搅拌降解45-240min,反应后待溶液冷却至室温,中和至中性,经透析、浓缩、冷冻干燥可得平均分子量在1kDa-50kDa的多种海藻低聚糖。共制得12种海藻低聚糖,将各海藻低聚糖样品按来源与分子量大小分别编号为蜈蚣藻2-5、孔石莼2-5和羊栖菜2-5,其中,蜈蚣藻多糖、孔石莼多糖、羊栖菜多糖的编号为蜈蚣藻-1、孔石莼-1、羊栖菜-1。各海藻低聚糖样品具体降解条件见表1。
表1海藻多糖和海藻低聚糖降解条件
实施例2
体外抗禽白血病病毒实验
试剂配制说明:
细胞生长液:10mL胎牛血清加入90mL DMEM培养基。
细胞维持液:2mL胎牛血清加入98mL DMEM培养基。
PBS缓冲液:取8gNaCl、0.2gKCl、3.58g Na2HPO4·12H2O、0.27g KH2PO4溶于1L双蒸水中,调pH至7.2-7.4,过三层0.22μm滤膜,灭菌。
1)细胞毒实验
鸡胚成纤维细胞(DF-1)平铺于96孔板上,在细胞生长液中生长至单层后,弃掉培养液,用PBS洗三遍,每孔加入用细胞维持液配制的、浓度分别为2、1、0.5、0.25、0.125、0.0625、0.03125mg/mL的各海藻低聚糖溶液100μL,每个浓度三个重复,同时设置细胞对照组(单层细胞加入100μL细胞维持液)和空白对照组(空白孔中加入100μL细胞维持液),维持24h。24h后将其中培养基弃掉,用PBS清洗3遍,加入100μL细胞维持液,以及10μL2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐(Cell Counting Kit-8,CCK-8)溶液,静置3h,在450nm波长下检测吸光度。细胞活性(A)用以下公式计算:A=(A样品-A空白)/(A细胞-A空白)×100%。结果表明所有海藻低聚糖半数抑制浓度(IC50)均在2mg/mL以上,以下浓度均为安全浓度。具体结果见表2。
表2细胞相对活性表
表2中浓度单位:mg/mL
2)样品筛选实验
鸡胚成纤维细胞(DF-1)平铺于96孔板上,在细胞生长液中生长至单层后,弃掉培养液,用PBS清洗三遍,接种100μL半数组织感染剂量一百倍(100TCID50)的ALV,同时加入100μL用细胞维持液配制的各海藻低聚糖样品溶液,使样品溶液与病毒液混合后的终浓度为2mg/mL,置于37℃下孵育2h后弃掉混合液,用PBS洗三遍,再加入100μL用细胞维持液配制的2 mg/mL各海藻低聚糖样品溶液,每个样品三个重复,同时设置细胞对照组、病毒对照组,维持24h后采用IDEXX禽白血病P27抗原ELISA检测试剂盒检测上清中的P27抗原表达量,检测波长650nm,最后按照公式S/P=(A样品-A阴性对照)/(A阳性对照-A阴性对照)计算S/P值,阴性对照和阳性对照为试剂盒中自带对照样品,并规定当S/P值大于0.2时判定为阳性。结果如图1所示,所有样品均对ALV有非常明显的抑制作用。病毒对照S/P值达到0.28,抗原水平较高,除蜈蚣藻-1和蜈蚣藻-2的S/P分别为0.207和0.233外,其余低聚糖样品S/P值均在0.2以下,显示为阴性。孔石莼低聚糖样品与羊栖菜低聚糖样品抗原整体水平低于蜈蚣藻低聚糖样品,说明前两者抗病毒效果可能优于后者。根据结果,我们从三类样品中分别筛选出三个效果最好的海藻低聚糖样品进行后续实验分析,分别为蜈蚣藻-4(S/P值为0.136)、孔石莼-4(S/P值0.109)和羊栖菜-3(S/P值为0.108)。
3)作用机理检测
将DF-1细胞接种于96孔板上,在37℃、5%CO2条件下长成单层后,测定上述筛选的三种海藻低聚糖对病毒的预防作用、阻止病毒吸附作用以及治疗作用。
预防作用:分别将上述筛选出的三种海藻低聚糖溶于细胞维持液配成1mg/mL,取100μL加到长成单层的DF-1细胞上,37℃作用2h,弃掉药液,用PBS清洗三遍,接种100TCID50的ALV 100μL,37℃孵育2h,弃掉病毒液,用PBS清洗三遍,加入100μL细胞维持液在37℃、5%CO2培养箱维持24h,同时设置细胞对照组和病毒对照组,用IDEXX禽白血病P27抗原ELISA检测试剂盒检测上清液中的P27抗原表达量。结果如图2所示,三种海藻低聚糖样品对病毒没有抑制作用,先给药后接毒的方式不能实现其抗病毒效果。
阻止病毒吸附作用:分别将100μL用细胞维持液配制的蜈蚣藻-4、孔石莼-4、羊栖菜-3溶液加入到生长至单层的DF-1细胞上,同时接种100TCID50的ALV 100μL,使各海藻低聚糖药液与病毒液混合后终浓度达到1mg/mL,置于4℃下作用2h。之后弃掉混合液,用PBS清洗三遍,加入100μL细胞维持液在37℃、5%CO2培养箱维持24h,同时设置细胞对照组和病毒对照组。用IDEXX禽白血病P27抗原ELISA检测试剂盒检测上清液的P27抗原表达量。结果如图3所示,海藻低聚糖能显著抑制病毒的吸附。
治疗作用:接种100TCID50的ALV于生长至单层的DF-1细胞上,100μL/孔,37℃孵育2h后弃掉病毒液,用PBS清洗三次,加入用细胞维持液配制的1mg/mL上述筛选出的三种海藻低聚糖溶液100μL,在37℃、5%CO2培养箱维持24h,同时设置细胞对照组和病毒对照组。用IDEXX禽白血病P27抗原ELISA检测试剂盒检测上清液中的P27抗原表达量。结果如图4所示,实验组与病毒对照组间没有显著差异,无治疗作用。
4)荧光定量PCR测病毒相对表达量
根据上述结果,我们采用同时接种ALV病毒和海藻低聚糖药物的方式来检测病毒的相对表达量。具体操作为:DF-1细胞接种于12孔板上生长至单层后接种ALV-J病毒100μL,同时加入用细胞维持液配成的蜈蚣藻-4、孔石莼-4、羊栖菜-3溶液100μL,设置三个稀释度(1000μg/mL、200μg/mL、40μg/mL),在37℃下孵育2h,弃掉混合液,用PBS清洗三遍,加入100μL细胞维持液在37℃、5%CO2培养箱维持24h,细胞用PBS清洗三遍后提取RNA,经反转录后通过荧光定量PCR检测ALV表达量。结果如图5所示,实验表明,1000μg/mL蜈蚣藻-4处理组ALV表达量为3.44,200μg/mL的蜈蚣藻-4处理组ALV表达量达到42.53,显著低于病毒对照的82.49,但40μg/mL蜈蚣藻-4处理病毒表达量为106.04,高于病毒对照组,说明低浓度的蜈蚣藻低聚糖可能对病毒生长具有一定的促进作用。1000μg/mL、200μg/mL、40μg/mL的孔石莼-4处理组ALV表达量分别为35.91、58.22和74.29,与病毒对照组差异显著,说明孔石莼低聚糖能显著抑制ALV。对于羊栖菜-3,在三个浓度下ALV的表达量为2.22、11.51和10.59,均能显著抑制ALV,且40μg/mL的羊栖菜低聚糖就能达到很好的抑制效果。上述实验结果表明,三种海藻低聚糖可以从RNA水平抑制ALV的相对表达量,其中羊栖菜-3的抑制效果最好。
5)蛋白质免疫印迹(western-blot)
DF-1细胞接种于12孔板上生长至单层后接种ALV病毒100μL,同时加入用细胞维持液配成的蜈蚣藻-4、孔石莼-4、羊栖菜-3溶液100μL,设置三个稀释度(1000μg/mL、200μg/mL、40μg/mL),在37℃下孵育2h,弃掉混合液,用PBS清洗三遍,加入100μL细胞维持液在37℃、5%CO2培养箱维持48h,弃掉培养基,用PBS清洗三遍,裂解细胞,经SDS-PAGE电泳、转膜、免疫反应、显影定影后对凝胶图像进行分析。我们使用根据ALV特异性抗原蛋白gp-85设计的单克隆抗体进行western-blot实验,条带深浅可表示gp-85蛋白的含量。结果如图6所示,gp-85蛋白在三种药液1000μg/mL浓度下含量很低,随着药液浓度的降低,gp-85蛋白含量逐渐升高,表明海藻低聚糖抗病毒效果随浓度降低而降低。另外羊栖菜-3样品在200μg/mL和40μg/mL下gp-85蛋白含量依然较低,与荧光定量PCR所测结果相一致,同样表明羊栖菜低聚糖样品抗病毒效果最好。
- 还没有人留言评论。精彩留言会获得点赞!