带有瓣膜的球囊反搏驱动的机械辅助循环装置的制作方法
本申请涉及医疗器械技术领域,具体地说,涉及一种带有瓣膜的球囊反搏驱动的机械辅助循环装置。
背景技术:
随着人口老龄化加剧,心衰患者越来越多,几乎所有的心脏病最后都将走向心力衰竭。心衰治疗费用高昂,给整个社会带来了沉重负担。心衰治疗方法局限,效果并不理想。特别是对于晚期心衰患者,药物治疗效果很差,心脏移植治疗效果好,但移植面临供体严重缺乏、移植后免疫抑制、药物昂贵等问题,故移植治疗经多年发展,仍不能解决根本问题。机械辅助循环(Mechanical Circulation Support,MCS)的出现,为终末期心衰的治疗带来了一线曙光。MCS能增加心衰患者的心输出量,减轻心脏的前后负荷,从而减少心肌细胞氧耗,提高舒张期血压。在部分替代心脏泵功能的同时,MCS使得心脏处于休息状态,可使心功能有所恢复。其作用迅速肯定,是药物治疗无法比拟的。
根据治疗目的和辅助时间的长短,机械辅助循环可分为:①暂时性的支持治疗,使患者心功能有机会得以恢复,例如急性重症心肌炎、急性心梗、顽固性室性心律失常、术后低心排等,可通过辅助循环的帮助使患者度过急性期;②移植前辅助支持(Bridege to Transplant Therapy,BTT),用于供心短缺需等待心脏移植的患者;③永久替代治疗(Destination Therapy,DT)。
机械辅助循环装置按植入方式分为植入式和非植入式。非植入式心室辅助装置以气动式搏动泵为主,通过驱动器产生气体驱动力,使得血泵产生搏动性泵血。其优点是构造简单可靠,不受胸腔大小限制,血流为搏动性,费用较低,管理方便。但其体积较大,寿命有限,不适合植入患者体内,不能进行长期的辅助。近年来,非植入式的辅助装置应用逐渐局限于小儿的短期辅助。植入式心室辅助装置以轴流泵和离心泵为主流,通过电机带动桨叶旋转,推动血流,体积小,可植入胸腔,驱动器携带方便,只有一根电线引出,可长时间甚至永久代替自身心脏。
心室辅助装置根据设计形式分为三代。第一代为搏动泵,代表是HeartMate XVE,FDA批准其用于BTT,2002年批准用于DT。第二代为轴流泵,代表是HeartMateⅡ,有轴承和定子。第三代为离心泵,代表是HeartWare,使用磁悬浮和水动力悬浮轴承。近年来,植入式心室辅助装置日新月异,性能优异的新型泵不断出现。但是国外成熟产品尚不能进入国内。已经完成FDA批准和CE认证的成熟产品,进入中国市场,也需要时间和经费通过国内审批。同时,这些进口设备价格高昂,一项综合6个VAD临床实验费用效益比的荟萃分析发现,HeartMate可使每例患者的生存时间增加18.3个月,费用增加了99,475美元。每个VAD植入病人平均花费21万美元,再次植入VAD花费10万美元。这些花费,对于国内患者而言,也难以接受。
这就是国内心血管医师面临的困难现状:一方面有大量需要救治的患者,另一方面国外产品难以进入国内市场,而国内尚无成熟产品可用。使得临床很多情况下,医生缺乏有力的武器,只能目睹本可救治的患者被病魔吞噬。
技术实现要素:
有鉴于此,本申请所要解决的技术问题是提供了一种带有瓣膜的球囊反搏驱动的机械辅助循环装置,具有小型化、微型化等特点,既可以体外进行循环辅助,又可以微型化经血管介入途径置入进行循环辅助,还可以连接氧合器作为一种新型体外膜肺氧合装置。
为了解决上述技术问题,本申请有如下技术方案:
一种带有瓣膜的球囊反搏驱动的机械辅助循环装置,其特征在于,包括:引流管路、输入瓣膜、球囊反搏系统、储血室、输出瓣膜和输注管路,其中,
所述球囊反搏系统,包括:控制系统、报警系统和球囊,所述球囊通过球囊导管与所述控制系统和所述报警系统连接,所述球囊内填充有工作介质,所述工作介质为气体或液体,所述球囊的容积为0.1ml至500ml,所述球囊的反搏频率为1次/分至100000次/分,所述球囊的反搏压力为1mmHg至300mmHg;
所述球囊位于所述储血室内,所述球囊导管的两端经由所述输注管路或所述引流管路分别连接到位于所述储血室内的所述球囊以及位于体外的控制系统和报警系统,所述控制系统通过所述球囊导管控制所述球囊的反搏频率,所述球囊反搏时为所述储血室提供将血液排出的驱动力,控制所述储血室的出血容量,当所述球囊内的工作介质发生泄漏时,所述报警系统进行泄漏报警;
所述引流管路通过所述输入瓣膜连接到所述储血室,使得血流从所述引流管路单向输入到所述储血室;
所述储血室通过所述输出瓣膜连接到所述输注管路,使得血流从所述储血室单向输出到所述输注管路;
所述储血室的容积为0.2ml至600ml,所述输入瓣膜和所述输出瓣膜为金属瓣膜、生物瓣膜、高分子材料瓣膜或自动化控制的阀门装置;
将所述所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体外时,形成体外机械辅助循环装置,将所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体内时,形成体内机械辅助循环装置。
优选地,其中:
所述球囊采用高分子材料、生物材料或金属材料制成,或采用高分子材料、生物材料和金属材料构成的复合材料制成。
优选地,其中:
所述球囊采用或不采用药物涂层,所述球囊采用或不采用亲水涂层,所述药物涂层包括:肝素涂层和雷帕霉素涂层。
优选地,其中:
所述引流管路和所述输注管路为圆柱形,采用金属材料、高分子材料、生物材料制成或者采用金属材料、高分子材料和生物材料构成的复合材料制成。
优选地,其中:
所述引流管路和所述输注管路上带有或不带有侧孔,所述侧孔用于将血流从所述引流管路输入或从所述输注管路输出。
优选地,其中:
所述储血室为球形、圆柱形、椭圆球形或不规则形体,采用人工血管、高分子材料、生物材料或金属制成或者采用金属、人工血管、高分子材料和生物材料构成的复合材料制成。
优选地,其中:
所述引流管路、所述输注管路和所述储血室采用或不采用药物涂层,所述引流管路、所述输注管路和所述储血室采用或不采用亲水涂层,所述引流管路、所述输注管路和所述储血室采用或不采用高分子材料涂层,所述药物涂层包括:肝素涂层和雷帕霉素涂层。
优选地,其中:
将所述所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体外时,所述引流管路的输入端连接到静脉、右心房或左心室,所述输注管路的输出端连接到静脉或动脉,所述球囊的容积为1ml至500ml,所述球囊的反搏频率为0次/分至300次/分,所述球囊的反搏压力为1mmHg至300mmHg,所述储血室的排出血容量为0ml/分至15000ml/分。
优选地,其中:
将所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体内时,所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜位于左心室内或主动脉内,所述引流管路经主动脉瓣瓣口位于左心室内,所述输注管路在主动脉内,将血液输注至所述主动脉内;
所述球囊容积为0.1ml-100ml,所述球囊反搏频率从0次/分至100000次/分,所述储血室排出血容量为0ml/分至100000ml/分,所述引流管路的直径为1mm至30mm。
优选地,其中:
将所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体内时,所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜位于右心室内或肺动脉内,所述引流管路经肺动瓣瓣口位于右心室内,所述输注管路在主肺动脉内,将右心室内血液输注到所述主肺动脉内;
所述球囊容积为0.1ml-100ml,所述球囊反搏频率从0次/分至100000次/分,所述储血室排出血容量为0ml/分至100000ml/分,所述引流管路的直径为1mm至30mm。
与现有技术相比,本申请所述的机械辅助循环装置,达到了如下效果:
第一,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置,能够提供高流量循环辅助,具有可小型化和微型化的特点,制作工艺简单,既可以体外进行循环辅助,又可以微型化经血管介入途径置入人体内进行循环辅助,也可连接氧合器,作为一种新型体外膜肺氧合装置。
第二,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置中,引流管路、输注管路、球囊和储血室采用或不采用肝素或雷帕霉素等药物,采用或不采用亲水涂层,有效预防引流管路、输注管路、储血室以及球囊附壁血栓形成,还能防止激活血小板、凝血因子等。
第三,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置中,输入瓣膜和输出瓣膜采用金属瓣膜、生物瓣膜、高分子材料瓣膜或自动化控制的阀门装置等制成,能够有效保证血流单向流动,且具有良好的生物相容性。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
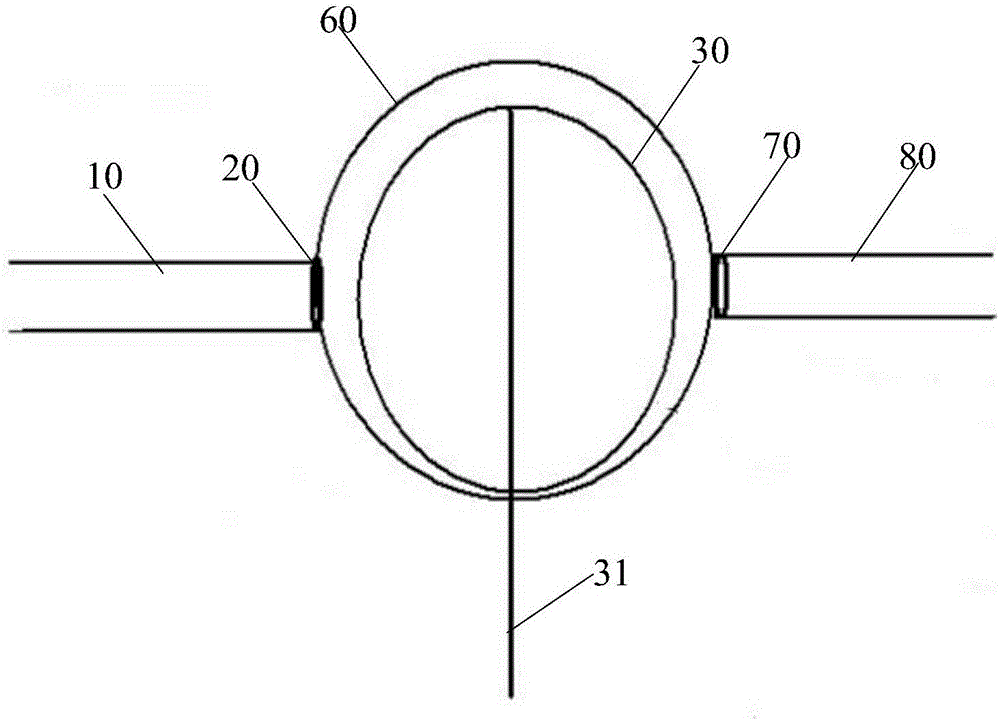
图1为本发明的所述一种带有瓣膜的球囊反搏驱动的机械辅助循环装置结构示意图;
图2为本发明中带有瓣膜的球囊反搏驱动的机械辅助循环装置作为体外机械辅助循环装置的构成示意图;
图3为本发明中带有瓣膜的球囊反搏驱动的机械辅助循环装置作为体内左心室机械辅助循环装置的构成示意图;
图4为本发明中带有瓣膜的球囊反搏驱动的机械辅助循环装置作为体内右心室机械辅助循环装置的构成示意图。
具体实施方式
如在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可理解,硬件制造商可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名称的差异来作为区分组件的方式,而是以组件在功能上的差异来作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。此外,“耦接”一词在此包含任何直接及间接的电性耦接手段。因此,若文中描述一第一装置耦接于一第二装置,则代表所述第一装置可直接电性耦接于所述第二装置,或通过其他装置或耦接手段间接地电性耦接至所述第二装置。说明书后续描述为实施本申请的较佳实施方式,然所述描述乃以说明本申请的一般原则为目的,并非用以限定本申请的范围。本申请的保护范围当视所附权利要求所界定者为准。
实施例1
参见图1所示为本申请所述一种带有瓣膜的球囊反搏驱动的机械辅助循环装置的具体实施例,该机械辅助循环装置,包括:引流管路10、输入瓣膜20、球囊反搏系统、储血室60、输出瓣膜70和输注管路80,其中,
所述球囊反搏系统,包括:控制系统40、报警系统50和球囊30,所述球囊30通过球囊导管31与所述控制系统40和所述报警系统50连接,所述球囊30内填充有工作介质,所述工作介质为气体或液体,所述球囊30的容积为0.1ml至500ml,所述球囊30的反搏频率为1次/分至100000次/分,所述球囊30的反搏压力为1mmHg至300mmHg;
所述球囊30位于所述储血室60内,所述球囊导管31的两端经由所述输注管路80或引流管路10分别连接到位于所述储血室60内的所述球囊30以及位于体外的控制系统40和报警系统50,所述控制系统40通过所述球囊导管31控制所述球囊30的反搏频率,所述球囊30反搏时为所述储血室60提供将血液排出的驱动力,控制所述储血室60的排出血容量,当所述球囊30内的工作介质发生泄漏时,所述报警系统50进行泄漏报警;
所述引流管路10通过所述输入瓣膜20连接到所述储血室60,使得血流从所述引流管路10单向输入到所述储血室60;
所述储血室60通过所述输出瓣膜70连接到所述输注管路80,使得血流从所述储血室60单向输出到所述输注管路80;
所述储血室60的容积为0.2ml至600ml,所述输入瓣膜20和所述输出瓣膜70为金属瓣膜、生物瓣膜、高分子材料瓣膜或自动化控制的阀门装置;
将所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70置于体内时,形成体内机械辅助循环装置,将所述所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70置于体外时,形成体外机械辅助循环装置。
本申请中的输入瓣膜20和输出瓣膜70采用金属瓣膜、生物瓣膜、高分子材料瓣膜或自动化控制的阀门装置,能够保证血流单向流动,还具有良好的生物相容性。本申请中的输入瓣膜20和输出瓣膜70采用介入导管的方式与储血室60连接,或者直接与储血室60连接。本申请中自动化控制的阀门装置例如可以是机械瓣膜机等等。
本申请的球囊30中填充的工作介质是气体或液体,报警系统50能够监控球囊30内工作介质的泄漏情况,即使有少量工作介质泄漏时,球囊30就会立即停止反搏,报警系统50发出警报,提醒及时快速更换球囊30。
本申请中的球囊30采用高分子材料、生物材料或金属材料制成,或采用高分子材料、生物材料和金属材料构成的复合材料制成。
进一步地,上述球囊30采用或不采用药物涂层或亲水涂层,所述药物涂层包括:肝素涂层和雷帕霉素涂层等等。当采用药物涂层时,能有效防止球囊30附壁血栓形成,并能防止激活血小板、凝血因子等。
本申请中的引流管路10和所述输注管路80为圆柱形,采用金属材料、高分子材料、生物材料或者金属材料、高分子材料和生物材料构成的复合材料制成。
进一步地,所述引流管路10和所述输注管路80上可带有或不带有侧孔,所述侧孔用于将血流从所述引流管路10输入或从所述输注管路80输出。
进一步地,上述引流管路10和输注管路80采用或不采用药物涂层、亲水涂层或高分子材料涂层,所述药物涂层包括:肝素涂层和雷帕霉素涂层。当采用药物涂层或高分子材料涂层时,能有效防止引流管路10和输注管路80附壁血栓形成,并能防止激活血小板、凝血因子等等。
本申请中的储血室60为球形、圆柱形、椭圆球形或不规则形体,采用人工血管、高分子材料、生物材料或金属制成或者采用金属、人工血管、高分子材料和生物材料构成的复合材料制成。储血室60内容容纳球囊30,储血室60容积相对固定,如果采用介入途径放置的储血室容积可以随着压力变化有一定的变化,以防止附壁血栓。本申请中的储血室60在体内可采用介入导管的方式置入。
所述储血室60采用或不采用药物涂层、亲水涂层或高分子材料涂层,所述药物涂层包括:肝素涂层和雷帕霉素涂层等等。当采用药物涂层或高分子材料涂层时,能有效防止引流管路10和输注管路80附壁血栓形成,并能防止激活血小板、凝血因子等等。
本申请带有瓣膜的球囊反搏驱动的机械辅助循环装置中,将所述所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体外时,形成体外机械辅助循环装置,所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜位于左心室内或主动脉内,所述引流管路经主动脉瓣瓣口位于左心室内,所述输注管路在主动脉内,将血液输注至所述主动脉内;此时球囊的容积为1ml至500ml,所述球囊的反搏频率为0次/分至300次/分,所述球囊的反搏压力为1mmHg至300mmHg,,所述储血室的排出血容量为0ml/分至15000ml/分。
本申请带有瓣膜的球囊反搏驱动的机械辅助循环装置中,将所述所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜置于体内时,形成体内机械辅助循环装置,所述输入瓣膜、所述球囊、所述储血室和所述输出瓣膜位于右心室内或肺动脉内,所述引流管路经肺动瓣瓣口位于右心室内,所述输注管路在主肺动脉内,将右心室内血液输注到所述主肺动脉内;此时球囊容积为0.1ml-100ml,所述球囊反搏频率从0次/分至100000次/分,所述储血室排出血容量为0ml/分至100000ml/分,所述引流管路的直径为1mm至30mm。
实施例2
以下提供将本申请的机械辅助循环装置应用于体外的体外机械辅助循环装置的应用实施例,参见图2。
在图1所示实施例的基础上,将所述所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70置于体外时,所述引流管路10的输入端连接到静脉或右心房,引流管路10的输出端通过输入瓣膜20连接到储血室60,储血室60通过输出瓣膜70连接到输注管路80,输注管路80的输出端连接到静脉或动脉。从引流管路10到输注管路80,血流方向可以是从静脉到静脉,或者从静脉到动脉,例如,引流管路10的输入端可连接到颈部静脉、股静脉、上腔静脉、下腔静脉或者右心房,输注管路80的输出端可连接到颈动脉、股动脉、腋动脉、主动脉或者某一个大的静脉内等等。
球囊30位于储血室60内,球囊30通过球囊导管31连接到控制系统40和报警系统50。球囊30内填充有气体或液体状的工作介质,控制系统40通过球囊导管31控制球囊30内气体或液体的压力,使得球囊30进行反搏。球囊30反搏使得储血室60内的血液的压力发生变化,进而控制储血室60的排出血容量。
该实施例中,球囊30容积为60ml,所述球囊30的反搏频率从1次/分至200次/分,所述储血室60的排出血容量0ml/分至12000ml/分。
该实施例中的输入瓣膜20和输出瓣膜70采用生物瓣膜、金属瓣膜、高分子材料瓣膜或自动化控制的阀门装置,保证血流单向流动,而且还具有良好的生物相容性。上述引流管路10和输注管路80都为圆柱形,采用肝素涂层聚乙烯材料,防止附壁血栓形成或防止激活血小板、凝血因子等。
该实施例中的体外机械辅助循环装置可连接氧合器,组成体外膜肺氧合装置(ECMO)。
实施例3
以下提供将本申请的机械辅助循环装置应用于体内的机械辅助循环装置-左心室球囊反搏系统的应用实施例,参见图3。
在上述实施例1的基础上,将所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70置于体内时,所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70位于左心室内或主动脉内,所述引流管路10经主动脉瓣瓣口位于左心室内,所述输注管路80连接主动脉,输注管路80位于主动脉内,将血液输注至所述主动脉内。
该实施例中,引流管路10跨过主动脉瓣进入左心室,引流管路10的另一端通过输入瓣膜20连接到储血室60,该输入瓣膜20保证血流从引流管路10单向排入到储血室60,储血室60的另一端通过输出瓣膜70连接到输注管路80,输出瓣膜70保证血流从储血室60单向排出到输注管路80。球囊30位于储血室60内部,球囊导管30贯穿输注管路80,球囊导管30的一端连接到球囊30,另一端连接到控制系统40,控制系统40控制球囊30高频率反搏提供驱动力,将血液从储血室60经由输注管路80排入主动脉。储血室60的容积相对固定,球囊30高频率反搏提供的驱动力使得储血室60内的血液排入主动脉的同时又不会造成主动脉梗阻。
从图3可看出,输注管路80和引流管路10的侧壁上均分布有侧孔,血液从引流管路10的侧孔进入引流管路10,进而输入到储血室60中;储血室60内的血液输出时,血液从储血室60流入输注管路80后,血液从输注管路80的侧孔进入主动脉。
本实施例中,球囊30采用含硅聚脲胺酯材料,所述球囊30容积为20ml,所述球囊30反搏频率从1次/分至5000次/分,所述储血室60排出血容量0ml/分至100000ml/分,所述引流管路10的直径为4mm。上述储血室60为椭圆球球形,该储血室60可膨胀,采用肝素涂层聚乙烯与镍钛合金复合材料制成。上述输入瓣膜20和输出瓣膜70采用生物瓣,保证血流单向流动,且具有良好的生物相容性。
实施例4
以下提供将本申请的机械辅助循环装置应用于体内的机械辅助循环装置-右心室球囊反搏系统的应用实施例,参见图4。
在图1所示实施例的基础上,将所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70置于体内时,所述输入瓣膜20、所述球囊30、所述储血室60和所述输出瓣膜70位于右心室内或肺动脉内,所述引流管路10经肺动瓣瓣口位于右心室内,所述输注管路80连接主肺动脉,位于主动脉内,将右心室血液输注到所述主肺动脉内。
该实施例中,引流管路10从肺动脉瓣内通过进入右心室内,引流管路10的另一端通过输入瓣膜20连接到储血室60,该输入瓣膜20保证血流从引流管路10单向排入到储血室60,储血室60的另一端通过输出瓣膜70连接到输注管路80,输出瓣膜70保证血流从储血室60单向排出到输注管路80。球囊30位于储血室60内部,球囊导管31贯穿引流管路10,两端分别连接球囊30和控制系统40,控制系统40控制球囊30高频率反搏提供驱动力,将血液从储血室60经由输注管路80排入肺动脉。储血室60的容积相对固定,球囊30高频率反搏提供的驱动力使得储血室60内的血液排入肺动脉的同时又不会造成肺动脉梗阻。
该实施例中,所述球囊30采用含硅聚脲胺酯材料,所述球囊30容积为10ml,所述球囊30反搏频率从1次/分至10000次/分,所述储血室60排出血容量为0ml/分至100000ml/分,所述引流管路10的直径为4mm,引流管路10经肺动脉瓣瓣口位于右心室内。本实施例中的储血室60为椭圆球球形,该储血室60可膨胀且容积相对固定,采用肝素涂层聚乙烯与镍钛合金复合材料制成。
从图4可看出,输注管路80和引流管路10的侧壁上均分布有侧孔,血液从引流管路10的侧孔进入引流管路10,进而输入到储血室60中;储血室60内的血液输出时,血液从储血室60流入输注管路80后,血液从输注管路80的侧孔进入肺动脉。
本实施例中的输入瓣膜和输出瓣膜为高分子材料三叶瓣。
通过以上各实施例可知,本申请存在的有益效果是:
第一,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置,能够提供高流量循环辅助,具有可小型化和微型化的特点,制作工艺简单,既可以体外进行循环辅助,又可以微型化经血管介入途径置入人体内进行循环辅助,也可连接氧合器,作为一种新型体外膜肺氧合装置。
第二,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置中,引流管路、输注管路、球囊和储血室采用或不采用肝素或雷帕霉素等药物,采用或不采用亲水涂层,有效预防引流管路、输注管路、储血室以及球囊附壁血栓形成,还能防止激活血小板、凝血因子等。
第三,本发明所提供的带有瓣膜的球囊反搏驱动的机械辅助循环装置中,输入瓣膜和输出瓣膜采用金属瓣膜、生物瓣膜、高分子材料瓣膜或自动化控制的阀门装置等制成,能够有效保证血流单向流动,且具有良好的生物相容性。
本领域内的技术人员应明白,本申请的实施例可提供为方法、装置、或计算机程序产品。因此,本申请可采用完全硬件实施例、完全软件实施例、或结合软件和硬件方面的实施例的形式。而且,本申请可采用在一个或多个其中包含有计算机可用程序代码的计算机可用存储介质(包括但不限于磁盘存储器、CD-ROM、光学存储器等)上实施的计算机程序产品的形式。
上述说明示出并描述了本申请的若干优选实施例,但如前所述,应当理解本申请并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本申请的精神和范围,则都应在本申请所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!