一种双层组织工程皮肤及其制备方法与流程
本发明涉及组织工程技术领域,尤其涉及一种双层组织工程皮肤及其制备方法。
背景技术:
皮肤是人体最大的器官组织,是机体与外界环境接触的屏障,具有保护、分泌、代谢和感觉等重要的功能。但当皮肤由于遗传因素、烧烫伤、糖尿病等引起的创伤,可使机体屏障功能丧失,引起感染、水电解质失衡、免疫低下以及多脏器功能衰竭。最普通的方法是进行自身皮肤移植,但对于大面积的烧伤,自身正常皮肤来源有限而且移植后皮肤存活的几率低,倘若利用非已皮肤也会出现免疫排斥的问题。
组织工程学是应用工程学和生命科学的原理与方法,构建生物性替代物,以恢复、维持或增进受损器官或组织功能的一门科学。先已商业化的皮肤产品有Dermagraft、Apligraft等,理想的组织工程皮肤应包含表皮与真皮两层,表皮与真皮无论在解剖上还是在功能上都是相互依存的整体。Dermagraft只具有真皮层的单层组织工程皮肤;Apligraft既含有表皮层又含有真皮层的组织工程化皮肤,但是所用支架胶原凝胶的收缩率较大,使用同种异体细胞和牛胶原,存在着不可预知的免疫排斥反应和潜在病毒感染的风险而且脆性大,操作困难。
因此,制备一种取材方便,培养周期短,成本低,移植效率高的皮肤替代物是很有必要的。
技术实现要素:
为了克服现有技术的不足,本发明提供一种组织工程皮肤,所用的种子细胞是由成纤维细胞和表皮细胞经过一系列的诱导而得到的,无需从病人自身获得,减轻了病人的痛苦,取材方便,而且以脱细胞羊膜为支架材料,具有成本低、操作简便、来源广泛和易于贮存的优点,是一种移植效率高的皮肤替代物。
本发明还提供一种组织工程皮肤的制备方法,该制备方法取材方便,培养周期短,成本低。
实现本发明的目的可以通过采取如下技术方案达到:
一种组织工程双层皮肤,其是以成纤维细胞和表皮细胞作为种子细胞,以脱细胞羊膜作为生物支架,构建获得的组织工程双层皮肤。
组织工程双层皮肤的制备方法,包括下列步骤:
a、准备脱细胞羊膜、培养液和多能干细胞
1)准备脱细胞羊膜
1-1)选取已经脱离人体的胎盘,用无菌PBS冲洗,自羊膜与绒毛膜间的潜在空隙钝性剥离羊膜,前述取材均在无菌条件下完成;
1-2)羊膜的脱脂处理:浸泡于氯仿和乙醇的混合液30min,其中,氯仿和乙醇的体积比为1:1;
1-3)羊膜的去污处理:浸泡于稀释的Triton X-100中,常温去污处理5-7h;
1-4)羊膜的脱细胞处理:用0.02%EDTA,在37℃下处理2h,然后用细胞刮片在显微镜下刮去上皮细胞;
1-5)羊膜的灭菌处理:将羊膜放入含有抗菌药的PBS液浸20-30min;
1-6)羊膜的保存处理:用无纺布作为羊膜的贴载物,-80℃保存于无菌甘油和DMEM的混和液中,混和液中无菌甘油和DMEM的体积比为1:1;
1-7)羊膜在使用前浸泡在无菌生理盐水10-20min,使无纺布与羊膜分离开,之后羊膜用无菌PBS洗干净至无甘油,得到脱细胞羊膜备用;
2)准备培养液
2-1)配制培养液A:REGM培养基与MEF培养基以体积比为1:1的比例混合;
2-2)配制培养液B:mTesR1培养基;
2-3)配制500mL培养液C:1-5mmol/L L-谷酰胺、50-100ug/L bFGF、8-10mol/L地塞米松、DMEM基础培养基、FBS,其中DMEM基础培养基与FBS的体积比为9:1;
2-4)配制500mL培养液D:450mL DMEM/F12培养基、50mL FBS、10-50ng/mL hEGF、1-6ng/mL HGF、1-4ng/mL bFGF、1-10ng/mL PDGF、1-10ng/mL IGF、2-10ng/mL TGF-β、DMEM/F12培养基、FBS,其中DMEM/F12培养基与FBS的体积比为9:1;
2-5)配制500mL培养液E:450mL DMEM基础培养基、50mL FBS、10-40ug/L KGF、20-80ug/L TGF-β、6-15ug/L PDGF-AB、10-25ug/L VEGF、1-7ug/L IL-2、0.1-0.75ug/mL氢化可的松、MEM基础培养基、FBS,其中MEM基础培养基与FBS的体积比为9:1;
2-6)配制500mL培养液F:450mL商品用DMEM/F12培养基、50mLFBS、0.1-1ng/mL氢化可的松、1×10-10mol/L霍乱毒素、0.01-0.1ng/mL胰岛素、1×10-7mol/L三碘甲状腺原氨酸、1.8×10-4mol/L腺嘌呤、100IU/mL青霉素、10-25ng/mL hEGF、5-15ug/m L转铁蛋白、1-10ug/mL谷氨酸、1-7μM Y-27632、0.01-0.5mg/mL羧甲基壳聚糖、DMEM/F12培养基、FBS,其中,DMEM/F12培养基、FBS的体积比为9:1;
2-7)配制500mL培养液G:5-15ug/L bFGF、0.05-2mmol/L Vc、0.01-0.05mmol/mL非必需氨基酸、DMEM基础培养基、FBS,其中,DMEM基础培养基、FBS的体积比为9:1;
2-8)配制500mL培养液H:1-5ng/mL胰岛素、0.1-0.5ug/mL氢化可的松、10-50ug/mL腺嘌呤、100-150ug/mL Vc、1-10ng/mL hEGF、2-16ng/mL bFGF、10-45ug/mL BPE、1-25ug/mL转铁蛋白、0.1-1mg/mL羧甲基壳聚糖、DMEM/F12培养基、FBS,其中,DMEM/F12培养基、FBS的体积比为9:1;
2-9)配制500mL培养液I:0.01-1μmol/L胰岛素、0.01-1mmol/mL非必需氨基酸、2-20ng/mL hEGF、100IU/mL青霉素、15-50ug/mL BPE、100-500μg/mL氯化钙、DMEM/F12培养基、FBS,其中,DMEM/F12培养基、FBS的体积比为9:1;
3)准备多能干细胞
3-1)收集尿液细胞
在每个收集杯加2mL混有青霉素和链霉素的双抗,每个收集杯中收集一份尿液;为每份尿液准备六孔板中的一个孔,将该孔用质量浓度为0.1%明胶包被20min以上,使用前吸去孔内液体,得到包被孔;把尿液倒入离心管里,离心400g,10min;吸去上清液,每管留下1-5mL的余量,然后将每管中的余量混合到一个总离心管内;向该总离心管加入10-30mL PBS,轻轻混匀;然后离心400g,10min;再吸去上清液,剩余0.5-1mL液体;把剩余的液体加入包被孔中,再加入3mL REGM、3μL Primocin;再将六孔板放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用PBS清洗,再进行换液处理;当尿液细胞中融合细胞的体积达到总细胞体积的80%,进行传代培养;
3-2)尿液细胞经重编程生成诱导多能干细胞
将表达转录调控因子OCT4、SOX2、NANOG、KLF4、LIN28中的一种或两种以上导入尿液细胞,将细胞分至预先用matrigel包被的六孔板中,用培养液A培养补至2mL;转染后第2天,将培养液更换为2mL培养液B,每天更换新鲜培养液B,使尿液细胞克隆继续增殖;转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,加1mL培养液B培养获得诱导多能干细胞,将生长稳定的诱导多能干细胞进行传代培养得到多能干细胞;
b、间充质干细胞的诱导培养
1)弃除原有培养液B,向传代培养得到的多能干细胞中加DMEM/F12培养液清洗;
2)弃除DMEM/F12培养液,加入DPBS消化5min,所述DPBS中含有0.5mM EDTA;
3)然后离心400g,5min,再收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待多能干细胞的面积长至六孔板面积的70%-80%时,用PBS冲洗后,更换间充质干细胞诱导培养液C,每两天更换一次培养液;
5)培养1-3d,加含0.5mM EDTA的DPBS进行消化,间充质干细胞培养液D重悬细胞,制成单细胞悬液,接种至0.1%明胶预先包被的10cm细胞培养皿中,当细胞达到90%融合后,加含0.5mM EDTA的DPBS消化细胞并按照1:3的比例进行细胞传代,得到传代的间充质干细胞;
c、表皮细胞的诱导培养
1)弃除原有培养液D,向传代的间充质干细胞中加DMEM/F12培养液清洗;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后离心400g,5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞长至六孔板的70%-80%时,PBS冲洗一遍后,更换表皮细胞诱导培养液E,每两天更换一次培养液E;
5)培养3-5d,加含0.5mM EDTA的DPBS进行消化,表皮细胞培养液F重悬细胞沉淀,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液F重悬细胞,制成1×106单细胞悬液,得到表皮细胞备用;
d、成纤维细胞的诱导培养
1)弃除原有培养液D,加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后离心400g,5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)将间充质干细胞诱导培养液C更换成培养液G,每两天更换一次培养液G;
5)培养4-6d,加含0.5mM EDTA的DPBS进行消化,得到成纤维细胞培养液H重悬细胞,制成单细胞悬液,接种至细胞培养皿中,细胞生长的面积达到整个细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液H重悬细胞,制成5×105单细胞悬液,得到成纤维细胞备用;
e、组织工程双层皮肤的培养
1)将羊膜用打孔器在无菌的环境下,打成与培养板孔直径相同的羊膜圆片;
2)将成纤维细胞接种到六孔板中的一个孔中,接种量为5×105,补加500μL培养液H,用羊膜圆片朝下平铺于成纤维细胞上,固定住羊膜圆片,加入2mL培养液H进行培养;
3)培养3d后,将成纤维细胞浸入到羊膜圆片中,每天更换一次培养液H,得到组织工程皮肤真皮层;
4)接着吸弃培养液,然后将表皮细胞以1×106的接种量,接种于羊膜圆片的上皮面,补加培养液F置2mL,移动培养皿使表皮细胞能均匀分散,置于细胞培养箱中培养;
5)培养2d后表皮细胞紧贴于羊膜上皮面,将培养液弃去,加入2mL培养液I继续培养,培养3d,每天更换培养液I,完成制备,得到组织工程双层皮肤。
作为优选,步骤a的步骤1-3)中,Triton X-100用0.1M的PBS液进行稀释,稀释后的Triton X-100的质量百分浓度为1%。
作为优选,步骤a的步骤1-4)中,刮去上皮细胞后,利用HE染色检测细胞是否去除干净。
作为优选,步骤a的步骤1-5)中,抗菌药具体为:含青霉素1000U/mL,庆大霉素1000U/mL,两性霉素B 2.5μg/mL。
作为优选,步骤a的步骤3-1)中,向总离心管加入的PBS含有青霉素或链霉素,PBS与青霉素或链霉素的体积比均为18:1。
作为优选,步骤d中的步骤4)中待间充质干细胞长至六孔板的70%-80%时,PBS冲洗一遍后,更换为培养液G。
作为优选,步骤e中的步骤2)中,补加培养液H后,当成纤维细胞的面积长到孔的面积的80%时,吸弃培养液,用PBS洗去死细胞,用羊膜圆片朝下平铺于成纤维细胞上。
作为优选,步骤e中的步骤4)中细胞培养箱中的条件为37℃,5%CO2。
作为优选,步骤e中的步骤2)中用与羊膜圆片相同尺寸的无菌不锈钢圈固定住羊膜圆片。
本发明的配方设计原理如下:
相比现有技术,本发明的有益效果在于:
1、本发明的种子细胞是由成纤维细胞和表皮细胞经过一系列的诱导而得到的,无需从病人自身获得,减轻了病人的痛苦,取材方便,而且以脱细胞羊膜为支架材料,具有成本低、操作简便、来源广泛和易于贮存的优点,而且羊膜的脱细胞处理,避免了免疫排斥的发生,本发明的双层组织工程皮肤是一种移植效率高的皮肤替代物;
2、本发明的培养液F和培养液H中加入羧甲基壳聚糖,缩短了表皮细胞和成纤维细胞的培养周期;
3、本发明的双层组织工程皮肤的制备方法,该制备方法取材方便,培养周期短,成本低。
附图说明
图1为实施例1加有羧甲基壳聚糖的培养基所培养的皮肤表皮细胞照片。
图2为实施例1未加羧甲基壳聚糖的培养基所培养的皮肤表皮细胞照片。
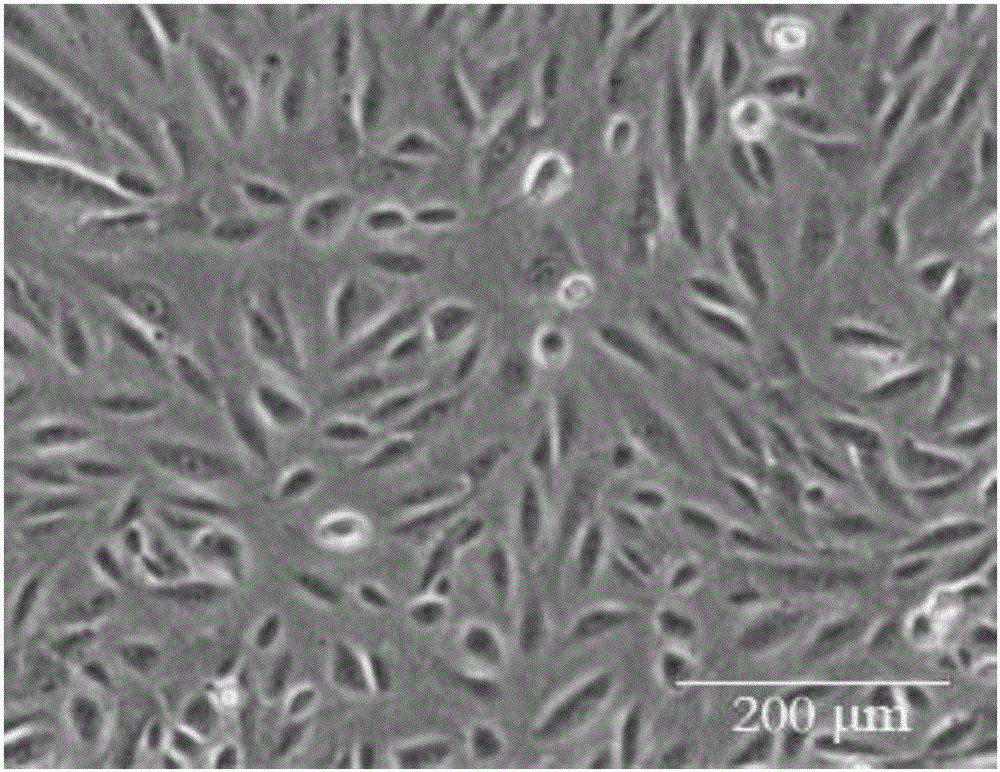
图3为实施例1加有羧甲基壳聚糖的培养基所培养的皮肤成纤维细胞照片。
图4为实施例1未加羧甲基壳聚糖的培养基所培养的皮肤成纤维细胞照片。
图5为实施例1所培养的双层组织工程皮肤照片。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
实施例1:
一种组织工程双层皮肤,其是以成纤维细胞和表皮细胞作为种子细胞,以脱细胞羊膜作为生物支架,构建获得的组织工程双层皮肤。
该组织工程双层皮肤的制备方法,包括下列步骤:
a、准备脱细胞羊膜、培养液和多能干细胞
1)准备脱细胞羊膜
1-1)选取剖宫产分娩产妇的胎盘,产前血清学检查排除乙肝、丙肝、梅毒及获得性免疫缺陷综合征,将检测后的胎盘羊膜面用无菌PBS冲洗干净,自羊膜与绒毛膜间的潜在空隙钝性剥离羊膜,前述取材均在无菌条件下完成;
1-2)羊膜的脱脂处理:浸泡于氯仿和乙醇的混合液30min,其中,氯仿和乙醇的体积比为1:1;
1-3)羊膜的去污处理:浸泡于稀释的Triton X-100中,常温去污处理5h,其中,Triton X-100用0.1M的PBS液进行稀释,稀释后的Triton X-100的质量百分浓度为1%;
1-4)羊膜的脱细胞处理:用0.02%EDTA,在37℃下处理2h,然后用细胞刮片在显微镜下刮去上皮细胞,然后利用HE染色检测细胞是否去除干净;
1-5)羊膜的灭菌处理:将羊膜放入含有抗菌药的PBS液浸20min,其中抗菌药具体为:含青霉素1000U/mL,庆大霉素1000U/mL,两性霉素B 2.5μg/mL;
1-6)羊膜的保存处理:用无纺布作为羊膜的贴载物,-80℃保存于无菌甘油和DMEM的混和液中,混和液中无菌甘油和DMEM的体积比为1:1;
1-7)羊膜在使用前浸泡在无菌生理盐水10min,使无纺布与羊膜分离开,之后羊膜用无菌PBS洗干净至无甘油,得到脱细胞羊膜备用;
2)准备培养液
2-1)配制培养液A:商品用REGM培养基与MEF培养基以体积比为1:1的比例混合;
2-2)配制培养液B:商品用mTesR1培养基;
2-3)配制培养液C:450mL商品用DMEM基础培养基、50mL FBS、1mmol/L L-谷酰胺、50ug/L bFGF,8mol/L地塞米松
2-4)配制培养液D:450mL商品用DMEM/F12培养基、50mL FBS、10ng/mL hEGF、1ng/mL HGF、1ng/mL bFGF、1ng/mL PDGF,1ng/mL IGF、2ng/mL TGF-β;
2-5)配制培养液E:450mL商品用DMEM基础培养基、50mL FBS、10ug/L KGF、20ug/L TGF-β、6ug/L PDGF-AB、10ug/L VEGF、1ug/L IL-2、0.1ug/mL氢化可的松;
2-6)培养液F:450mL商品用DMEM/F12培养基、50mLFBS、0.1ng/mL氢化可的松、1×10-10mol/L霍乱毒素、0.01ng/mL胰岛素、1×10-7mol/L三碘甲状腺原氨酸、1.8×10-4mol/L腺嘌呤、100IU/m L青霉素、10ng/mL hEGF、5ug/mL转铁蛋白、1ug/mL谷氨酸、1μM Y-27632、0.01mg/mL羧甲基壳聚糖;
2-7)配制培养液G:450mL商品用DMEM基础培养基、50mL FBS、5ug/L bFGF、0.05mmol/L Vc、0.01mmol/mL非必需氨基酸;
2-8)配制培养液H:450mL商品用DMEM/F12培养基、50mL FBS、1ng/mL胰岛素、0.1ug/mL氢化可的松、10ug/mL腺嘌呤、100ug/mL Vc、1ng/mL hEGF、2ng/mL bFGF、10ug/mL BPE、1ug/mL转铁蛋白、0.1mg/mL羧甲基壳聚糖;
2-9)配制培养液I:450mL商品用DMEM/F12培养基、50mL FBS、0.01μmol/L胰岛素、0.01mmol/mL非必需氨基酸、2ng/mL hEGF、100IU/mL青霉素、15ug/mL BPE、100μg/mL氯化钙;
3)准备多能干细胞
3-1)收集尿液细胞
在每个收集杯加2mL混有青霉素和链霉素的双抗,每个收集杯中收集一份尿液;为每份尿液准备六孔板中的一个孔,将该孔用质量浓度为0.1%明胶包被20min以上,使用前吸去孔内液体,得到包被孔;把尿液倒入所需的50mL离心管里,离心400g,10min;吸去上清液,每管留下1mL的余量,然后将每管中的余量混合到一个总离心管内;向该总离心管加入10mL PBS,该PBS含有青霉素,PBS与青霉素的体积比为18:1,轻轻混匀;然后离心400g,10min;再吸去上清液,剩余0.5mL液体;把剩余的液体加入包被孔中,再加入3mL REGM、3μL Primocin;再将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用PBS洗一遍,再进行换液处理;当尿液细胞中融合细胞的体积达到总细胞体积的80%,进行传代培养;
3-2)尿液细胞经重编程生成诱导多能干细胞
将表达转录调控因子OCT4、SOX2、NANOG、KLF4和LIN28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的六孔板中,用培养液A培养补至2mL;转染后第2天,将培养液更换为2mL培养液B,每天更换新鲜培养液B,使克隆继续增殖;转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,加1mL培养液B培养获得诱导多能干细胞,将生长稳定的诱导多能干细胞进行传代培养得到多能干细胞;
b、间充质干细胞的诱导培养
1)弃除原有培养液B,向传代培养得到的多能干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加入DPBS消化5min,所述DPBS中含有0.5mM EDTA;
3)然后离心400g,5min,再收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)更换间充质干细胞诱导培养液C,每两天更换一次培养液;
5)培养1d,加含0.5mM EDTA的DPBS进行消化,间充质干细胞培养液D重悬细胞,制成单细胞悬液,接种至0.1%明胶预先包被的10cm细胞培养皿中,当细胞达到90%融合后,加含0.5mM EDTA的DPBS消化细胞并按照1:3的比例进行细胞传代,得到传代的间充质干细胞;
c、表皮细胞的诱导培养
1)弃除原有培养液D,向传代的间充质干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后取400g,离心5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞长至六孔板的70%-80%时,PBS冲洗一遍后,更换表皮细胞诱导培养液E,每两天更换一次培养液E;
5)培养3d,加含0.5mM EDTA的DPBS进行消化,表皮细胞培养液F重悬细胞沉淀,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液F重悬细胞,制成1×106单细胞悬液,得到表皮细胞备用;
d、成纤维细胞的诱导培养
1)弃除原有培养液D,加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后离心400g,5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞的面积长至六孔板面积的70%-80%时,用PBS冲洗一遍,然后将间充质干细胞诱导培养液C更换成培养液G,每两天更换一次培养液G;
5)培养4d,加含0.5mM EDTA的DPBS进行消化,得到成纤维细胞培养液H重悬细胞沉淀,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到整个细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液H重悬细胞,制成5×105单细胞悬液,得到成纤维细胞备用;
e、组织工程双层皮肤的培养
1)将备用的羊膜用打孔器在无菌的环境下,打成与培养板孔直径相同的羊膜圆片;
2)将备用的成纤维细胞接种到六孔板中的一个孔中,接种量为5×105,补加500μL培养液H,当成纤维细胞的面积长到孔的面积的80%时,吸弃培养液,用PBS洗去死细胞,用羊膜圆片朝下平铺于成纤维细胞上,用与羊膜圆片相同尺寸的无菌不锈钢圈固定住羊膜圆片,加入2mL培养液H进行培养;
3)培养3d后,将成纤维细胞浸入到羊膜圆片中,每天更换一次培养液H,得到组织工程皮肤真皮层;
4)接着吸弃培养液,然后将以备用的表皮细胞以1×106的接种量,接种于羊膜圆片的上皮面,补加培养液F置2mL,移动培养皿使表皮细胞能均匀分散,置于细胞培养箱中培养,细胞培养箱中的条件为37℃,5%CO2;
5)培养2d后表皮细胞紧贴于羊膜上皮面,将培养液弃去,加入2mL培养液I继续培养,培养3d,每天更换培养液I,完成制备,得到组织工程双层皮肤。
实施例2
一种组织工程双层皮肤,其是以成纤维细胞和表皮细胞作为种子细胞,以脱细胞羊膜作为生物支架,构建获得的组织工程双层皮肤。
该组织工程双层皮肤的制备方法,包括下列步骤:
a、准备脱细胞羊膜、培养液和多能干细胞
1)准备脱细胞羊膜
1-1)选取剖宫产分娩产妇的胎盘,产前血清学检查排除乙肝、丙肝、梅毒及获得性免疫缺陷综合征,将检测后的胎盘羊膜面用无菌PBS冲洗干净,自羊膜与绒毛膜间的潜在空隙钝性剥离羊膜,前述取材均在无菌条件下完成;
1-2)羊膜的脱脂处理:浸泡于氯仿和乙醇的混合液30min,其中,氯仿和乙醇的体积比为1:1;
1-3)羊膜的去污处理:浸泡于稀释的Triton X-100中,常温去污处理6h,其中,Triton X-100用0.1M的PBS液进行稀释,稀释后的Triton X-100的质量百分浓度为1%;
1-4)羊膜的脱细胞处理:用0.02%EDTA,在37℃下处理2h,然后用细胞刮片在显微镜下刮去上皮细胞,然后利用HE染色检测细胞是否去除干净;
1-5)羊膜的灭菌处理:将羊膜放入含有抗菌药的PBS液浸25min,其中抗菌药具体为:含青霉素1000U/mL,庆大霉素1000U/mL,两性霉素B 2.5μg/mL;
1-6)羊膜的保存处理:用无纺布作为羊膜的贴载物,-80℃保存于无菌甘油和DMEM的混和液中,混和液中无菌甘油和DMEM的体积比为1:1;
1-7)羊膜在使用前浸泡在无菌生理盐水15min,使无纺布与羊膜分离开,之后羊膜用无菌PBS洗干净至无甘油,得到脱细胞羊膜备用;
2)准备培养液
2-1)配制培养液A:商品用REGM培养基与MEF培养基以体积比为1:1的比例混合;
2-2)配制培养液B:商品用mTesR1培养基;
2-3)配制培养液C:450mL商品用DMEM基础培养基、50mL FBS、2mmol/L L-谷酰胺、80ug/L bFGF,9mol/L地塞米松;
2-4)配制培养液D:450mL商品用DMEM/F12培养基、50mL FBS、30ng/mL hEGF、5ng/mL HGF、3ng/mL bFGF、5ng/mL PDGF,5ng/mL IGF、5ng/mL TGF-β;
2-5)配制培养液E:450mL商品用DMEM基础培养基、50mL FBS、20ug/L KGF、60ug/L TGF-β、10ug/L PDGF-AB、15ug/L VEGF、4ug/L IL-2、0.25ug/mL氢化可的松;
2-6)培养液F:450mL商品用DMEM/F12培养基、50mLFBS、0.6ng/mL氢化可的松、1×10-10mol/L霍乱毒素、0.06ng/mL胰岛素、1×10-7mol/L三碘甲状腺原氨酸、1.8×10-4mol/L腺嘌呤、100IU/mL青霉素、18ng/mL hEGF、12ug/mL转铁蛋白、8ug/mL谷氨酸、5μM Y-27632、0.1mg/mL羧甲基壳聚糖;
2-7)配制培养液G:450mL商品用DMEM基础培养基、50mL FBS、8ug/L bFGF、0.1mmol/L Vc、0.03mmol/mL非必需氨基酸;
2-8)配制培养液H:450mL商品用DMEM/F12培养基、50mL FBS、2ng/mL胰岛素、0.3ug/mL氢化可的松、30ug/mL腺嘌呤、130ug/mL Vc、5ng/mL hEGF、9ng/mL bFGF、24ug/mL BPE、19ug/mL转铁蛋白、0.5mg/mL羧甲基壳聚糖;
2-9)配制培养液I:450mL商品用DMEM/F12培养基、50mL FBS、0.5μmol/L胰岛素、0.5mmol/mL非必需氨基酸、10ng/mL hEGF、100IU/mL青霉素、30ug/mL BPE、300μg/mL氯化钙;
3)准备多能干细胞
3-1)收集尿液细胞
在每个收集杯加2mL混有青霉素和链霉素的双抗,每个收集杯中收集一份尿液;为每份尿液准备六孔板中的一个孔,将该孔用质量浓度为0.1%明胶包被20min以上,使用前吸去孔内液体,得到包被孔;把尿液倒入所需的50mL离心管里,离心400g,10min;吸去上清液,每管留下3mL的余量,然后将每管中的余量混合到一个总离心管内;向该总离心管加入20mL PBS,该PBS含有青霉素,PBS与青霉素的体积比为18:1,轻轻混匀;然后离心400g,10min;再吸去上清液,剩余0.7mL液体;把剩余的液体加入包被孔中,再加入3mL REGM、3μL Primocin;再将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用PBS洗一遍,再进行换液处理;当尿液细胞中融合细胞的体积达到总细胞体积的80%,进行传代培养;
3-2)尿液细胞经重编程生成诱导多能干细胞
将表达转录调控因子OCT4、SOX2、NANOG、KLF4和LIN28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的六孔板中,用培养液A培养补至2mL;转染后第2天,将培养液更换为2mL培养液B,每天更换新鲜培养液B,使克隆继续增殖;转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,加1mL培养液B培养获得诱导多能干细胞,将生长稳定的诱导多能干细胞进行传代培养得到多能干细胞;
b、间充质干细胞的诱导培养
1)弃除原有培养液B,向传代培养得到的多能干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加入DPBS消化5min,所述DPBS中含有0.5mM EDTA;
3)然后离心400g,5min,再收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)更换间充质干细胞诱导培养液C,每两天更换一次培养液;
5)培养2d,加含0.5mM EDTA的DPBS进行消化,间充质干细胞培养液D重悬细胞,制成单细胞悬液,接种至0.1%明胶预先包被的10cm细胞培养皿中,当细胞达到90%融合后,加含0.5mM EDTA的DPBS消化细胞并按照1:3的比例进行细胞传代,得到传代的间充质干细胞;
c、表皮细胞的诱导培养
1)弃除原有培养液D,向传代的间充质干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后取400g,离心5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞长至六孔板的70%-80%时,PBS冲洗一遍后,更换表皮细胞诱导培养液E,每两天更换一次培养液E;
5)培养4d,加含0.5mM EDTA的DPBS进行消化,表皮细胞培养液F重悬细胞沉淀,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液F重悬细胞,制成1×106单细胞悬液,得到表皮细胞备用;
d、成纤维细胞的诱导培养
1)弃除原有培养液D,加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后离心400g,5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞的面积长至六孔板面积的70%-80%时,用PBS冲洗一遍,然后将间充质干细胞诱导培养液C更换成培养液G,每两天更换一次培养液G;
5)培养5d,加含0.5mM EDTA的DPBS进行消化,得到成纤维细胞培养液H重悬细胞,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到整个细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液H重悬细胞,制成5×105单细胞悬液,得到成纤维细胞备用;
e、组织工程双层皮肤的培养
1)将备用的羊膜用打孔器在无菌的环境下,打成与培养板孔直径相同的羊膜圆片;
2)将备用的成纤维细胞接种到六孔板中的一个孔中,接种量为5×105,补加500μL培养液H,当成纤维细胞的面积长到孔的面积的80%时,吸弃培养液,用PBS洗去死细胞,用羊膜圆片朝下平铺于成纤维细胞上,用与羊膜圆片相同尺寸的无菌不锈钢圈固定住羊膜圆片,加入2mL培养液H进行培养;
3)培养3d后,将成纤维细胞浸入到羊膜圆片中,每天更换一次培养液H,得到组织工程皮肤真皮层;
4)接着吸弃培养液,然后将以备用的表皮细胞以1×106的接种量,接种于羊膜圆片的上皮面,补加培养液F置2mL,移动培养皿使表皮细胞能均匀分散,置于细胞培养箱中培养,细胞培养箱中的条件为37℃,5%CO2;
5)培养2d后表皮细胞紧贴于羊膜上皮面,将培养液弃去,加入2mL培养液I继续培养,培养3d,每天更换培养液I,完成制备,得到组织工程双层皮肤。
实施例3
一种组织工程双层皮肤,其是以成纤维细胞和表皮细胞作为种子细胞,以脱细胞羊膜作为生物支架,构建获得的组织工程双层皮肤。
该组织工程双层皮肤的制备方法,包括下列步骤:
a、准备脱细胞羊膜、培养液和多能干细胞
1)准备脱细胞羊膜
1-1)选取剖宫产分娩产妇的胎盘,产前血清学检查排除乙肝、丙肝、梅毒及获得性免疫缺陷综合征,将检测后的胎盘羊膜面用无菌PBS冲洗干净,自羊膜与绒毛膜间的潜在空隙钝性剥离羊膜,前述取材均在无菌条件下完成;
1-2)羊膜的脱脂处理:浸泡于氯仿和乙醇的混合液30min,其中,氯仿和乙醇的体积比为1:1;
1-3)羊膜的去污处理:浸泡于稀释的Triton X-100中,常温去污处理7h,其中,Triton X-100用0.1M的PBS液进行稀释,稀释后的Triton X-100的质量百分浓度为1%;
1-4)羊膜的脱细胞处理:用0.02%EDTA,在37℃下处理2h,然后用细胞刮片在显微镜下刮去上皮细胞,然后利用HE染色检测细胞是否去除干净;
1-5)羊膜的灭菌处理:将羊膜放入含有抗菌药的PBS液浸30min,其中抗菌药具体为:含青霉素1000U/mL,庆大霉素1000U/mL,两性霉素B 2.5μg/mL;
1-6)羊膜的保存处理:用无纺布作为羊膜的贴载物,-80℃保存于无菌甘油和DMEM的混和液中,混和液中无菌甘油和DMEM的体积比为1:1;
1-7)羊膜在使用前浸泡在无菌生理盐水20min,使无纺布与羊膜分离开,之后羊膜用无菌PBS洗干净至无甘油,得到脱细胞羊膜备用;
2)准备培养液
2-1)配制培养液A:商品用REGM培养基与MEF培养基以体积比为1:1的比例混合;
2-2)配制培养液B:商品用mTesR1培养基;
2-3)配制培养液C:450mL商品用DMEM基础培养基、50mL FBS、5mmol/L L-谷酰胺、100ug/L bFGF,10mol/L地塞米松;
2-4)配制培养液D:450mL商品用DMEM/F12培养基、50mL FBS、50ng/mL hEGF、6ng/mL HGF、4ng/mL bFGF、10ng/mL PDGF,10ng/mL IGF、10ng/mL TGF-β;
2-5)配制培养液E:450mL商品用DMEM基础培养基、50mL FBS、40ug/L KGF、80ug/L TGF-β、15ug/L PDGF-AB、25ug/L VEGF、7ug/L IL-2、0.75ug/mL氢化可的松;
2-6)培养液F:450mL商品用DMEM/F12培养基、50mLFBS、1ng/mL氢化可的松、1×10-10mol/L霍乱毒素、0.1ng/mL胰岛素、1×10-7mol/L三碘甲状腺原氨酸、1.8×10-4mol/L腺嘌呤、100IU/m L青霉素、25ng/m L hEGF、15ug/m L转铁蛋白、10ug/m L谷氨酸、7μM Y-27632、0.5mg/mL羧甲基壳聚糖;
2-7)配制培养液G:450mL商品用DMEM基础培养基、50mL FBS、15ug/L bFGF、2mmol/L Vc、0.05mmol/mL非必需氨基酸;
2-8)配制培养液H:450mL商品用DMEM/F12培养基、50mL FBS、5ng/mL胰岛素、0.5ug/mL氢化可的松、50ug/mL腺嘌呤、150ug/mL Vc、10ng/mL hEGF、16ng/mL bFGF、45ug/mL BPE、25ug/mL转铁蛋白、1mg/mL羧甲基壳聚糖;
2-9)配制培养液I:450mL商品用DMEM/F12培养基、50mL FBS、1μmol/L胰岛素、1mmol/mL非必需氨基酸、20ng/mL hEGF、100IU/mL青霉素、50ug/mL BPE、500μg/mL氯化钙;
3)准备多能干细胞
3-1)收集尿液细胞
在每个收集杯加2mL混有青霉素和链霉素的双抗,每个收集杯中收集一份尿液;为每份尿液准备六孔板中的一个孔,将该孔用质量浓度为0.1%明胶包被20min以上,使用前吸去孔内液体,得到包被孔;把尿液倒入所需的50mL离心管里,离心400g,10min;吸去上清液,每管留下5mL的余量,然后将每管中的余量混合到一个总离心管内;向该总离心管加入30mL PBS,该PBS含有青霉素,PBS与青霉素的体积比为18:1,轻轻混匀;然后离心400g,10min;再吸去上清液,剩余1mL液体;把剩余的液体加入包被孔中,再加入3mL REGM、3μL Primocin;再将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用PBS洗一遍,再进行换液处理;当尿液细胞中融合细胞的体积达到总细胞体积的80%,进行传代培养;
3-2)尿液细胞经重编程生成诱导多能干细胞
将表达转录调控因子OCT4、SOX2、NANOG、KLF4和LIN28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的六孔板中,用培养液A培养补至2mL;转染后第2天,将培养液更换为2mL培养液B,每天更换新鲜培养液B,使克隆继续增殖;转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,加1mL培养液B培养获得诱导多能干细胞,将生长稳定的诱导多能干细胞进行传代培养得到多能干细胞;
b、间充质干细胞的诱导培养
1)弃除原有培养液B,向传代培养得到的多能干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加入DPBS消化5min,所述DPBS中含有0.5mM EDTA;
3)然后离心400g,5min,再收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)更换间充质干细胞诱导培养液C,每两天更换一次培养液;
5)培养3d,加含0.5mM EDTA的DPBS进行消化,间充质干细胞培养液D重悬细胞,制成单细胞悬液,接种至0.1%明胶预先包被的10cm细胞培养皿中,当细胞达到90%融合后,加含0.5mM EDTA的DPBS消化细胞并按照1:3的比例进行细胞传代,得到传代的间充质干细胞;
c、表皮细胞的诱导培养
1)弃除原有培养液D,向传代的间充质干细胞中加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后取400g,离心5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞长至六孔板的70%-80%时,PBS冲洗一遍后,更换表皮细胞诱导培养液E,每两天更换一次培养液E;
5)培养5d,加含0.5mM EDTA的DPBS进行消化,表皮细胞培养液F重悬细胞沉淀,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液F重悬细胞,制成1×106单细胞悬液,得到表皮细胞备用;
d、成纤维细胞的诱导培养
1)弃除原有培养液D,加DMEM/F12培养液清洗一遍;
2)弃除DMEM/F12培养液,加含0.5mM EDTA的DPBS,消化5min;
3)然后离心400g,5min,收集细胞沉淀,以1:3的比例进行传代,传至已被Matrigel包被好的六孔板中;
4)待间充质干细胞的面积长至六孔板面积的70%-80%时,用PBS冲洗一遍,然后将间充质干细胞诱导培养液C更换成培养液G,每两天更换一次培养液G;
5)培养6d,加含0.5mM EDTA的DPBS进行消化,得到成纤维细胞培养液H重悬细胞,制成单细胞悬液,接种至10cm细胞培养皿中,细胞生长的面积达到整个细胞培养皿面积的90%后,加含0.5mM EDTA的DPBS消化,培养液H重悬细胞,制成5×105单细胞悬液,得到成纤维细胞备用;
e、组织工程双层皮肤的培养
1)将备用的羊膜用打孔器在无菌的环境下,打成与培养板孔直径相同的羊膜圆片;
2)将备用的成纤维细胞接种到六孔板中的一个孔中,接种量为5×105,补加500μL培养液H,当成纤维细胞的面积长到孔的面积的80%时,吸弃培养液,用PBS洗去死细胞,用羊膜圆片朝下平铺于成纤维细胞上,用与羊膜圆片相同尺寸的无菌不锈钢圈固定住羊膜圆片,加入2mL培养液H进行培养;
3)培养3d后,将成纤维细胞浸入到羊膜圆片中,每天更换一次培养液H,得到组织工程皮肤真皮层;
4)接着吸弃培养液,然后将以备用的表皮细胞以1×106的接种量,接种于羊膜圆片的上皮面,补加培养液F置2mL,移动培养皿使表皮细胞能均匀分散,置于细胞培养箱中培养,细胞培养箱中的条件为37℃,5%CO2;
5)培养2d后表皮细胞紧贴于羊膜上皮面,将培养液弃去,加入2mL培养液I继续培养,培养3d,每天更换培养液I,完成制备,得到组织工程双层皮肤。
实验例
以实施例1为例,观察所培养的皮肤表皮细胞、成纤维细胞和双层组织工程皮肤,观察未加羧甲基壳聚糖的培养基所培养的皮肤表皮细胞和成纤维细胞。
实施例1的表皮细胞培养基重悬细胞,制成1×106单细胞悬液,在显微镜下拍照,如图1所示用加有羧甲基壳聚糖的培养基,培养表皮细胞3d,细胞量已达到90%以上,如图2未加羧甲基壳聚糖的培养基,培养表皮细胞3d,细胞量达到50%,说明羧甲基壳聚糖促进了表皮细胞的生长,从而缩短了培养周期。
实施例1的成纤维细胞培养基重悬细胞,制成5×105单细胞悬液,显微镜下拍照,如图3所示用加有羧甲基壳聚糖的培养基,培养成纤维细胞3d,细胞量已达到90%以上,如图4未加有羧甲基壳聚糖的培养基,培养成纤维细胞3d,细胞量达到50%,说明羧甲基壳聚糖促进了成纤维细胞的生长,从而缩短了培养周期。
实施例1的双层皮肤培养基继续培养,培养2d,每天换液,如图5所示,为所制备出的双层皮肤培养基的优化及种子细胞培养周期的缩短,致使培养成双层皮肤的时间缩短。
对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!