一种双组分可注射型原位功能水凝胶生物材料及其制备方法与流程
本发明属于生物材料领域,具体涉及一种双组分可注射型原位功能水凝胶生物材料及其制备方法。
背景技术:
水凝胶不溶于水,但能在水中溶胀,由于其具有高含水量、优良的溶胀性能、良好的生物相容性、高渗透性和3D网状结构被广泛应用于组织工程、创伤修复及再生医学等领域。近些年来,可注射性水凝胶已成为一个重要的研究领域,引起各界的广泛关注。与普通凝胶相比,它具有以下优势:(1)成胶快速,可填充任意形状,使用灵活;(2)可通过注射方式使用,从而创伤较小,减少患者的疼痛;(3)可均匀包裹细胞、蛋白质、激素等各种生物活性物质,生物相容性好;(4)凝胶性能易于调控,可根据不同用途如创伤修复、药物缓释、组织再生等不同应用场景进行选择和调控。
可注射性水凝胶的制备主要有物理交联和化学交联两种方式。物理交联主要通过分子间相互作用力(范德华力、疏水相互作用、电荷作用、氢键等)形成,这类凝胶由于形成过程中不涉及化学反应,因而应用更简单、更安全,但其力学性能也较弱,稳定性较差。相对而言,化学交联可以改进这些不足,通过如迈克加成(Michael addition)、席夫碱反应(Schiff-base)、双硫键交换(Disulfide-bonding exchange)等化学反应对聚合物进行交联形成三维网状结构,大大加强水凝胶的力学强度和稳定性。不仅如此,基于化学交联的可注射性水凝胶除了可以保持良好的力学强度和稳定性外,更易通过控制组分之间的不同比例来达到不同的使用场景和目的,这对于实际使用也更为必要,因而更易实现产业化生产。
技术实现要素:
本发明的目的在于提供一种双组分可注射型原位功能水凝胶生物材料的制备方法。
本发明提出的一种双组分可注射型原位功能水凝胶生物材料的制备方法,所述水凝胶生物材料以端基功能化的水溶性聚醚高分子为第一组分,以氨基功能化的大分子为第二组分,然后通过第一组分和第二组分通过注射器快速均匀混合得到;其中:所述第一组分的端基功能化的水溶性聚醚高分子的质量百分数为5~15%,所述第二组分的富含氨基的大分子的质量百分数为1~10%。
本发明中,所述第一组分为端基功能化水溶性聚醚高分子,具体为端基是NHS羧酸酯基团的功能化聚醚高分子,包括但不限于线性、多臂或树枝状的功能化聚乙二醇高分子等,其结构分别如结构式1~4所示:
本发明中,所述第一组分线性、多臂或树枝状的端基功能化的聚乙二醇高分子的分子量分别在2kDa~20kDa范围内。
本发明中,所述第二组分为富含氨基的大分子,具体为富含氨基的天然或化学改性或合成高分子,包括但不限于壳聚糖及化学改性壳聚糖、多聚赖氨酸、氨基改性胶原蛋白、聚醚胺等,其结构式分别如式5~式8所示。
本发明中,所述第二组分为富含氨基的富含氨基的天然或化学改性或合成高分子,其中,壳聚糖或化学改性壳聚糖的分子量在100kDa~150kDa范围内;多聚赖氨酸的分子量在3.5kDa~10kDa范围内;氨基改性胶原蛋白的分子量在80kDa~100kDa范围内;聚醚胺的分子量在2kDa~20kDa范围内。
本发明提出的双组分可注射型原位功能水凝胶生物材料的制备方法,具体步骤为:将第一组分和第二组分通过注射器快速均匀混合,经灭菌处理,封装后得到所需产品;其中:所述第一组分与第二组分快速混合时固含量之比为5:1~1:1。
本发明的有益效果在于:本发明制备的双组分可注射型原位功能水凝胶生物材料,其制备方法简单,快速,容易实现工业化生产,在组织工程支架、骨修复材料、药物控释材料、生物粘合剂、创伤敷料、医用止血及抗菌等材料方面将有广泛的应用前景。
附图说明
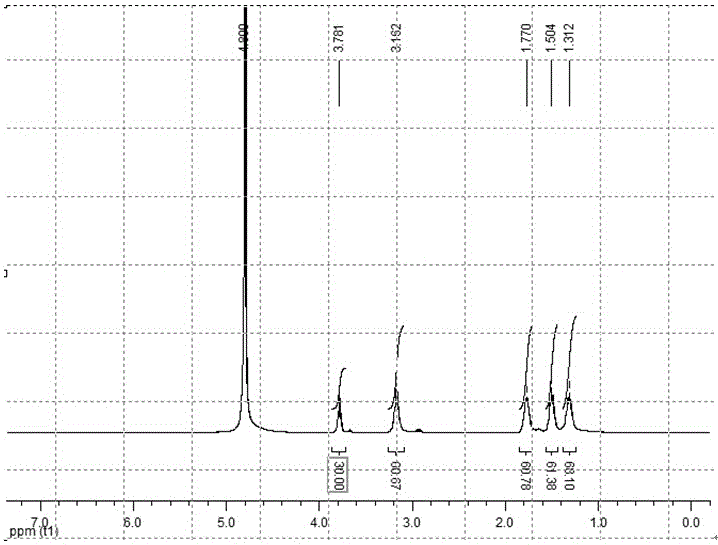
图1为实施例2中4-arm-PEG-SCM聚合物的核磁谱图(CDCl3,300MHz);
图2为实施例2中ε-PL聚合物的核磁谱图(D2O,300MHz);
图3为实施例2中原位功能水凝胶材料的溶胀性能测试;
图4为实施例2中原位功能水凝胶材料的抑菌测试图;其中:(a)为试验组(水凝胶试样),(b)为对照组(对照试样),(c)为不加样品组;
图5为实施例2中原位功能水凝胶材料的细胞毒性测试(细胞形态图);其中:A,25%样品提液,B,50%样品提液,C,75%样品提液,D,100%样品提液,E,空白对照,F,阳性对照(DMSO);
图6为实施例2中原位功能水凝胶材料的细胞毒性测试(MTT定量检测)。
具体实施方式
下面结合具体实施例和附图对本发明进行说明,所举的实施例仅是对本发明产品或方法做概括性例示,有助于更好地理解本发明,但不会限制本发明的范围,在不偏离本发明精神的基础上所做的修改和改进,均属于本发明要求保护的范围。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可由商业途径获得。
实施例1
将3.0g聚乙二醇(PEG1500-SCM2)溶于0.1M pH 7.4的PBS缓冲液,其质量分数控制在5%~15%之间,设为组分一;将1.0g多聚赖氨酸(ε-PL)溶于0.1M pH 7.4PBS缓冲液,其质量分数控制在1%~10%之间,设为组分二;随后分别将组分一和组分二装入双组分混合注射器中,通过快速混合即可制备该双组分可注射型原位功能水凝胶生物材料。经灭菌处理,封装后即得到产品。
实施例2
将1.0g四臂-聚乙二醇(4-arm-PEG-SCM4,核磁分析图谱见图1)溶于0.1M pH 7.4的PBS缓冲液,其质量分数控制在5%~15%之间,设为组分一;将0.8g多聚赖氨酸(ε-PL,核磁谱图见图2)溶于0.1M pH 7.4PBS缓冲液,其质量分数控制在1%~10%之间,设为组分二;随后分别将组分一和组分二装入双组分混合注射器中,通过快速混合即可制备该双组分可注射型原位功能水凝胶生物材料。经灭菌处理,封装后即得到产品。
实施例3
将1.8g八臂-聚乙二醇(8-arm-PEG-SCM8)溶于去离子水中,其质量分数控制在5%~15%之间,设为组分一;将0.2g氨基改性胶原蛋白(Collagen-NH2)溶于去离子水中,控制其质量分数在1%~3%之间,设为组分二;随后分别将组分一和组分二装入双组分混合注射器中,通过快速混合即可制备该双组分可注射型原位功能水凝胶生物材料,经灭菌处理,封装后即得到产品。
实施例4
将0.6g树枝状-聚乙二醇(dendrimer-PEG-SCM)溶于0.1M pH 7.4的PBS缓冲液,其质量分数控制在5%~15%之间,设为组分一;将2.4g聚醚胺溶于0.1M pH 7.4PBS缓冲液,其质量分数控制在5%~10%之间,设为组分二;随后分别将组分一和组分二装入双组分混合注射器中,通过快速混合即可制备该双组分可注射型原位功能水凝胶生物材料,经灭菌处理,封装后即得到产品。
实施例5
双组分可注射型原位水凝胶的溶胀率(Swelling Ratio,SR)测试:
该水凝胶材料的溶胀测试按照如下方法进行测试:
首先将实施例2中水凝胶进行冷冻干燥,然后对其进行称重,记为Ws,随后将其浸泡在0.1M pH 7.4的PBS缓冲液中,在特定的时间间隔点取出水凝胶,用滤纸吸去表面水分后进行称重记为Wt,时间间隔点分别为10min、20min、30min、60min、120min、240min、360min、720min、1440min、2880min及4230min。测试结束后,按照公式(1)计算其溶胀率:
溶胀曲线如图3所示。由图可知我们的双组分可注射型原位水凝胶具有非常高的溶胀能力,其在6个小时内溶胀率可达8000%以上,相比市面上常见的水凝胶有较大的优势。
实施例6
双组分可注射型原位水凝胶的抑菌测试:
该水凝胶材料的抑菌率按如下方法测试:
首先在无菌操作下打开大肠杆菌的甘油保种菌接种于营养肉汤培养基中,置37℃恒温培养箱中培养18h,用0.9%生理盐水进行10倍系列稀释操作,充分混匀,制备含菌量为5×103cfu/ml~5×104cfu/ml的菌悬液。取水凝胶试样(0.6g)和对照试样(与水凝胶试样同等重量,成分为琼脂)分别置于15ml离心管中,另设一个不加样品组(空的15ml无菌离心管),然后取上述菌悬液,分别在水凝胶试样、对照试样以及不加样品组的离心管中添加1ml菌悬液,室温振荡1h,到规定时间后,对上述所有离心管中的菌悬液稀释10倍后,取100微升稀释液置于无菌培养皿中,用凉至40~45℃的营养琼脂培养基15ml,作倾注,转动平皿,使其充分均匀,琼脂凝固后翻转平板,35℃±2℃培养24h,观察结果。抑菌率按公式(2)计算:
式中:
A对照组平均菌落数(CFU/ml);
B试验组平均菌落数(CFU/ml)。
测试结果显示,该双组分可注射型原位功能水凝胶材料的抑菌率达到了98%以上(如表1及图4所示),具有较强的抑菌作用。
表1
实施例7
双组分可注射型原位水凝胶的细胞毒性测试:
该水凝胶材料的细胞毒性采用GB/T 16886.12/ISO 10993.12的方法即将水凝胶的浸提液与小鼠的成纤维细胞(L929)进行接触培养的方法进行测试,具体过程如下,细胞培养:首先将L929细胞采用含10%FBS的DMEM培养基于二氧化碳培养箱(5%CO2,37℃)培养,调节细胞密度至1×105个细胞/mL,取96孔板,每孔接种100uL,孵育24h;浸提液制备:称量1g试样,切成5mm×25mm的小块,加入5mL无血清DMEM培养基,37℃水浴振荡浸提24h,然后采用0.22um过滤膜过滤浸提液,添加10%FBS,然后分别稀释浓度为75%、50%、25%;细胞毒性测试:除去培养L929细胞24h后96孔板中的培养基,分别加入100uL不同浓度的浸提液(100%、75%、50%、25%),高密度聚乙烯浸提液作为阴性对照,含0.5%苯酚的DMEM完全培养基作为阳性对照,DMEM完全培养基作为空白,于二氧化碳培养箱中孵育24h;取孔板观察细胞形态,进行形态学改变评价;除去培养基,加入50uL MTT溶液二氧化碳培养箱孵育2h,每孔加入100uL异丙醇,振荡培养板酶标仪测定570nm处光密度(参照波长650nm)。细胞存活率按公式(3)进行计算:
其中,OD570e为供试品100%浸提液组的光密度平均值;OD570b为空白组光密度平均值。
测试结果分别如图5和图6所示,可以看出该双组分可注射型原位功能水凝胶对细胞完全无毒性,生物相容性好。
实施例1、实施例3和实施例4的溶胀率、抑菌率和细胞毒性测试同实施例2。
- 还没有人留言评论。精彩留言会获得点赞!