成骨型骨转移模型动物的制备方法与流程
本发明涉及成骨型骨转移模型动物的制备方法。另外,本发明还涉及利用所述制备方法的、用于筛选用以检测成骨型骨转移的化合物的方法、及用于筛选具有抑制成骨型骨转移的活性的化合物的方法。进而,本发明还涉及利用所述制备方法制得的成骨型骨转移模型动物。
背景技术:
所谓骨转移,是指肿瘤细胞经由血管迁移、在骨中形成其病灶的现象,在病理学上,其主要被分类为以下四个类型:成骨型、溶骨型、此二者混合存在的混合型、及确认不到成骨和溶骨的骨小梁间型(intertrabecular)。另外,伴随着近来的对原发灶有效的治疗方法的增加,癌症患者的寿命得以延长,但作为不利的一面,因骨转移而引起疼痛、骨折、麻痹等各种严重的症状,患者的生活品质下降成为问题。特别是成骨型骨转移的患者的生存时间比其他类型更长,因而强烈要求开发用于治疗或预防该转移的方法。
另外,近年来,在对癌症的治疗药·诊断药的开发中,为了评价其功能效果、adme,正在尝试制作荷癌模型动物。关于成骨型骨转移,也报道过通过将肿瘤细胞注入骨髓腔内而成功制作了其模型动物的内容(非专利文献1及2)。然而,该动物是通过将肿瘤细胞直接注入骨中制作的,与原本的发生机理(经血管迁移而在骨中形成病灶)不同,因此,作为模型动物的有效性不足。
另外,关于成骨型骨转移,还报道过通过将肿瘤细胞注入心脏的左心室内或尾静脉内来尝试制作其模型动物(非专利文献2)。然而,在利用这样的经由血管的方法而得到的动物中,虽然观察到了暗示骨转移的后肢运动障碍,但并未检测到能利用闪烁造影法检测出来的程度的成骨性病变。
现有技术文献
非专利文献
非专利文献1:lamoureuxf.等,int.j.cancer,2008年,122(4),751~760页
非专利文献2:liepek.等,anticancerres.,2005年,25(2a),1067~1073页
技术实现要素:
发明所要解决的课题
本发明是鉴于上述现有技术中存在的课题而作出的,目的在于提供通过使肿瘤细胞经由血管迁移而在骨中形成成骨性病变的非人动物。
用于解决课题的手段
本申请的发明人为了达成上述目的而反复进行了深入研究,结果发现,在向大鼠施予钙调神经磷酸酶(calcineurin)抑制剂之后、将与该大鼠为同种异系的关系的肿瘤细胞注入动脉内的情况下,以极高的概率形成了广范围的成骨性病变。
本发明是基于以上的研究结果而完成的,涉及成骨型骨转移模型动物的制备方法。另外,本发明还涉及用于筛选用以检测成骨型骨转移的化合物的方法、及用于筛选具有抑制成骨型骨转移的活性的化合物的方法。此外,本发明还涉及利用上述制备方法制得的成骨型骨转移模型动物,更具体而言,内容如下。
<1>用于制备成骨型骨转移模型动物的方法,所述方法包括向非人动物施予钙调神经磷酸酶抑制剂的工序、和向该非人动物的动脉或静脉内注入肿瘤细胞的工序,并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
<2>用于筛选用以检测成骨型骨转移的化合物的方法,所述方法包括下述工序:
工序(1),向非人动物施予钙调神经磷酸酶抑制剂;
工序(2),向该非人动物的动脉或静脉内注入肿瘤细胞,使得形成成骨性病变;
工序(3),使该非人动物摄取被测化合物;
工序(4),在所述成骨性病变部位中对所述被测化合物进行检测;和
工序(5),以检测到的所述被测化合物在成骨性病变部位中的蓄积程度作为指标,判定该化合物是否能够检测出成骨型骨转移,
并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
<3>用于筛选具有抑制成骨型骨转移的活性的化合物的方法,所述方法包括下述工序:
工序(1),向非人动物施予钙调神经磷酸酶抑制剂;
工序(2),向该非人动物的动脉或静脉内注入肿瘤细胞;
工序(3),在该肿瘤细胞的注入前、注入时或注入后,使该非人动物摄取被测化合物;
工序(4),对已摄取所述被测化合物的非人动物中的成骨性病变的程度进行检测;
工序(5),针对在工序(2)中注入了所述肿瘤细胞的非人动物,对不使其摄取所述被测化合物的情况下的成骨性病变的程度进行检测;和
工序(6),对在工序(4)及工序(5)中检测到的成骨性病变的程度进行比较,在工序(4)中检测到的成骨性病变的程度比在工序(5)中检测到的成骨性病变的程度低时,判定所述被测化合物为具有抑制成骨型骨转移的活性的化合物,
并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
<4>如<1>~<3>中任一项所述的方法,其中,所述肿瘤细胞为前列腺癌细胞或乳腺癌细胞。
<5>如<1>~<4>中任一项所述的方法,其中,所述非人动物为啮齿类。
<6>如<1>~<5>中任一项所述的方法,其中,注入所述肿瘤细胞的血管为隐动脉。
<7>成骨型骨转移模型动物,其为通过施予钙调神经磷酸酶抑制剂、并向动脉或静脉内注入肿瘤细胞而形成了成骨性病变的非人动物,并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
<8>如<7>所述的成骨型骨转移模型动物,其中,所述肿瘤细胞为前列腺癌细胞或乳腺癌细胞。
<9>如<7>或<8>所述的成骨型骨转移模型动物,其中,所述非人动物为啮齿类。
<10>如<7>~<9>中任一项所述的成骨型骨转移模型动物,其中,注入所述肿瘤细胞的血管为隐动脉。
发明的效果
根据本发明,能够在非人动物中以100%这样的极高的概率形成成骨性病变。另外,形成的成骨性病变的部位遍及广范围。进而,通过驱动或控制要注入肿瘤细胞的动脉或静脉的血流,还能够使得在所期望的骨中形成成骨性病变。因此,通过使用本发明的制备方法、及利用该方法制备的成骨型骨转移模型动物,还可以高效且灵敏度良好地进行对在成骨型骨转移的治疗、预防或诊断方面有用的化合物的筛选。
附图说明
图1a是显示对施予了环孢素(ciclosporin)、并向其隐动脉中注入了大鼠前列腺癌细胞(at6-1)的sd大鼠的下肢骨(股骨及胫骨)截面以甲苯胺蓝染色后利用显微镜观察得到的结果的照片。在图中正中央的照片中,标示了at6-1转移的部位(黑白显示中用灰色表示的位置、或彩色显示中用淡蓝色表示的位置),右侧的照片中还标示了成骨性病变部位(黑白显示中用白色表示的位置、或彩色显示中用黄色表示的位置)。
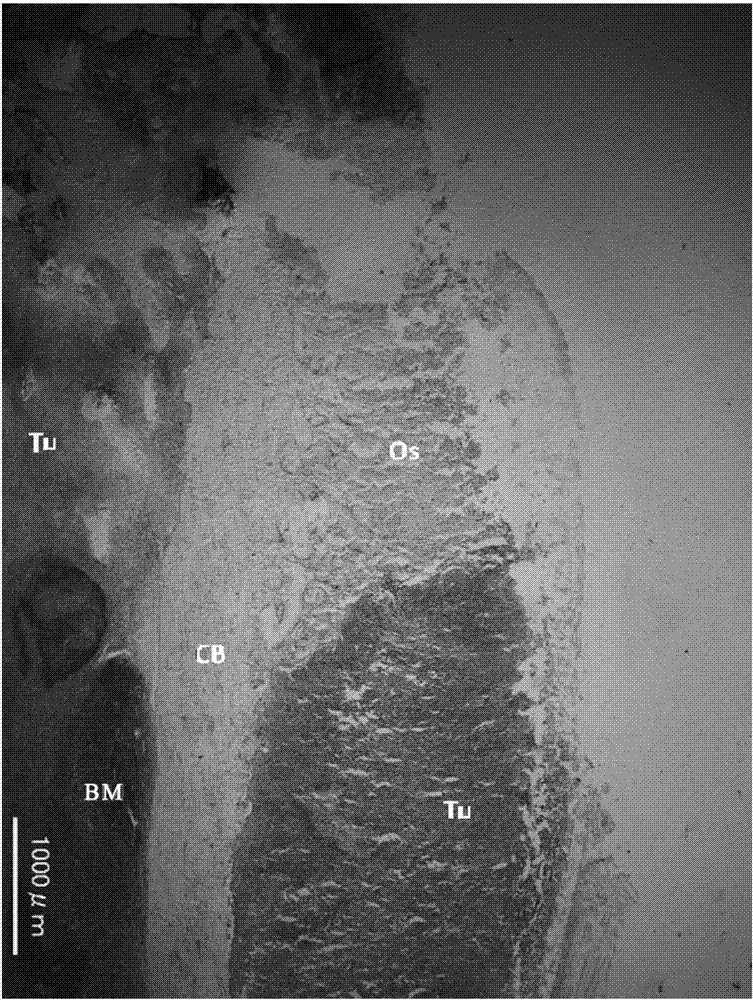
图1b是显示将在图1a中的右侧照片中由方形圈出的部位(1)进行放大观察的结果的显微镜照片。另外,标示为“bm”的部位是骨髓,标示为“cb”的部位是皮质骨,标示为“os”的部位是类骨质,标示为“tu”的部位是at6-1转移的部位(以下,关于图中的标记,在图1c~f、5b及5c中也同样)。
图1c是显示将在图1a中的右侧照片中由方形圈出的部位(2)进行放大观察的结果的显微镜照片。
图1d是显示将在图1a中的右侧照片中由方形圈出的部位(3)进行放大观察的结果的显微镜照片。
图1e是显示将在图1a中的右侧照片中由方形圈出的部位(4)进行放大观察的结果的显微镜照片。
图1f是显示将在图1a中的右侧照片中由方形圈出的部位(5)进行放大观察的结果的显微镜照片。
图2是显示对施予了环孢素并向其隐动脉中注入了at6-1的sd大鼠(图中左侧)、和不施予环孢素但向其隐动脉中注入了at6-1的哥本哈根大鼠(copenhagenrat)(图中右侧)的下肢骨截面以甲苯胺蓝染色后利用显微镜观察得到的结果的照片。需要说明的是,关于图中的标记,与图1a同样。
图3a是显示对向其隐动脉中注入了at6-1的裸大鼠(nuderat)的下肢骨截面以甲苯胺蓝染色后利用显微镜观察得到的结果的照片。需要说明的是,关于图中的标记,与图1a同样。
图3b是显示将在图3a中由较大的方形圈出的部位进行放大观察的结果的显微镜照片。需要说明的是,关于图中的标记,与图1b同样。
图3c是显示将在图3a中由较小的方形圈出的部位进行放大观察的结果的显微镜照片。需要说明的是,关于图中的标记,与图1b同样。
图4是显示通过ct对施予了环孢素并向其隐动脉中注入了大鼠前列腺癌细胞(at6-1)的sd大鼠的下肢(移植肢)进行分析而得到的结果的图。图中,箭头指示的部位为成骨性病变部位,三角形指示的部位为at6-1转移的部位。
图5a是显示对施予了环孢素并向其隐动脉中注入了大鼠乳腺癌细胞(mrmt-1)的sd大鼠的下肢骨(股骨及胫骨)的截面以甲苯胺蓝染色后利用显微镜观察得到的结果的照片。图中右侧的照片中,标示了mrmt-1转移的部位(黑白显示中用灰色表示的位置、或彩色显示中用淡蓝色表示的位置),还标示了成骨性病变部位(黑白显示中用白色表示的位置、或彩色显示中用黄色表示的位置)。
图5b是显示将在图5a中的右侧照片中由方形圈出的部位(1)进行放大观察的结果的显微镜照片。
图5c是显示将在图5a中的右侧照片中由方形圈出的部位(2)进行放大观察的结果的显微镜照片。
具体实施方式
<成骨型骨转移模型动物、及其制备方法>
本发明的用于制备成骨型骨转移模型动物的方法包括向非人动物施予钙调神经磷酸酶抑制剂的工序、和向该非人动物的动脉或静脉内注入肿瘤细胞的工序,并且所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
本发明中,所谓“成骨型骨转移”,是指注入至非人动物中的肿瘤细胞作用于骨组织、从而在该非人动物中形成至少1处骨形成被促进的部位(成骨性病变)。即,本发明中的骨转移不仅包含成骨型(成骨型占优),而且包含还观察到溶骨性病变等的混合型。另外,即使是溶骨型(溶骨型占优),只要也形成有成骨性病变,则其也被包含在内。
在本发明中,作为用于制作成骨型骨转移模型的“非人动物”,没有特别限制,可举出小鼠、大鼠、仓鼠、豚鼠、兔、猪、小型猪、绵羊、猫、狗等哺乳动物等脊椎动物,只要为人以外则可以是任何动物,其性别、周龄等也没有特别限定。另外,本发明涉及的“非人动物”优选为小鼠、大鼠、仓鼠、豚鼠等啮齿类,更优选为大鼠,进一步优选为sprague-dawley(sd)大鼠或wister大鼠。此外,如后述的实施例所示,本发明涉及的“非人动物”优选为免疫功能(t细胞的功能等)未被抑制的非人动物。
在本发明中,在将肿瘤细胞注入前或注入时所施予的“钙调神经磷酸酶抑制剂”是指具有抑制钙调神经磷酸酶的酶活性的活性的化合物,例如,可举出环孢素、他克莫司,优选为环孢素。另外,已知通过对钙调神经磷酸酶活性的抑制,il-2的产生将被抑制。因此,该化合物也可以是具有抑制il-2产生的活性的化合物。需要说明的是,本发明中的“抑制”不仅包括部分性的抑制,而且也包括完全的抑制(阻碍)。
另外,作为钙调神经磷酸酶抑制剂向非人动物的施予方法,没有特别限制,可举出口服施予、皮下施予、静脉内施予、动脉内施予、腹腔内施予、皮内施予、气管内施予、直肠施予、肌肉内施予。
另外,从在注入肿瘤细胞前预先抑制钙调神经磷酸酶的酶活性的观点考虑,期望钙调神经磷酸酶抑制剂的施予在所述注入之前,但也可与肿瘤细胞的注入同时进行。进而,钙调神经磷酸酶抑制剂的施予可以为单次,也可以是多次的施予,还可以是利用药物传递系统(渗透压泵)等的持续性施予。另外,钙调神经磷酸酶抑制剂的施予可以在后述的肿瘤细胞注入后仍继续进行。进而,从操作的容易性的观点考虑,将钙调神经磷酸酶抑制剂持续性地施予至非人动物的皮下是优选的。另外,作为钙调神经磷酸酶抑制剂的施予量,本领域技术人员可根据作为对象的非人动物的种类、体重、年龄等来适当调节,通常为1~150mg/kg体重,优选为2~50mg/kg体重,可一次施予所述量,也可分成数次(例如,2周中每天)施予。
在本发明中,在钙调神经磷酸酶抑制剂的施予后或施予时被注入至非人动物中的肿瘤细胞只要是具有在骨组织中促进骨形成的活性的肿瘤细胞即可,例如,可举出前列腺癌、乳腺癌、消化器官癌(胃未分化癌等)、卵巢癌的细胞,根据成骨型骨转移在癌症患者中的发生频率的实际高低,优选为前列腺癌细胞或乳腺癌细胞,更优选为大鼠前列腺癌细胞或大鼠乳腺癌细胞。在大鼠前列腺癌细胞中,进一步优选r-3327或其衍生株,特别优选at6-1。在大鼠乳腺癌细胞中,进一步优选mrmt-1。需要说明的是,本发明涉及的肿瘤细胞必须与接受其注入的非人动物为同种异系或异种的关系。
在本发明中,作为被注入的肿瘤细胞的数量,本领域技术人员可根据作为对象的非人动物的种类、体重、周龄等来适当调节,通常每一个注入部位为1.0×104~1.0×107个,优选为1.0×104~5.0×105个,更优选为2.5×104~2.0×105个。
另外,对于肿瘤细胞而言,通常将其悬浮在溶液中,通过注射而注入。作为这样的溶液,只要是适合细胞生存的溶液即可,例如,可举出缓冲液(hbss、生理盐水、pbs、hepes等)、培养基(rpmi1640、dmem、mem等)。
此外,作为注入肿瘤细胞的时机,可在环孢素施予后或施予时(持续性施予的情况下,在该施予开始后或施予开始时),本领域技术人员可根据作为对象的非人动物的种类、体重、年龄等来适当调节,通常为第1~5天,优选为第2~5天。另外,肿瘤细胞的注入通常为一次,也可分成数次实施。
需要说明的是,在本发明中,“第…天”是指以不包括开始施予当天等的第一天在内的方式计数的天数。
另外,在本发明中,肿瘤细胞是从动脉或静脉注入的。作为接受注入的动脉或静脉,没有特别限制,根据期望形成成骨性病变的骨,优选使用相对于该骨而言位于血流方向的上游侧的动脉或静脉、即能够随着该血流而将注入的肿瘤细胞送达至作为目标的骨的动脉或静脉。另外,即使不使用位于上游侧的动脉或静脉,本领域技术人员也可以通过结扎周围的血管等方式来控制血流,从而使肿瘤细胞到达所期望的骨(例如,如非专利文献2中公开的那样,通过夹住腹部静脉来中止血流,可以将从尾静脉注入的肿瘤细胞诱导至腰椎中)。此外,使成骨性病变形成于下肢骨的情况下,例如,可使用隐动脉、腹壁浅动脉、腹壁上动脉、腹壁下动脉、股深动脉、旋股外侧动脉、腘动脉、髂外动脉,从操作的容易性的观点考虑,更优选向隐动脉、腹壁浅动脉或腹壁上动脉的注入,特别优选向隐动脉的注入。
因此,根据以上说明的制备方法,如后述的实施例所示,可以在非人动物中以100%这样的极高的概率形成成骨性病变。另外,形成的成骨性病变的部位遍及广范围。进而,通过驱动或控制要注入肿瘤细胞的动脉或静脉的血流,可使得在所期望的骨中形成成骨性病变。因此,利用本发明的制备方法制得的成骨型骨转移模型动物在筛选对于成骨型骨转移的治疗、预防或诊断有用的化合物的方面是有用的。此外,本发明还提供下述成骨型骨转移模型动物。
成骨型骨转移模型动物,其为通过施予钙调神经磷酸酶抑制剂、并向动脉或静脉内注入肿瘤细胞而形成了成骨性病变的非人动物,并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
另外,在本发明中,形成成骨性病变的时期取决于使用的非人动物及注入的肿瘤细胞的种类和细胞数量等,通常为注入肿瘤细胞后的第14~28天。另外,作为如此形成的成骨性病变的部位的范围,也取决于使用的非人动物及肿瘤细胞的种类等,在骨的长轴方向的截面中,将该截面整体设为100%时,所述范围通常为0.5%以上,优选为1%以上,更优选为2%以上。此外,作为成骨性病变形成的部位,没有特别限制,通常为骨髓腔外,但也可以是骨髓腔内。另外,对于本发明的成骨型骨转移模型动物而言,除了骨转移以外,也可同时确认到向其他脏器(肺、淋巴结、肝脏、肾脏等)的转移。
<用于筛选用以检测成骨型骨转移的化合物的方法>
如上文所述,在由本发明制备的成骨型骨转移模型动物中,在所期望的骨中以100%的概率形成了遍及广范围的成骨性病变,因此,也可合适地用于对在成骨型骨转移的诊断方面有用的化合物的筛选。
因此,本发明还提供用于筛选用以检测成骨型骨转移的化合物的下述方法。所述方法包括下述工序:
工序(1),向非人动物施予钙调神经磷酸酶抑制剂;
工序(2),向该非人动物的动脉或静脉内注入肿瘤细胞,使得形成成骨性病变;
工序(3),使该非人动物摄取被测化合物;
工序(4),在所述成骨性病变部位中对所述被测化合物进行检测;和
工序(5),以检测到的所述被测化合物在成骨性病变部位中的蓄积程度作为指标,判定该化合物是否能够检测出成骨型骨转移,
并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
关于工序(1)及(2),如上文所述。并且,作为使经过这些工序而制备的成骨型骨转移模型动物摄取的“被测化合物”,没有特别限制,例如,可举出合成低分子化合物、糖类(单糖、二糖、寡糖等)、抗体、肽、核苷酸、脂质、及由各种化合物构成的文库(library)、细菌分泌物、细胞(微生物、植物细胞、动物细胞)的提取液及培养上清液、来自于海洋生物、植物或动物的提取物、土壤、噬菌体展示随机肽文库。另外,为了用后述的方法检测这些化合物,可对其实施标记。作为这样的标记,可举出放射性同位素(99mtc、18f、14c、3h、89zr、111in、123i、124i、125i、131i、68ga、64cu、15o、97ru、67cu、11c、13n等)、顺磁性同位素(153gd、157gd、55mn、162dy、52cr、56fe等)、造影剂(钆、钆络合物、碘造影剂等)、荧光物质(吲哚花青绿、irdye800系列、荧光素(fluorescein)、fitc、发荧光金属(152eu、镧系列等)等)、化学发光物质或生物发光物质(鲁米诺(luminol)、咪唑、虫荧光素(luciferin)、荧光素酶、gfp等)。另外,被测化合物与标记的结合可利用本技术领域中已知的方法进行,例如可直接进行化学性结合,或者也可以介由合适的连接体而间接性地结合。
另外,作为非人动物对被测化合物的摄取方法,没有特别限制,可举出口服施予、皮下施予、静脉内施予、动脉内施予、腹腔内施予、皮内施予、气管内施予、直肠施予、肌肉内施予。另外,作为摄取的被测化合物的浓度、次数及时期,没有特别限制,可根据其种类、性质(溶解度、毒性等)而适当调节。
被测化合物的检测方法也没有特别限制,本领域技术人员可适当使用已知方法进行检测。作为所述已知方法,体内法的情况下,可举出生物成像技术(闪烁造影法、单光子发射计算机断层摄影法(spect)、正电子发射型断层摄影法(pet)、计算机轴向断层摄影法(cat、ct)、pet/ct、磁共振成像法(mri))。另外,体外法的情况下,例如,可举出闪烁造影法、利用荧光显微镜的观察、质谱分析、液相色谱分析。
并且,在本发明中,可将以上述方式检测到的上述被测化合物在成骨性病变部位中的蓄积程度作为指标,来判定该化合物是否能够检测出成骨型骨转移。所谓“蓄积程度”,例如,可举出在成骨性病变部位中检测到的、来自于被测化合物的信号的强度(放射线量、荧光强度、发光强度等)、被测化合物的量。另外,作为这样的判定方法,没有特别限制,例如,若利用本发明的方法而形成了成骨性病变的骨中的被测化合物的蓄积程度显著地高于没有形成成骨性病变的骨,则可判定该被测化合物为能够检测出成骨型骨转移的化合物。
<用于筛选具有抑制成骨型骨转移的活性的化合物的方法>
如上文所述,在由本发明制备的成骨型骨转移模型动物中,得以在所期望的骨中以100%的概率形成遍及广范围的成骨性病变,因此,本发明也可合适地用于对在成骨型骨转移的治疗或预防方面有用的化合物的筛选。
因此,本发明还提供用于筛选具有抑制成骨型骨转移的活性的化合物的下述方法。所述方法包括下述工序:
工序(1),向非人动物施予钙调神经磷酸酶抑制剂;
工序(2),向该非人动物的动脉或静脉内注入肿瘤细胞;
工序(3),在该肿瘤细胞的注入前、注入时或注入后,使该非人动物摄取被测化合物;
工序(4),对已摄取所述被测化合物的非人动物中的成骨性病变的程度进行检测;
工序(5),针对在工序(2)中注入了所述肿瘤细胞的非人动物,对不使其摄取所述被测化合物的情况下的成骨性病变的程度进行检测;和
工序(6),对在工序(4)及工序(5)中检测到的成骨性病变的程度进行比较,在工序(4)中检测到的成骨性病变的程度比在工序(5)中检测到的成骨性病变的程度低时,判定所述被测化合物为具有抑制成骨型骨转移的活性的化合物,
并且,所述非人动物与所述肿瘤细胞为同种异系或异种的关系。
关于工序(1)和(2)、以及工序(3)中的被测化合物及其摄取方法,如上文所述。另外,被测化合物的摄取可在肿瘤细胞的注入前、注入时或注入后,以筛选对于成骨型骨转移的治疗有用的化合物为目的时,优选在肿瘤细胞的注入后使非人动物摄取被测化合物,更优选在成骨性病变形成后使其摄取。另外,以筛选对于成骨型骨转移的预防有用的化合物为目的时,优选在肿瘤细胞的注入前使非人动物摄取被测化合物。
另外,作为经过这样的工序后的非人动物中的“成骨性病变的程度的检测”,例如,可举出如后述的实施例所示的、利用显微镜的观察、利用pet、cat、ct、pet/ct、微焦x射线ct(μct)、闪烁造影法、spect、软x射线摄影、mri等进行的骨形态观察。另外,也可通过对骨形成标志物(骨型碱性磷酸酶(bap)、骨钙素(oc)、i型前胶原羧基端前肽(picp)、i型前胶原氨基端前肽(pncp))的检测来进行。另外,作为标志物的检测方法,例如,可举出免疫组织化学分析、cleia法、eia法、elisa法。此外,对成骨性病变程度的检测也可以是对由成骨型骨转移引起的症状(运动障碍、骨折等)的检测。
并且,将以上述方式检测到的成骨性病变的程度与未摄取被测化合物的非人动物中的成骨性病变的程度进行比较,前者更低时,可判定所述被测物质为具有抑制成骨型骨转移的活性的化合物。
实施例
以下,基于实施例及比较例来更具体地说明本发明,但本发明不限于以下的实施例。
本申请的发明人利用以下所示的4种方法尝试了成骨型骨转移模型动物的制作。
(实施例1)
首先,将环孢素施予至sprague-dawley(sd)大鼠。然后,在该施予开始后的第5天,向该sd大鼠的隐动脉内注入大鼠前列腺癌细胞。
(比较例1)
使用哥本哈根大鼠代替sd大鼠,并且不对该大鼠施予环孢素,除此以外,利用实施例1中记载的方法,尝试了成骨型骨转移模型动物的制作。
(比较例2)
使用哥本哈根大鼠代替sd大鼠,并在开始对该大鼠施予环孢素后的第4天注入癌细胞,除此以外,利用实施例1中记载的方法,尝试了成骨型骨转移模型动物的制作。
(比较例3)
使用f344裸大鼠(t细胞功能缺陷的大鼠)代替sd大鼠,并且不对该大鼠施予环孢素,除此以外,利用实施例1中记载的方法,尝试了成骨型骨转移模型动物的制作。
另外,在上述4种制作方法中使用的大鼠、细胞及实验方法的详情如下所述。
<大鼠及细胞>
sd大鼠由japanslc,inc.提供,使用了3只9周龄的雄鼠。哥本哈根大鼠由japanslc,inc.提供,在比较例1中使用了2只10周龄的雄鼠和3只13周龄的雄鼠,总计5只;在比较例2中使用了2只17周龄的雄鼠。f344裸大鼠由cleajapan,inc.提供,使用了2只19周龄的雄鼠。
另外,注入至上述大鼠的前列腺癌细胞为来自于哥本哈根大鼠的前列腺癌细胞株r-3327的亚系at6-1。即,对于at6-1与接受其注入的大鼠而言,在实施例1及比较例3中为同种异系的关系,在比较例1及2中为同种同系的关系。
<环孢素的施予>
对于上述大鼠,如下所述,通过在皮下埋入渗透压泵,从而持续性地施予环孢素。
首先,测定渗透压泵(alzet(注册商标)osmoticpump,型号:2ml4)和安装于其上的流量调节器(flowmoderator)的净重量。接着,将灌注管(fillingtube)安装于抽吸了约2ml环孢素溶液(50mg/ml,novartispharma公司制,产品名:sandimmun(注册商标)静脉滴注用250mg)的2cc注射器(泰尔茂公司制)后,排出注射器内的气泡。接着,将渗透压泵的插入口朝上并垂直固定,将灌注管插入至插入口中,直到灌注管变得无法行进的位置为止。然后,缓缓推动注射器的柱塞,将环孢素溶液注入渗透压泵内。接着,确认到该溶液从插入口的漏出后,停止注入,拔掉灌注管。用kimwipe擦拭纸等拭去漏出的溶液后,将流量调节器从渗透压泵的插入口插入,向内推直到凸缘与泵贴合为止,并再次用kimwipe擦拭纸等拭去漏出的溶液。然后,测定安装有流量调节器的渗透压泵的重量,基于上述净重量,算出注入的环孢素溶液的重量(体积)。需要说明的是,算出的体积为渗透压泵灌注体积(fillvolume)的90%以上的情况下,由于混有气泡的可能性极低,因此评价为合格,并将其如下所述地埋入大鼠中。
如上述那样将环孢素溶液灌注进渗透压泵后,将大鼠用异氟烷麻醉,以俯卧位固定,将从颈部到腰部的背面的毛剃除。用剪刀将腰背部的皮肤剪开约1cm,将渗透压泵插入该切开部后,用5-0的缝合线将皮肤缝合。然后,皮下注射10μl抗生素(fosfomins(磷霉素钠)),放回笼中饲养。需要说明的是,在比较例1及3中,不实施上述埋入渗透压泵的手术,而将下述前列腺癌细胞注入大鼠中。
<前列腺癌细胞的注入>
在开始施予环孢素后的第4天或第5天、或在不施予环孢素的情况下,如下所述地操作,将前列腺癌细胞(at6-1)注入大鼠的作为股动脉分支的隐动脉中。
首先,对at6-1进行胰蛋白酶处理,将其从培养皿剥离,测定细胞数,以使细胞数成为2×106个/ml的方式悬浮在不含ca2+/mg2+的hank’s平衡盐溶液(hbss)中,进行冰冷却直到注入大鼠为止。
另外,将大鼠用异氟烷麻醉,以仰卧位固定,然后将后肢鼠蹊部的毛剃除,用70%乙醇/聚维酮碘(isodine)进行消毒。接着,皮下注射0.01~0.02ml(0.2mg/kg)的美洛昔康(metacam)0.5%注射液,然后将鼠蹊部皮肤切开约2~3cm。接下来,对腹壁浅动脉、隐动脉等加以确认后,剥离血管、神经周围的被膜,分别剥离隐动脉、静脉及神经,使其彼此分开。接着,在较之腘动脉分支部而言的远端部的隐动脉上穿设一根结扎线(3-0),将腹壁浅动脉分支部周围的组织剥离(将该结扎线也称为缝合线(1))。在腹壁浅动脉分支部与腘动脉分支部之间的股动脉(较之腹壁浅动脉分支部而言的略远端部)上穿设一根结扎线,沿着隐动脉滴加数滴平滑肌松弛剂(盐酸罂粟碱注射液)(将该结扎线也称为缝合线(2))。
抽吸0.1ml上述细胞悬浮液至29gmyjector注射器中,用手术钳夹持缝合线(1)及(2)的端部,为了避免细胞的反流及从隐动脉向末梢的流入,吊起隐动脉。将棉棒插入隐动脉下方后,从吊起的隐动脉的远端部朝向中枢方向刺入注射针,缓缓注入细胞悬浮液(0.1ml/10秒)。然后,缓缓拔除注射针,确认没有出血后,在刺入口处滴加瞬间粘合剂(产品名:aronalpha),将脂肪块置于其上方而堵塞刺入口,确认了没有出血。接着,松开缝合线(1)及(2),使来自股动脉的血流再次流动,并确认到没有出血。进而,用70%乙醇浸满手术区,为了除去漏出至血管外的肿瘤细胞,放置约10秒。接着,用脱脂棉吸取70%乙醇,用生理盐水浸满手术区后,充分地清洗。再次用生理盐水清洗手术区后,将手术区的肌肉、组织复位,用缝合线(5-0)将皮肤缝合。
需要说明的是,在实施例1、比较例1及3中,利用上述方法将细胞悬浮液注入一条后肢并进行处置,对于另一条后肢,除了注入hbss来代替细胞悬浮液以外,如上所述地进行处置。另外,在比较例2中,利用上述方法将细胞悬浮液注入两条后肢并进行处置。然后,在这样地处置后,皮下注射抗生素(fosfomins),将大鼠放回笼中饲养。
<骨的未经固定的冷冻切片的甲苯胺蓝染色>
为了检测经前列腺癌细胞注入的大鼠中的成骨型骨转移,如下所述地进行了甲苯胺蓝染色。
首先,将股骨、胫骨及腓骨在股关节和脚踝附近处切断,在不摘取它们之间的关节的情况下,从如上所述地注入了前列腺癌的大鼠中分离上述3根骨(下肢骨),按照川本膜法(硬组织的未经固定非脱钙冷冻切片制作方法),制备冷冻切片。
更具体而言,如下文所述,为了能够在骨表面形成成骨性病变,以残留少许周围的肌肉的方式,从注入前列腺癌2~3周后的大鼠中摘出下肢骨。接着,切断股骨头及胫骨远端,将下肢骨弯曲成松针状,用线将股骨近位及胫骨远位切断端打结固定。
接下来,将上述下肢骨置于不锈钢制网眼勺(烹饪用的撇去浮沫的器具)中,并沉入冷却液(异戊烷/干冰)中,在挪动勺的同时急速冷冻(约10秒)。接着,在不锈钢制的包埋用容器中放入经预先冷藏的包埋剂(scem,section-lab制),拭去骨表面的冷却材料,将下肢骨沉入包埋剂中。然后,将包埋容器整体沉入冷却液中,在挪动包埋容器的同时进行冷冻(直到包埋剂上表面开始冻结的程度为止,约10秒)。提起包埋容器,使得包埋剂的上表面与冷却液面等高,在该状态下将包埋剂完全地冷冻。将得到的包埋块移至冷冻切片机(cryostat)冷却室内(-20℃),用冷冻切片机制备5μm的切片,从而得到与骨长轴平行的截面。接着,在冷冻切片机内放置30分钟,冷冻干燥后,从冷冻切片机中取出,于室温干燥1分钟。接着,在无水乙醇中浸泡3~5秒,然后用kimtowel擦拭纸吸取多余的乙醇,立即在4%多聚甲醛(paraformaldehyde)溶液中浸泡1分钟以上。通过在纯水中进出10秒而进行洗涤后,在0.05%甲苯胺蓝溶液(ph7)中浸泡5分钟。接下来,通过再次在纯水中进出30秒而进行洗涤后,用kimtowel擦拭纸吸取多余的水。接下来,在组织面滴加数滴专用密封剂scmm-r3,然后,使用切割器,在载玻片的双面胶带的内侧将切片支承用粘合膜切断。另外,准备滴加了数滴scmm-r3的其他的新载玻片,将之前的切片支承用粘合膜以组织面位于下方的方式覆盖在该新载玻片上。使2片切成细条的滤纸在切片支承用粘合膜上进行左右往复滑动,吸取多余的scmm-r3。需要说明的是,在载玻片与该膜之间混入气泡时,用尖头镊子揭起膜,滴下1、2滴scmm-r3,再次用滤纸吸取多余的scmm-r3。接着,将载玻片设置于切片密封装置中,照射紫外线1分钟后,供于水洗。
然后,利用数码显微镜(keyence公司制,多功能显微镜)对以上述方式制备的、骨的未经固定的冷冻切片进行观察,得到染色图像。得到的结果中,注入前列腺癌后第18天的代表性的染色图像示于图1a~3c。
<计算机断层摄影(ct)>
为了检测经前列腺癌细胞注入的大鼠中的成骨型骨转移,还如下所述地进行了ct分析。即,向注入前列腺癌后第15~20天的大鼠导入异氟烷进行麻醉,在仰面朝上的状态下,使用胶带等将腹部及腿部固定在大鼠用固定床上。接着,将该大鼠送入ct装置内,照射x射线,在以下所示的摄影条件下,获取后肢的膝关节部周围的ct图像(raw文件)。
投影数(projectcount):180个视图(180views)
面平均(framesaveraged):1帧/视图(1frames/view)
检测器像素合并(detectorbinning):2x2
x射线管电流(x-raytubecurrent):“默认(default)(150μa)”
x射线管电压(x-raytubevoltage):75kv
暴露时间(exposuretime):230ms
放大倍数(magnification):2.6
将得到的raw文件用trifoilconsole重建(重建条件:halfres),将重建图像用图像显示软件进一步转换,制作hdr及img文件,用imagej读取这些文件,显示图像,进行分析。得到的结果示于图4。
如图1a~f所示,在用实施例1中记载的方法制备的大鼠中,在肿瘤细胞注入后2~3周左右,确认到该细胞的胫骨表面及骨髓腔内的转移(在图1a~f中,黑白显示中用灰色表示的位置、或彩色显示中用淡蓝色表示的位置)。进而,确认到在胫骨近端或股骨远端(膝附近)的骨髓腔外,成骨性病变在广范围内形成。此外,如图4所示,确认到对于用实施例1中记载的方法制备的大鼠,通过ct分析也能够检测出成骨性病变。另外,这样的广范围的成骨性病变的形成在制备的所有大鼠(向3只大鼠各自的一条后肢中移植肿瘤细胞,结果,3条后肢为阳性(3条后肢中有3条为阳性,100%))中均可观察到,由此还可知,实施例1中记载的方法是在成骨性病变形成的效率方面也极其优异的方法。
需要说明的是,虽然图中并未显示,但是,除了在开始施予环孢素后的第3天注入大鼠前列腺癌细胞以外、使用实施例1中记载的方法对另外的3只大鼠的总计5条下肢(1只仅对右下肢进行细胞注入处理,2只对左右两条下肢进行细胞注入处理)进行处置的结果,确认到在任一只大鼠的下肢中,均与上述同样地在骨髓腔外于广范围内形成了成骨性病变。另外,对于这些注入了肿瘤细胞的大鼠,在注入后第18天(仅对右下肢进行了细胞注入处理的1只大鼠)、及第22天或第23天(对左右两条下肢进行了细胞注入处理的2只大鼠),使用在新生骨部分蓄积的放射性药品(羟基亚甲基二膦酸锝(99mtc)(technetium(99mtc)hydroxymethylenediphosphonate),产品名:clearbone(注册商标),nihonmedi-physicsco.,ltd.制)进行分析,评价蓄积有该放射性药品的成骨性病变部的面积,结果,将截面整体(胫骨及股骨)设为100%时,其病变部位的比例为1.22±0.63%(各下肢分别为0.91%、0.50%、1.67%、0.95%、2.05%)。
而另一方面,在不施予环孢素、使用了哥本哈根大鼠的比较例1中记载的方法中,在制备的所有大鼠(向4只大鼠各自的一条后肢中移植肿瘤细胞,结果,4条后肢为阳性(4条后肢中有4条为阳性,100%))的骨髓腔外均检测到了成骨性病变的形成。
然而,成骨性病变的部位极小(参见图2)。另外,将环孢素施予至2只哥本哈根大鼠、并向左右后肢中移植肿瘤细胞,结果,仅在1条后肢中(4条后肢中的1条,25%)检测到了骨髓腔外的成骨性病变的形成(比较例2)。另外,其病变部位与比较例1同样地微小。此外,在不施予环孢素、使用了裸大鼠的比较例3中记载的方法中,向单条后肢中移植了肿瘤细胞的2只大鼠中,在1只(50%)中检测到了骨髓腔外的较广范围内的成骨性病变的形成(参见图3a~c),但其病变部位与实施例1的病变部位相比为同等程度以下。
如上所述,确认到在向大鼠施予作为钙调神经磷酸酶抑制剂的1种的环孢素后、将与该大鼠为同种异系的关系的肿瘤细胞注入动脉的情况下,以100%这样的极高的概率形成了广范围的成骨性病变(实施例1)。
而另一方面,即使将为同种同系的关系的肿瘤细胞注入大鼠的动脉内,得到的成骨性病变也极小(比较例1及2);通过还施予环孢素,导致其病变形成的概率降低至25%(比较例2)。
需要说明的是,在非专利文献2中,也与本申请的比较例1和比较例2同样地,通过将at6-1的母株即r-3327注入与其为同种同系关系的哥本哈根大鼠的心脏的左心室内或尾静脉内来试着制作成骨型骨转移模型。然而,在该方法中,也没有检测到能利用闪烁造影法检测出来的程度的成骨性病变。这暗示:如果肿瘤细胞与接受其注入的大鼠为同种异系的关系、以及肿瘤细胞注入部位为血管系统的话,是不会形成成骨性病变的,或仅形成难以检测到的微小病变。
另外,已知钙调神经磷酸酶抑制剂通常被用作免疫抑制剂。然而,如比较例3所示,在免疫功能被抑制的大鼠(裸大鼠)中,即使向其动脉中注入了与该大鼠为同种异系关系的肿瘤细胞,其病变形成的概率也降低至50%,这暗示:实施例1中极高的成骨性病变形成概率并非是因免疫功能的抑制而产生的。
此外,本申请的发明人利用以下所示的方法确认了通过本发明的方法能够以100%这样的极高的概率形成成骨性病变。
(实施例2)
使用wister大鼠(2只9周龄的雄鼠)代替sd大鼠,并在开始施予环孢素后第3天,经由该大鼠的隐动脉将大鼠前列腺癌细胞(at6-1,2×105个/肢)注入两条后肢中,除此以外,利用实施例1中记载的方法,尝试了成骨型骨转移模型动物的制作。
(实施例3)
使用wister大鼠(2只9周龄的雄鼠)代替sd大鼠,并在开始施予环孢素后第3天,经由该大鼠的隐动脉将大鼠乳腺癌细胞(mrmt-1,2.5×104个/肢)注入两条后肢中,除此以外,利用实施例1中记载的方法,尝试了成骨型骨转移模型动物的制作。
需要说明的是,wister大鼠由japanslc,inc.提供。另外,mrmt-1是来自于sd大鼠的乳腺癌细胞株。因此,在实施例2及3中,肿瘤细胞与接受其注入的大鼠也为同种异系的关系。
然后,针对以上述方式制备的大鼠的下肢(移植肢),在肿瘤细胞注入后第17天通过上述ct进行分析。进而,利用上述甲苯胺蓝染色,在实施例2中,对肿瘤细胞注入后第19天的大鼠(2只)进行分析,在实施例3中,对1只肿瘤细胞注入后第19天的大鼠进行分析,并在肿瘤细胞注入后第21天对另1只大鼠进行分析。
其结果虽然未在图中示出,但通过任一种分析方法,均确认到在实施例2中以100%的概率形成了广范围的成骨性病变。
另外,在实施例3中也同样地,通过任一种分析方法均能确认到广范围的成骨性病变以100%的概率形成。更具体而言,如实施例3中的代表性染色图像(图5a~5c)所示,在肿瘤细胞注入后2~3周左右,从股骨远端及胫骨近端(膝附近)朝向下肢下方,在胫骨表面及骨髓腔内确认到了转移。此外,在股骨远端(膝附近)及胫骨近端的骨髓腔外,能够检测到广范围的成骨病变。而且,由此也可以确认,不限于前列腺癌细胞,即使注入乳腺癌细胞,通过本发明的方法也能够以极高的概率制备成骨型骨转移模型动物。
产业上的可利用性
如以上说明的那样,根据本发明,可以在非人动物中以100%这样的极高的概率形成成骨性病变。另外,形成的成骨性病变的部位遍及广范围。进而,通过驱动或控制要注入肿瘤细胞的动脉或静脉的血流,还可使得在所期望的骨中形成成骨性病变。
因此,本发明的制备方法、及利用该方法制备的成骨型骨转移模型动物在筛选对于成骨型骨转移的治疗、预防或诊断有用的化合物的方面是有用的。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于制备塑料桶的组合物的制作方法与工艺
- 功能生物材料在制备促进动物脊髓全横断损伤修复的材料中的应用的制作方法与工艺
- IGF2BP3和AFP联合标志物在制备肝癌诊疗评估试剂盒中的应用及试剂盒的制作方法与工艺
- 不同节理粗糙度隐节理岩体模型试样制备方法及制备模具与流程
- 一种中药组合物在制备预防和/或治疗肿瘤药物中的应用的制作方法与工艺
- 一种六小时高效保湿组合物及其制备和应用的制作方法与工艺
- 一种缓释复合型动物消毒剂的制备方法与流程
- 一种组合物以及用该组合物制备的环保标本保存液的制作方法与工艺
- 密封剂组合物、通过使其硬化制备的太阳能电池组件密封剂和使用其生产太阳能电池组件的方法与流程
- 4’‑GL高纯度组合物的制备方法与流程