功能生物材料在制备促进动物脊髓全横断损伤修复的材料中的应用的制作方法
本发明涉及生物医学领域中功能生物材料在制备促进动物脊髓全横断损伤修复的材料中的应用。
背景技术:
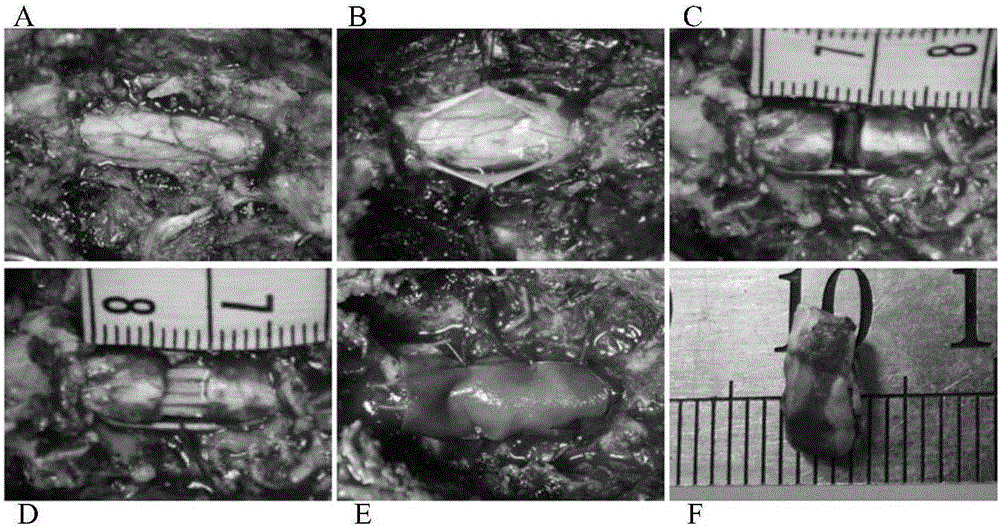
:脊髓损伤(Spinalcordinjury,SCI)是一种严重的神经系统创伤,致残性高,极具破坏力。损伤多造成截瘫,不仅严重影响患者的身心健康,而且还给家庭和社会造成巨大的经济、精神和人力负担。脊髓损伤后,通常在损伤部位形成空洞,使神经细胞失去支撑和粘附的细胞外基质。神经支架材料可以在一定程度上替代细胞外基质成份为受损的神经元轴突再生提供支撑和引导。由于脊髓神经细胞生长的特点,理想的脊髓损伤修复材料应具有细胞导向性,即能引导细胞轴突的有序性生长。技术实现要素:本发明所要解决的技术问题是如何修复全横断损伤脊髓。为解决上述技术问题,本发明首先提供了功能生物材料在制备促进动物脊髓损伤修复的材料中的应用。本发明所提供的功能生物材料在制备促进动物脊髓损伤修复的材料中的应用中,所述功能生物材料为用胶原结合脑源性神经营养因子修饰神经再生胶原支架得到的生物材料;所述胶原结合脑源性神经营养因子为下述A1)或A2)或A3)的蛋白质:A1)氨基酸序列为SEQIDNo.1的第22-162位氨基酸所示的蛋白质;A2)在SEQIDNo.1的第22-162位氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有相同功能的由A1)衍生的蛋白质;A3)在A1)或A2)的N端或/和C端连接标签得到的融合蛋白质。其中,SEQIDNo.1由162个氨基酸组成,SEQIDNo.1的第44-162位氨基酸为脑源性神经营养因子的序列,SEQIDNo.1的第22-28位氨基酸为胶原蛋白的序列,SEQIDNo.1的第5-10位氨基酸为His标签的序列。上述A2)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述A2)中的蛋白质的编码基因可通过将序列表中SEQIDNo.2的第64-486位核苷酸所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变得到。上述A3)中的蛋白质可在SEQIDNo.2的第64-486位核苷酸所示的DNA序列的5′端和/或3′端连上标签的编码序列得到。所述标签可为His标签。其中,SEQIDNo.2的第130-486位核苷酸编码SEQIDNo.1的第44-162位所示 的脑源性神经营养因子;SEQIDNo.2的第64-84位核苷酸编码SEQIDNo.1的第22-28位所示的胶原蛋白;SEQIDNo.2的第13-30位核苷酸编码SEQIDNo.1的第5-10位所示的His标签。上述应用中,所述神经再生胶原支架可按照如下方法制备:1)用磷酸三丁酯(TnBP)处理筋膜,得到TnBP处理的材料;2)用NaCl处理所述TnBP处理的材料,得到NaCl处理的材料;3)用胰蛋白酶处理所述NaCl处理的材料神经再生胶原支架。上述应用中,所述筋膜可为牛筋膜。上述应用中,所述动物可为哺乳动物。所述哺乳动物具体可为犬,如比格犬。上述应用中,所述脊髓损伤可为脊髓全横断损伤。上述应用中,所述用磷酸三丁酯处理筋膜的时间可为24-72小时;所述用NaCl处理所述TnBP处理的材料的时间可为24-72小时;所述用胰蛋白酶处理所述NaCl处理的材料的时间可为48-96小时。上述应用中,所述用磷酸三丁酯处理筋膜的时间具体可为48小时;所述用NaCl处理所述TnBP处理的材料的时间具体可为48小时;所述用胰蛋白酶处理所述NaCl处理的材料的时间具体可为72小时。上述应用中,所述用磷酸三丁酯处理筋膜可为用体积百分浓度为1-1.5%的磷酸三丁酯溶液处理筋膜;所述用NaCl处理所述TnBP处理的材料可为用NaCl溶液处理所述TnBP处理的材料;所述NaCl溶液可为向25-100mmol/L、pH为7.6-8.5的Tris-HCl缓冲液中加入NaCl得到的溶液,NaCl溶液中NaCl的浓度为0.5-1.5mol/L;所述用胰蛋白酶处理所述NaCl处理的材料可为用胰蛋白酶溶液处理所述NaCl处理的材料;所述胰蛋白酶溶液可为向25-100mmol/LTris-HCl的缓冲液(pH为7-8)中加入胰蛋白酶得到的溶液,胰蛋白酶溶液中胰蛋白酶的浓度为0.5-1.5g/100ml)。上述应用中,步骤3)得到所述神经再生胶原支架还经过浓度为0.5-1.5mol/L强碱溶液处理5-10分钟;所述磷酸三丁酯溶液的溶剂可为PBS缓冲液或Tris-HCl缓冲液;所述筋膜在处理前还要去除内层粘附的肌肉组织和外层粘附的脂肪。上述应用中,所述强碱具体可为NaOH。所述用所述强碱溶液处理的时间可为3-10分钟。所述3-10分钟具体可为5分钟。所述强碱溶液的浓度具体可为1M。上述处理的温度均可为2-8℃,优选是4℃。上述应用中,所述功能生物材料可按照如下方法制备:将所述神经再生胶原支架浸泡在含有所述胶原结合脑源性神经营养因子的溶液中得到所述功能生物材料。上述应用中,所述神经再生胶原支架与所述溶液中的所述胶原结合脑源性神经营养因子的配比可为30-150mg:400μg。所述30-150mg:400μg具体可为20mg:100μg。上述应用中,所述神经再生胶原支架的长度可为1-10毫米;所述浸泡的时间可为20-40分钟。上述应用中,所述1-10毫米具体可为5毫米;所述20-40分钟具体可为30分钟。为解决上述技术问题,本发明还提供了所述功能生物材料的制备方法。本发明所提供的所述功能生物材料的制备方法,包括用所述胶原结合脑源性神经营养因子修饰所述神经再生胶原支架得到所述功能生物材料。上述方法中,所述用所述胶原结合脑源性神经营养因子修饰所述神经再生胶原支架包括将所述神经再生胶原支架浸泡在含有所述胶原结合脑源性神经营养因子的溶液中。上述方法中,所述神经再生胶原支架与所述溶液中的所述胶原结合脑源性神经营养因子的配比可为30-150mg:400μg。所述30-150mg:400μg具体可为20mg:100μg。上述方法中,所述神经再生胶原支架的长度可为1-10毫米;所述浸泡的时间可为20-40分钟。上述方法中,所述1-10毫米具体可为5毫米;所述20-40分钟具体可为30分钟。上述方法中,所述方法还可包括利用所述神经再生胶原支架的制备方法制备所述神经再生胶原支架。为解决上述技术问题,本发明还提供了用于制备所述功能生物材料的成套试剂。本发明所提供的用于制备所述功能生物材料的成套试剂,为下述M或N:M、用于制备所述功能生物材料的成套试剂,由所述胶原结合脑源性神经营养因子和所述神经再生胶原支架组成;N、用于制备所述功能生物材料的成套试剂,由与所述胶原结合脑源性神经营养因子相关的生物材料和所述神经再生胶原支架组成;所述与所述胶原结合脑源性神经营养因子相关的生物材料,为B1)至B16)中的任一种:B1)编码所述胶原结合脑源性神经营养因子的核酸分子;B2)含有B1)所述核酸分子的表达盒;B3)含有B1)所述核酸分子的重组载体;B4)含有B2)所述表达盒的重组载体;B5)含有B1)所述核酸分子的重组微生物;B6)含有B2)所述表达盒的重组微生物;B7)含有B3)所述重组载体的重组微生物;B8)含有B4)所述重组载体的重组微生物;B9)含有B1)所述核酸分子的转基因动物细胞系;B10)含有B2)所述表达盒的转基因动物细胞系;B11)含有B3)所述重组载体的转基因动物细胞系;B12)含有B4)所述重组载体的转基因动物细胞系;B13)含有B1)所述核酸分子的转基因植物细胞系;B14)含有B2)所述表达盒的转基因植物细胞系;B15)含有B3)所述重组载体的转基因植物细胞系;B16)含有B4)所述重组载体的转基因植物细胞系。上述成套试剂中,B2)所述的含有编码所述胶原结合脑源性神经营养因子的核酸分子的表达盒,是指能够在宿主细胞中表达所述胶原结合脑源性神经营养因子的DNA,该DNA不但可包括启动所述胶原结合脑源性神经营养因子基因转录的启动子,还可包括终止所述胶原结合脑源性神经营养因子基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用现有的表达载体构建含有所述胶原结合脑源性神经营养因子基因表达盒的重组载体。上述成套试剂中,所述载体可为质粒、黏粒、噬菌体或病毒载体。上述成套试剂中,所述微生物可为酵母、细菌、藻或真菌,如大肠杆菌。所述大肠杆菌具体可为BL21(DE3)。上述成套试剂中,所述转基因植物细胞系和转基因动物细胞系均不包括繁殖材料。在本发明的一个实施方式中,胶原结合脑源性神经营养因子的编码基因(即SEQIDNo.2的第64-486位核苷酸所示的DNA分子)通过含有胶原结合脑源性神经营养因子的编码基因的表达盒的重组载体导入大肠杆菌BL21(DE3)中。所述重组载体为用SEQIDNo.2的第130-489位核苷酸所示的DNA分子替换pET28ahis-CBD载体的SalⅠ和XhoⅠ识别序列间的片段得到的重组载体T-CBD-BDNF,T-CBD-BDNF表达SEQIDNo.1所示的胶原结合脑源性神经营养因子。为解决上述技术问题,本发明还提供了下述任一用途:X1、所述功能生物材料在制备生物修复材料中的应用;X2、所述功能生物材料在制备促进动物脊髓神经丝再生的材料中的应用;X3、所述功能生物材料在制备促进动物脊髓髓鞘再生的材料中的应用;X4、所述功能生物材料在制备促进动物脊髓体觉诱发电位恢复的材料中的应用;X5、所述成套试剂在制备生物修复材料中的应用;X6、所述成套试剂在制备促进动物脊髓损伤修复的材料中的应用;X7、所述成套试剂在制备促进动物脊髓神经丝再生的材料中的应用;X8、所述成套试剂在制备促进动物脊髓髓鞘再生的材料中的应用;X9、所述成套试剂在制备促进动物脊髓体觉诱发电位恢复的材料中的应用;X10、所述方法在制备生物修复材料中的应用;X11、所述方法在制备促进动物脊髓损伤修复的材料中的应用;X12、所述方法在制备促进动物脊髓神经丝再生的材料中的应用;X13、所述方法在制备促进动物脊髓髓鞘再生的材料中的应用;X14、所述方法在制备促进动物脊髓体觉诱发电位恢复的材料中的应用。上述用途中,所述动物可为哺乳动物。所述哺乳动物可为犬,如比格犬。实验证明,本发明的功能生物材料可以促进动物脊髓全横断损伤的修复:(1)从术后4周开始,植入本发明的功能生物材料的术后功能生物材料组比格犬的Olby评分显著高于未植入任何材料的对照组比格犬的Olby评分(P<0.05);从术后26周开始,植入本发明的功能生物材料的术后功能生物材料组比格犬的Olby评分显著高于植入神经再生胶原支架的术后神经再生胶原支架组比格犬的Olby评分(P<0.05);植入本发明的功能生物材料的术后功能生物材料组比格犬中有25%的比格犬后肢能够承重并偶尔迈步行走。(2)术后0周(脊髓刚刚全横断)的比格犬的脊髓体觉诱发电位恢复率为0.20,术后38周对照组、神经再生胶原支架组和功能生物材料组的脊髓体觉诱发电位恢复率分别为0.49、0.74和0.89,植入本发明的功能生物材料的术后功能生物材料组的脊髓体觉诱发电位恢复率最高,并显著高于对照组和术后神经再生胶原支架组的脊髓体觉诱发电位恢复率(P<0.05)。实验证明,本发明的功能生物材料可以促进和引导轴突再生:对照组的损伤区域变大,而且有较大的空腔。术后功能生物材料组较术后神经再生胶原支架组展现出更好的有序结构。对照组脊髓全横断损伤中心有大量的胶原增生,NF染色几乎没有可见的神经丝。而植入本发明的功能生物材料的术后功能生物材料组虽然损伤中心也有胶原增生,但并不妨碍无瘢痕处神经丝的长入,而且再生轴突成有序排列,与材料填充方向一致。术后功能生物材料组、对照组、神经再生胶原支架组和假手术组的神经丝染色面积比率分别为19.41±4.67%、8.19±2.76%、14.35±4.61%和60.53±1.43%,植入本发明的功能生物材料的术后功能生物材料组神经丝染色面积比率显著高于对照组与术后神经再生胶原支架组,说明功能胶原支架能很好的促进和引导轴突再生。实验证明,本发明的功能生物材料可以促进髓鞘再生:对照组内可见零星的新生髓鞘,植入本发明的功能生物材料的术后功能生物材料组和术后神经再生胶原支架组中均可见大量的新生髓鞘。每1000μm2术后功能生物材料组中髓鞘数目均显著高 于对照组和术后神经再生胶原支架组(P<0.05),每1000μm2术后功能生物材料组中髓鞘数目分别为对照组和术后神经再生胶原支架组的9.14倍和2.5倍。术后功能生物材料组中髓鞘直径显著高于对照组(P<0.05),术后功能生物材料组中髓鞘直径分别为对照组和术后神经再生胶原支架组的1.31倍和1.08倍。术后功能生物材料组中髓鞘厚度均显著高于对照组和术后神经再生胶原支架组(P<0.05),术后功能生物材料组中髓鞘厚度分别为对照组和术后神经再生胶原支架组的1.41倍和1.38倍。实验证明,本发明的功能生物材料可以用来制备促进动物脊髓全横断损伤修复的材料。附图说明图1为神经再生胶原支架示意图。其中,a、b和c分别表示片状的、管状的和纤维状的神经再生胶原支架,标尺长=1cm;d为神经再生胶原支架的扫描电镜照片。图2为犬急性T12全横断损伤模型。其中,A为暴露脊髓,B为打开硬脊膜,C为切除2-3mm长度的脊髓,D为在缺损处填充神经再生胶原支架或功能生物材料;由于回缩,两个断端之间的缺损距离约为4-5mm,E为缺损部位严密缝合硬脊膜,F为被切除的脊髓。图3为各组比格犬的运动情况和Olby评分。其中,A为各组比格犬的运动情况;B为各组比格犬的Olby评分,*表示术后功能生物材料组或术后神经再生胶原支架组与对照组间有显著性差异(P<0.05);Δ表示术后功能生物材料组和术后神经再生胶原支架组间有显著性差异(P<0.05)。图4为脊髓体觉诱发电位示意图和术后38周各组比格犬的体觉诱发电位恢复结果。其中,A为脊髓体觉诱发电位示意图;B为术后38周各组比格犬的体觉诱发电位恢复结果,*表示术后功能生物材料组或术后神经再生胶原支架组与对照组间有显著性差异(P<0.05);Δ表示术后功能生物材料组和术后神经再生胶原支架组间有显著性差异(P<0.05)。图5为术后38周各组比格犬的脊髓全横断损伤处的组织形态学观察。其中,左侧各图为各组HE染色整体图片,标尺为5mm;右侧各图分别为左侧各图方框处放大图片,标尺为200μm。图6为术后38周各组比格犬的脊髓全横断损伤处胶原性瘢痕沉积和神经丝蛋白NF表达检测结果。其中A为切片观察胶原性瘢痕沉积和神经丝蛋白NF表达;B为神经丝染色面积比率,*表示术后功能生物材料组或术后神经再生胶原支架组与对照组间有显著性差异(P<0.05);Δ表示术后功能生物材料组和术后神经再生胶原支架组间有显著性差异(P<0.05)。图7为坚牢蓝染色和透射电镜观察各组比格犬的髓鞘数目、直径以及髓鞘厚度。其中,A-D为各组比格犬的髓鞘坚牢蓝染色;E-H为各组比格犬的髓鞘透射电镜照片;I为各组比格犬的髓鞘数目;J为各组比格犬的髓鞘直径;K为各组比格犬的髓鞘厚度。I-K中,*表示术后功能生物材料组和对照组间有显著性差异(P<0.05);Δ表示术后功能生物材料组和术后神经再生胶原支架组间有显著性差异(P<0.05)。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的pET28ahis-CBD载体为将pET28a(Novagen公司)的NdeI和SalI识别序列间的DNA片段替换为SEQIDNo.2的第64-123位核苷酸所示的DNA片段得到的重组载体。pET28ahis-CBD载体表达SEQIDNo.1的第1-43位氨基酸所示的蛋白质。下述实施例中的比格犬为南京安立默科技有限公司公司产品。实施例1、功能生物材料的制备本发明所提供的功能生物材料为用胶原结合脑源性神经营养因子(collagenbindingBDNF,CBD-BDNF)修饰神经再生胶原支架得到的生物材料;CBD-BDNF为氨基酸序列是序列表中SEQIDNo.1的蛋白质,其编码序列为序列表中SEQIDNo.2。其中,SEQIDNo.1的第44-162位氨基酸为脑源性神经营养因子的序列,其编码序列为SEQIDNo.2的第130-486位核苷酸;SEQIDNo.1的第22-28位氨基酸为胶原蛋白的序列,其编码序列为SEQIDNo.2的第64-84位核苷酸;SEQIDNo.1的第5-10位氨基酸为His标签的序列,其编码序列为SEQIDNo.2的第13-30位核苷酸。一、胶原结合脑源性神经营养因子(CBD-BDNF)的制备将pET28ahis-CBD载体的SalⅠ和XhoⅠ识别序列间的序列替换为序列表中SEQIDNo.2的第130-489位核苷酸所示的DNA片段,得到重组载体,将该重组载体命名为T-CBD-BDNF。T-CBD-BDNF和pET28ahis-CBD载体的区别仅在于:T-CBD-BDNF为将pET28ahis-CBD载体的SalⅠ和XhoⅠ识别序列间的序列替换为序列表中SEQIDNo.2的第130-489位核苷酸所示的DNA片段得到的重组载体。T-CBD-BDNF表达SEQIDNo.1所示的CBD-BDNF。将T-CBD-BDNF导入大肠杆菌BL21(DE3)(Novagen产品,货号为VDN0199)中,得到重组菌,将该重组菌命名为BL21-T-CBD-BDNF,BL21-T-CBD-BDNF能表达SEQID No.1所示的CBD-BDNF。将BL21-T-CBD-BDNF接种至LB培养基中进行培养,得到BL21-T-CBD-BDNF培养液;按2%的接种量将BL21-T-CBD-BDNF培养液转接至LB培养基中扩大培养后加入IPTG,得到诱导前液,诱导前液中IPTG的浓度为1mM;将诱导前液在37℃下培养5小时,得到BL21-T-CBD-BDNF诱导液。将BL21-T-CBD-BDNF诱导液在8000rpm、4℃下进行离心,弃上清液,得到BL21-T-CBD-BDNF菌体。将BL21-T-CBD-BDNF菌体进行超声并进行离心,得到含有CBD-BDNF的上清液,超声条件为120w,超声5秒,间隔10秒,共超声20min。将CBD-BDNF的上清液进行镍柱亲和层析纯化目的蛋白CBD-BDNF,最后将目的蛋白CBD-BDNF收集在PBS中,得到CBD-BDNF溶液,CBD-BDNF溶液中CBD-BDNF的浓度为1mg/ml,-80℃下保存。聚丙烯酰胺凝胶电泳检测CBD-BDNF溶液中的目的蛋白CBD-BDNF,结果显示,CBD-BDNF溶液中含有预期蛋白大小相符的目的蛋白CBD-BDNF。二、神经再生胶原支架的制备1、预处理筋膜取新鲜带有白色筋膜的成年牛肌肉,用冷的去离子水冲洗3遍;用镊子和手术刀分离出筋膜,尽量去除内层粘附的肌肉组织和外层的脂肪等组织,得到预处理筋膜。2、材料制备将预处理筋膜在4℃下按如下步骤处理:1)将步骤1得到的预处理筋膜在TnBP(磷酸三丁酯)溶液(TnBP溶液为向50mMTris-HCl缓冲液(pH=8.0)中加入TnBP得到的溶液,TnBP溶液中TnBP的体积百分比浓度为1%)中孵育48小时,得到TnBP处理的材料;2)将步骤1)得到的TnBP处理的材料在NaCl溶液(NaCl溶液为向50mMTris-HCl缓冲液(pH=8.0)中加入NaCl得到的溶液,NaCl溶液中NaCl的浓度为1M)中孵育48小时,得到NaCl处理的材料;3)将步骤2)得到的NaCl处理的材料在胰蛋白酶溶液(胰蛋白酶溶液为向50mMTris-HCl缓冲液(pH=8.0)中加入胰蛋白酶得到的溶液,胰蛋白酶溶液中胰蛋白酶的浓度为1g/100ml)中孵育72小时,得到胰蛋白酶处理的材料;4)将步骤3)得到的胰蛋白酶处理的材料在1MNaOH水溶液中处理5分钟,充分清洗直至中性,冻干,得到神经再生胶原支架(Linearorderedcollagenscaffolds,LOCS)。上述步骤4)制备的神经再生胶原支架LOCS为白色片状形态,还可以将其制备为有序的管状或者胶原纤维。LOCS的形态图如图1所示,图1中a、图1中b和图1中 c分别表示片状的、管状的及纤维状的LOCS,标尺长=1cm;图1中d为LOCS的扫描电镜照片。由图1表明,LOCS保持了天然胶原纤维的结构,其电镜照片显示了它具有有序的表面结构,其粗糙的表面结构也利于细胞的贴附。三、功能生物材料的制备选取步骤二得到的长度为5mm的神经再生胶原支架,将其浸泡在步骤一得到的CBD-BDNF溶液中,神经再生胶原支架与CBD-BDNF溶液中CBD-BDNF的质量比为20mg:100μg,室温孵育30分钟,使CBD-BDNF溶液中的CBD-BDNF被神经再生胶原支架吸收,得到功能生物材料。实施例2、功能生物材料对脊髓全横断损伤的修复2.1功能生物材料修复脊髓全横断损伤手术选用24只1周岁雌性比格犬,体重7-9kg。犬脊髓全横断损伤模型的制备方法如下:将比格犬麻醉后,打开T11-T13椎板暴露脊髓组织,将T12段比格犬的脊髓切除2-3mm(由于脊髓回缩,两断端之间的长度约为5mm),得到犬急性T12全横断损伤模型(图2)。将进行脊髓全横断损伤手术的当周记为术后1周。将24只比格犬得到的犬急性T12全横断损伤模型随机分为三组,每组8只,一组为对照组,另一组为神经再生胶原支架组,第三组为功能生物材料组。通过填充的方式将实施例1的功能生物材料桥接在功能生物材料组每只比格犬脊髓全横断损伤的近端和远端,然后将胶原膜严密缝合在硬脊膜上,最后将该组比格犬在护理条件下喂养38周,得到术后功能生物材料组比格犬。通过填充的方式将实施例1的神经再生胶原支架桥接在神经再生胶原支架组每只比格犬脊髓全横断损伤的近端和远端,然后将胶原膜严密缝合在硬脊膜上,然后将该组比格犬在相同条件下护理38周,得到术后神经再生胶原支架组比格犬。直接将对照组比格犬在相同条件下喂养38周,得到术后对照组比格犬。另取8只比格犬,将每只比格犬麻醉后,打开T11-T13椎板暴露脊髓组织,随后缝合打开椎板过程中造成的伤口,最后在相同条件下护理38周,得到术后假手术组比格犬。2.2功能生物材料对脊髓全横断损伤的修复鉴定对步骤2.1得到的术后功能生物材料组比格犬、术后神经再生胶原支架组比格犬、术后假手术组比格犬和术后对照组比格犬进行行为学观察、电生理检测、形态学染色和免疫组织化学染色,鉴定功能生物材料对脊髓全横断损伤的修复效果。2.2.1行为学观察使用Olby评分评估步骤2.1的术后4、8、12、20、26、32和38周的各组比格犬后肢运动功能的恢复情况(图3和表1)。在评估过程中,比格犬在一个开放的环境中自由移动,由两名观察者评分。观察者熟悉评分细则但不知各比格犬的手术情况。Olby评分标准如下:0为无任何后肢运动或深度疼痛(用止血钳夹一下比格犬后肢的脚趾,如果比格犬后肢脚趾回缩,说明有深度疼痛);1为无任何后肢运动,有深度疼痛;2为无任何后肢运动,但尾部自发运动;3为后肢不能承重,仅有一个关节(髋关节)运动;4为后肢不能承重,多于一个关节运动,运动时间小于50%;5为后肢不能承重,多于一个关节运动,运动时间大于50%;6为后肢能承重,但承重时间小于10%;7为后肢能承重,但承重时间在10-50%之间;8为后肢能承重,承重时间大于50%;9为后肢100%承重,但肌力没有完全恢复,步态错误时间大于90%;10为后肢100%承重,但肌力没有完全恢复,步态错时间在50-90%之间;11为后肢100%承重,但肌力没有完全恢复,步态错误时间小于50%;12为肌力正常,但后肢步态混乱,错误时间大于50%;13为肌力正常,但后肢步态混乱,错误时间小于50%;14为正常步态。表1、各组比格犬的Olby评分术后功能生物材料组术后神经再生胶原支架组对照组术后4周2.75±0.522.33±0.6011.58±0.58术后8周3.5±0.773.42±1.361.83±0.82术后12周4.50±0.553.92±1.393.25±1.08术后20周5.00±0.714.17±1.293.50±1.26术后26周5.58±1.203.92±1.243.67±1.21术后32周6.08±1.594.17±1.443.75±1.41术后38周6.00±1.584.25±1.333.83±1.29结果显示,从术后4周(除术后12周)开始,术后功能生物材料组比格犬与对照组比格犬的Olby评分均具有显著性差异(图3中B,P<0.05);从术后26周开始,术后功能生物材料组比格犬与术后神经再生胶原支架组比格犬的Olby评分均具有显著性差异(图3中B,P<0.05)。并且,术后功能生物材料组比格犬中有25%的比格犬后肢能够承重并偶尔迈步行走(图3中A)。2.2.2电生理检测对步骤2.1的术后38周的各组比格犬进行脊髓体觉诱发电位(Spinal SomatosensoryEvokedResponses,SSERs)的检测。所用的仪器是成都仪器厂生产的RM6240USB2.0Z型生物信号采集处理系统。具体检测方法如下:将比格犬麻醉,打开椎板后暴露出脊髓,用塑料手套垫在脊髓下,使神经与周围的组织隔开以减少干扰。调整好仪器的各种参数,将刺激电极在犬的坐骨神经处施加电刺激,接收电极在脊髓横断部位的靠头端和靠尾端接受电刺激。如果脊髓横断部位的神经传导恢复的越好,电刺激就能越多的传导到横断部位的靠头端,靠头端的接收电极接受到的电位与靠尾端的接收电极接收的电位之比越接近于1。结果(图4)显示,术后0周(脊髓刚刚全横断)的比格犬的脊髓体觉诱发电位恢复率为0.20,术后38周对照组、神经再生胶原支架组和功能生物材料组的脊髓体觉诱发电位恢复率分别为0.49、0.74和0.89,表明,术后38周对照组、神经再生胶原支架组和功能生物材料组的脊髓体觉诱发电位均有恢复,其中,术后功能生物材料组的脊髓体觉诱发电位恢复率最高,并显著高于对照组和术后神经再生胶原支架组的脊髓体觉诱发电位恢复率(P<0.05)。2.2.3组织形态学观察对步骤2.1的术后38周的各组比格犬的脊髓全横断损伤处的组织进行组织形态学观察,结果如图5所示。具体方法如下:术后38周,将比格犬甲醛灌注处死,迅速将手术部位再生组织取出,得到各组比格犬的脊髓全横断损伤处的脊髓;将各组比格犬的脊髓全横断损伤处的脊髓于4%多聚甲醛中固定48小时。石蜡包埋,切片,厚度5μm,使用Poly-D-lysine处理过的玻片粘片,烘干,得到各组比格犬的脊髓全横断损伤处的组织切片。将切片进行HE染色观察损伤部位大体组织学形态。HE染色的具体步骤如下:依次二甲苯I,10分钟;二甲苯II,10分钟;二甲苯/乙醇(1:1),5分钟;100%乙醇,5分钟;95%乙醇,5分钟;80%乙醇,5分钟;70%乙醇,5分钟;50%乙醇,5分钟;蒸馏水浸泡3次,每次5分钟;苏木素染色10分钟;自来水冲洗15分钟;蒸馏水浸泡2次,每次5分钟;酸性水分化,约3秒,变红即可;蒸馏水浸泡2次,每次5分钟;碱性水分化,重新变蓝即可;蒸馏水浸泡2次,每次5分钟。50%乙醇,5分钟;70%乙醇,5分钟;80%乙醇,5分钟;95%乙醇,5分钟;95%乙醇,5分钟;100%乙醇,5分钟;100%乙醇,5分钟;乙醇/二甲苯1:1,5分钟;二甲苯I,10分钟;二甲苯II,5分钟;中性树胶封片,显微镜观察,照相。HE染色结果(图5)显示,对照组的损伤区域变大,而且有较大的空腔。术后功能生物材料组较术后神经再生胶原支架组展现出更好的有序结构。图5中,左侧各图为各组HE染色整体图片,标尺为5mm;右侧各图分别为左侧各图方框处放大图片, 标尺为200μm。2.2.4利用胶原性瘢痕沉积染色和免疫组织化学染色检测神经丝蛋白NF表达对步骤2.1的术后38周的各组比格犬的脊髓全横断损伤处的组织进行胶原性瘢痕沉积染色和免疫组织化学染色,分别鉴定胶原性瘢痕组织的沉积和神经丝再生情况,结果如图6所示。胶原性瘢痕沉积染色(Masson染色,也叫马松染色)具体步骤如下:将步骤2.2.3的各组比格犬的脊髓全横断损伤处的组织切片脱蜡至水;苏木素染色10分钟;酸性水分化5秒;流水蓝化,蒸馏水洗;丽春红酸性品红液中染色5分钟,蒸馏水洗;1%磷钼酸中染3分钟;直接放入苯胺蓝染色5min;蒸馏水速洗,置于60℃温箱中烘干,二甲苯透明,封片。检测神经丝(NF)再生的免疫组织化学染色的具体步骤如下:将步骤2.2.3的各组比格犬的脊髓全横断损伤处的组织切片依次二甲苯I,10分钟;二甲苯II,10分钟;二甲苯/乙醇(1:1),5分钟;100%乙醇,5分钟;95%乙醇,5分钟;80%乙醇,5分钟;70%乙醇,5分钟;50%乙醇,5分钟;蒸馏水,5分钟。PBS浸泡3次,每次5分钟。柠檬酸抗原修复液热修复;PBS浸泡3次,每次5分钟。3%H2O2去离子水处理10分钟,使内源过氧化物酶失活。PBS漂洗3次,每次5分钟。加入羊血清封闭液,室温孵育10-15分钟,弃去,勿洗;滴加适当比例小鼠来源的单抗anti-Neurofilement(Abcam产品,货号为ab3966),4℃孵育过夜后,PBS漂洗3次,每次5分钟。加入生物素标记山羊抗小鼠IgG,室温孵育10-15分钟,PBS漂洗3次,每次5分钟。滴加辣根酶标记链霉卵白素(北京中杉金桥生物技术有限公司产品,货号为SP-9002)工作液,室温孵育10-15分钟,PBS漂洗3次,每次5分钟。样品滴加适量新鲜配置的DAB溶液,室温反应10分钟,弃掉反应液,自来水终止。中性树胶封片,显微镜观察,照相。结果显示,对照组损伤中心有大量的胶原增生,NF染色几乎没有可见的神经丝。而术后神经再生胶原支架组和术后功能生物材料组虽然损伤中心也有胶原增生,但并不妨碍无瘢痕处神经丝的长入,而且再生轴突成有序排列,与材料填充方向一致(图6中A)。术后功能生物材料组、对照组、神经再生胶原支架组和假手术组的神经丝染色面积比率(图6中B)分别为19.41±4.67%;、8.19±2.76%、14.35±4.61%和60.53±1.43%,术后功能生物材料组神经丝染色面积比率显著高于对照组与术后神经再生胶原支架组,说明功能胶原支架能很好的促进和引导轴突再生。2.2.5髓鞘数目、直径及髓鞘厚度对步骤2.1的术后38周的各组比格犬的脊髓全横断损伤处的组织进行坚牢蓝(LFB)染色,并用透射电镜(TEM)观察各组脊髓全横断损伤部位髓鞘再生情况, 结果如图7所示。坚牢蓝染色具体步骤如下:将步骤2.2.3的各组比格犬的脊髓全横断损伤处的组织切片脱水至95%的酒精,坚牢蓝染液37℃过夜。95%酒精冲洗干净,蒸馏水流水漂洗;没入0.05%碳酸锂溶液(每次新鲜配制)5秒;70%的酒精分化2次,每次10秒;蒸馏水漂洗。显微镜下观察,重复3-4次碳酸锂至蒸馏水漂洗步骤,直至白质和灰质对比鲜明。70%酒精分化;0.5%伊红浸一下,乙醇性伊红染色1分钟;蒸馏水漂洗,结晶紫染色1分钟;蒸馏水漂洗;95%酒精脱水1次,5分钟;100%酒精脱水2次,每次1分钟,二甲苯透明,中性树脂封片。显微镜观察照相(图7中A、B、C和D),利用Image-ProPlus软件(MediaCybernetics)统计髓鞘数目、直径以及髓鞘厚度(表2和图7中I、J和K)。表2、各组比格犬的髓鞘数目、直径以及髓鞘厚度髓鞘数目(个/1000μm2)髓鞘直径(μm)髓鞘厚度(μm)术后功能生物材料组22.85±8.113.72±0.830.55±0.14术后神经再生胶原支架组8.89±3.433.43±0.810.40±0.06对照组2.50±1.272.83±0.690.39±0.07假手术组88.73±12.243.91±1.301.02±0.30坚牢蓝(LFB)染色结果(图7中A、B、C和D)显示,对照组内可见零星的新生髓鞘,而术后神经再生胶原支架组和术后功能生物材料组中均可见大量的新生髓鞘。图7中I、J和K显示,每1000μm2术后功能生物材料组中髓鞘数目均显著高于对照组和术后神经再生胶原支架组(P<0.05),每1000μm2术后功能生物材料组中髓鞘数目分别为对照组和术后神经再生胶原支架组的9.14倍和2.57倍。术后功能生物材料组中髓鞘直径显著高于对照组(P<0.05),术后功能生物材料组中髓鞘直径分别为对照组和术后神经再生胶原支架组的1.31倍和1.08倍。术后功能生物材料组中髓鞘厚度均显著高于对照组和术后神经再生胶原支架组(P<0.05),术后功能生物材料组中髓鞘厚度分别为对照组和术后神经再生胶原支架组的1.41倍和1.38倍。髓鞘透射电镜样品制备具体步骤如下:在步骤2.2.3的各组比格犬的脊髓全横断损伤处的脊髓中点用锋利的刀片取1mm3的组织块,置于2.5%戊二醛溶液中固定2小时。用0.1M磷酸漂洗液漂洗15分钟,重复3次;1%锇酸固定液固定2小时;用0.1M磷酸漂洗液漂洗15分钟,重复3次。然后对组织经行脱水处理:50%乙醇, 15-20分钟;70%乙醇,15-20分钟;90%乙醇,15-20分钟;90%乙醇+90%丙酮(1:1),15-20分钟;90%丙酮,15-20分钟;100%丙酮室温15-20分钟,重复3次。组织包埋:纯丙酮+包埋液(2:1)室温4小时;纯丙酮+包埋液(1:2)室温过夜;纯包埋液,37℃3小时;固化:37℃烘箱内过夜;45℃烘箱12小时;60℃烘箱内24小时。用超薄切片机切片(50-60nm)。3%醋酸铀-枸橼酸铅双染色。透射电镜观察,拍照(图7中E、F、G和H)。透射电镜(TEM)结果(图7中E、F、G和H)显示,术后功能生物材料组的髓鞘数目、直径以及髓鞘厚度相对于术后神经再生胶原支架组和对照组均有提高。上述实验结果表明,本发明的功能生物材料可以促进髓鞘的再生,而且再生的神经呈现有序状态。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种用于制备塑料桶的组合物的制作方法与工艺
- 功能生物材料在制备促进动物脊髓全横断损伤修复的材料中的应用的制作方法与工艺
- IGF2BP3和AFP联合标志物在制备肝癌诊疗评估试剂盒中的应用及试剂盒的制作方法与工艺
- 不同节理粗糙度隐节理岩体模型试样制备方法及制备模具与流程
- 一种中药组合物在制备预防和/或治疗肿瘤药物中的应用的制作方法与工艺
- 一种六小时高效保湿组合物及其制备和应用的制作方法与工艺
- 一种缓释复合型动物消毒剂的制备方法与流程
- 一种组合物以及用该组合物制备的环保标本保存液的制作方法与工艺
- 密封剂组合物、通过使其硬化制备的太阳能电池组件密封剂和使用其生产太阳能电池组件的方法与流程
- 4’‑GL高纯度组合物的制备方法与流程