一种适配体修饰的携氧载药多功能脂质体复合物的制作方法
本发明属于医药技术领域,具体涉及一种可逆转肿瘤耐药的适配体修饰的携氧载药多功能脂质体复合物。
背景技术:
癌症是严重危害人类健康的重大疾病之一,近年来发病率呈显著上升趋势。肺癌是所有癌症中存活率最低的癌症之一。肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。非小细胞肺癌是肺癌中的常见类型,大约占所有确诊肺癌患者中的80~85%。厄洛替尼(erlotinib)是一类选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI),是特异性较高的抗肿瘤靶向治疗药物。尽管厄洛替尼在NSCLC的治疗中取得了一定的疗效,但肿瘤细胞对其产生耐药性阻碍了其在临床上的有效应用。
研究表明,肺癌细胞对分子靶向药物产生耐药性的原因有很多。缺氧是致使肺癌细胞对厄洛替尼的敏感性降低的原因之一。缺氧是非小细胞肺癌的主要微环境特征之一,在肿瘤的发生、发展中起重要作用。局部微环境的缺氧可促进肿瘤细胞的增殖、浸润和转移、凋亡等恶性生物学行为的发生。因此,如何逆转缺氧诱导的肿瘤耐药性已成为当今医学界研究的热点。
目前,临床上已有应用的携氧体分为两类:全氟碳化物(PFCs)和血红蛋白携氧载体(HBOC)。PFCs相对HBOC携氧能力更强,具有的化学氧超过患者自身红细胞的供氧能力。而且,PFC颗粒微小,可经毛细血管渗入到红细胞不能达到的肿瘤缺氧区,使肿瘤组织的P(O2)显著提高。因此,利用PFCs供氧可提高化疗的疗效,明显延缓肿瘤的生长速度。PFCs种类很多,相比较而言,全氟溴辛烷(PFOB)具有载氧量高、易降解、已用于临床试验等优势。因此,PFOB是理想的、可靠的、安全的携氧载体。
由于PFOB和厄洛替尼均不溶于水,需要选择能够装载难溶性药物的纳米材料作为载体。脂质体是由卵磷脂、胆固醇按一定比例制备而成的,具有与生物体细胞相类似的磷脂双分子层结构,因此具有很好的生物相容性。但脂质体在体内酶以及化学环境下,容易降解而破坏。目前,已有很多学者利用聚乙二醇(PEG)修饰脂质体,以提高脂质体的稳定性。然而,PEG化容易阻碍细胞摄取,降低了药物输送效率。壳聚糖(chitosan,简写Cs)是由自然界广泛存在的几丁质经过脱乙酰作用得到的疏水性聚合物,其生物相容性好,在生物体内可降解,并且已用于临床。因此,利用壳聚糖来修饰脂质体,可以有效的提高脂质体的稳定性。
近年来,靶向纳米药物在肿瘤治疗方面具有广阔的应用前景。纳米药物的主动靶向是通过偶联一定的配体,如核酸适配体、抗体、多肽等,以提高药物在肿瘤中的浓度。核酸适配体是一小段经体外筛选得到的寡核苷酸序列,与传统抗体相比,它具有体积小、稳定、生物相容性高、能与相应的配体进行高亲和力和强特异性的结合等优势。EGFR在NSCLC中高表达,并且与肿瘤细胞的增殖、侵袭、损伤修复、血管生成密切相关。因此,EGFR可作为肺癌治疗的靶蛋白,将纳米材料用识别EGFR的适配体修饰可特异性靶向EGFR高表达的肺癌细胞。
基于以上背景,本发明构建了一种由壳聚糖修饰的脂质体以及固定在脂质体中具有特异性EGFR识别能力的核酸适配体组成的,并包载有分子靶向药物厄洛替尼和携氧体PFOB的携氧载药多功能脂质体复合物,其能特异性地靶向肺癌细胞,并能释放氧气调节肿瘤缺氧微环境,以协同改善分子靶向药物厄洛替尼的耐药性,有效抑制肿瘤的生长,达到治疗肺癌的效果。
技术实现要素:
本发明目的在于提供一种适配体修饰的携氧载药多功能脂质体复合物,该复合物具有靶向能力,可包载对肿瘤细胞有杀伤作用的抗癌药物,并同时通过携带的携氧体负载氧气以改善肿瘤缺氧的微环境,从而逆转肿瘤细胞缺氧所诱导产生的耐药性。
为实现上述目的,本发明采用如下技术方案:
一种适配体修饰的携氧载药多功能脂质体复合物,其由抗癌药物、携氧体和纳米载体构成,具有一体化靶向输送药物和供氧功能,能够逆转肿瘤细胞耐药性;
所述纳米载体是由卵磷脂、胆固醇、壳聚糖、靶向EGFR的核酸适配体制成。
所述脂质体复合物的粒径均一,尺寸为80~250 nm。
纳米载体中所用卵磷脂与胆固醇的质量比为1:1~5:1;壳聚糖用量占所得纳米载体重量的15%~50%。
脂质体复合物中抗癌药物量为纳米载体重量的1%~10%;所述抗癌药物包括分子靶向药物厄洛替尼。
所述携氧体为全氟溴辛烷。
所述多功能脂质体复合物的制备方法包括以下步骤:
1)将壳聚糖溶于0.1%(v/v)的冰醋酸中,并加水稀释成1%(m/v)的壳聚糖溶液;然后在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)/N-羟基琥珀酰亚胺(NHS)的作用下,将其与靶向EGFR的核酸适配体共价偶联,超滤后得到适配体修饰的壳聚糖悬浮液;其中,核酸适配体的连接量为10~150 pmol/mg;
2)将卵磷脂、胆固醇、抗癌药物和携氧体溶于有机溶剂中,减压旋蒸,形成脂质膜;
3)用步骤1)所得壳聚糖悬浮液水化脂质膜,冰浴超声10 min,过0.45 μm滤膜,即得所述多功能脂质体复合物(ACLEP)的悬浮液;其氧气含量为50~400 mg/mL。
所述多功能脂质体复合物可用于制备肺癌治疗药物。
本发明适配体修饰的携氧载药复合物包括由卵磷脂和胆固醇制备的脂质体,固定在脂质体中、经靶向表皮生长因子受体(EGFR)的核酸适配体修饰的壳聚糖衍生物(Apt-Cs),以及包载在脂质体中的分子靶向药物和携氧体构成;可利用水化薄膜法在水溶液中自组装而成,制备方法简单。
本发明的显著效果在于:
(1)本发明中利用壳聚糖稳定脂质体,解决了脂质体稳定性差的问题,因此可延长药物在体内的循环时间,从而提高药物的生物利用度。
(2)本发明中的纳米载体表面连接有适配体,解决了非靶向纳米药物特异性差的问题;同时,利用适配体的靶向功能,可与抗癌药物协同增效,提高药物的抗肿瘤效果。
(3)本发明脂质体复合物中还包载有携氧体,能够实现药物和氧气的共输送,有利于改善肿瘤缺氧微环境,可达到逆转肿瘤细胞耐药性的效果。
附图说明
图1为实施例1所合成ACLEP的粒径分布(A)和AFM图(B)。
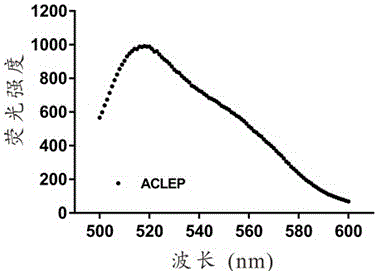
图2为实施例1所合成ACLEP的荧光光谱图。
图3为在常氧和缺氧条件下,实施例2所得ACLE和实施例2所得ACLEP中厄洛替尼的累积释放曲线对比图。
图4为在常氧和缺氧条件下,不同肺癌细胞对ACLE和ACLEP的摄取情况试验图。
图5为在常氧和缺氧条件下,不同脂质体复合物对A549、PC-9和H1975细胞增殖抑制作用的情况图。
图6为模型小鼠在给予不同脂质体复合物后的体重变化曲线(A)和瘤体积变化曲线(B)。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1
将4mg EDC和8mg NHS溶于200μL的二次水中,再向其中加入100μL羧基修饰的靶向EGFR的适配体(10μM,其具体序列参见文献Tan Y, Shi Y-s, Wu X-d, Liang H-y, Gao Y-b, Li S-j, et al. DNA aptamers that target human glioblastoma multiforme cells overexpressing epidermal growth factor receptor variant III in vitro. Acta Pharmacologica Sinica. 2013;34(12):1491-8.),室温避光搅拌3h;然后再向其中加入200μL 1%(v/v)的壳聚糖溶液,搅拌8h,超滤(MW=10000)三次,每次15min,弃滤液,用PBS稀释制成适配体修饰的壳聚糖(Apt-Cs)悬浮液。
称取20mg卵磷脂、5mg胆固醇、1.58mg厄洛替尼和200μL PFOB于梨形烧瓶,加入二氯甲烷进行溶解,减压旋蒸,形成脂质膜;用上述所得Apt-Cs悬浮液水化脂质膜,冰浴超声10min,得到装载有厄洛替尼和全氟溴辛烷的适配体修饰的携氧载药脂质体复合物(ACLEP)的悬浮液。
利用粒度测定仪测定合成的ACLEP的粒径分布,并利用原子力电子显微镜(AFM)观测ACLEP的形貌,结果如图1所示。
由图1(A)可见,所得ACLEP粒径均一,平均粒径约为200nm;由图1(B)可见,所得ACLEP呈球形,表面光滑。
实施例2
称取20mg卵磷脂、5mg胆固醇和1.58mg厄洛替尼于梨形烧瓶,加入二氯甲烷进行溶解,减压旋蒸,形成脂质膜,用实施例1中制备的Apt-Cs悬浮液水化脂质膜,冰浴超声10min,得到仅装载厄洛替尼的适配体修饰的载药脂质体复合物(ACLE)的悬浮液。利用粒度测定仪测定合成的ACLE的粒径约为200 nm。
实施例3
称取20mg卵磷脂、5mg胆固醇和200μL PFOB于梨形烧瓶,加入二氯甲烷进行溶解,减压旋蒸,形成脂质膜,用实施例1中制备的Apt-Cs悬浮液水化脂质膜,冰浴超声10min,得到仅装载全氟溴辛烷的适配体修饰的携氧脂质体复合物(ACLP)悬浮液。利用粒度测定仪测定合成的ACLP的粒径约为200 nm。
实施例4
称取20mg卵磷脂和5mg胆固醇于梨形烧瓶,加入二氯甲烷进行溶解,减压旋蒸,形成脂质膜,用实施例1中制备的Apt-Cs悬浮液水化脂质膜,冰浴超声10min,得到适配体修饰的空脂质体复合纳米载体(ACL)的悬浮液。利用粒度测定仪测定合成的ACL的粒径约为150 nm。
实施例5
利用适配体在520nm处有最大荧光强度的特点,通过荧光光谱仪绘制系列浓度适配体的标准曲线,并根据所得标准曲线确定实施例1中制备得到的ACLEP的连接量。
图2为实施例1所得ACLEP的荧光光谱图。经计算,所得ACLEP中适配体的连接量为0.150±0.42 nmol/mg。
实施例6
依据氧化还原反应:(1) Na2SO3+O2=Na2SO4;(2) KMnO4+Na2SO3+H2O=3Na2SO4 +2KOH+ 2MnO2,取少量实施例1中制备得到的ACLEP悬浮液与Na2SO3溶液充分反应,将未反应的Na2SO3溶液进一步用KMnO4溶液氧化,根据KMnO4溶液的用量确定ACLEP中的氧气含量。
经计算,所得ACLEP中含氧量为0.406±0.14 g/mL。
实施例7
在常氧(20%O2)和缺氧(5%O2)条件下,分别取1mL实施例2中制备得到的ACLE悬浮液和1mL实施例1中制备得到的ACLEP悬浮液于透析袋中(MW=3KDa),置于100mL的PBS缓冲溶液中,分别于37℃搅拌0.5h、1h、2h、4h、6h、8h、10h、12h、24h、36h、48h、72h进行取样,并同时补加相同体积的缓冲液,245nm处测各个样品的紫外吸光度,得到ACLE和ACLEP在常氧和缺氧条件下的药物释放率,结果如图3所示。
由图3可见,在常氧条件下,ACLE和ACLEP中厄洛替尼的释放量相当;然而在缺氧条件下,ACLEP中厄洛替尼的释放量明显高于ACLE,因此说明氧气的输送有助于药物在缺氧环境中的释放。
从分子水平看,非小细胞肺癌存在着不同的分子分型,A549细胞是EGFR野生型、K-Ras突变的原发性耐药株,H1975细胞则是EGFR的L858R、T790M突变所致的获得性耐药细胞株,PC-9细胞为表达EGFR外显子19位缺失的单突变对厄洛替尼敏感的细胞株。因此,在肺癌细胞的研究中,选取A549、H1975、PC-9这三株细胞作为研究对象。
实施例8
分别在常氧(20%O2)和缺氧(5%O2)条件下培养A549、PC-9、H1975细胞,每株细胞均设2组实验组和1组对照组。待细胞密度达到80%左右,弃去旧培养基,补充不完全培养基, 2组实验组分别加入10μL实施例2中制备得到的ACLE和实施例1中制备得到的ACLEP,避光,37℃孵育3h,然后弃去旧培养基,消化细胞,1500rpm离心5min,用washing buffer洗两遍,最终悬浮于400μL的PBS中,流式检测,分析各细胞株对ACLE和ACLEP的摄取能力;与此同时,为了考察该适配体(Apt)对肺癌细胞的特异性识别,另取培养的肺癌细胞预先与适配体孵育1h,使其竞争性结合肺癌细胞表面的EGFR蛋白,washing buffer洗去未结合的适配体,然后再加入实施案例2中制备得到的ACLE孵育3h,流式检测,结果如图4所示。
由图4可见,(1)当Apt竞争性结合EGFR后,肺癌细胞摄取的ACLE明显降低;(2)在不同氧分压的条件下,各肺癌细胞对ACLE和ACLEP的摄取均存在差异,相比较而言,摄取能力H1975>PC-9>A549;(3)与常氧条件相比,缺氧条件下各肺癌细胞对ACLE的摄取量相对较少;(4)在缺氧条件下,各肺癌细胞对ACLEP的摄取明显多于ACLE。上述结果(1)(2)表明,该适配体可特异性识别肺癌细胞表面的EGFR,且对H1975细胞的特异性最高;结果(3)(4)表明,在缺氧条件下,氧气的不足会抑制肺癌细胞对ACLE的摄取,携载PFOB有助于细胞对纳米粒子ACLEP的摄取,从而可增加细胞内的厄洛替尼的浓度,克服耐药性。
实施例9
用胰蛋白酶消化对数生长期的A549、PC-9、H1975细胞,用培养基稀释成浓度为1×105个/mL的细胞悬浮液。分别在常氧(20%O2)和缺氧(5%O2)条件下,按每孔100μL细胞悬浮液的量接种到96孔板中,周围用PBS封孔,置于培养箱中孵育24h后,按浓度梯度分别加入实施例4中制备得到的ACL、实施例2中制备得到的ACLE、实施例3中制备得到的ACLP及实施例1中制备得到的ACLEP,每个浓度设五个复孔;同时设置Control组,即加入不含药物的新鲜完全培养基。药物作用72h后,弃上清液,每孔加入100μL MTT溶液(5mg/mL),继续培养4h后终止培养,小心吸去孔内培养液。每孔加入100μL DMSO,置摇床上低速振荡10min,使结晶物充分溶解。用酶联免疫检测仪检测490nm处各孔的吸光值,并依据以下公式计算存活率,结果如图5所示:
存活率=(A样品-A空白)/(AControl-A空白)×100%。
由图5可知,(1)空载体ACL在一定的浓度范围内对肺癌细胞几乎没有毒性,说明本发明所使用的纳米载体是安全可靠的;(2)在两种氧气浓度条件下,ACLP对细胞的毒性差异不大,而在缺氧条件下,ACLE作用的各肺癌细胞的存活率明显高于常氧条件下的细胞存活率,说明缺氧降低了ACLE的作用效果,原因可能是由于缺氧会抑制细胞对纳米粒子的摄取;(3)在缺氧条件下,ACLEP相对ACLE有效地抑制了各肺癌细胞的生长,说明通过氧气输送改善肿瘤缺氧微环境有助于克服肺癌细胞的耐药性。
实施例10
收集对数生长期的A549细胞,1000rpm离心5min,用PBS洗涤2次,无菌条件下送到动物室。
在无菌实验条件下,于裸鼠右侧腋窝皮下注射A549细胞,每只0.1mL,待裸鼠腋窝处出现米粒大结节,说明成功建立模型。
裸鼠尾静脉分别注射生理盐水、实施例4中制备得到的ACL、实施例2中制备得到的ACLE、实施例1中制备得到的ACLEP,每三天测动物体重及肿瘤体积,肿瘤体积(v)按公式V=(长×宽2)/2计算,并绘制肿瘤生长曲线,结果如图6所示。
由图6(A)可见,给药后,给药组裸鼠体重与空白对照组相比未发生明显的变化,表明各脂质体复合物在给药剂量范围为裸鼠的安全剂量范围。由图6(B)可见,相对于其他脂质体复合物,ACLEP在裸鼠体内的抗肿瘤效果最显著,说明在体内ACLEP通过负载氧气可协同增加分子靶向药物厄洛替尼在肺癌治疗中的效果。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!