一种抑制胃癌增殖的方法及其药物与流程
本发明涉及一种抑制胃癌增殖的方法及其药物。
背景技术:
胃癌是世界上第四大最常见肿瘤和第二大最常见癌症死亡原因。尽管诊断和治疗方法的提高使得早期胃癌有着较为良好的长期存活期望,但晚期胃癌患者的前景仍不容乐观。而预后不良往往是由于缺乏早期诊断的生物标志物以及有效的治疗方法。因此,我们十分迫切地希望确定一种新型、更有效的治疗药物来克服这一困难。
在数千种初步检测其抗癌潜能的天然化合物中,仅有大约40种有前途的药物被应用到临床试验中。姜黄素,一种取自姜黄块茎的二酮化合物,在印度俗称为“haldi”,正是这些目前处于临床研究的药物中的一种。多个动物研究已经证实了姜黄素的抗癌潜能。作为近几年研究最为成功的化合物之一,姜黄素预防和治疗癌症的能力正在被评估,其展示出良好的药理活性,并在肿瘤细胞增殖、生长、存活、凋亡、迁移、侵袭、血管生成和转移中显示出有益的效果。一些研究已经表明姜黄素可以通过它的抗炎、抗氧化、抗增殖和促凋亡活性来阻止肿瘤的发展。尽管它的作用机制尚未完全清楚,但可以认为姜黄素的作用直接与几种蛋白相关,包括炎症分子、细胞存活蛋白、组蛋白酰基转移酶(hats)、组蛋白去乙酰化酶(hdac)、蛋白激酶和还原酶、乙二醛酶i、蛋白酶体、肌浆网ca2+-atp酶(serca)、人类免疫缺陷病毒1型(hiv-1)整合酶和蛋白酶、dna甲基转移酶1(dnmt1)、ftsz原丝、载体蛋白、dna、rna、和金属离子。姜黄素也间接与一些转录因子和辅助因子相互作用,包括nf-κb、激活蛋白1(ap-1)、β-连环蛋白、信号转导和转录激活(stat)蛋白以及过氧化物酶体增殖激活受体y(ppary)。姜黄素至少部分是通过介导内在或外在的p53、nf-κb和nf-κb调控的b细胞淋巴瘤2(bcl-2)、细胞周期蛋白d1、环氧合酶-2(cox-2)、基质金属蛋白酶-9(mmp-9)、akt、丝裂原活化蛋白激酶(mapk)、nf-e2相关因子2(nrf2)、β-连环蛋白以及细胞间粘附等的基因表达而起到作用。nf-κb据报道称是由包括notch信号在内的多种炎症细胞因子所调控的,并在人类癌症的临床病例中具有高度活性。而姜黄素已经表明可以通过抑制nf-κb以及它相关的基因产物来介导其抗凋亡作用。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种有效抑制胃癌增殖的方法及其药物。
为实现上述目的,本发明提供了如下技术方案:一种抑制胃癌增殖的方法,通过减少胃癌细胞线粒体mtdna的拷贝数和dna聚合酶γ的表达,增强氧化应激进而引发细胞能量代谢的紊乱,以抑制胃癌细胞的增殖。
本发明还提供了如下技术方案:一种抑制胃癌增殖的药物,该药物为姜黄素。
线粒体在大多数真核细胞的能量代谢中其主要作用,不仅有近95%的细胞atp是通过线粒体的氧化磷酸化产生,它同时也控制着细胞的死亡或者存活。线粒体相关的细胞凋亡是内在细胞凋亡的关键机制之一,而线粒体稳态的破坏将导致这一过程的启动。细胞的能量代谢由线粒体呼吸(oxphos)和有氧糖酵解组成,可促进细胞的生长调控和其他细胞功能。线粒体具有独立的基因组可编码13个蛋白、2个rrna和22个trna,称之为mtdna。这13个线粒体蛋白作为线粒体电子传递链复合物中重要的亚基维持着氧化磷酸化(oxphos)的稳定。在肿瘤细胞中,为了满足更高的能量需求以支持快速而不受控制的细胞生长,发生了代谢重组并导致oxphos到有氧糖酵解的改变,这一过程被称为warburg效应。大量的研究均支持针对细胞的代谢可能是一个很有前景的癌症治疗策略这一观点。例如,针对2-dg来破坏细胞糖酵解,针对线粒体谷氨酰胺酶来抑制癌变,针对ampk/mtor轴来抑制肿瘤细胞的生长,以及针对aicar直接激活ampk来促进细胞周期阻滞和细胞凋亡。
因此,细胞能量代谢在调控细胞生长方面的重要性表明姜黄素的抗癌特性与调节细胞能量代谢过程中的成分紧密相关。到目前为止,姜黄素在细胞能量代谢过程中潜在的调控作用尚不清楚。在这项研究中,我们研究假设姜黄素对胃癌细胞生长的抑制效果是由于破坏了细胞的能量代谢而实现的。我们的研究结果表明,姜黄素显著抑制胃癌细胞的生长并促进细胞凋亡。此外,我们发现姜黄素可明显促进ros的产生并破坏细胞的能量代谢从而导致细胞生长的抑制。而进一步研究发现姜黄素破坏细胞能量代谢的作用部分是由于ros介导的polg耗竭,从而抑制mtdna的复制,进一步降低了能量供应有关的蛋白编码。在体内实验中通过裸鼠模型的研究进一步支持了姜黄素在胃癌细胞中的抗瘤活性。总而言之,我们认为姜黄素抑制胃癌生长的作用是通过产生大量的ros从而导致dna聚合酶γ(polg)和mtdna的耗竭并随之破坏细胞能量代谢这一新的机制得以实现的。
附图说明
图1.姜黄素体外抑制胃癌细胞生长及促进细胞凋亡
图1a.用rtca确定总细胞增殖曲线;图1b.在细胞活力测定中,6×103个sgc-7901或bgc-823细胞接种于96孔板,用0、2.5、5、10、20、40µg/ml姜黄素处理24小时做mtt法测定;对细胞增殖的测定则将2×103个sgc-7901或bgc-823细胞接种于5个96孔板中,分别经10µg/ml的姜黄素处理0-5天,用cck-8试剂盒检测细胞相对数;图1c.300个sgc-7901或bgc-823细胞培养于6孔板,10µg/ml姜黄素处理5天后,用giemsa染料染色做集落形成评估;显示的是处理组有代表性的集落以及集落的数量;图1d.对细胞凋亡的评价,sgc和bgc细胞经10µg/ml的姜黄素处理24小时,用annexinv试剂盒制备成样品,在流式细胞仪上分析;显示的是有代表性的曲线以及实验组量化的数据;图1e.从10µg/ml姜黄素处理的sgc和bgc细胞裂解液中做有代表性的凋亡相关蛋白和信号分子的蛋白印迹分析,β肌动蛋白作为内参;图1f.用10µg/ml姜黄素处理的sgc和bgc细胞用荧光膜电位指示仪jc-1分析测定线粒体膜电位;图1g.利用荧光探针和dcfh-da试剂盒检测细胞内ros,sgc和bgc细胞用10µg/ml姜黄素处理xx分钟后用流式细胞仪分析;图1h.对于线粒体超氧化物生成的测定,sgc或bgc细胞用10µg/ml姜黄素处理xx分钟后用mitosox荧光检测;b-d和f-h的数据均以均数±sd表示;相比空白或无dmso组*p<0.05,**p<0.01,***p<0.001;
图2.姜黄素抑制线粒体呼吸和糖酵解
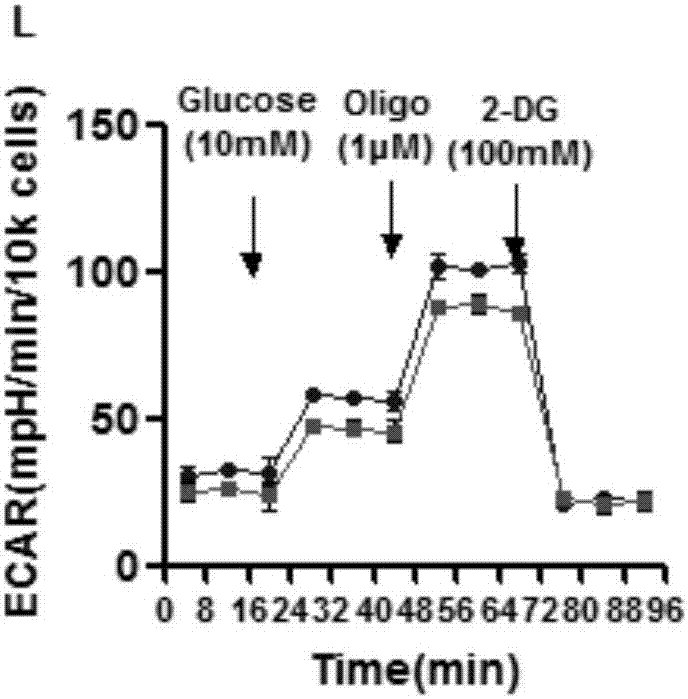
图2a.姜黄素对实时线粒体耗氧率(ocr)的作用。用10µg/ml姜黄素处理12小时后的sgc-7901和bgc-823细胞序贯注射atp合酶抑制剂寡霉素(1μm)、解偶联剂fccp(1μm)、复合体i抑制剂鱼藤酮(1μm)和复合物ⅲ抑制剂抗霉素a(1μm),用海马xf96分析仪评估线粒体氧耗;图2b.10µg/ml姜黄素处理12小时对细胞基础呼吸的作用;图2c.细胞最大呼吸率和图2d.sgc-7901和bgc-823细胞的atp生产;图2e.sgc-7901或bgc-823细胞10µg/ml姜黄素处理后依次注射葡萄糖(10mm)、寡霉素(1μm)和2-dg(100mm),测量细胞外酸化率(ecar)评估细胞有氧糖酵解;sgc-7901和bgc-823细胞经或未经10µg/ml姜黄素处理的基础(图2f)和储备(图2g)细胞糖酵解率;数据以均数±sd表示;相比空白或无dmso组*p<0.05,**p<0.01,***p<0.001;
图3.姜黄素下调mtdna和polg以抑制细胞能量代谢
图3a&图3b.实时定量pcr和蛋白印迹分析分别测定10µg/ml姜黄素对sgc-7901或bgc-823细胞mtdna拷贝数和呼吸复合体蛋白的作用;显示的是以β肌动蛋白为内参的有代表性的呼吸复合体蛋白印迹;姜黄素=curc;图3c&图3d.相似的蛋白印迹和荧光pcr用于分析sirna介导的polg基因沉默的sgc-7901或bgc-823细胞;显示的是有代表性的呼吸蛋白印迹分析;
polg基因沉默对bgc-823细胞线粒体呼吸的作用通过实时测定线粒体耗氧率(ocr)来确定;图3e.通过细胞外酸化率(ecar)来确定有氧糖酵解;图3f;如图2所示,箭头表示呼吸复合体调节剂的注射顺序;sirna介导的polg基因沉默对bgc-823细胞基础(图3g)和最大(图3h)呼吸通过线粒体ocr和atp生产(图3i)来确定;sirna介导的polg基因沉默对bgc-823细胞基础(图3j)和储备(图3k)糖酵解率的作用;图3l.显示的是单用n-乙酰半胱氨酸或合用姜黄素处理的bgc-823细胞用蛋白印迹分析以β肌动蛋白为内参的polg表达;nac对姜黄素诱导bgc-823细胞;图3m.线粒体呼吸(ocr)和图3n.有氧糖酵解(ecar)改变的作用;如图2所示,箭头表示呼吸复合体调节剂的注射顺序;对a、c-k、m-n,数据以均数±sd表示,相比空白或无dmso组*p<0.05,**p<0.01;
图4.姜黄素体内抑制胃癌生长
balb/c裸鼠皮下注射0.1mlbgc细胞悬液以建立肿瘤生长移植瘤模型,mock=模拟手术,vehicle=生理盐水,25mg/kg姜黄素,6只小鼠每组;数据报告如下:图4a.裸鼠移植瘤移植部位图像;姜黄素对肿瘤生长的影响表现为肿瘤体积随时间的变化而变化;图4b.老鼠体重;图4c.肿瘤体重;图4d&图4e.胃癌细胞的量化和活体成像;图4f.胃癌细胞代表性的he组织学染色图像;
图4g.肿瘤组织中mtdna拷贝数的变化;图4h.以β-肌动蛋白作为内参的蛋白印迹分析肿瘤组织中凋亡相关蛋白、信号转导通路和线粒体呼吸复合体的表达;收集并消化小鼠的肿瘤以分离原代肿瘤细胞;用sirna沉默polg基因的细胞通过实时测定线粒体耗氧率(ocr)评价图4i.线粒体的呼吸;通过细胞外酸化率(ecar)来确定图4j.有氧糖酵解;如图2所示,箭头表示呼吸复合体调节剂的注射顺序;对a-c、e、g、i-j,数据以均数±sd表示,相比空白或阴性组*p<0.05,**p<0.01;
图5.人胃癌患者polg的表达和姜黄素对细胞能量代谢的影响
从确诊为胃癌的患者中提取胃癌(c)与周围正常组织(n)并评估polg的表达如下:图5a.蛋白印迹分析,以β-肌动蛋白作为内参;图5b.polg表达水平;图5c.polgmrna的表达;消化胃癌组织标本分离出原代胃癌细胞以研究姜黄素的作用;图5d.通过ocr测定整体呼吸改变;图5e.通过ecar测定有氧糖酵解;图5f.基础呼吸;图5g.最大呼吸;图5h.atp生产;图5i.基础糖酵解率;图5j.储备糖酵解能力;使用sirna沉默人胃癌细胞polg基因,通过实时测定线粒体耗氧率来评估细胞的图5k.线粒体呼吸;通过细胞外酸化率(ecar)来确定图5l.有氧糖酵解;如图2所示,箭头表示呼吸复合体调节剂的注射顺序;图5m.姜黄素抑制胃癌细胞生长的作用机制通过(i)增强过量的活性氧产生和激活p53、p21启动细胞凋亡;(ii)消耗polg导致mtdna含量减少,使氧化磷酸化受损以限制能量供应;对b-l,数据以均数±sd表示,相比n或对照组*p<0.05,**p<0.01。
具体实施方式
参见附图,本发明公开的抑制胃癌增殖的方法,通过减少胃癌细胞线粒体mtdna的拷贝数和dna聚合酶γ的表达,增强氧化应激进而引发细胞能量代谢的紊乱,以抑制胃癌细胞的增殖。
本发明还提供了如下技术方案:一种抑制胃癌增殖的药物,该药物为姜黄素。
一、姜黄素抑制胃癌细胞生长并促进ros介导的凋亡
为了研究姜黄素在调节胃癌细胞生长中的作用,我们确定了影响细胞活性的姜黄素浓度(0-40µg/ml)并发现其降低细胞活性的作用呈剂量依赖性(图1a和b)。此外,通过长达5天的对姜黄素治疗量(10µg/ml)减少细胞增殖的监测(图1b)发现其可显著抑制胃癌sgc-7901和bgc-823细胞株的集落形成(图1c)。姜黄素诱导细胞凋亡的作用则是通过pi/fitc染色的流式细胞仪分析来识别凋亡细胞与非凋亡细胞来评估的。结果显示姜黄素治疗量(10µg/ml)诱导两种类型的胃癌细胞凋亡的量均达6倍以上(图1d),这与其他文献的报道相一致。目前的研究表明姜黄素很有可能是通过抑制bcl-2抗凋亡通路以及灭活erk/mapk信号来促进细胞凋亡。因此,我们猜测姜黄素介导的胃癌细胞凋亡是否同样依赖于这些途径。结果表明姜黄素在减少erk激活和降低bcl-2水平的同时也伴随着p53丝氨酸磷酸化的增加(图1e)。图1f显示姜黄素显著破坏线粒体的膜电位,提示可能的线粒体稳态丧失(图1f)。线粒体由于电子传递链(etc)的“电子漏”,是主要的ros产生部位。尽管生理水平的ros在正常细胞的增殖和信号传导中起重要的作用,但线粒体释放过多的ros可导致严重的氧化损伤以及随之而来的细胞凋亡。我们发现姜黄素治疗的胃癌细胞产生的ros增加达2倍以上(图1g)。并且,姜黄素诱导增加的ros量主要定位在线粒体上(图1h)。总的来说,我们的研究结果表明姜黄素很可能是通过增加氧化应激这一机制来显著促进细胞凋亡。
二、姜黄素抑制线粒体呼吸和有氧糖酵解
我们的数据表明姜黄素在增强线粒体氧化应激的同时伴随着强大的细胞凋亡,这是其抑制肿瘤生长的一个重要性质。大约95%的细胞atp是通过线粒体氧化磷酸化产生,因而其在大多数真核细胞的能量代谢中起主要作用并控制着细胞的死亡或存活。我们推测姜黄素能够增强对线粒体完整性的氧化损伤,从而进一步限制细胞的能量代谢。为了验证我们的猜想,我们使用海马96xf细胞外流量分析仪来确定姜黄素对线粒体呼吸(oxphos)和有氧糖酵解的有效性。如图2a所示,姜黄素可减少完整的细胞耗氧率(ocr),提示其可减少胃癌sgc-7901和bgc-823细胞的氧化磷酸化。此外,我们也评估了特定的线粒体功能,尤其是基础呼吸、最大呼吸和atp生产。图2b显示姜黄素能显著降低代表线粒体基础氧化磷酸化活性的基础呼吸。此外,在解偶联剂fccp的存在下,细胞的氧耗急剧增加,也可通过etc阻滞剂鱼藤酮和抗霉素a来抑制电子在复合体i和复合体iii之间的传递。同时,姜黄素能明显降低最大呼吸(图2c)。线粒体整合的电子传递链可驱动h+泵为atp合酶催化生成atp提供能量。在我们的胃癌sgc-7901和bgc-823细胞实验模型中发现10μg/ml的姜黄素能显著降低atp的产生(图2d)。这些数据表明姜黄素能抑制线粒体的呼吸来减少atp的供应,从而限制癌细胞的生长。ottowarburg通过真核细胞的增殖提出了癌症是细胞退化到更为原始的新陈代谢的结果,而高水平的有氧糖酵解在癌细胞中是最共同的一个代谢过程。因此我们猜想姜黄素是否也能够通过调节有氧糖酵解来限制肿瘤的生长。通过海马96xf细胞外流量分析仪,我们确定了姜黄素对糖酵解的作用效果。细胞外酸化率(ecar)的测定结果表明姜黄素治疗能显著降低sgc-7901和bgc-823细胞的有氧糖酵解(图2e)。为进一步了解姜黄素在调节有氧糖酵解中的作用,我们分析了基础糖酵解率的指标和剩余糖酵解能力。正如图2f所示,姜黄素治疗能降低基础糖酵解率,同时可观察到其抑制线粒体的呼吸,从而显著抑制肿瘤细胞的整体生长。此外,剩余糖酵解能力在姜黄素中明显被阻滞(图2g)。总之,我们的研究表明姜黄素很有可能通过限制细胞的能量代谢来抑制肿瘤细胞的生长。
三、姜黄素通过降低polg的表达从而减少mtdna拷贝数来调控细胞的能量代谢
由于缺乏有效的保护机制如组蛋白,线粒体的dna很容易受到氧化损伤。我们的研究发现姜黄素治疗可增加ros的生成,从而加重细胞的氧化损伤。我们推测姜黄素诱导的ros水平缓慢升高可能会损害线粒体dna从而导致线粒体呼吸的破坏。我们通过实时pcr检测mtdna的拷贝数来研究这种可能性,发现姜黄素治疗确实能导致sgc-7901和bgc-823细胞的mtdna减少(图3a)。此外,姜黄素诱导的mtdna减少同样与蛋白polg以及呼吸复合物的亚基例如coxi、coxii、coxiv、cytb的表达减少有关(图3b)。polg在mtdna的复制、转录和维持其完整性中十分重要。为了研究polg在胃癌生物学中调整线粒体呼吸的作用,我们使用特定的靶向sirna序列沉默polg来显著降低polg的mrna和蛋白水平(图3c)。同时,polg基因的沉默伴随着线粒体呼吸复合物亚基的表达减少(图3c)。同姜黄素诱导的polg下调一样,sirna沉默的polg也和mtdna拷贝数减少有关(图3d)。基于这些研究,我们猜想polg的沉默是否也会导致和姜黄素类似的细胞能量代谢表型。因此,我们通过海马96xf细胞外流量分析仪来确定胃癌细胞中sirna诱导的polg沉默对线粒体呼吸功能评估(ocr)和有氧糖酵解评价(ecar)的改变。结果表明下调的polg明显降低线粒体的整体呼吸作用(图3e)和有氧糖酵解(图3f)。此外,在通过氧化磷酸化(oxphos)和有氧糖酵解来评估特定的线粒体功能中,我们发现下调的polg能够降低基础呼吸(图3g)、最大呼吸(图3h)、atp产生(图3i),基础糖酵解率(图3j)和糖酵解能力(图3k)。之后我们猜测姜黄素诱导产生的过量ros是否会导致polg的耗竭。在研究中,我们使用ros清除剂nac来阻滞胃癌细胞中姜黄素诱导产生的ros,然后评估其对线粒体呼吸和糖酵解的影响。正如预测的一样,nac能有效地挽回姜黄素诱导的polg耗竭和有氧糖酵解减少(图3l-n)。总之,我们的数据表明姜黄素部分通过减少polg以减少mtdna含量从而进一步抑制细胞的能量代谢来抑制癌细胞的生长。但仍需进一步的研究来揭示姜黄素下调polg,启动mtdna的减少以及干扰细胞能量代谢的机制。
四、姜黄素体内抗肿瘤活性
为了证实我们在体内的数据,我们采用了一种bcg细胞皮下接种的裸鼠移植瘤模型。姜黄素(25mg/kg)和生理盐水通过ip交替注射并评估14天的肿瘤大小。结果显示在长达15天的测量中,姜黄素可导致肿瘤的体积逐步减少(图4a)。而裸鼠体重在治疗期间并没有受到姜黄素的影响(图4b),说明裸鼠仍处于正常生长的条件下。正如预期的那样,姜黄素诱导肿瘤体积的减小也与肿瘤质量的显著降低相关(图4c)。实时成像进一步从可视化和量化的角度来确定姜黄素对肿瘤抑制的作用(图4d和e)。肿瘤的组织学(h&e)评价表明姜黄素治疗组相比于空白和阴性组出现了坏死并导致细胞结构更不明显(图4f)。姜黄素治疗组的肿瘤mtdna比对照组要低50%(图4g),这与降低polg蛋白的表达有关(图4h)。此外,姜黄素处理过的肿瘤在凋亡相关蛋白、信号蛋白和呼吸复合体蛋白的表达上出现了与姜黄素治疗的胃细胞株类似的变化。之后我们将裸鼠移植瘤的肿瘤细胞分离出来并采用sirna沉默polg基因。在对细胞能量代谢作用的评估中不出所料地显示出ecar和ocr是被抑制的(分别为图4i和j)。总的来说,我们在体外和体内实验模型获得的数据表明,姜黄素显著抑制胃癌细胞的生长。
五、临床胃癌组织原代细胞经姜黄素处理polg的表达下调进而抑制能量代谢
我们以周围正常的胃组织为对照,来确定从确诊为胃癌的人类受试者中分离出来的胃肿瘤polg的表达量。结果表明在肿瘤组织中polg蛋白和mrna表达均显著上调(图5a-c)。从原代细胞分离消化来的肿瘤细胞通过确定ocr和ecar来研究姜黄素对细胞能量代谢的作用。我们发现,姜黄素可明显抑制细胞的氧化磷酸化(图5d)和糖酵解(图5e)。此外,姜黄素能降低ocr的指数即基础呼吸、atp生产和最大呼吸(分别为图5f、g、h)。而正如预期的一样,细胞糖酵解参数即基础糖酵解率和储备糖酵解率在姜黄素治疗下均有所减少(分别为图5i和j)。我们进一步耗竭了原代胃癌细胞的polg并确定其线粒体呼吸和有氧糖酵解。与裸鼠肿瘤和胃癌细胞株的结果相同,polg降低导致呼吸(图5k)和糖酵解(图5l)的减少。总之,从人胃肿瘤中所得到的数据进一步证实了姜黄素抑制胃癌细胞的能量代谢。
五、材料和方法
试剂和抗体:
姜黄素、寡霉素、羰基-氰-对-三氟甲氧基本腙(fccp)、抗霉素a、鱼藤酮购自sigma(st.路易斯,mo);吉姆萨染料和结晶紫购自索宝生物科技有限公司(上海,中国);mtt检测试剂盒、cck-8、dcfh-daros检测试剂盒、jc-1线粒体膜电位检测试剂盒、辣根过氧化物酶(hrp)标记的兔抗、鼠抗免疫球蛋白g购自beyotime(海门,中国);bca蛋白测定试剂盒和ecl蛋白印迹基板购自thermoscientific(waltham,ma);抗β-肌动蛋白单克隆抗体购自abmart(上海,中国);polg、coxi、coxii、coxiv、p21、nd1、nd2和cytb购自protechgroup(武汉,中国);p-erk、erk、p-jnk、jnk、p-p38、p38、bax、bcl-2、p-akt和akt购自cellsignallingtechnology;细胞凋亡检测试剂盒购自bdscience。
细胞培养:
人胃癌细胞株sgc-7901、bgc-823购自xxx并在含10%胎牛血清(fbs)和抗生素(100u/ml青霉素和链霉素)的rpmi1640中于37℃含5%co2的加湿孵化器中培养。
克隆形成实验:
sgc-7901和bgc-823细胞300/孔接种于培养板并培养于37℃含5%co2的培养箱。两周后,用预热的pbs冲洗细胞3次,甲醇固定20分钟,用结晶紫染色15分钟。之后细胞用ddh2o洗涤以清除残余的结晶紫,通过imagej软件计算细胞的克隆形成数。
细胞增殖和细胞活性测定:
在细胞增殖实验中,3×103细胞/孔接种于96孔板,用10µg/ml的姜黄素分别处理0、24、48、72和96小时,然后用cck-8检测试剂盒测定相对细胞数,用读板测出450nm处的od值。细胞活力的检测采用mtt实验。6×103细胞接种于96孔板,分别用0、2.5、5、10、20和40µg/ml的姜黄素处理24小时,然后通过mtt试剂盒说明书来测定。简而言之,将mtt试剂(5µg/ml)添加到细胞中培养4小时,产生的晶体可溶解在甲瓒中,用读板测出od值。
流式细胞分析仪检测细胞凋亡、活性氧和线粒体膜电位:
在细胞凋亡分析中,姜黄素(10µg/ml)预处理后的sgc-7901和bgc-823细胞用冰冻pbs冲洗并收集,添加annexinv-fitc/pi(bd,sanjose,ca)混合物随后在室温下避光孵育20分钟。之后,将样品放入bdaccuritmc6流式细胞仪(bd,franklinlakes,nj)。细胞内ros水平是根据说明书采用荧光探针2,7-二氯二乙酸酯(dcfh-da)来测定的。细胞收集并用预热pbs洗涤后,在溶有dcfh-da的无血清1640培养基中37℃培养20分钟。之后细胞用无血清的1640培养基冲洗2次,在流式细胞仪中分析。同样,姜黄素处理的细胞中线粒体过氧化物产生量根据说明书用mitosox染色来确定,并用荧光显微镜和流式细胞仪分析。在线粒体膜电位分析中,10μg/ml姜黄素处理xx分钟后的sgc和bgc细胞在完全培养基中用2.0μmjc-1染色,并在37℃黑暗中孵育20分钟。用pbs洗去多余的jc-1染料后通过荧光显微镜来评价。
rna提取、实时定量pcr和dna测定:
根据说明书将dna聚合酶γ基因沉默的sgc和bgc细胞中提取总的rna,并采用primescripttmrt-pcr试剂盒以及gdnaeraser人工合成cdna。实时定量pcr检测根据说明书均采用2μlcdna/20μl反应体积在应用sybrgreeni(bio-rad)的cfxconnecttm实时系统中进行。引物序列由supplementaryinformation提供。对于cdna扩增,采用以下步骤进行热循环:95℃10分钟,95℃10秒变性40次,60℃延长30秒。为了量化mtdna拷贝数,基因组dna被分离,线粒体dna和核dna则分别用内引物nd1和内引物β肌动蛋白来探查。每个反应的阈值周期数(ct)都会被记录。每个样品都会分析3次并重复实验3次。所有的结果都以均数±标准差来表示。
蛋白印迹分析:
蛋白印迹(westernblot)分析的操作如前所述。简单来说,从整个细胞或组织中提取等量的蛋白在sds-page中分离,然后在tris-甘氨酸缓冲液中通过电泳转移到硝酸纤维素膜上。在室温下用3%脱脂牛奶在摇床中放置1.5小时封闭条带,随后用相应的一抗在4℃孵育一夜。之后,回收一抗并冲洗条带3次,每次10分钟,在室温下用相应的二抗孵育1小时。最后,用1×tbst溶液清洗条带3次,每次10分钟,然后根据说明书与ecl试剂反应1分钟,随后用x线进行曝光。
氧化磷酸化和糖酵解的测量:
如前所述,使用海马96xf细胞外流量分析仪实时收集细胞的耗氧率(ocr)和细胞外酸化率(ecar)。简单来说,sgc-7901或bgc-823细胞在10µg/ml的姜黄素处理12小时后,取103个细胞接种到海马定制的细胞板。用探针校准后,按下列顺序依次注射相应的调节线粒体呼吸的复合体来测定耗氧率(ocr):寡霉素(atp合酶抑制剂;1μm)、fccp(解偶联剂;1μm)、鱼藤酮(复合体i抑制剂;1μm)和抗霉素a(复合物iii抑制剂;1μm)。细胞有氧糖酵解的测定则是通过测量姜黄素处理的sgc-7901或bgc-823细胞的细胞外酸化率(ecar)。依次注射葡萄糖(10mm)、寡霉素(1μm)或2-dg(100mm)后进行测量。图2f.未经或经10µg/ml姜黄素处理的sgc-7901和bgc-823细胞的基础糖酵解率;图2g.sgc和bgc细胞经姜黄素处理后细胞储备糖酵解能力的改变。
裸鼠移植瘤实验:
balb/c裸鼠(6–8周,雌性,约20g)购自温州医科大学实验动物中心并在特定无病原体环境中饲养。所有的实验设计和动物护理均符合实验室动物护理和使用指南(实验动物资源协会)的规定,并经过温州医科大学动物护理与使用委员会机构的同意。裸鼠皮下接种0.1ml含5×106bgc细胞的悬液,待肿瘤体积长到约100mm3开始治疗。小鼠随机分为三组,每组六只,每组分别腹腔注射生理盐水(对照)、pbs和25mg/kg姜黄素悬液。14天里每隔2天测定每只小鼠的体重和肿瘤体积。肿瘤体积用下列公式计算:肿瘤体积=长×宽×高/2。第14天用过量戊巴比妥钠处死小鼠,立即取出肿瘤组织做进一步分析。
数据分析:
所有数据的统计分析均采用spss16.0,各组的数据比较采用t检验。数据的获取必须经至少三个独立的实验,用平均值±标准差(sd)表示。p值<0.05认为有统计学意义。
- 还没有人留言评论。精彩留言会获得点赞!