一种乏氧改善的顺铂前药脂质体制剂及其制备方法与应用与流程
本发明涉及生物医药技术领域,尤其涉及一种乏氧改善的顺铂前药脂质体制剂及其制备方法与应用。
背景技术:
肿瘤(tumour)是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物(neogrowth),因为这种新生物多呈占位性块状突起,也称赘生物(neoplasm)。根据新生物的细胞特性及对机体的危害性程度,又将肿瘤分为良性肿瘤和恶性肿瘤两大类,而癌症即为恶性肿瘤的总称。与良性肿瘤相比,恶性肿瘤生长速度快,呈浸润性生长,易发生出血、坏死、溃疡等,并常有远处转移,造成人体消瘦、无力、贫血、食欲不振、发热以及严重的脏器功能受损等,最终造成患者死亡。由于人口老龄化等原因,当前我国癌症发病率、死亡率呈持续增长趋势。世界癌症报告估计,2012年中国癌症发病人数为306.5万,约占全球发病人数的五分之一;癌症死亡人数为220.5万,约占全球癌症死亡人数的四分之一。今后20年,我国癌症的发病数和死亡数还将持续上升:根据国际癌症研究署预测,如不采取有效措施,我国癌症发病数和死亡数到2020年将上升至400万人和300万人;2030年将上升至500万人和350万人。
放疗和化疗是目前临床应用最为广泛的两种癌症治疗方法,由于放疗和化疗各有其优势和不足,比如放疗具有局部限制性和耐受性,化疗具有较大的副作用和药物耐受性,所以为了进一步提高治疗的效果,放疗和化疗相结合的治疗方案在临床被广泛地推广应用开来。然而,放化疗的治疗效果仍然被复杂的肿瘤微环境所限制。
由于恶性肿瘤生长迅速,内部血管生长、分布不均匀,容易造成肿瘤组织内氧气、养料供应不足,进而导致部分区域的癌细胞严重乏氧甚至癌细胞转移。有大量研究表明,肿瘤内乏氧区域对临床上常用的癌症治疗方法(如:化疗、放疗)的效果会产生重要的影响,是癌细胞对常规的化疗、放疗产生耐受性以及癌症治疗失败的重要原因之一。目前大量的科学家致力于开发改善肿瘤乏氧的药物,用以改善放化疗治疗效果,以实现对肿瘤的高效杀灭。
技术实现要素:
有鉴于此,本申请提供一种乏氧改善的顺铂前药脂质体制剂及其制备方法与应用,本申请提供的顺铂前药脂质体制剂具有良好的提高肿瘤区域氧气含量增敏放疗的效果,同时结合化疗药物顺铂产生良好的肿瘤协同治疗效果。
为了实现本发明的目的,本发明采用如下技术方案:
一种顺铂前药脂质体制剂,包括脂质体、顺铂前药和过氧化氢酶;所述脂质体中心为亲水区,所述过氧化氢酶包裹于脂质体中心的亲水区,顺铂前药装载在脂质体的疏水区域。
本发明这种脂质体制剂即脂质体-顺铂前药-过氧化氢酶制剂,主要由脂质体、顺铂前药和过氧化氢酶组成。
其中,过氧化氢酶(CAT)是一种广泛存在于生物体内的过氧化物酶,在动物的各个组织中都有存在,尤其在肝脏中的浓度最高。过氧化氢酶能够催化H2O2产生O2和H2O,以免H2O2与O2在Fe螯合物作用下反应生成非常有害的-OH,从而达到调控和清除动物体内有害H2O2的作用;反应式如下:
本发明所述顺铂前药为四价顺铂前药;在本发明的一些具体实施例中,所述顺铂前药由顺铂和过氧化氢以及丁二酸酐反应生成。
顺铂是一种临床常用的化疗药物,能够杀伤多种癌症细胞,具有一定的临床普适性。顺铂的化学名是顺式二氨基二氯络铂,分子式为Cl2(NH3)2Pt,英文缩写为DDP或PDD。前体药物也称前药、药物前体、前驱药物等,是指药物经过化学结构修饰后得到的在体外无活性或活性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物。在本发明的实施例中,顺铂前药是在顺铂的结构基础上引入了另外两条基团链,以减低顺铂的副作用(神经毒性和肾毒性)。
脂质体(liposome)是一种人工膜;在水中磷脂分子亲水头部插入水中,脂质体疏水尾部伸向空气,搅动后形成双层脂分子的球形脂质体。其生物学定义:当两性分子如磷脂和鞘脂分散于水相时,分子的疏水尾部倾向于聚集在一起,避开水相,而亲水头部暴露在水相,形成具有双分子层结构的封闭囊泡,称为脂质体。脂质体的药剂学定义:系指将药物包封于类脂质双分子层内而形成的微型泡囊体。
本发明所述脂质体制剂中,过氧化氢酶包裹于脂质体中心的亲水区,顺铂前药装载在脂质体的疏水区域。
本发明所述脂质体制剂可以有效的在肿瘤部位富集,同时由于过氧化氢酶的存在,使得所述脂质体制剂可以有效地氧化肿瘤区域的过氧化氢产生氧气,以改善肿瘤乏氧。由于外放疗使用X射线可以利用过氧化氢酶产生的O2提高对癌细胞的杀伤作用,同时结合顺铂前药的化疗作用,最终实现对肿瘤的高效、协同杀灭。
传统的顺铂脂质体合成方法是将顺铂包埋在脂质体的内腔亲水部分,而本发明第一次将顺铂前药装载在脂质体的表面。该结构的优点是提高了顺铂前药的装载效率,大概为50%,而传统的装载方法一般不超过20%。并且,本发明该脂质体有了更多的亲水内腔来装载过氧化氢酶。本发明第一次将顺铂前药和过氧化氢酶设计进脂质体结构,通过改善肿瘤的乏氧,用以提高肿瘤的放化疗效果。
按照本发明,在一些实施方案中,所述脂质体制剂中,疏水区域装载顺铂前药的脂质体由二棕榈酰磷脂酰胆碱(DPPC)、胆固醇(CH)和磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)及磷脂酰乙醇胺类物质-顺铂前药组成。
其中,所述磷脂酰乙醇胺类物质-顺铂前药、二棕榈酰磷脂酰胆碱、胆固醇、磷脂酰乙醇胺-聚乙二醇的摩尔比可为(2~8):(0.1~8):(2~4):(0.5~1)。在本发明的实施例中,所述磷脂酰乙醇胺类物质-顺铂前药、二棕榈酰磷脂酰胆碱、胆固醇、磷脂酰乙醇胺-聚乙二醇的摩尔比优选为8:8:4:1;其他比例如6:0.1:4:0.5和2:6:2:0.5亦可获得。
在本发明实施例中,所述磷脂酰乙醇胺类物质-顺铂前药包括但不限于磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV)),二油酰磷脂酰乙醇胺-顺铂前药(DOPE-Pt(IV)),二棕榈酰基磷脂酰乙醇胺-顺铂前药(DPPE-Pt(IV))。
本发明一些实施例提供了磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))的合成方法,顺铂和过氧化氢以及丁二酸酐先后反应生成四价顺铂前药,然后通过共价键和磷脂酰乙醇胺反应,生成磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))。
在本申请的实施例中,凡是带有氨基结构的诸如DOPE、DPPE都能与顺铂前药通过共价键连接,合成上述类似的结构。其中,所述磷脂酰乙醇胺类物质-顺铂前药由四价顺铂前药与磷脂酰乙醇胺类物质可按照(1~3):1的摩尔比例反应生成,两者的摩尔比优选为2:1,产物质量最佳。
在一些实施方案中,本发明所述的脂质体制剂,其粒径为90~140nm。在本发明的一些实施例中,所述脂质体制剂可同时装载光敏分子以及过氧化氢酶。其中,所述光敏分子如DiD(1,1'-双十八烷基-3,3,3',3'-四甲基吲哚二碳菁高氯酸盐)、DiR(1,1'-双十八烷基-3,3,3',3'-四甲基吲哚二碳菁碘化物)等荧光染料分子。
相应地,本发明提供了一种顺铂前药脂质体制剂的制备方法,包括以下步骤:
提供可装载的顺铂前药;
将磷脂类物质及附加剂与可装载的顺铂前药溶解于有机溶剂中,先吹干再水化,然后与过氧化氢酶溶液混合,进行脂质体挤膜,得到顺铂前药脂质体制剂。
所述制备方法具体可为:将二棕榈酰磷脂酰胆碱、胆固醇、磷脂酰乙醇胺-聚乙二醇和磷脂酰乙醇胺类物质-顺铂前药溶解于三氯甲烷溶液中,氮气吹干,水化搅拌后加入过氧化氢酶溶液,进行脂质体挤膜,得到顺铂前药脂质体制剂。
本发明实施例提供的脂质体-顺铂前药-过氧化氢酶制剂的制备方法中,将二棕榈酰磷脂酰胆碱(DPPC)、胆固醇(CH)、磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)和磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))溶解于三氯甲烷溶液中,氮气吹干,水化搅拌后加入过氧化氢酶溶液进行脂质体挤膜。
其中,磷脂酰乙醇胺类物质-顺铂前药如磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV)),即为可装载的顺铂前药,可由四价顺铂前药与磷脂酰乙醇胺类物质优选按照2:1的摩尔比例反应生成。
本发明一些实施例提供了磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))的合成方法,顺铂和过氧化氢以及丁二酸酐先后反应生成四价顺铂前药,然后通过共价键和磷脂酰乙醇胺反应,生成磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))。其中,理论上磷脂酰乙醇胺类物质(如DOPE,DPPE)都可以和顺铂前药以相同比例如2:1的摩尔比例反应生成类似结构。
在一些实施方案中,本发明所述脂质体制剂的制备方法中所述二磷脂酰乙醇胺-顺铂前药、棕榈酰磷脂酰胆碱、磷脂酰乙醇胺-聚乙二醇、胆固醇的摩尔比优选为8:8:4:1。
本发明实施例所述的磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)采用市售产品即可,如Laysan bio、Avanti lipids等公司的产品。在一些实施方案中,本发明所述脂质体制剂的制备方法中,所述搅拌优选于40~70℃、更优选于65℃搅拌。在本发明的一些实施例中,所述过氧化氢酶溶液中酶浓度可为5~10mg/mL,优选为7.5mg/mL。
按照本发明,在一些实施方案中,所述脂质体制剂的制备方法中制得的所述脂质体-顺铂前药-过氧化氢酶制剂的粒径为90~140nm。
利用本发明制备的脂质体-顺铂前药-过氧化氢酶制剂,对小鼠通过尾静脉注射,并由荧光成像技术对其体内药代动力学行为进行监测。实验表明,脂质体-顺铂前药-过氧化氢酶制剂能够在肿瘤的部位具有很高的富集。通过免疫荧光染色的方法发现,肿瘤部位的乏氧状况在注射本发明脂质体-顺铂前药-过氧化氢酶制剂后被大大改善。还发现,肿瘤乏氧改善后的放化疗治疗效果有了很大的改善,能够更加有效地抑制肿瘤的生长。
因此,本发明还提供了所述脂质体制剂(脂质体-顺铂前药-过氧化氢酶制剂)在制备改善肿瘤乏氧的治疗肿瘤疾病药物中的应用,包括:在制备改善肿瘤区域局部乏氧状况、提高外放疗治疗效果的药物中的应用。
进一步的,还提供了所述脂质体制剂(脂质体-顺铂前药-过氧化氢酶制剂)在制备克服肿瘤乏氧、增强放化疗的药物中的应用。
与现有技术相比,本发明提供了一种脂质体制剂及其制备方法与应用。本发明提供的脂质体制剂(脂质体-顺铂前药-过氧化氢酶制剂)主要由脂质体、顺铂前药和过氧化氢酶组成,粒径均一,在水中分散良好,在水中粒径主要集中在100nm左右,可以同时装载光敏分子(如DiD、DiR等)以及过氧化氢酶,是理想的药物载体,具有良好的药代动力学行为。实验表明,本发明所述脂质体-顺铂前药-过氧化氢酶制剂在肿瘤的部位具有很高的富集,改善肿瘤区域局部乏氧状况,提高外放疗对癌细胞的杀伤效果,提高了放化疗的治疗效果,实现了对肿瘤高效杀灭。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂的透射电镜图;
图2示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂在水中的粒径分布;其中,实线表示脂质体-顺铂前药制剂(Pt(IV)-Liposome)在水中的粒径;虚线表示脂质体-顺铂前药-过氧化氢酶制剂(CAT@Pt(IV)-Liposome)在水中的粒径;
图3示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂在过氧化氢溶液中催化产生的氧含量变化;其中,数值点为正方形的曲线表示对照组CTR过氧化氢溶液中氧气浓度随时间的变化;数值点为圆点的曲线表示加入脂质体-顺铂前药制剂(Pt(IV)-Liposome)后的过氧化氢溶液中氧气浓度随时间的变化;数值点为三角形的曲线表示加入脂质体-顺铂前药-过氧化氢酶制剂(CAT@Pt(IV)-Liposome)后的过氧化氢溶液中氧气浓度随时间的变化;
图4示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂基于不同过氧化氢酶浓度催化过氧化氢溶液导致的氧含量变化;其中,过氧化氢溶液中加入的脂质体-顺铂前药-过氧化氢酶制剂中过氧化氢酶的浓度分别为0mg/L(方形数值点曲线)、0.06mg/L(向下三角数值点曲线)、0.12mg/L(向右三角数值点曲线)、0.24mg/L(五边形数值点曲线)、0.48mg/L(十字线段数值点曲线)、0.96mg/L(单线段数值点曲线);
图5示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂在消化酶作用下酶活力的变化;其中,数值点为正方形的曲线表示过氧化氢酶溶液(Free CAT)在消化酶作用下酶活力随时间的变化;数值点为圆点的曲线表示过脂质体-顺铂前药-过氧化氢酶制剂(CAT@Pt(IV)-Liposome)在消化酶作用下酶活力随时间的变化;
图6示实施例1所得脂质体-顺铂前药-过氧化氢酶制剂在消化酶作用下催化过氧化氢溶液产生氧气气泡的示意图;其中,1号溶液为过氧化氢溶液对照组(Control);2号溶液为加入过氧化氢酶溶液(Free CAT)催化后的过氧化氢溶液;3号溶液为加入消化酶(Free CAT+Protease K)作用24h的过氧化氢酶溶液的过氧化氢溶液;4号溶液为加入脂质体-顺铂前药-过氧化氢酶制剂(CAT@Pt(IV)-Liposome)后的过氧化氢溶液;5号为加入消化酶作用24h的脂质体-顺铂前药-过氧化氢酶制剂(CAT@Pt(IV)-Liposome+Protease K)的过氧化氢溶液;
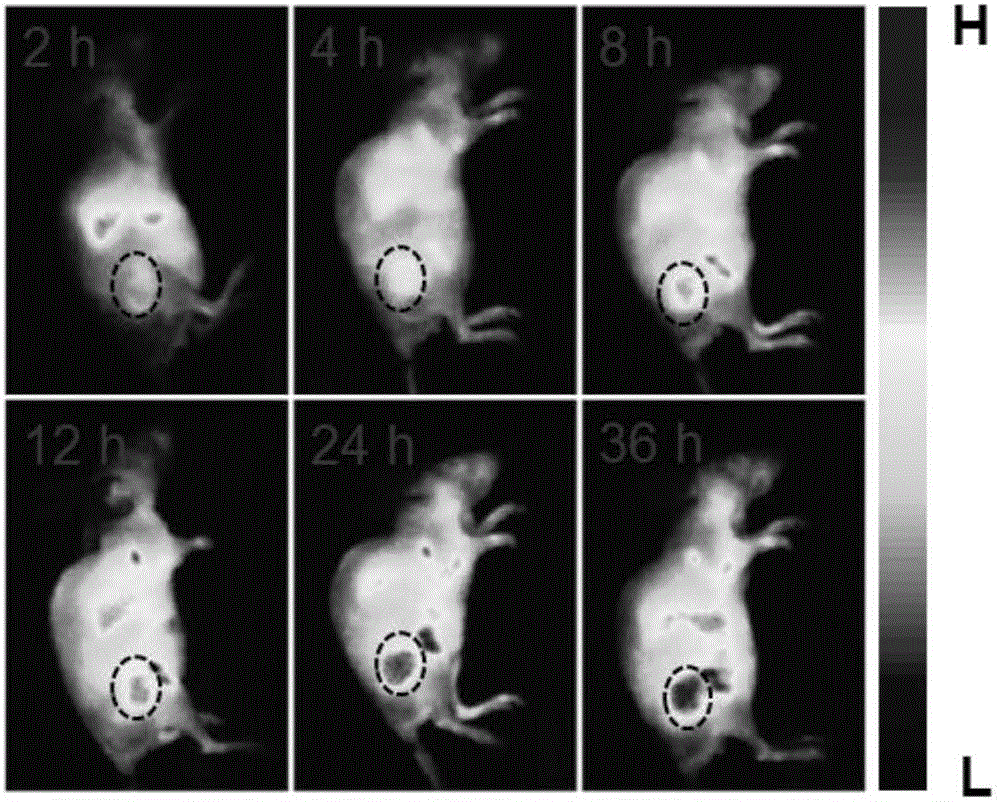
图7示实施例5小鼠注射脂质体-顺铂前药-过氧化氢酶制剂后,不同时间点在肿瘤部位富集情况的活体荧光成像图;
图8示实施例5小鼠注射脂质体-顺铂前药-过氧化氢酶制剂后,不同时间点在肿瘤部位富集情况的荧光强度统计图;
图9示实施例5小鼠注射脂质体-顺铂前药-过氧化氢酶制剂24h后,在体内各个器官分布的荧光成像图;
图10示实施例5小鼠注射脂质体-顺铂前药-过氧化氢酶制剂24h后,在体内各个器官分布的荧光强度统计图;
图11示实施例6免疫荧光染色的方法对小鼠肿瘤部位乏氧状况变化的检测,该图为共聚焦显微镜的成像结果图,其中横坐标为不同实验组(分别为:I,对照组(仅注生理盐水);II,注射脂质体-过氧化氢酶制剂组;III,注射脂质体-顺铂前药制剂组;IV,注射脂质体-顺铂前药-过氧化氢酶制剂);
图12为示实施例6免疫荧光染色的方法对小鼠肿瘤部位乏氧状况变化的荧光信号统计结果图,其中横坐标为不同实验组(分别为:I,对照组(仅注生理盐水);II,注射脂质体-过氧化氢酶制剂组;III,注射脂质体-顺铂前药制剂组;IV,注射脂质体-顺铂前药-过氧化氢酶制剂);
图13示实施例7不同分组的小鼠肿瘤在光动力治疗后肿瘤的生长曲线;其中,第一组,对照组(仅注生理盐水);第二组,注射脂质体-顺铂前药制剂组;第三组,注射脂质体-顺铂前药-过氧化氢酶制剂;第四组,只照射线组;第五组,注射脂质体-顺铂前药制剂24h后进行射线照射治疗组;第六组,注射脂质体-过氧化氢酶制剂24h后进行射线照射治疗组;第七组,注射脂质体-顺铂前药-过氧化氢酶制剂24h后进行射线照射治疗组。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为了进一步理解本申请,下面结合实施例对本申请提供的脂质体制剂及其制备方法与应用进行具体地描述。
实施例1、脂质体-顺铂前药-过氧化氢酶制剂的制备
将顺铂与过氧化氢在水溶液中充分氧化,得到产物溶入DMSO与丁二酸酐反应生成四价顺铂前药(具体制备内容可参见文献1.Rational Design of Polyion Complex Nanoparticles to Overcome Cisplatin Resistance in Cancer Therapy.Advance materials,2014,26,931-936.文献2.Polyvalent Oligonucleotide Gold Nanoparticle Conjugates as Delivery Vehicles for Platinum(IV)Warheads.J.Am.Chem.Soc.,2009,131,14652–14653),得到的顺铂前药在经过EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和NHS(N-羟基琥珀酰亚胺)活化后,在一定氯仿、乙醇和水的混合溶剂中与磷脂酰乙醇胺按照摩尔比例2:1反应,生成磷脂酰乙醇胺-顺铂前药(DSPE-Pt(IV))。
将DSPE-Pt(IV)、DPPC、CH、DSPE-PEG(5k,Laysan bio公司)按照摩尔比为8:8:4:1的比例称取后,溶于三氯甲烷溶液中,用氮气将三氯甲烷溶液吹干。加入磷酸缓冲液在65℃水浴中搅拌30分钟后,加入过氧化氢酶溶液(7.5mg/mL)后,用200nm滤膜来回挤压20次,得到脂质体制剂。
所述脂质体制剂中,疏水性的结构DSPE-Pt(IV)在脂质体表面,亲水性的过氧化氢酶在脂质体亲水内部。
实施例2、脂质体-顺铂前药-过氧化氢酶-荧光染料制剂的制备
将DSPE-Pt(IV)、DPPC、CH、DSPE-PEG(5k,Laysan bio公司)和DiD按照摩尔比为8:8:4:1:1的比例称取后,根据实施例1中的步骤制备,得到脂质体-顺铂前药-过氧化氢酶-荧光染料制剂。
实施例3、脂质体-顺铂前药-过氧化氢酶制剂的性质检测
对实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂进行定性检测,分别进行透射电镜检测、动态光散射。
其中,透射电镜检测的结果如图1所示,结果显示,实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂在水中呈单分散状态分布,表明本发明制得的脂质体-顺铂前药-过氧化氢酶制剂的粒径均一,在水中分散良好。
动态光散射检测的结果如图2所示,结果显示,实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂在水中粒径主要集中在100nm左右。
实施例4、脂质体-顺铂前药-过氧化氢酶制剂的催化活力检测
对实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂进行催化活力检测,分别进行催化氧含量检测、酶活力检测。
催化氧含量结果如图3、4所示,结果显示,实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂能够有效催化过氧化氢产生氧气,提高过氧化氢溶液中的氧含量。
酶活性检测的实施方法是:将过氧化氢酶或者包埋有过氧化氢酶的脂质体与过氧化氢溶液反应1分钟,加入钼酸铵溶液与未分解的过氧化氢反应形成淡黄色产物,然后测量其在405nm的紫外吸收强度,通过对比相对强度来得到酶的相对活性。另一个酶稳定性的检测是:先将过氧化氢酶或包埋有过氧化氢酶的脂质体与蛋白酶K(一种蛋白剪切酶)反应一段时间,再使用上述方法检测其活性,通过活性判断其稳定性。
酶活力检测结果如图5、6所示,结果显示,实施例1制得脂质体-顺铂前药-过氧化氢酶制剂能够在剪切酶的作用下很好保护过氧化氢酶的酶活力。
实施例5、脂质体-顺铂前药-过氧化氢酶制剂注射进小鼠后在小鼠的体内行为
将实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂通过尾静脉注射到小鼠体内,肿瘤使用细胞种类为4T1(小鼠乳腺癌细胞),老鼠种类为雌性Balb/c,肿瘤生长期为一周左右。在小动物成像系统(CRI)上在不同的时间点进行实时采集图片,观察脂质体-顺铂前药-过氧化氢酶制剂在肿瘤部位的富集量,结果见图7、8。选用的激发光源是635nm,曝光时间是50ms。
图7、8结果显示,随着时间的推移,肿瘤区域脂质体-顺铂前药-过氧化氢酶制剂的荧光信号逐渐增强,其在肿瘤部位的富集随时间增加。
将脂质体-顺铂前药-过氧化氢酶制剂通过尾静脉注射到小鼠体内,24小时后将小鼠主要器官取出后,测量其荧光强度,根据荧光强度的数值定量分析出脂质体-顺铂前药-过氧化氢酶在不同器官中分布情况,结果见图9、10。
图9、10结果显示,脂质体-顺铂前药-过氧化氢酶制剂在肿瘤部位富集可以达到较高的水平。
实施例6、免疫荧光染色检测肿瘤乏氧状况的变化
将实施例1制得的脂质体-顺铂前药-过氧化氢酶制剂经尾静脉注射到荷瘤小鼠体内,24小时后将四组小鼠腹腔注射0.6mg/只乏氧荧光探针HypoxyprobeTM(pimonidazole hydrochloride),90分钟后将小鼠肿瘤切下后冷冻切片染色,结果见图11、12。
图11共聚焦显微镜的成像结果表明,相比较于对照组,注射脂质体-顺铂前药-过氧化氢酶制剂的小鼠肿瘤区域的乏氧状况有明显改善。
实施例7、肿瘤的放化疗联合治疗
将带有乳腺癌皮下肿瘤模型的小鼠分为7组,治疗时的肿瘤大小为250mm*3左右,注射剂量为:顺铂前药5mg/kg,过氧化氢酶2mg/kg;其中包括:第一组,对照组(仅注生理盐水);第二组,注射脂质体-顺铂前药制剂组;第三组,注射脂质体-顺铂前药-过氧化氢酶制剂;第四组,只照射线组;第五组,注射脂质体-顺铂前药制剂24h后进行射线照射治疗组;第六组,注射脂质体-过氧化氢酶制剂24h后进行射线照射治疗组;第七组,注射脂质体-顺铂前药-过氧化氢酶制剂24h后进行射线照射治疗组。对小鼠进行相应的治疗后,测量其肿瘤的生长,结果见于图13。
结果表明,相比较对照组,第四组、第五组、第六组和第七组的肿瘤生长仅得到了部分抑制,而第七组的肿瘤生长则得到了有效的抑制。表明脂质体-顺铂前药-过氧化氢酶制剂能够实现对肿瘤的高效杀灭。
以上所述仅是本发明的优选实施方式,应当指出,对于使本技术领域的专业技术人员,在不脱离本发明技术原理的前提下,是能够实现对这些实施例的多种修改的,而这些修改也应视为本发明应该保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!