水溶性富勒烯结构在制备治疗肥胖症的药物中的应用的制作方法
本发明属于医药领域,具体涉及一种水溶性富勒烯结构在制备治疗肥胖症的药物中的应用。
背景技术
肥胖症是一种常见的新陈代谢综合症。当人体进食热量多于消耗热量时,多余热量以甘油三酯形式储存于脂肪细胞内,增加体内的脂肪积累,最终演变为肥胖症。肥胖症的诊断标准①按体内脂肪的百分含量(f)计算,一般体重正常的成年男性f=15%,女性f=22%,若男性f>25%,女性f>30%,可诊断为肥胖症;②根据体重指数bmi(体重/身高2单位kg/m2)来判断,按who建议:bmi=18.5—24.9为正常,25-29.9为超重,>30为肥胖症;③腰围(wc)男>94cm,女>80cm为肥胖。
根据肥胖症的形成原因,可以将其分为三种类型:单纯性肥胖、续发性肥胖和药物性肥胖,其中单纯性肥胖又分为体质性肥胖和过食性肥胖。近几十年以来,随着我国的城市化发展,人民生活水平不断提高的同时也面临着紧张快节奏的工作。饮食结构变化和缺乏锻炼使得我国肥胖人口快速增加。若不及时采取措施进行治疗,肥胖症会增加患者高血压、动脉粥样硬化、糖尿病、脂肪肝等新陈代谢类疾病的风险,严重影响人类的健康长寿。
富勒烯是由不同数目碳原子组成的笼状碳原子簇,其是除石墨、金刚石和无定型碳之外碳元素的另一种同素异形体。含量最多的富勒烯分子是c60,然后是c70、c84,其次是含量相对较少的c76、c78、c82等。另外由于富勒烯的碳笼内部为空腔结构,因此其内部空腔可内嵌不同原子、离子或原子簇,被称之为内嵌富勒烯,如gd@c82,表示gd内嵌在c82的笼状结构中,@表示at,形象的表达了内嵌的含义。富勒烯结构因为其独特的分子结构决定了它独特的物理化学性质。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
本发明的目的在于提供一种水溶性的富勒烯、水溶性的内嵌金属富勒烯、水溶性的富勒烯和水溶性的内嵌金属富勒烯的组合物、以上三者对应的可药用的酯或以上三者对应的可药用的盐在制备治疗肥胖症的药物中的应用。本发明的另一目的在于提供一种包含上述水溶性富勒烯结构的治疗肥胖症的药物组合物。本发明的再一目的在于提供一种使用上述水溶性富勒烯结构治疗肥胖症的方法。作为有效成分的上述水溶性富勒烯结构能够高效地治疗肥胖,改善脂肪代谢,降低白色脂肪的含量。
为了实现目的,本发明提供了以下技术方案:
一种水溶性的富勒烯、水溶性的内嵌金属富勒烯、所述水溶性的富勒烯和所述水溶性的内嵌金属富勒烯的组合物、以上三者的可药用的酯或以上三者中的可药用的盐在制备治疗肥胖症的药物中的应用。
本发明还提供了一种治疗肥胖症的方法,包括向患有肥胖症的受试者施用有效量的至少一种选自下组的有效成分:水溶性的富勒烯、水溶性的内嵌金属富勒烯、所述水溶性的富勒烯和所述水溶性的内嵌金属富勒烯的组合物、以上三者的可药用的酯、以上三者的可药用的盐。
本发明还提供了一种治疗肥胖症的药物组合物,包括至少一种选自下组的有效成分:水溶性的富勒烯、水溶性的内嵌金属富勒烯、所述水溶性的富勒烯和所述水溶性的内嵌金属富勒烯的组合物、以上三者的可药用的酯、以上三者的可药用盐,还包括可药用的载体、稀释剂和赋形剂中的至少一种。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性的富勒烯包括选自下组的一种或多种富勒烯:(1)表面修饰有亲水基团的富勒烯;(2)被亲水性生物小分子包裹的富勒烯;(3)被具有生物相容性的载体材料负载的富勒烯;(4)自组装形成的水溶性超分子体系富勒烯。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性的内嵌金属富勒烯包括选自下组的一种或多种内嵌金属富勒烯:(1)表面修饰有亲水基团的内嵌金属富勒烯;(2)被亲水性生物小分子包裹的内嵌金属富勒烯;(3)被具有生物相容性的载体材料负载的内嵌金属富勒烯;(4)自组装形成的水溶性超分子体系内嵌金属富勒烯。
上述应用、方法或药物组合物在另一种实施方式中,所述富勒烯包括一种或多种通式为c2m的由碳原子组成的笼状结构,30≤m≤60,例如;c60,c70,c84等。
上述应用、方法或药物组合物在另一种实施方式中,所述内嵌金属富勒烯包括m@c2n、m2@c2n、ma@c2n、m3n@c2n、m2c2@c2n、m2s@c2n、m2o@c2n和mxa3-xn@c2n中的一种或多种,其中:m、a均代表金属元素且m、a均选自sc、y和镧系金属元素中的任意一种,30≤n≤60;0≤x≤3。例如:gd@c82。n代表氮元素,c代表碳元素,s代表硫元素,镧系金属元素包括la、ce、pr、nd、pm、sm、eu、gd、tb、dy、ho、er、tm、yb和lu。
上述应用、方法或药物组合物在另一种实施方式中,所述亲水基团包括羟基、羧基、巯基、氨基、水溶性氨基酸残基中的一种或多种。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性的富勒烯的通式为c2a(oh)b(aminoacid)c,aminoacid代表水溶性氨基酸残基;30≤a≤60,可选的a为30或35;0<b<50,可选的0<b<30,还可选的b=13、20、24等;0≤c<20,可选的c=2-15,还可选的c=6。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性内嵌金属富勒烯的通式为m@c2d(oh)e(aminoacid)f,aminoacid代表水溶性氨基酸残基;m选自稀土金属,可选的稀土金属为gd、la等;30≤d≤60,可选的d为41或30或35;0<e<50,可选的0<e<30,还可选的e=13、20、24等;0≤f<20,可选的f=2-15,还可选的f=6。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性氨基酸残基是指水溶性氨基酸在修饰富勒烯和/或内嵌金属富勒烯时,失去氨基酸分子的一部分后剩余的不完整的氨基酸,即:氨基酸残基是氨基酸分子的一部分,其是不完整的氨基酸。缺少氨基酸分子中的任何一个部分都算是氨基酸残基,如:失去氨基酸中氨基上的氢、失去氨基酸中羧基上的氢或羟基等。可选的,所述水溶性氨基酸残基为丙氨酸残基、甘氨酸残基、丝氨酸残基、精氨酸残基、赖氨酸残基和天门氨酸残基中的至少一种。
上述应用、方法或药物组合物在另一种实施方式中,所述亲水性生物小分子包括氨基酸和肽链中的至少一种。
上述应用、方法或药物组合物在另一种实施方式中,所述具有生物相容性的载体材料包括脂质体和细胞膜载体的至少一种。
上述修饰的方法、包裹的方法、负载的方法和自组装的方法均可按照现有技术公开的方法进行。列举如下:
(1)物理包覆的方法可以将原料富勒烯和原料内嵌金属富勒烯中的至少一种与聚乙二醇、聚乙烯吡咯烷酮和环糊精中的至少一种混合并进行球磨或超声等就可以得到与原料相应的包覆的水溶性富勒烯结构,如聚乙二醇包覆的富勒烯和/或聚乙二醇包覆的内嵌金属富勒烯,聚乙烯吡咯烷酮包覆的富勒烯和/或聚乙烯吡咯烷酮包覆的内嵌金属富勒烯。
(2)当水溶性的富勒烯结构中含氨基酸残基的个数为0(即富勒醇)时,可通过相转移催化剂参与的液液反应(xinggetal,j.phys.chem.b.,2004(108):11473-11479)或富勒烯/内嵌金属富勒烯本体直接与碱溶液反应得到。可选的,水溶性富勒烯/水溶性内嵌金属富勒烯的制备方法包括:(a)将过氧化氢水溶液(可选的,过氧化氢水溶液质量百分含量为1-30%)和氢氧化钠溶液/氢氧化钾溶液(可选的,氢氧化钠溶液/氢氧化钾溶液的质量百分含量为10-80%)混合(可选的,按照过氧化氢水溶液和氢氧化钠溶液/氢氧化钾溶液的体积比为1-10:1混合),在混合液中加入富勒烯本体/内嵌金属富勒烯本体(可选的,在每10-200ml混合液中加入20-500mg富勒烯本体/内嵌金属富勒烯本体),在温度50-80℃下反应(可选的,所述反应为搅拌反应4-24h;可选的,搅拌转速为1000r/min),过滤,保留滤液。(b)将所述滤液加入过量的乙醇(可选的,所述乙醇浓度为85%-100%),经过离心(可选的,离心转速为10000r/min,离心时间为1-10min)后收集沉淀,将所述沉淀溶于水,得到溶液。(c)将(b)步骤得到的溶液进行透析处理,可选的,透析至所述溶液在室温的电导率小于1μs/cm;可选的,将经过所述透析后的所述溶液冷冻干燥,以便获得羟基化富勒烯固体/羟基化内嵌金属富勒烯固体。
(3)当水溶性的富勒烯结构中含氨基酸残基的个数不为0时,(a)使用水溶性氨基酸和naoh/koh配制水溶性氨基酸碱溶液(可选的,水溶性氨基酸和naoh/koh的质量比为1:1-10,还可选的为1:2或1:1-8;可选的,水溶性氨基酸碱溶液中naoh/koh的质量分数可为10~50%,还可选的为14%或10~30%);(b)按照氨基酸与富勒烯本体/内嵌金属富勒烯本体摩尔比为1-1000:1,可选的为50-1000:1,100-1000:1,200-1000:1,将氨基酸碱溶液与富勒烯本体/内嵌金属富勒烯本体进行混合;(c)将上述混合物40-80℃反应(可选的,所述反应为搅拌反应1-7小时),过滤除去未反应的少量固体粉末;(d)滤液透析除去小分子杂质,过滤后,得到的棕黑色溶液即为本发明的氨基酸修饰的水溶性的富勒烯/内嵌金属富勒烯。可选的,透析所使用的透析袋的截留分子量mw=3500,透析后的过滤所使用的微孔滤膜的孔径200-220nm。
上述应用、方法或药物组合物在另一种实施方式中,所述水溶性氨基酸为丙氨酸、甘氨酸、丝氨酸、精氨酸、赖氨酸和天门氨酸中的至少一种。
上述应用、方法或药物组合物在另一种实施方式中,所述治疗肥胖症包括:1)使体重趋于正常;2)降低皮下脂肪、肾周脂肪、生殖腺脂肪等体内脂肪含量。
上述药物或上述药物组合物在另一种实施方式中,该药物或药物组合物可以是片剂、丸剂、散剂、锭剂、小药囊、扁囊剂、酏剂、悬浮剂、乳剂、溶液剂、糖浆剂、气溶胶、软膏、软和硬明胶胶囊、栓剂、无菌注射溶液或无菌包装粉针剂的制剂。本发明中将有效成分制备成药物或药物组合物的方法可采用本领域普通技术人员公知的方法来制备在制备过程中,使其在施用于受试者后速释、缓释或延迟释放有效成分,例如:有效成分可以与载体混合,用载体稀释或者包封在载体中。载体、赋形剂和稀释剂既可以是充当有效成分的载体、赋性剂和稀释剂,也可以是充当介质的载体、赋性剂和稀释剂。
上述应用中的药物或上述药物组合物在另一种实施方式中,适宜的载体、赋形剂和稀释剂可以是固体、半固体或液体材料,如:乳糖、右旋糖、蔗糖、山梨醇、甘露醇、淀粉、树脂、阿拉伯胶、磷酸钙、海藻酸盐、西黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水糖浆(watersyrup)、甲基纤维素、尼泊金甲酯和丙酯、滑石粉、硬脂酸镁或液状石蜡。
上述应用中的药物或上述药物组合物在另一种实施方式中,该药物或药物组合物还可以另外包括润滑剂、润湿剂、乳化和悬浮剂、防腐剂、甜味剂或矫味剂。
上述药物组合物在另一种实施方式中,当所述药物或所述药物组合物以液体形式存在时,有效成分在所述药物或所述药物组合物中的浓度为0.01-100mg/ml,可选的为0.01-3mg/ml,0.01-5mg/ml,0.01-10mg/ml,0.01-20mg/ml,0.01-30mg/ml,0.01-40mg/ml,0.01-50mg/ml;当所述药物或所述药物组合物以固体形式存在时,有效成分在所述药物或所述药物组合物中的浓度为0.01-100mg/g,可选的为0.01-3mg/g,0.01-5mg/g,0.01-10mg/g,0.01-20mg/g,0.01-30mg/g,0.01-40mg/g。
上述方法在另一种实施方式中,所述受试者为哺乳动物,如小鼠、豚鼠、大鼠、狗、兔子、猴子和人等。
上述方法在另一种实施方式中,所述有效成分的施用剂量为1mg/kg/d-100mg/kg/d,可选的为1-20mg/kg/d,1-10mg/kg/d等,施用疗程可以为5天-30天,根据病情可短期服用或长期服用;有效成分的施用方式可以为口服、静脉注射或腹腔给药。
本发明所用的术语“治疗”包括其通常被接受的含义,该含义包括阻止、预防、抑制、改善以及减缓、停止或逆转所产生症状或预期病变的发展。照此,本发明涵盖治疗性和预防性的施用。
本发明所用的术语“有效成分”、“有效成分水溶性富勒烯结构”或“水溶性富勒烯结构”均指的是水溶性的富勒烯、水溶性的内嵌金属富勒烯、水溶性的富勒烯和水溶性的内嵌金属富勒烯的组合物、以上三者的可药用的酯和以上三者的可药用的盐中的至少一种。
本发明所用的术语“有效量”指有效成分经单次或多次施用于患者而给所诊断或所治疗的患者提供预期效应的量或剂量。有效量可由所参与的诊断医师作为本领域技术人员通过已知技术以及在类似情形下所得的观察结果而确定。在确定所施用有效成分的有效量或剂量时,所参与的诊断医师应考虑多种因素,所述因素包括但不限于:哺乳动物的种属;体积、年龄及一般健康;所涉及的具体疾病;该疾病的涉入程度或严重程度;个体患者的响应;所施用的具体化合物;给药模式;所施用制剂的生物利用度性质;所选择的给药方案;伴随药物疗法的使用;以及其它相关的情形。
本发明所用的术语“原料富勒烯”、“富勒烯”、“富勒烯本体”均是指没有经过水溶性改性的富勒烯。
本发明所用的术语“原料内嵌金属富勒烯”、“内嵌金属富勒烯”、“内嵌金属富勒烯本体”均是指没有经过水溶性改性的内嵌金属富勒烯。
本发明中所有范围的公开应当视为对范围内所有子范围和所有点值的公开。例如:1-1000的公开应当视为也公开了1-200,200-300等范围,同时也公开了200、300、400、500、600、700、800、900和100等点值。
本发明中为了方便叙述,使用了“/”符号,其含义为其中的至少一种,如“富勒烯本体/内嵌金属富勒烯本体”表示富勒烯本体和内嵌金属富勒烯本体中的至少一种。
与现有技术相比,本发明具有如下有益效果:本发明中作为有效成分的上述水溶性富勒烯结构能够高效地治疗肥胖,改善脂肪代谢,降低白色脂肪如肾周脂肪组织、皮下脂肪组织和生殖腺脂肪组织的含量。
附图说明
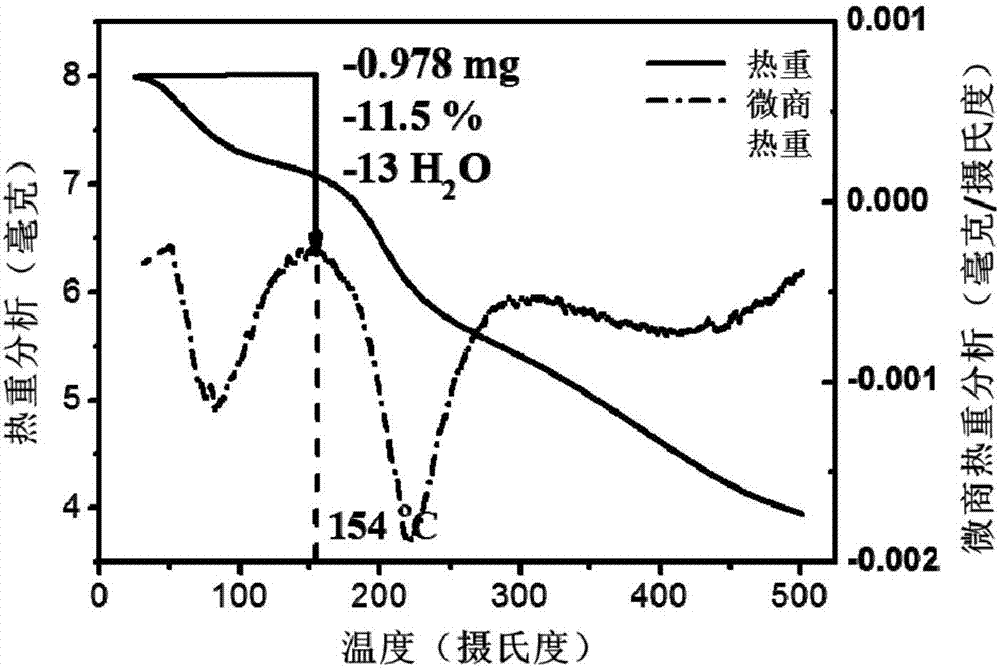
图1为本发明实施例1gd@c82(oh)13(nhch2ch2cooh)6热重分析热重及微商热重曲线。
图2为本发明实施例1gd@c82(oh)13(nhch2ch2cooh)6的红外光谱图。
图3是实施例3中gf材料的电子自旋核磁共振(esr)图。
图4是实施例4中给药治疗期间各组小鼠的体重变化曲线,上半部分的曲线为模型组和治疗组的曲线,从上到下依次为模型组、治疗组-0.375mm、治疗组-0.75mm和治疗组-1.5mm,下半部分的曲线为空白组,从上到下的曲线依次为空白+生理盐水组、空白+gf组。
图5是实施例4中给药治疗开始到结束后,各组小鼠的体重增加图,其中:n.s.表示生理盐水,gf表示gd@c82(oh)13(nhch2ch2cooh)6,即从左到右各组分别为:空白+生理盐水组、空白+gf组、模型组、治疗组-0.375mm、治疗组-0.75mm和治疗组-1.5mm。
图6是实施例4中给药治疗后各组小鼠主要部位脂肪含量的统计图,其中:n.s.表示生理盐水,gf表示gd@c82(oh)13(nhch2ch2cooh)6,即从左到右各组分别为:空白+生理盐水组、空白+gf组、模型组、治疗组-0.375mm、治疗组-0.75mm和治疗组-1.5mm。每一组别中,从左到右分别代表肾周脂肪组织、皮下脂肪组织和生殖腺脂肪组织。
具体实施方式
下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、水溶性氨基酸修饰的内嵌金属富勒烯结构的制备
把10mggd@c82固体加入单口瓶中,加入6mlnaoh质量分数为14%的β-丙氨酸碱溶液(氨基酸与氢氧化钠的摩尔比具体为1:2;β-丙氨酸与gd@c82的摩尔比为1000:1),50℃下剧烈搅拌1.5h,黑色固体逐渐溶解生成棕黑色溶液。过滤除去未反应的少量固体粉末,滤液使用乙醇洗涤,mw=3500透析袋透析除去小分子杂质,使用220nm微孔滤膜过滤后得到的棕黑色溶液即为本发明的水溶性氨基酸修饰的内嵌金属富勒烯结构。
实施例2
对实施例1使用gd@c82制备得到的水溶性氨基酸修饰的内嵌金属富勒烯结构进行元素分析和热重曲线分析,元素分析的结果如表1所示,热重曲线分析如图1所示:
表1β-丙氨酸修饰的内嵌金属富勒烯结构的元素分析结果
根据热重曲线分析可以得出水溶性氨基酸修饰的内嵌金属富勒烯结构中含10.9%的水,经过计算约为13个h2o分子,再结合元素分析,进一步推测得到该物质的平均分子式为gd@c82(oh)13(nhch2ch2cooh)6,以下简称为gf。
图2为红外光谱在3300cm-1左右的强的吸收峰归属为o-h的伸缩振动,在1740和1630cm-1处中等的吸收峰归属为c=o的伸缩振动、n-h的弯曲振动,在1568,1400和1300cm-1处的强峰分别为c=c的伸缩振动、o-h的弯曲振动以及c-o、c-n的伸缩振动峰。由图2可知,本发明β-丙氨酸修饰的内嵌金属富勒烯结构中含有上述的亲水基团,即本发明是水溶性。
实施例3、水溶性金属富勒烯gf清除自由基能力检测
本发明通过电子自旋共振波谱(esr)来检测水溶性金属富勒烯gf清除自由基的能力。
检测方法:采用紫外诱导产生羟基自由基的方法,将40μldmpo水溶液、20μl100mmol/l的过氧化氢水溶液和20μl去离子水混合,用280nm波长的紫外照射4min,关闭紫外保持黑暗一分钟,检测自由基信号,作为空白对照组;实验组将上述实验中的去离子水替换为实施例1制备的不同浓度的等体积水溶性金属富勒烯即可。如图3所示,水溶性金属富勒烯显著降低了溶液中的羟基自由基信号,且清除效果随着浓度增加而增加。
实施例4、水溶性金属富勒烯gf对肥胖症的治疗
(1)治疗实验
本实验所用的小鼠模型为ob/ob小鼠,该小鼠是一种瘦素分泌基因缺陷型肥胖症小鼠,其体内不能正常的产生瘦素(一种蛋白类激素,可以参与体内糖类和脂肪的代谢),因此缺乏瘦素分泌的ob/ob小鼠会过量摄取食物,相对于野生型的正常小鼠,体重明显增加,体型变大,患有肥胖症。该小鼠购自南京大学-南京生物医药研究院,引自美国杰克逊实验室。
小鼠分为6组,即:空白+生理盐水组、空白+gf组、模型组、治疗组-0.375mm、治疗组-0.75mm、治疗组-1.5mm,每组6只小鼠。空白+生理盐水组、空白+gf组均为不患有肥胖症的健康小鼠,给药时其平均体重为23g;模型组、治疗组-0.375mm、治疗组-0.75mm、治疗组-1.5mm均为ob/ob小鼠,给药时其平均体重均为33g。
空白+生理盐水组:小鼠腹腔注射150μl生理盐水。小鼠出生后第6周开始给药,每天给药一次,持续16天。
空白+gf组:小鼠注射实施例1制备的水溶性金属富勒烯gf配制的1.5mm溶液150μl。小鼠出生后第6周开始给药,每天给药一次,持续16天。
模型组:小鼠腹腔注射150μl生理盐水。小鼠出生后第6周开始给药,每天给药一次,持续16天。
治疗组-0.375mm:小鼠注射实施例1制备的水溶性金属富勒烯gf配制的0.375mm溶液150μl。小鼠出生后第6周开始给药,每天给药一次,持续16天。
治疗组-0.75mm:小鼠注射实施例1制备的水溶性金属富勒烯gf配制的0.75mm溶液150μl。小鼠出生后第6周开始给药,每天给药一次,持续16天。
治疗组-1.5mm:小鼠注射实施例1制备的水溶性金属富勒烯gf配制的1.5mm溶液150μl。小鼠出生后第6周开始给药,每天给药一次,持续16天。
(2)治疗效果
在给药治疗期间的第1、4、7、10、13和16天测量各组小鼠的体重,绘制各组小鼠体重变化曲线;并计算整个治疗期间各组小鼠体重的增加。
给药治疗结束后取小鼠皮下脂肪、肾周脂肪和生殖腺脂肪,统计脂肪含量来验证水溶性金属富勒烯gf对肥胖症的治疗作用。
1)各组小鼠体重变化
如图4所示,进行治疗的过程中,ob/ob小鼠的体重增加受到抑制,且受抑制的程度与给药浓度成正相关,其中治疗组-1.5mm从第7天起体重与模型组体重有显著性差异,并保持到治疗结束,而治疗组-0.375mm则没有明显效果,治疗组-0.75mm则介于高低两组之间。不患有肥胖症的空白小鼠腹腔注射1.5mm水溶性金属富勒烯gf生理盐水溶液后体重较仅注射生理盐水的有轻微的下降,但未出现显著性差异。
2)各组小鼠体重增加
如图5所示治疗从开始到结束后小鼠的体重增加质量(#和##表示与空白组有显著性差异,*和**表示与模型组有显著性差异,即模型组与空白组有显著性差异,治疗组与模型组有显著性差异),模型组ob/ob小鼠体重相对于空白组无肥胖症的健康小鼠的体重增加显著,但是进行治疗后,体重增加量明显减少,且与给药浓度呈负相关。
3)小鼠取材后各种脂肪含量统计
如图6所示取材后对主要的脂肪组织(肾周脂肪、皮下脂肪和生殖腺脂肪)质量进行统计(#和##表示与空白组有显著性差异,*和**表示与模型组有显著性差异),模型组中的ob/ob肥胖症小鼠体内这三种脂肪的含量相对于正常小鼠增加了7-10倍,治疗后,体内脂肪含量均有下降,其中肾周脂肪改善不明显,皮下脂肪和生殖腺脂肪在体内占比下降较为明显。
上述结果可以说明腹腔注射水溶性金属富勒烯gf的生理盐水溶液后,ob/ob小鼠的肥胖症状得到改善,体内的脂肪含量降低。。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!