辣木籽总酚苷及其在制备药物及保健品中的应用的制作方法
一、技术领域
本发明涉及辣木总酚苷的新用途,具体来说是在制备抗抑郁、抗焦虑、抗老年痴呆症、抗酒精性化学肝损伤、抗炎以及预防治疗糖尿病以及头痛药物及保健品中的应用。
二、背景资料
辣木籽为辣木科辣木属植物辣木moringaoleiferalam.的干燥成熟种子(中国植物志,1984:34(1):006)。原产于热带、南亚热带的干旱和半干旱地区,现广泛分布于非洲、阿拉伯、东南亚、太平洋岛屿等热带海洋气候区(anwarf,etal.phytotherres,2007,21(1):17-25)。上世纪60年代初中国在云南景洪引种,1998年后在海南和云南大面积种植(董小英等.广东饲料,2008,17(9):39-41.)。辣木为多用途速生乔木,种植6个月后即可以开花结果,其根、茎、叶、花和种子均可药用。辣木籽中的主要化学成分为酚类及其苷、黄酮及其苷、甾醇及其苷,以及多糖、氨基酸和维生素等。其中,酚类及其苷为其特征性化学成分,主要是1,4-二取代苯环的一侧酚羟基与糖连接成酚苷,而糖主要为鼠李糖及其衍生物,还有少量化合物为葡萄糖苷;而苯环的另一侧则主要为氨甲基以及氨甲基的取代产物(mangurolo,etal.natprodres,2007,21(1):56-58;shaheenf,etal.jnatprod,1994,57(9):1256-1261)。
现代药理研究表明辣木籽具有降血压、降血脂、调节血糖、抗肿瘤以及抗氧化等功能(rajanandhmg,etal.intjpharmtechres,2010,2(2):1409-1414)。例如,辣木籽可显著降低糖尿病大鼠血糖水平,并明显改善其认知功能障碍和神经元损伤,提示辣木籽对大鼠糖尿病脑病具有保护作用(刘冰等.长春中医药大学学报,2010(2):179-180)。此外,辣木籽还可使血清酶(got,gpt,ggt及alp)和胆红素水平显著恢复正常,表明其对四氯化碳诱导的脂质过氧化和肝损伤具有保护作用(al-saidms,etal.jfoodsci,2012,77(7):124-130)。辣木籽的醇提物和氯仿提取物对乙酸诱发的结肠炎大鼠有抗炎作用,两者都可有效地减少结肠溃疡的严重程度和面积以及缓解黏膜炎严重程度和范围(minaiyanm,etal.avicennajphytomed.2014,4(2):127-136)。辣木籽水提物可通过减少小鼠巨噬细胞中no、tnf-a和il-1β的释放,从而发挥抗炎作用。此外,辣木籽水提物还可减少角叉菜胶诱导的小鼠胸膜炎的白细胞移动,降低白细胞数量,同时减少了过氧化物酶的活性,显示出良好的抗炎活性(araújolc,etal.plosone,2013,8(12):1-15)。然而,上述药理活性均是针对辣木籽的水提物或醇提物的研究,目前,尚未见有关辣木籽总酚苷在制备抗抑郁、抗焦虑、抗老年痴呆症、治疗酒精性化学肝损伤、抗炎以及预防治疗糖尿病和头痛药物及保健品中应用的公开报道。
三、
技术实现要素:
本发明涉及一种辣木籽总酚苷,其主要成分辣木酚苷a-辣木酚苷k的含量之和大于60%,以及在制备抗抑郁、抗焦虑、抗老年痴呆症、治疗酒精性化学肝损伤、抗炎以及预防治疗糖尿病和头痛药物及保健品中的应用。
本发明的辣木籽总酚苷,该总酚苷主要包含以下成分:
本发明的总酚苷还包含以下成分中的一种或多种:
优选进一步包含辣木酚苷b、c和d,或者优选辣木酚苷e、f和j,或者优选辣木酚苷b、c、f和j,或者优选辣木酚苷b、c、d、e、f和j。
本发明的总酚苷含量大于50%,优选大于60%,或者优选60-90%,或者优选60-80%。
本发明总酚苷主要包含辣木酚苷a、b、c、d、e、f、g、h、i、j和k共11种主要成分。
以辣木籽总酚苷总重量为基准,其中辣木酚苷a-辣木酚苷k的含量之和大于50%,优选大于60%,或者优选50-90%,或者优选60-80%,或者优选60%-70%,或者优选65%。
本发明的辣木籽总酚苷,以辣木总酚苷总重量为基准,其中辣木酚苷k、辣木酚苷g、辣木酚苷h和辣木酚苷i的含量之和为40-70%,优选45-60%,或者优选50-55%。
本发明辣木籽总酚苷中辣木酚苷k含量为15-30%,优选15-25%,更优选18-22%;其中辣木酚苷g含量为5-15%,优选6-10%;其中辣木酚苷h含量为10-20%,优选12-18%;其中辣木酚苷i含量为7-15%,优选8-12%;
本发明辣木籽总酚苷中辣木酚苷a含量为1-4%,优选2-3%;其中辣木酚苷b含量为0.5-2%;其中辣木酚苷c含量为0.5-2%;其中辣木酚苷d含量为1-5%,优选2-4%;其中辣木酚苷e含量为1-5%,优选2-4%;其中辣木酚苷f含量为1-5%,优选2-4%;其中辣木酚苷j含量为1-5%,优选1-3%。
本发明还提供辣木籽总酚苷的制药以及保健品用途,辣木籽总酚苷可用于在制备治疗或预防抑郁症药物及保健品中的应用。
本发明辣木籽总酚苷可用于在制备治疗或预防焦虑症药物及保健品中的应用。
本发明辣木籽总酚苷可用于在制备治疗或预防老年痴呆症药物及保健品中的应用。
本发明辣木籽总酚苷可用于在制备治疗或预防酒精性化学肝损伤药物及保健品中的应用。
本发明辣木籽总酚苷可用于在制备抗炎药物及保健品中的应用。
本发明辣木籽总酚苷可用于在制备预防治疗糖尿病药物以及保健品中的应用。
本发明辣木籽总酚苷可用于在制备预防治疗头痛药物以及保健品中的应用,所述头痛优选为偏头痛,同时本发明能抑制降钙素基因相关肽(cgrp)的产生,能够抑制p物质(sp)的产生,调节(促进)5-羟色胺(5-ht)的产生。由此本发明能进一步用于在制备改善脑或者血管(心血管或者脑血管)功能障碍药物以及保健品中的应用。本发明辣木籽总酚苷还可以进一步加入常规的辅料,制成常规的剂型如煎膏剂、硬胶囊剂、软膏剂、片剂、颗粒剂、丸剂、口服液、糖浆剂、散剂、丹剂、混悬剂、溶液剂、注射液、冻干粉针、大容量注射剂、栓剂、硬膏剂、霜剂、喷雾剂或贴剂。
本发明的辣木籽总酚苷可采用多种方法制备获得,比如将辣木籽经醇溶液提取后,再用乙醚、氯仿、丙酮、正丁醇、石油醚等有机溶剂中的一种或多种混合有机溶剂多次萃取制得;或者将辣木籽醇溶液提取后,提取液用大孔吸附树脂吸附,再依次用水、低浓度乙醇溶液(10-30%乙醇溶液)洗脱后,再用高浓度乙醇溶液(60-90%乙醇溶液)洗脱,收集高浓度乙醇溶液浓缩干燥制得;或者将辣木籽醇溶液提取后,提取液用聚酰胺树脂柱吸附,再依次用水、低浓度乙醇溶液(10-30%乙醇溶液)洗脱后,再用高浓度乙醇溶液(60-90%乙醇溶液)洗脱,收集高浓度乙醇溶液浓缩干燥制得;或者将辣木籽醇溶液提取后,提取液用mci柱层析吸附,再依次用水、低浓度乙醇溶液(10-30%乙醇溶液)洗脱后,再用高浓度乙醇溶液(60-90%乙醇溶液)洗脱,收集高浓度乙醇溶液浓缩干燥制得。所述醇溶液为乙醇、甲醇水溶液。
本发明的目的是由以下技术方案实现的:
1.辣木籽总酚苷成分鉴别
本发明的辣木籽总酚苷运用硅胶、sephadexlh-20、ods色谱以及制备型hplc等方法分离,并利用hr-esims、nmr等方法鉴定其结构,辣木籽总酚苷内含有的主要成分为辣木酚苷a(1-o-(4-hydroxymethylphenyl)-α-l-rhamnopyranoside)、辣木酚苷b(moringinthiourea)、辣木酚苷c(niazirin)、辣木酚苷d(p-hydroxybenzaldehyde-o-α-l-rhamnopyranoside)、辣木酚苷e(methyl-2-[4-(α-l-rhamnpyranosyl)phenyl]-acetate)、辣木酚苷f(pyrrolemarumine4″-o-α-l-rhamnopyranoside)、辣木酚苷g(ethyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate)、辣木酚苷h(niazimicin)、辣木酚苷i(methyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate)、辣木酚苷j(n-{4-[(α-l-rhamnosyloxy)benzyl]methyl}-carbamide)和辣木酚苷k(glucomoringin)以及其它少量的酚苷类化合物。经hplc-dad检测,分离出的辣木酚苷a~辣木酚苷k的纯度均大于98%。
2.酚苷类化合物的结构鉴定
(1)辣木酚苷a(n-{4-[(α-l-rhamnosyloxy)benzyl]methyl}-carbamide):黄色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:357[m+hcoo]-。1h-nmr(cd3od)δ:7.40(2h,d,j=8.5hz,h-2,h-6),7.12(1h,d,j=8.5hz,h-3,h-5),5.49(1h,d,j=2.0hz,h-1),4.70(2h,brs,h-7),4.18(1h,m,h-2),3.98(1h,dd,j=9.5,3.0hz,h-3),3.75(1h,m,h-5),3.48(1h,t,j=9.5hz,h-4),1.21(3h,d,j=6.5hz,h-6)。13c-nmr(cd3od)δ:160.9(c-8),154.3(c-4),133.3(c-1),128.3(c-2和c-6),117.3(c-3和c-5),98.3(c-1),72.0(c-4),70.1(c-3),70.0(c-2),69.4(c-5),42.2(c-7),18.0(c-6)。
根据以上光谱数据鉴定辣木酚苷a为一新化合物并命名为n-{4-[(α-l-rhamnosyloxy)benzyl]methyl}-carbamide。
(2)辣木酚苷b(moringinthiourea):黄色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:373[m+hcoo]-。1h-nmr(dmso-d6)δ:7.32(2h,d,j=8.5hz,h-2和h-6),7.08(1h,d,j=8.5hz,h-3和h-5),5.50(1h,d,j=1.5hz,h-1),4.53(2h,s,h-7),4.12(1h,m,h-2),3.97(1h,dd,j=9.5,3.5hz,h-3),3.75(1h,m,h-5),3.49(1h,t,j=9.5hz,h-4),1.19(3h,d,j=6.5hz,h-6)。13c-nmr(dmso-d6)δ:183.3(c-8),155.1(c-4),132.6(c-1),128.8(c-2和c-6),116.4(c-3和c-5),98.4(c-1),71.8(c-4),70.5(c-3),70.2(c-2),69.5(c-5),46.9(c-7),18.0(c-6)。
以上光谱数据与文献(nielsa,etal.phytochemistry,2015,118:109-115)报道一致且该化合物为新天然产物,故鉴定辣木酚苷b为moringinthiourea。
(3)辣木酚苷c(niazirin):黄色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:324[m+hcoo]-。1h-nmr(cd3od)δ:7.21(2h,d,j=8.5hz,h-2和h-6),7.00(1h,d,j=8.5hz,h-3和h-5),5.35(1h,d,j=1.5hz,h-1),3.92(1h,m,h-2),3.77(1h,dd,j=9.5,3.5hz,h-3),3.75(2h,s,h-7),3.54(1h,m,h-5),3.38(1h,t,j=9.5hz,h-4),1.19(3h,d,j=6.5hz,h-6)。13c-nmr(cd3od)δ:157.4(c-4),130.3(c-1),125.7(c-2和c-6),119.8(c-8),118.0(c-3和c-5),99.8(c-1),73.7(c-4),72.2(c-3),71.9(c-2),70.7(c-5),22.7(c-7),18.0(c-6)。
以上光谱数据与文献(faizis,etal.jnatprod,1994,57(9):1256-1261)报道一致,故鉴定辣木酚苷c为niazirin。
(4)辣木酚苷d(p-hydroxybenzaldehyde-o-α-l-rhamnopyranoside):黄色无定型粉末,
化学结构式为:
光谱数据如下:esi-msm/z:313[m+hcoo]-。1h-nmr(d2o)δ:9.78(1h,s,h-7),7.92(2h,d,j=8.5hz,h-2和h-6),7.25(1h,d,j=8.5hz,h-3和h-5),5.69(1h,d,j=1.5hz,h-1),4.17(1h,m,h-2),4.00(1h,dd,j=9.5,3.5hz,h-3),3.70(1h,m,h-5),3.52(1h,t,j=9.5hz,h-4),1.21(3h,d,j=6.5hz,h-6)。13c-nmr(d2o)δ:196.6(c-7),162.6(c-4),134.1(c-1),132.0(c-2和c-6),118.4(c-3和c-5),99.0(c-1),73.4(c-4),71.6(c-3),71.3(c-2),71.2(c-5),18.2(c-6)。
以上光谱数据与文献(michaell,etal.carbohydres,1998,312(1):33-44)报道一致,故鉴定辣木酚苷d为p-hydroxybenzaldehyde-o-α-l-rhamnopyranoside。
(5)辣木酚苷e(methyl-2-[4-(α-l-rhamnpyranosyl)phenyl]-acetate):棕色膏状物,化学结构式为:
光谱数据如下:esi-msm/z:357[m+hcoo]-。1h-nmr(cd3od)δ:7.18(2h,d,j=8.5hz,h-2和h-6),6.99(1h,d,j=8.5hz,h-3和h-5),5.39(1h,d,j=2.5hz,h-1),3.98(1h,m,h-2),3.82(1h,dd,j=9.5,3.5hz,h-3),3.69(3h,s,h-9),3.62(1h,m,h-5),3.58(2h,s,h-7),3.44(1h,t,j=9.5hz,h-4),1.21(3h,d,j=6.5hz,h-6)。13c-nmr(cd3od)δ:174.2(c-8),156.9(c-4),131.4(c-1),129.3(c-2和c-6),117.5(c-3和c-5),99.8(c-1),73.7(c-4),72.2(c-3),71.9(c-2),70.7(c-5),52.4(c-9),40.8(c-7),18.0(c-6)。
以上光谱数据与文献(francisja,etal.helvchimacta,2004,87(2):317-326)报道一致,故鉴定辣木酚苷e为methyl-2-[4-(α-l-rhamnpyranosyl)phenyl]-acetate。
(6)辣木酚苷f(pyrrolemarumine4″-o-α-l-rhamnopyranoside):白色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:422[m+hcoo]-。1h-nmr(cd3od)δ:9.36(1h,s,h-13),7.89(4h,m,h-2,h-3,h-5,h-6),6.96(1h,d,j=4.0hz,h-10),6.24(1h,d,j=4.0hz,h-11),5.58(2h,s,h-7),5.29(1h,d,j=2.0hz,h-1),4.44(2h,s,h-14),3.87(1h,m,h-2),3.73(1h,dd,j=9.0,3.0hz,h-3),3.51(1h,m,h-5),3.32(1h,t,j=9.0hz,h-4),1.12(3h,d,j=6.5hz,h-6)。13c-nmr(cd3od)δ:181.2(c-13),157.1(c-4),145.1(c-12),133.7(c-9),133.1(c-1),128.6(c-2和c-6),125.2(c-10),117.6(c-3和c-5),111.6(c-11),99.9(c-1),73.8(c-4),72.2(c-3),72.0(c-2),70.6(c-5),18.0(c-6)。
以上光谱数据与文献(sahakitpichanp,etal.phytochemistry,2011,72(8):791-795)报道一致,故鉴定辣木酚苷f为pyrrolemarumine4″-o-α-l-rhamnopyranoside。
(7)辣木酚苷g(ethyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate):白色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:386[m+hcoo]-。1h-nmr(dmso-d6)δ:7.18(2h,d,j=8.5hz,h-2和h-6),6.96(1h,d,j=8.5hz,h-3和h-5),5.31(1h,d,j=2.0hz,h-1),4.54(2h,s,h-7),3.98(2h,q,j=7.1hz,h-10),3.89(1h,m,h-2),3.74(1h,dd,j=9.5,3.5hz,h-3),3.58(2h,s,h-7),3.52(1h,m,h-5),3.35(1h,t,j=9.5hz,h-4),1.12(3h,d,j=6.0hz,h-6),1.15(3h,d,j=7.1hz,h-11)。13c-nmr(dmso-d6)δ:156.5(c-9),156.4(c-4),133.3(c-1),128.4(c-2和c-6),116.4(c-3和c-5),98.4(c-1),71.8(c-4),70.5(c-3),70.3(c-2),69.5(c-5),59.8(c-10),43.2(c-7),18.0(c-6),14.8(c-11)。
以上光谱数据与文献(ameliap,etal.mutationresearch,1999,440(2):181-188)报道一致,故鉴定辣木酚苷g为ethyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate。
(8)辣木酚苷h(niazimicin):白色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:356[m-h]-。1h-nmr(cd3od)δ:7.16(2h,d,j=8.5hz,h-2和h-6),6.92(1h,d,j=8.5hz,h-3和h-5),5.31(1h,d,j=2.0hz,h-1),4.54(2h,s,h-7),4.37(2h,q,j=7.0hz,h-10),3.89(1h,m,h-2),3.74(1h,dd,j=9.5,3.5hz,h-3),3.58(2h,s,h-7),3.52(1h,m,h-5),3.35(1h,t,j=9.5hz,h-4),1.20(3h,d,j=7.0hz,h-11),1.12(3h,d,j=6.0hz,h-6)。13c-nmr(cd3od)δ:192.3(c-9),157.1(c-4),133.1(c-1),130.1(c-2和c-6),117.5(c-3和c-5),99.9(c-1),73.8(c-4),72.2(c-3),72.1(c-2),70.6(c-5),66.9(c-10),43.2(c-7),18.0(c-6),14.6(c-11)。
以上光谱数据与文献(faizis,etal.phytochemistry,1995,38(4):957-963)报道一致,故鉴定辣木酚苷h为niazimicin。
(9)辣木酚苷i(methyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate):黄色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:372[m+hcoo]-。1h-nmr(d2o)δ:7.40(2h,d,j=8.5hz,h-2和h-6),7.12(1h,d,j=8.5hz,h-3和h-5),5.49(1h,d,j=2.0hz,h-1),4.34(2h,q,j=7.1hz,h-10),4.13(1h,m,h-2),4.12(2h,s,h-7),3.98(1h,dd,j=9.5,3.5hz,h-3),3.75(1h,m,h-5),3.58(2h,s,h-7),3.48(1h,t,j=9.5hz,h-4),1.21(3h,d,j=6.0hz,h-6)。13c-nmr(d2o)δ:157.4(c-9),156.2(c-4),132.2(c-1),130.9(c-2和c-6),119.0(c-3和c-5),99.5(c-1),73.5(c-4),71.2(c-3),70.9(c-2),70.0(c-5),50.4(c-10),44.1(c-7),18.2(c-6)。以上光谱数据与文献(sahakitpichanp,etal.phytochemistry,2011,72(8):791-795)报道一致,故鉴定辣木酚苷i为methyl-4-(α-l-rhamnosyloxy-benzyl)-carbamate。
(10)辣木酚苷j(1-o-(4-hydroxymethylphenyl)-α-l-rhamnopyranoside):黄色无定型粉末,化学结构式为:
光谱数据如下:esi-msm/z:315[m+hcoo]-。1h-nmr(d2o)δ:7.32(2h,d,j=8.5hz,h-2和h-6),7.08(1h,d,j=8.5hz,h-3和h-5),5.50(1h,d,j=1.5hz,h-1),4.54(2h,s,h-7),4.12(1h,m,h-2),3.97(1h,dd,j=9.5,3.5hz,h-3),3.75(1h,m,h-5),3.49(1h,t,j=9.5hz,h-4),1.19(3h,d,j=6.5hz,h-6)。13c-nmr(d2o)δ:156.4(c-4),136.4(c-1),130.8(c-2和c-6),118.8(c-3,和c-5),99.7(c-1),73.6(c-4),71.7(c-3),71.6(c-2),71.0(c-5),64.9(c-7),18.2(c-6)。以上光谱数据与文献(faizis,etal.jnatprod,1994,57(9):1256-1261)报道一致,故鉴定辣木酚苷j为1-o-(4-hydroxymethylphenyl)-α-l-rhamnopyranoside。
(11)辣木酚苷k(glucomoringin):黄色无定型粉末,化学结构式为:
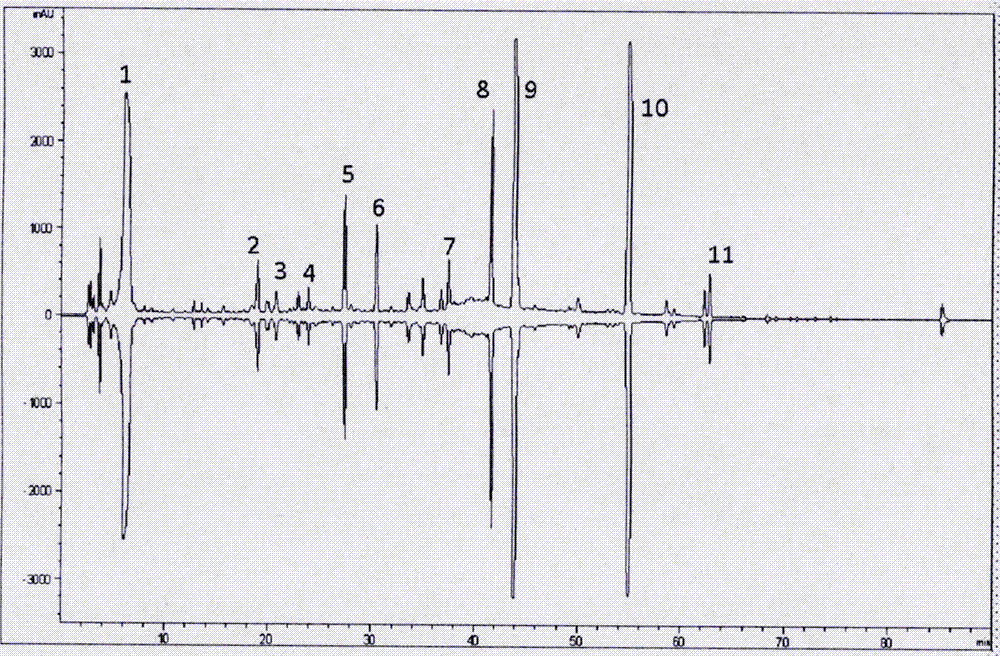
光谱数据如下:esi-msm/z:570[m-k]-。1h-nmr(d2o)δ:7.41(2h,d,j=8.4hz,h-2和h-6),7.20(1h,d,j=8.4hz,h-3和h-5),5.60(1h,brs,h-1),4.74(1h,m,h-1),4.20(1h,s,h-7),4.12(1h,m,h-2),3.97(1h,dd,j=9.5,3.5hz,h-2),3.75(1h,m,h-5),3.64(2h,m,h-6),3.49(1h,t,j=9.5hz,h-4),3.32-3.48(4h,m,h-2-h-5),1.19(3h,d,j=6.5hz,h-6)。13c-nmr(d2o)δ:164.3(c-8),156.3(c-4),130.9(c-1),130.9(c-2和c-6),119.1(c-3和c-5),99.6(c-1),82.9(c-1),81.4(c-5),78.5(c-2),73.5(c-4),73.3(c-2),71.6(c-3),71.5(c-2),70.9(c-5),70.3(c-4),61.8(c-6),39.1(c-7),18.2(c-6)。以上光谱数据与文献(gueyrardd,etal.tetrahedronlett,2000,41(43):8307-8309)报道一致,故鉴定辣木酚苷k为glucomoringin。根据附图2中各物质出峰,测定结果如下:
峰1:辣木酚苷k的保留时间为5.9分钟,外标法测得其含量为20.1%;
峰2:辣木酚苷a的保留时间为20.8分钟,外标法测得其含量为2.3%;
峰3:辣木酚苷b的保留时间为22.9分钟,外标法测得其含量为1.2%;
峰4:辣木酚苷c的保留时间为23.9分钟,外标法测得其含量为1.1%;
峰5:辣木酚苷d的保留时间为27.4分钟,外标法测得其含量为3.1%;
峰6:辣木酚苷f的保留时间为30.5分钟,外标法测得其含量为2.9%;
峰7:辣木酚苷e的保留时间为37.5分钟,外标法测得其含量为2.6%;
峰8:辣木酚苷g的保留时间为41.7分钟,外标法测得其含量为8.3%;
峰9:辣木酚苷h的保留时间为43.9分钟,外标法测得其含量为15.6%;
峰10辣木酚苷i的保留时间为55.0分钟,外标法测得其含量为9.7%;
峰11:辣木酚苷j的保留时间为62.8分钟,外标法测得其含量为1.8%。
以上总酚苷经hplc-dad分析,以辣木酚苷a~辣木酚苷k为标准品,通过外标法,测得总酚苷中辣木酚苷a、辣木酚苷b、辣木酚苷c、辣木酚苷d、辣木酚苷e、辣木酚苷f、辣木酚苷g、辣木酚苷h、辣木酚苷i、辣木酚苷j和辣木酚苷k的含量之和大于60%。
经动物实验表明,本发明的辣木籽总酚苷具有抗抑郁、抗焦虑、抗老年痴呆症、预防或治疗酒精性化学肝损伤以及抗炎活性,可应用于抗抑郁、抗焦虑、抗老年痴呆症、预防或治疗酒精性化学肝损伤和抗炎药物及保健品中。
辣木籽总酚苷可以直接使用或者以药物组合物的形式使用。该药物组合物中含有1%-99%本发明中的辣木籽总酚苷,其余为药物学上可接受的对人体无毒的可药用载体及赋形剂。所用的载体及赋形剂是一种或多种固体、半固体和液体稀释剂、填料以及药物制品辅剂。辣木籽总酚苷采用制药领域公认的方法制备成各种剂型、如液体制剂(混悬剂、糖浆剂、口服液剂或注射剂等)、固体制剂(片剂、胶囊剂或颗粒剂等)、喷剂等。上述药物可经口服、舌下或注射(静脉注射、肌肉注射或皮下注射等)给药等途径给药。
(1)辣木籽总酚苷口服液制剂:5-20重量份的辣木籽总酚苷,加100-200重量份水混悬,加入辅料为0.3-0.8重量份矫味剂,如甜菊素、蔗糖、蜂蜜中的一种或多种,,0.2-0.5重量份的抑菌剂剂,如选自苯甲酸钠、羟苯甲酯钠、山梨酸钾中的一种或多种。搅匀,灌装,灭菌。
(2)辣木籽总酚苷胶囊剂:5-50重量份辣木籽总酚苷,胶囊壳为常规胶囊壳,或选择以明胶、羟丙基甲基纤维素、海藻多糖、果胶等为主要成分制成的胶囊壳;稀释剂,如选用淀粉、糊精、羧甲基淀粉、改良性预胶化淀粉、乳糖、磷酸钙、碳酸钙等或其组合,50-200重量份;润滑剂,如选用硬脂酸镁、硬脂酸、聚乙二醇、硬脂酸钙等或其组合,0.5-5重量份;助流剂,如选用滑石粉、二氧化硅、微粉硅胶等或其组合,0.3-3重量份。混合,制粒,干燥,整粒,加入润滑剂,混合均匀,装胶囊壳即得。
(3)辣木籽总酚苷颗粒剂:5-20重量份辣木籽总酚苷,填充剂,如选用淀粉、乳糖、糊精、蔗糖、微晶纤维素等或其组合,35-70重量份;粘合剂,如选用羟丙基甲基纤维素、淀粉浆、预胶化淀粉、羧甲基纤维素钠等或其组合,1-5重量份;润湿剂,如选用蒸馏水、乙醇等或其组合,1-10重量份;崩解剂,如选用淀粉、微晶纤维素、交联羧甲基纤维素钠等或其组合,10-20重量份;润滑剂,如选用硬脂酸、硬脂酸镁、滑石粉、微粉硅胶等或其组合,2-10重量份。将上述混合后制软材,制粒,干燥,整粒。
(4)辣木籽总酚苷片剂:5-10重量份辣木籽总酚苷;填充剂,如选用淀粉、乳糖、糊精、蔗糖、可压性等或其组合,35-70重量份;粘合剂,如选用羟丙基甲基纤维素、淀粉浆、交联聚维酮、羧甲基纤维素钠等或其组合,1-15重量份;崩解剂,如选用淀粉、羧甲基淀粉钠、交联聚乙烯吡咯酮等或其组合,10-20重量份;润滑剂,如选用硬脂酸、硬脂酸镁、滑石粉、微粉硅胶等或其组合,0.5-10重量份。混合,干燥,压片即得。
(5)辣木籽总酚苷注射液制剂:5-50重量份辣木籽总酚苷,加100-200重量份注射用水制成注射液,上述注射液还可以进一步包括以下附加剂:8重量份的磷酸-磷酸氢二钠缓冲剂,1-3重量份的碳酸氢钠、碳酸钠、醋酸钠中的一种或多种作为ph调节剂,0.1-0.3重量份的枸橼酸钠,0.1-0.3重量份的丙二醇硬脂酸酯,0.1-0.3重量份的麦芽糖醇,1-3重量份的甲壳糖。经0.22μm微孔滤膜过滤,121℃灭菌35分钟,得注射剂。
本发明的优点是:本发明的总酚苷类化合物具有抗抑郁、抗焦虑、抗老年痴呆、预防或治疗酒精性化学肝损伤、抗炎等药理活性;本发明的制备方法便捷、成本低廉,且易于实施,弥补了现有技术的不足,为辣木在医药和保健品方面的开发利用提供了广阔的前景。
附图说明:
图1为辣木酚苷a~辣木酚苷k指纹图谱
图2为辣木酚苷a~辣木酚苷k指纹图谱及含量测定
图3为辣木籽总酚苷对抑郁大鼠脑内皮质酮水平的影响(x±s,n=10)
图4为辣木籽总酚苷对抑郁大鼠海马中bdnf蛋白表达的影响(x±s,n=10)
图5辣木酚苷a的esi-ms图
图6辣木酚苷a的核磁共振氢谱
图7辣木酚苷a的核磁共振碳谱
四、具体实施方式
以下实施例是为了更好的阐明本发明内容,但本发明的内容不限定于此。
实施例1:辣木籽总酚苷的制备
取辣木籽5kg粉碎,加10倍重量30%乙醇渗滤提取两次,合并提取液,浓缩,过滤,滤液上d101大孔树脂柱吸附,依次用水及10%乙醇洗脱除去杂质,再用85%乙醇80l洗脱,回收85%乙醇洗脱液,浓缩,减压干燥,得辣木籽总酚苷303g。经hplc-dad检测,其中辣木籽总酚的含量为72.1%。
实施例2:辣木籽总酚苷的制备
取辣木籽5kg粉碎,加10倍重量30%乙醇渗滤提取两次,合并提取液,浓缩,过滤,滤液上hp-20大孔树脂柱吸附,依次用水及10%乙醇洗脱除去杂质,再用85%乙醇80l洗脱,回收85%乙醇洗脱液,浓缩,减压干燥,得辣木籽总酚苷312g。经hplc-dad检测,其中辣木籽总酚的含量为73.0%。
实施例3:辣木籽总酚苷的制备
取辣木籽10kg粉碎,加10倍重量50%乙醇回流提取两次,合并提取液,浓缩,过滤,滤液上聚酰胺树脂柱吸附,依次用水及15%乙醇洗脱除去杂质,再75%乙醇85l洗脱,回收75%乙醇洗脱液,浓缩,减压干燥,得辣木籽总酚苷706g。经hplc-dad检测,其中辣木籽总酚苷的含量为66.3%。
实施例4:辣木籽总酚苷的制备
取辣木籽10kg粉碎,加10倍量乙醇浸渍提取两次,合并提取液,浓缩,过滤,滤液上mci柱层析,依次用水及10%乙醇洗脱除去杂质,再85%乙醇85l洗脱,回收85%乙醇洗脱液,浓缩,减压干燥,得辣木籽总酚苷623g。经hplc-dad检测,其中辣木籽总酚苷的含量为68.8%。
实施例5:辣木籽总酚苷口服液制剂
10重量份辣木籽总酚苷,加100重量份注射用水,搅拌均匀;加入辅料为0.5%的甜菊素,0.3%的苯甲酸钠;搅匀,灌装,灭菌。
实施例6:辣木籽总酚苷胶囊剂
10重量份辣木籽总酚苷;20重量份微晶纤维素;80重量份淀粉;40重量份改良性预胶化淀粉;混合,制粒,干燥,整粒,1.2重量份润滑剂;1重量份助流剂滑石粉,混合均匀,装胶囊壳,即得胶囊剂。
实施例7:辣木籽总酚苷颗粒剂
5重量份辣木籽总酚苷;70重量份填充剂淀粉;2重量份粘合剂羟丙基甲基纤维素;2重量份润湿剂蒸馏水;10重量份崩解剂淀粉;3重量份润滑剂硬脂酸混合后制软材,制粒,干燥,整粒。
实施例8:辣木籽总酚苷片剂
10重量份辣木籽总酚苷,40重量份填充剂淀粉,3重量份粘合剂淀粉浆,15重量份崩解剂交联聚乙烯吡咯酮,1重量份润滑剂硬脂酸,混合,干燥,压片即得。
实施例9:辣木籽总酚苷注射液制剂
5重量份辣木籽总酚苷,加100重量份注射用水,搅拌均匀;继续加3重量份的磷酸-磷酸氢二钠缓冲剂,0.1重量份的枸橼酸钠,0.1重量份的丙二醇硬脂酸酯,0.1重量份的麦芽糖醇,1重量份的甲壳糖。不断搅拌,使完全溶解;加入碳酸氢钠ph调节剂,搅拌20分钟;经0.22μm微孔滤膜过滤,121℃灭菌35分钟,得注射剂。
实施例10:辣木籽总酚苷抗抑郁活性
(1)动物给药
适应性饲养一周后,参考体重及open-field评分,将70只大鼠随机分为7组:(1)空白组(10只):按10ml/kg给予0.9%生理盐水灌胃,1次/日,从第22天始,连续21天。(2)模型组(10只):按10ml/kg给予0.9%生理盐水灌胃,1次/日,从第22天开始,连续21天。(3)氟西汀组(10只):给予1.8mg/kg(0.09mg/ml)氟西汀混悬液灌胃,1次/日,从第22天开始,连续21天。(4)辣木籽总酚苷低剂量组(10只):给予浓度为250mg/kg的辣木籽总酚苷灌胃,1次/日,从第22天始,连续21天。(5)辣木籽总酚苷中剂量组(10只):给予浓度为500mg/kg的辣木籽总酚苷灌胃,1次/日,从第22天始,连续21天。(6)辣木籽总酚苷高剂量组(10只):给予浓度为1000mg/kg的辣木籽总酚苷灌胃,1次/日,从第22天始,连续21天。(7)辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。(8)辣木籽总提物组(10只):给予浓度为1000mg/kg的辣木籽总提物灌胃,1次/日,从第22天始,连续21天。
(2)动物造模
空白组每笼饲养10只,在实验中不接受任何刺激。其余各组每笼一只,在实验的21天内,接受7种不同的刺激,每口安排一种且同种刺激不连续出现。7种刺激分别为:1.夹尾:将大鼠放入固定笼中,露出尾巴,用止血钳夹住距尾根部1cm处,持续1min;2.冰水游泳:将大鼠放入盛有4℃冷水(冰水混合)的桶中,水深15cm,大鼠的足尖刚能触及桶底,5min后将大鼠取出。3.倾斜鼠笼:早上8点,将鼠笼倾斜30度,至次日早8点将鼠笼恢复原位。4.潮湿饲养:早上8点,往鼠笼中加入200ml水,至次日早8点换掉。5.昼夜颠倒:晚上8点打开灯照明,持续照明36h,至第3日早8点将灯关闭。6.禁水:断水24h。7.禁食:断食24h。
(3)大鼠体重的测量
实验过程中每周称量一次大鼠体重,观察各组大鼠体重变化情况。
(4)大鼠行为学观察
自实验开始的第0天、第21天和第42天,于大鼠测完体重后用open-field法(敞箱实验)进行检测。其检测箱为一个长1m、宽1m、高0.5m的木箱,底部有25个20cm×20cm的小方格。水平运动得分以大鼠四肢共同处于一个方格内为标准,计1分;垂直运动得分以前肢抬起、后肢直立为标准,计1分。检测时将大鼠放置于箱子中心,分别统计3min内大鼠水平和垂直运动得分。
(5)液体消耗实验
实验前先训练动物适应含糖饮水,每笼同时给予2个小瓶,第一个24小时,两个瓶内均装有1%蔗糖水,随后24小时,一个瓶装1%蔗糖水,一个瓶装纯水。24小时禁食禁水后,进行动物的基础糖水/纯水消耗实验。同时给予每只大鼠称重过的两瓶水,一瓶为1%庶糖,一瓶为纯水。60分种后,取走两瓶并称重。计算动物的总液体消耗、糖水消耗、纯水消耗,糖水偏爱(糖水偏爱=糖水消耗/总液体消耗×100%)。自实验开始的第0天、第21天和第42天各进行一次液体消耗实验。
(6)大鼠脑内crh含量的测定
在实验第42天,将大鼠处死,迅速分离大鼠全脑,去除小脑及脑干后匀浆,43000rpm离心10min,放置-2℃冰箱保存,采用酶联免疫法(elisa)测定大鼠脑内促肾上腺皮质激素释放激素(corticotropinreleasinghormone,crh,也叫皮质酮)、bdnf的含量。
(7)westernblot法检测bdnf蛋白表达
大鼠断头后在冰上取海马组织,置-80℃保存备用。大鼠海马组织总蛋白提取按总蛋白提取试剂盒说明书操作,考马斯亮蓝法测定蛋白的量。取总蛋白50μg,在sds-page凝胶上电泳分离2h,将凝胶湿转至pvdf膜。取出pvdf膜,浸于封闭液中,室温轻摇封闭1h,用tbst(100mmol/ltris-hcl、150mmol/lnacl、0.05%聚山梨酯20)缓冲液漂洗干净,浸入tbst稀释的一抗(兔抗人bdnf抗体1∶2000;山羊抗人β-actin抗体,1∶2000),室温下孵育1-2h,在tbst脱色摇床上室温下洗2次,每次10min;再用tbs(100mmol/ltris-hcl、150mmol/lnacl)洗1次,10min。同法准备二抗(兔抗山羊igg-hrp1∶1000)稀释液并与膜接触,室温下孵育1-2h后用tbst在脱色摇床上室温下洗2次,每次10min;再用tbs洗1次,10min。ecl检测试剂盒显色,曝光、显影和定影,将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的相对分子质量和净光密度值。
(8)实验结果
造模前,各组大鼠体重无明显差异(p>0.05)。造模21天后,各造模组与空白组比较,大鼠体重增长缓慢(p<0.05)。给药21天后,氟西汀组、辣木籽总酚苷高、中、低剂量组及辣木籽总提物组与模型组比较,大鼠体重增长加快(p<0.05),辣木籽总酚苷高剂量组增长最快;辣木籽总酚苷高剂量组与氟西汀组比较,差异显著(p<0.05)。实验结果显示,造模21天后,各造模组大鼠水平运动和垂直运动得分均低于空白组(p<0.01)。给药21天后,氟西汀组及辣木籽总酚苷高、中、低剂量组和辣木籽总提物组大鼠水平运动及垂直运动得分均高于模型组(p<0.01)。如表1所示,造模21天后,各造模组大鼠糖水偏爱系数得分均低于空白组(p<0.05)。给药21天后,氟西汀组及辣木籽总酚苷高、中、低剂量组和辣木籽总提物组大鼠糖水偏爱系数得分均高于模型组(p<0.01),其中辣木籽总酚苷中剂量组最高。与对照组比较,模型组大鼠血清中皮质酮水平显著升高(p<0.01)。如图1所示,与模型组比较,氟西汀组、辣木籽总酚苷各剂量组和辣木籽总提物组大鼠血清中皮质酮水平均显著降(p<0.05、0.01)。与对照组比较,模型组大鼠海马bdnf蛋白表达显著下调(p<0.01)。如图2所示,与模型组比较,氟西汀组、辣木籽总酚苷组辣木籽总提物组大鼠海马bdnf蛋白表达均显著上调(p<0.05、0.01)。辣木籽总提物组与辣木籽总酚苷低剂量组实验结果相当。表明,本发明所制备的辣木籽总酚苷比辣木籽总提物具有良好的抗抑郁活性。
表1.辣木籽总酚苷对大鼠体重、运动行为学和糖水偏爱的影响(x±s,n=10)
注:与空白组比较*p<0.05,**p<0.01;与模型组比较##p<0.01,#p<0.05。
实施例11:辣木籽总酚苷抗焦虑活性
(1)实验原理
焦虑症发病机制主要有神经递质假说和神经内分泌功能紊乱假说,前者主要与5-羟色胺(5-ht)、去甲肾上腺素(ne)、多巴胺(da)等系统功能的亢进有关,降低5-ht、nf功能的药物则有抗焦虑作用。
(2)实验材料
wistar大鼠;辣木籽总酚苷;辣木籽总提物;地西泮;去甲肾上腺素(ne)、多巴胺(da)、5-羟色胺(5-ht)、酶联免疫吸附(elisa)测试试剂盒;手套;鼠盒;去离子水;灌胃针。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)实验分组
实验组(辣木籽总酚苷、辣木籽总提物);空白组(去离子水);阳性对照组(地西泮)15mg/kg;模型组等体积给药。
(4)给药剂量与次数:
低剂量组250mg/kg、中剂量组500mg/kg、高剂量组1000mg/kg、辣木籽总提物1000mg/kg以灌胃方式给药,每日1次,连续10天。
(5)大鼠高架十字迷宫模型
wistar大鼠经1周适应性喂养后,随机分为正常对照组、模型组、地西泮组、辣木籽总提物组和辣木籽总酚苷高、中、低剂量组,每组10只。正常对照组可一笼多鼠,其余各组大鼠均单笼饲养,参照林文娟等的方法建立焦虑模型。具体方法如下:正常对照组不接受任何处理,自由饮水和摄食。其余各组定时喂水训练7天,即每天早上8:00-8:10和晚20:00-20:10给动物饮水10min,其余时间撤去水瓶不给水。定时喂水训练结束后,开始应激试验,在上述两个时间段内给予不确定空瓶刺激,维持1天1次或2次,持续2周。在不确定空瓶刺激期间,模型组每天给予等容积生理盐水,地西洋组给予1mg/kg灌胃,辣木籽总提物组1000mg/kg,辣木籽总酚苷高、中、低剂量组每天剂量分别为:1000mg/kg、500mg/kg、250mg/kg。于第21天在辣木籽总酚苷组末次给药2h、模型组及dzp组末次给药0.5h后,进行高架十字迷宫行为学测定,将大鼠提前2h进入测试实验室适应环境。在epm试验开始前,先将每只大鼠分别单独放入一个60cm×60cm×35cm塑料盒中,任其自由探究5min后迅速置于epm的中央平台上,使其头部正对一个开放臂,释放后即开始用digbehv动物行为分析系统2.0自动记录5min内大鼠的以下活动情况:①进入开放臂的次数(openarmentry,oe);②进入封闭臂的次数(closearmentry,ce);③进入开放臂的时间(openarmtime,ot),单位:秒;④进入封闭臂的时间(closearmtime,ct),单位:秒。之后利用以上数据分别计算出:①进入开放臂和封闭臂的总次数(oe+ce),以此表示大鼠的活动能力;②进入开放臂的次数占总入臂次数的比例:oe%=oe/(oe+ce)×100%;③进入开放臂的时间占总入臂时间的比例:ot%=ot/(ot+ct)×100%,以oe%和ot%作为抗焦虑作用的疗效评定指标。每只大鼠测试后用湿布擦拭迷宫,清除杂物并用干布擦净后再进行下一只的测试。
实验结束以后,大鼠断头处死,迅速在冰盘上分离出全脑组织,称重后保存于超低温冰箱-80℃。按试剂盒操作方法检测大鼠脑组织中5-ht、ne和da神经递质的浓度。
(6)实验结果
辣木籽总酚苷对高架十字迷宫模型(epm)大鼠行为学的影响如表2所示,与正常对照组比较,模型组大鼠进入开臂的时间百分率、次数百分率明显减少;地西洋组、辣木籽总提物组和辣木籽总酚苷高、中、低剂量组大鼠进入开臂次数百分率、时间百分率较模型组显著上升,辣木籽总提物组效果不明显,以地西泮组和辣木籽总酚苷高剂量组上升最为明显(p<0.01)。
表2.辣木籽总酚苷对epm大鼠行为学(oe+ce,oe%,ot%)的影响(x±s,n=10)
注:与空白组比较*p<0.05;与模型组比较##p<0.01,#p<0.05。
如表3所示,辣木籽中剂量组明显降低大鼠脑组织5-ht浓度,其高剂量组明显降低大鼠脑组织ne浓度,而对da浓度无显著影响,以上结果表明:辣木籽总酚苷具有改善焦虑的作用。
表3.辣木籽总酚苷对焦虑模型大鼠脑组织神经递质的影响(x±s,n=10)
与空白组比#p<0.05;与模型组比*p<0.05
实施例12:辣木籽总酚苷抗老年痴呆活性
(1)实验原理
aβ沉积是老年痴呆症最典型的病理特征之一,在老年痴呆症的发生和发展过程中具有关键作用。根据aβ沉积情况诊断老年痴呆准确率可达80%。研究表明,脑内aβ40和aβ42的含量与老年痴呆症患者认知功能障碍的程度呈正相关。morris水迷宫实验是用于评价空间学习记忆能力的经典方法,是评价痴呆动物模型复制结果的客观指标。近年来,痴呆动物模型已成为研究老年性痴呆的重要手段。采用sd大鼠制备aβ1-42脑室注射致痴呆模型,分别给予试验组和对照组辣木籽总酚苷和生理盐水,通过morris水迷宫实验,评价辣木籽总酚苷对老年痴呆大鼠学习记忆能力的改善状况。
(2)实验材料
spf级sd雄性大鼠;辣木籽总酚苷;辣木籽总提物;淀粉样蛋白片段(aβ1-42);dw-5大鼠脑立体定位仪;wmt-100morris水迷宫视频分析系统;手套;鼠盒;去离子水;有机玻璃水缸;摄像机;灌胃针。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)实验分组
实验组(辣木籽总酚苷、辣木籽总提物);模型组(去离子水);对照组(去离子水):等体积给药。
(4)给药剂量与次数
低剂量组250mg/kg、中剂量组500mg/kg、高剂量组1000mg/kg、辣木籽总提物组1000mg/kg,以灌胃方式给药,每日1次,连续7天。
(5)具体实验过程
①模型制备:将sd大鼠用10%乌拉坦麻醉后,平颅头位固定,经脑立体定位仪定位于前囟后3.4mm、脑正中线左右旁开2.0mm、深度为颅骨表面下2.7mm处分别缓慢匀速注射5μl凝聚态aβ1-42。aβ模型对照组注射等容积的等渗盐水。造模1周后进行morris水迷宫行为学测试。
②morris水迷宫行为学测试:选择安静、暗光、恒温环境进行测试,实验室墙壁可适当黏贴不同图形,以帮助动物确定方位。实验前将水桶灌以清水至预定高度(约40cm),再加入适量白色素,使水成为不透明的乳白色液体,加热器加热水温至25℃。站台置于第四象限中央,位于水面以下约1.5cm,整个实验过程中平台位置保持不变。定位航行试验:定位航行试验持续四天。将平台置于第二象限中心,大鼠依次从四个象限面向池壁入水,记录大鼠在120s内找到平台所用的时间,即逃避潜伏期(el)。若大鼠在120s内未找到平台,其逃避潜伏期为120s,此时应引导大鼠登上平台。所有登上平台的大鼠应在平台上停留15s,使其认知水下平台为逃生点,并记忆平台的空间位置。计算每组大鼠每天在四个象限的逃避潜伏期平均值,即平均逃避潜伏期。平均逃避潜伏期(ael)的长短反映了大鼠的学习记忆能力,ael越短说明大鼠对水下平台的空间位置学习认知的越快。空间搜索试验:定位航行试验结束后24小时进行空间搜索试验。具体方法为撤除平台,使大鼠在无平台情况下凭记忆寻找平台,记录大鼠在120s内的跨平台次数、在每个象限游泳的路程和总路程。在整个测试过程中,水池周围参照物包括实验者的位置应固定。
(6)实验结果
如表4所示,在定位航行试验中,与模型组比较,辣木籽总酚苷中剂量组和高剂量组的平均逃避潜伏期均显著缩短(p<0.05),低剂量组和辣木籽提取物组则无显著差异。空间搜索试验中,与模型组比较,辣木籽总酚苷高剂量组的跨平台次数和路程显著提高(p<0.05),中剂量组的跨平台次数和路程略有升高趋势,但无显著差异(表5)。辣木籽总提物组的的跨平台次数和路程与辣木籽总酚苷低剂量组相当。以上结果表明:辣木籽总酚苷具有改善老年痴呆大鼠记忆障碍的作用。
表4.辣木籽总酚苷对aβ1-42诱导的老年痴呆大鼠逃避潜伏期的影响(x±s,n=10)
与对照组比#p<0.05;与模型组比*p<0.05,**p<0.01
表5.辣木籽总酚苷对aβ1-42诱导的老年痴呆大鼠空间搜索实验的影响(x±s,n=10)
与对照组比#p<0.05,##p<0.05;与模型组比*p<0.05,**p<0.01
实施例13:辣木籽总酚苷治疗酒精性化学肝损伤活性
(1)实验原理
建立小鼠急性酒精性肝损伤模型,通过给予实验小鼠不同剂量辣木籽总酚苷。通过检测急性肝损伤模型小鼠血浆中天门冬氨酸氨基转移酶(ast)、丙氨酸转氨酶(alt)、碱性磷酸酶(alp)、乳酸脱氢酶(ldh)含量及肝脏组织丙二醛(mda)、谷胱甘肽(gsh)的含量来判断辣木籽总酚苷的保肝作用。
(2)实验材料
昆明小鼠;辣木籽总酚苷;辣木籽总提物;56%的酒精;谷丙转氨酶(alt)、谷草转氨酶(ast)、碱性磷酸酶(alp)、乳酸脱氢酶(ldh)、丙二醛(mda)、谷胱甘肽(gsh)试剂盒;酶标仪;甘草酸苷;手套;鼠盒;去离子水。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)实验分组
空白对照组(去离子水),实验组(辣木籽总酚苷、辣木籽总提物);模型组(去离子水);对照组(甘草酸苷)。
(4)给药剂量与次数
低剂量组5mg/kg、中剂量组20mg/kg、高剂量组80mg/kg、辣木籽总提物组80mg/kg、甘草酸苷组85mg/kg以灌胃方式给药,每天1次,连续10天。
(5)具体实验过程
模型对照组,小鼠随机分为辣木籽总酚苷高、中、低剂量组、总提物组,联苯双酯组。其中,药物组给予相应剂量药物(灌胃),空白对照组和模型对照组予同体积生理盐水(灌胃),连续15天。最后一次给药后1h,除正常对照组予生理盐水外(灌胃),其余各组一次性予56%乙醇灌胃(0.016ml/g),酒后8小时乙醚麻醉,心脏采血,制备血浆液样品和肝组织样品,血清中天门冬氨酸氨基转移酶(ast)、丙氨酸转氨酶(alt)、碱性磷酸酶(alp)和乳酸脱氢酶(ldh)的含量及肝脏组织丙二醛(mda)、谷胱甘肽(gsh)的含量。
(6)实验结果
辣木籽总酚苷保护肝脏实验中,与正常对照组相比,急性酒精肝模型对照组的血清中的alt、ast、alp、ldh含量均明显高(p<0.05),提示造模成功。如表6所示,与模型对照组相比,辣木籽总酚苷剂量组、辣木籽总提物组、阳性药药组alt、ast、alp、ldh含量均降低(p<0.05)。肝脏组织指数实验中:与正常对照组相比,急性酒精性肝损伤模型对照组肝脏mda含量显著增高(p<0.05),肝脏gsh含量显著降低(p<0.05),提示造模成功。如表7所示,与模型对照组相比,给药组肝脏mda含量显著降低(p<0.05)。如表8所示,与模型对照组相比,甘草酸苷组、辣木总提物组和辣木籽总酚苷组肝脏gsh含量明显升高(p<0.05)。以上结果显示,辣木籽总酚苷具有较好的防醉、解酒功能,其可能通过降低肝组织mda、升高gsh含量对急性酒精性肝损伤发挥保肝护肝作用。
表6.辣木籽总酚苷对酒精性肝损伤小鼠血浆alt和ast水平的影响(x±s,n=10)
##p<0.01,模型组vs正常对照组;*p<0.05,**p<0.01,给药组vs模型组。
表7.辣木籽总酚苷对酒精性肝损伤小鼠血浆alp和ldh水平的影响(x±s,n=10)
##p<0.01,模型组vs正常对照组;*p<0.05,**p<0.01,给药组vs模型组。
表8.辣木籽总酚苷对酒精性肝损伤小鼠gsh和mda水平的影响(x±s,n=10)
##p<0.01,模型组vs正常对照组;*p<0.05,**p<0.01,给药组vs模型组。
实施例14:辣木籽总酚苷抗炎活性
(1)实验原理
建立采用内毒素(lps)造成小鼠急性炎症模型,观察山豆根颗粒及其饮片对小鼠血清一氧化氮合酶(nos)、一氧化氮(no)、丙二醛(mda)、肿瘤坏死因子-α(tnf-α)、白介素-6(il-6)等含量的影响判断辣木籽总酚苷的抗炎作用。
(2)实验材料
昆明小鼠;辣木籽总酚苷;辣木籽总提物;地塞米松片;no试剂盒、nos试剂盒、tnf-α放免分析试剂盒、丙二醛(mda)、il-6放免分析试剂盒;fj-2008/g型γ免疫计数器;手套;鼠盒;去离子水。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)实验分组
实验组(辣木籽总酚苷、辣木籽总提物);空白组(去离子水);模型组(去离子水);对照组(地塞米松)。
(4)给药剂量与次数
低剂量组5mg/kg、中剂量组20mg/kg、高剂量组80mg/kg、地塞米松组5mg/kg以灌胃方式给药,每日1次,连续7天。
(5)具体实验过程
取小鼠随机分组,每组10只,除正常对照组外,其余组灌胃给药后0.5h均灌胃给予lps4.8mg/kg,造模2h后眼眶采血,制备血清,-20℃保存。按试剂盒说明,用紫外分光光度计测定no含量和nos的活性。用fj-2008/g型γ免疫计数器测定tnf-α、il-6的含量。
(6)实验结果
如表9和表10中所示,与模型对照组比较,地塞米松组、辣木籽总酚苷高、中、低剂组和辣木籽总提物组均能明显降低小鼠血清mda和no含量;降低血清中nos活性(p<0.05或p<0.01),此外,能明显降低小鼠血清中tnf-α、il-6的含量(p<0.05或p<0.01)。以上结果显示,辣木籽总酚苷具有抗炎作用。
表9.辣木籽总酚苷对小鼠血清mda、no含量的影响(x±s,n=10)
与模型组比较p<0.05,#p<0.05;与模型组比较p<0.01,*p<0.01
表10.辣木籽总酚苷对小鼠血清nos活性及炎症因子含量的影响(x±s,n=10)
与模型组比较p<0.05,#p<0.05;与模型组比较p<0.01,*p<0.01
实施例15:辣木籽总酚苷治疗糖尿病作用
(1)实验原理
采用高脂饮食加链脲佐菌素(streptozotocin,stz)诱导的小鼠糖尿病模型,分别用不同剂量辣木籽总酚苷灌胃,观察高、中、低剂量的辣木籽总酚苷对糖尿病小鼠的血糖、体重和血脂的影响,评价辣木籽总酚苷治疗糖尿病的作用。
(2)实验材料
昆明小鼠;辣木籽总酚苷;辣木籽总提物;链脲佐菌素(stz);猪油;血糖试纸及血糖仪;血清甘油三酯(tg)和总胆固醇(tc)测定试剂盒;柠檬酸钠缓冲液(ph4.4);手套;鼠盒;蒸馏水。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)实验分组
实验组(辣木籽总酚苷、辣木籽总提物);正常组(蒸馏水);模型组(hfd+stz)。
(4)模型的制备和处理
雄性昆明小鼠3只/笼,室温(22±3)℃,相对湿度60%±10%,每日光照12h,摄食、饮水自由。适应性喂养1周后,随机分组,每组10只:正常组给予普通饲料喂养,高脂饮食糖尿病(hfd+stz)组给予高脂饲料喂养,3周后,小鼠禁食不禁水12h,(hfd+stz)小鼠和给予stz溶液按100mg/kg腹腔注射,正常组组小鼠以同样的剂量腹腔注射柠檬酸-檬酸钠缓冲液。stz注射后继续用同样的饲料喂养,继续用同样饲料喂养,记录小鼠的饮食和摄水情况。两周后尾静脉取血用血糖仪检,随即选取普通饲料的小鼠10只,造模成功的糖尿病小鼠50只,随机分为5组。根据以下分组给药:辣木籽总酚苷低剂量组5mg/kg、辣木籽总酚苷中剂量组20mg/kg、辣木籽总酚苷高剂量组80mg/kg、辣木籽总提取组80mg/kg、模型组蒸馏水0.3~0.4ml/天,正常组蒸馏水0.3~0.4ml/天,以灌胃方式给药,每日1次。
(5)具体实验过程
给药2两周后观察采食、饮水、体质量、精神状态、毛色等状况;测量:血糖值、体重、tg和tc。
(6)实验结果
(1)一般情况观察
造模后小鼠出现了多饮、多食、多尿、体重减轻,并有反应迟钝,被毛杂乱无光等症状,在给药辣木籽总酚苷及辣木籽总提物后各组小鼠以上症状均有不同程度的改善,反应较灵活,毛平伏且有光泽,以辣木籽总酚苷高、中剂量组最为明显。
(2)不同剂量的辣木籽总酚苷对hfd+stz糖尿病小鼠血糖含量的影响
由结果(表11)可见:hfd+stz诱导的糖尿病小鼠平均血糖明显升高,与正常组比较有显著差异(p<0.05)。低剂量的辣木籽总酚苷组与模型组小鼠相比,血糖无明显变化(p<0.05);中、高剂量的辣木籽总酚苷组与模型组小鼠比较血糖显著降低(p<0.01)。结果表明,辣木籽总酚苷以时间和剂量依赖的方式降低糖尿病小鼠的血糖。
表11.辣木籽总酚苷对hfd+stz糖尿病小鼠血糖含量的影响(x±s,n=10)
#p<0.05模型组vs空白组,**p<0.01,给药组vs模型组
(3)不同剂量的辣木籽总酚苷对hfd+stz糖尿病小鼠体重的影响由结果(表12)可见:给予普通饮食的正常组小鼠体重正常增加;未给予治疗的糖尿病模型组小鼠体重在实验中无明显变化。糖尿病模型组小鼠体重较药物治疗组小鼠的体重显著增加(p<0.05),中、高剂量的辣木籽总酚苷与模型组相比体重显著下降(p<0.05)。
表12.辣木籽总酚苷对糖尿病小鼠体重的影响(x±s,n=10)
#p<0.01,给药组vs正常组;*p<0.05,给药组vs模型组。
(4)不同剂量的辣木籽总酚苷对糖尿病小鼠甘油三酯(tg)与总胆固醇(tc)水平的影响由结果(表13)可见:模型组小鼠血清中tg水平较空白对照组小鼠血清tg水平显著增高(p<0.05),经过不同剂量的辣木籽总酚苷治疗后,低剂量组队tg水平没有明显改善,但中、高剂量组小鼠的血清tg水平明显下降,与糖尿病模型组相比均有显著性差异(p<0.05)。结果表明辣木籽总酚苷可降低糖尿病小鼠血清tg水平,且随剂量增加作用增强,而对糖尿病小鼠的tc水平无明显影响。
表13.辣木籽总酚苷对糖尿病小鼠甘油三酯(tg)和总胆固醇(tc)水平的影响(x±s,n=10)
#p<0.01,给药组vs正常组;*p<0.05,给药组vs模型组。
实施例16:辣木籽总酚苷治疗偏头痛作用
(1)实验原理
偏头痛是一种反复发作性慢性头痛,目前尚无理想的治疗方法。偏头痛的三叉神经血管反射学说,认为偏头痛是三叉神经传入纤维末梢释放p物质(sp)及其他神经递质,传出神经作用于颅内外血管,引起头痛和血管扩张。与三叉神经系统相关的最主要的神经肽是降钙素基因相关肽(cgrp),其次是p物质(sp)、神经激肽a(nka)。p物质是传递并降低痛阈的神经递质,与神经激肽a(nka)有协同作用,而降钙素基因相关肽(cgrp)具有较强的扩血管作用,通过扩张血管而引起头痛。神经学说认为偏头痛发作时神经功能的变化是首要的,血流量的变化是继发的。5-羟色胺(5-ht)参与头痛发生。头痛发作开始时,5-ht从血小板中释出,直接作用于颅内小血管使之收缩,并附于血管壁上。本实验通过给予偏头痛大鼠模型不同剂量辣木籽总酚苷,通过测量血浆中cgrp、sp及5-ht含量来评价辣木籽总酚苷治疗偏头痛作用。
(2)实验材料
wistar大鼠;辣木籽总酚苷;辣木籽总提物;地西泮;硝酸甘油注射液、琥珀酸舒马普坦平片、sp放免试剂盒、cgrp放免试剂盒、兔抗大鼠5-ht抗体、;手套;鼠盒;去离子水;灌胃针。辣木籽总提物制备方法:取辣木籽粉碎,加10倍重量95%乙醇渗滤提取两次,合并提取液,浓缩,减压干燥,得辣木籽总提物。
(3)造模
健康wistar大鼠,皮下注射硝酸甘油注射剂10mg/kg,复制实验性偏头痛模型。以给药造模30min后大鼠出现双耳发红,前肢频繁搔头,爬笼次数增多等烦躁不安的症状为模型复制成功的标准。
(4)实验分组
实验组(辣木籽总酚苷、辣木籽总提物);正常组(去离子水);阳性对照组(琥珀酸舒马普坦)6mg/kg;模型组等体积给药。
(5)给药剂量与次数:
低剂量组100mg/kg、中剂量组150mg/kg、高剂量组200mg/kg、辣木籽总提物200mg/kg以灌胃方式给药,于注射硝酸甘油30min后按组灌胃给药。
(6)取材及处理
造模3h后腹主动脉采血约3ml,置于抗凝的真空采血管中,轻轻摇匀,迅速低温(4℃)4000r/min离心20min,分离血浆用放射免疫法测定血浆cgrp、sp、5-ht含量,操作按放免药盒说明书进行。
(7)实验结果
辣木籽总酚苷对对偏头痛大鼠血浆cgrp、sp、5-ht的影响如表1所示,与正常对照组比较,偏头痛模型组大鼠血浆中cgrp、p物质浓度显著增高(p<0.5),5-ht的含量显著降低(p<0.5)。;舒马普坦组、辣木籽总提物组和辣木籽总酚苷高、中、低剂量组及辣木籽总酚苷组能显著降低模型动物血浆cgrp、p物质浓度(p<0.5),升高5-ht的含量(p<0.5)。以舒马普坦组和辣木籽总酚苷高剂量组的cgrp、p物质浓度上升最为明显(p<0.01)。以上结果表明辣木籽总酚苷能治疗偏头痛可能与调节机体单胺类神经递质的释放和代谢机制得以恢复,进而改善脑及血管的功能障碍有关。
表14.辣木籽总酚苷对偏头痛大鼠血浆cgrp、sp、5-ht的影响(x±s,n=10)
与空白组比#p<0.05;与模型组比*p<0.05、**p<0.01。
- 还没有人留言评论。精彩留言会获得点赞!