以PGP为活性中心的多肽在制备缺血性脑卒中靶向递药系统中的用途的制作方法
本发明属制药技术领域,涉及以pgp为活性中心的肽的新的药用用途,具体涉及以pgp为活性中心的多肽作为靶头在构建缺血性脑卒中靶向递药系统中的应用
背景技术:
资料显示,脑卒中已成为全世界范围内第二大致死原因和第三大致残原因,且发病年龄向中青年蔓延。目前针对该类疾病的治疗,由于血脑屏障(bbb)的存在,使得98%的小分子和近乎100%的大分子药物被排除在脑组织外,实践显示,临床常用的给药方式由于缺乏组织特异性和病变部位的靶向性从而导致用药量大,极易引起严重的毒副作用,因此建立一种可帮助药物实现bbb穿透、脑内损伤组织选择、进入病变细胞等多级脑靶向给药平台已经成为临床实践治疗中枢神经系统疾病最为紧迫的需求。近年来,脑靶向制剂研究取得了巨大的成绩,由抗体或配体修饰的纳米制剂,不仅延长了在体循环时间,同时具有寻靶功能,增加药物的脑内递送,但是,目前靶向递药手段将药物递送跨越bbb后如何定位于缺血病变部位,并进一步介导进入靶细胞是脑靶向给药研究面临的新的难题。研究显示,现有制剂手段在帮助药物通过bbb后,缺乏在脑内的二次选择作用,因而脑内病灶部位的药物浓度仍然不高,且对病变细胞难以发挥药效,因此,建立一个不仅可跨越bbb而且可进一步到达脑内病变部位的靶细胞内的给药系统,成为脑卒中治疗的关键。
大量研究表明,缺血性脑卒中发病后,大量中性粒细胞在细胞因子作用下聚集于脑微血管内并穿过bbb,浸润至缺血脑组织,并进一步释放大量活性氧(ros),含酶颗粒等神经毒物质,加重损伤,促使缺血损伤转变为炎性损伤,因此,炎症的趋化性可促进中性粒细胞到达脑内病灶部位,并通过与病变细胞的融合和物质交换,将药物靶向递送至细胞内。业内研究人员拟利用脑缺血时的病理反应,以炎症反应募集入脑的内源性中性粒细胞为载体,进而构建一种十分理想的具有多级脑靶向功能的传输系统。
pgp(脯氨酸-甘氨酸-脯氨酸)三肽,是近年来被发现的可与白细胞表面cxcr2受体发生特异性结合,并由网格蛋白介导内吞的活性小肽,cxcr2受体在中性粒细胞有高表达,同时在单核细胞、淋巴细胞也有一定量的表达。研究表明,炎症反应时中性粒细胞到达病灶部位后不断释放大量基质金属蛋白酶(matrixmetalloproteinases,mmps)反复破坏组织结构然后释放大量胶原蛋白,再经过酶的进一步降解生成小分子三肽pgp,然后通过n端的乙酰化生成稳定性更高、活性更强的衍生肽n-乙酰-脯氨酸-甘氨酸-脯氨酸(n-acetylatedproline-glycine-proline,ac-pgp)[6,9];另有文献报道,ac-pgp可以更多的招募中性粒细胞迁移到病灶区。
基于现有技术的现状,本申请的发明人拟提供以pgp为活性中心的肽新的药用用途,具体涉及以pgp为活性中心的多肽作为靶头在构建缺血性脑卒中靶向递药系统中的应用,本发明将有助于纳米粒在血液循环中与中性粒细胞高效率结合并介导纳米粒内吞,实现is的多级靶向递药。
与本发明相关的现有技术有,
1.feiginvl,norrvingb,mensahga.globalburdenofstroke.circres2017;120(3):439-448.
2.tosig,costantinol,ruozib,fornif,vandellima.polymericnanoparticlesforthedrugdeliverytothecentralnervoussystem.expertopindrugdeliv20082008-02-01;5(2):155-174.
3.suzukiy,nagain,umemurak.areviewofthemechanismsofblood-brainbarrierpermeabilitybytissue-typeplasminogenactivatortreatmentforcerebralischemia.frontcellneurosci20162016-01-20;10:2.
4.deddenslh,vantilborgga,mulderwj,devrieshe,dijkhuizenrm.imagingneuroinflammationafterstroke:currentstatusofcellularandmolecularmristrategies.cerebrovascdis20122012-01-20;33(4):392-402.
5.downesce,crackpj.neuralinjuryfollowingstroke:aretoll-likereceptorsthelinkbetweentheimmunesystemandthecns?brjpharmacol20102010-08-01;160(8):1872-1888.
6.kimsd,leehy,shimjw,kimhj,yooyh,parkjs,etal.activationofcxcr2byextracellularmatrixdegradationproductacetylatedpro-gly-prohastherapeuticeffectsagainstsepsis.amjrespircritcaremed20112011-07-15;184(2):243-251.
7.yangw,wangd,richmonda.roleofclathrin-mediatedendocytosisincxcr2sequestration,resensitization,andsignaltransduction.jbiolchem19991999-04-16;274(16):11328-11333.
8.rosejj,foleyjf,murphypm,venkatesans.onthemechanismandsignificanceofligand-inducedinternalizationofhumanneutrophilchemokinereceptorscxcr1andcxcr2.jbiolchem20042004-06-04;279(23):24372-24386.
9.weathingtonnm,vanhouwelingenah,noeragerbd,jacksonpl,kraneveldad,galinfs,etal.anovelpeptidecxcrligandderivedfromextracellularmatrixdegradationduringairwayinflammation.natmed20062006-03-01;12(3):317-323.
10.xux,jacksonpl,tanners,hardisonmt,abdulrm,blalockje,etal.aself-propagatingmatrixmetalloprotease-9(mmp-9)dependentcycleofchronicneutrophilicinflammation.plosone20112011-01-13;6(1):e15781.。
技术实现要素:
本发明的目的在于基于现有技术的现状,提供以pgp为活性中心的肽的新的药用用途,具体涉及以pgp为活性中心的多肽在制备缺血性脑卒中靶向递药系统中的用途,所述的以pgp为活性中心的多肽作为靶头用于构建缺血性脑卒中靶向递药系统,有助于纳米粒在血液循环中与中性粒细胞高效率结合并介导纳米粒内吞,实现is的多级靶向递药。
本发明基于ac-pgp肽在体内稳定性好、与白细胞表面的cxcr2受体结合能力强,且在血液中较少的存在竞争性抑制,利用pgp肽为活性中心构建纳米递药系统靶头,帮助纳米粒在血液循环中与中性粒细胞高效率结合并介导纳米粒内吞,实现is的多级靶向递药,提供了pgp为活性中心的多肽作为靶头在构建缺血性脑卒中靶向递药系统中的应用。
本发明中,pgp(脯氨酸-甘氨酸-脯氨酸,pro-gly-pro)是一种与中性粒细胞表面cxcr2受体具有高度亲和性的三肽序列;
本发明中,所述的多肽为:以脯氨酸-甘氨酸-脯氨酸(pgp)三肽序列为活性中心的不同长度的线性多肽化合物,本发明中优选长链pgp多肽;
本发明中,所述的递药系统包括但不限定于:纳米粒、脂质体、磷脂复合物、微球、聚合物、纳米球、纳米乳、自微乳、包合物等任何一种常见于临床的剂型;
本发明中,所述的pgp肽应用于递药系统的方式包括但不限定为:与递药系统中的任何一种常见的功能性材料偶联;所述的功能性材料为:一端含nhs活泼酯,一端含mal等任何一种常见的可与多肽发生反应的基团;
本发明中,所述的功能性材料包括但不限定为:树枝状聚左旋赖氨酸、功能性peg、功能性磷脂、功能性胆固醇、功能性聚合物等。
本发明经实验显示,以pgp为活性中心的线性肽修饰纳米粒给药系统,可显著提高中性粒细胞对载药纳米粒的吞噬,从而携带纳米粒跨越血脑屏障进入脑内病灶部位,并进一步通过与神经元细胞的融合,将药物转移至神经元细胞而实现多级脑靶向递药;进一步的临床实验研究显示,应用该载药系统可有效提高大分子药物等神经保护剂对缺血再灌注损伤的治疗效果;其机制主要涉及到缺血性脑卒中发病过程中的炎症反应可高效募集白细胞的病理特点。
本发明利用以pgp为活性中心的多肽作为靶头构建缺血性脑卒中靶向递药系统,应用于不同给药系统后,可获得明显的脑靶向递药的效果,并显著提高了模型药的疗效。本发明将有助于纳米粒在血液循环中与中性粒细胞高效率结合并介导纳米粒内吞,实现is的多级靶向递药。
附图说明
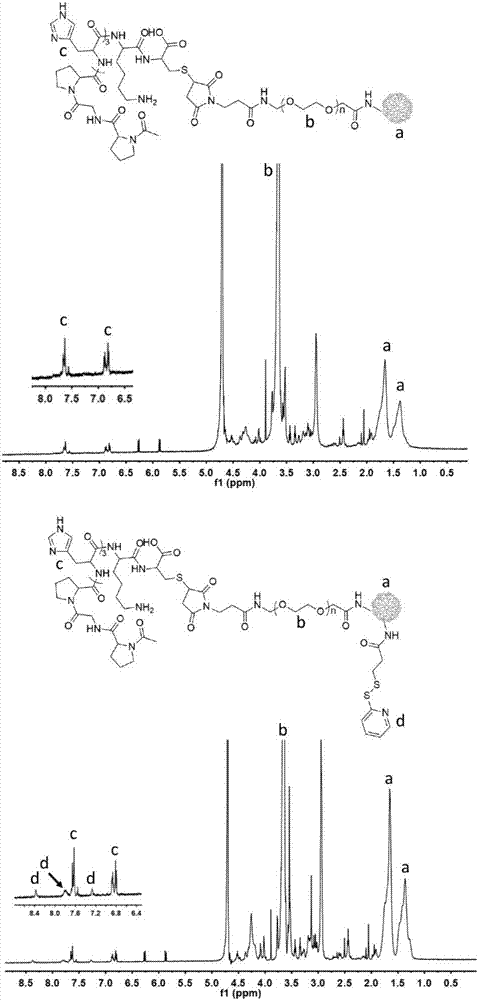
图1是pgp-peg-dgl(a)和pgp-peg-dgl-pdp(b)氢谱。
图2是cat标准曲线。
图3是pgp-peg-dgl-cat纳米粒透射电镜照片。
图4是cxcr2与n-ac-pgphhhkc(a)及cxcr2与pgp-peg-dgl-cat纳米粒(b)的表面等离子共振。
图5是cat和不同dglvector-cat纳米粒的细胞摄取结果。
图6是i/r裸鼠给予peg-dgl-cat,pgp-peg-dgl-cat后活体荧光照片(a)及半定量结果(b)。
图7是神经功能评分结果(n=6).。
图8是i/r小鼠给予peg-dgl-cat或pgp-peg-dgl-cat后核磁共振成像及结果分析。
具体实施方式
下述具体的实施方案仅作为本发明的解释,但绝不是对本发明的限制。
实施例1pgp-peg-dgl的合成与表征
树枝状聚左旋赖氨酸(dendrigraftpoly-l-lysines,dgl)表面的氨基与双功能peg一端的nhs发生特异性反应,按照dgl:peg=1:5(mol/mol)的比例精确称量,将nhs-peg3.5k-mal溶于pbs7.4缓冲溶液中,然后逐滴加入搅拌的dgl溶液中(5mg/ml,pbs,ph=7.4),室温搅拌反应1h。转移至5kda的超滤管内,加入pbs,6000rpm离心20min,重复两次,纯化得到peg-dgl;其次,peg-dgl一端的mal与pgp的巯基发生特异性反应,将peg-dgl与pgp(dgl:pgp=1:2mol/mol)混合于pbs溶液中,室温搅拌过夜;转移至5kda的超滤管内,加入10mmtris(ph=7.4),6000rpm离心20min,重复两次,纯化得到pgp-peg-dgl,-80℃过夜,冻干保存,取3mg的固体粉末,加入0.5mld2o,600mhz进行1h-nmr鉴定,结果如图1所示。
实施例2制备包载过氧化氢酶pgp-peg-dgl纳米粒
电荷吸附法制备pgp-peg-dgl-cat纳米粒,精密称取适量过氧化氢酶(catalase-cis-aconiticanhydride,cat),使其终浓度为1mg/ml和pgp-peg-dgl-pdp(dgl终浓度2.5mg/ml),分别溶于10mmtris(ph7.4)溶液中,水浴超声2min。定量称取dtt,溶于10mmtris(ph7.4)缓冲液中,使其浓度为2mg/ml,按照1:40的体积比(dtt:dgl)加入pgp-peg-dgl-pdp溶液中,迅速涡旋15min,将pdp的二硫键还原成巯基,并逐滴加入搅拌的等体积cat溶液中(dgl:cat=2.5:1wt/wt),室温持续搅拌20min,用5l10mmtris(ph=7.4)溶液透析1h,移除dtt和释放的硫代吡啶酮,透析过程中,氧化dgl赖氨酸侧链引入的巯基使其形成二硫键,制得包载cat的纳米粒pgp-peg-dgl-cat。
实施例3pgp-peg-dgl-cat包封率测定
精密称量cat,用10mmtris(ph=7.4)稀释成浓度分别为1.60、0.80、0.40、0.20、0.10、0.05、0.04mg/ml的溶液,紫外分光光度计法在404nm处测定吸光度,绘制标准曲线;吸取制备纳米粒的cat投药溶液,通过紫外分光光度计检测在404nm下吸光度值,得到纳米粒的总含药量(ct,mg/ml);另取纳米粒的混悬液于超速离心机上,在4℃条件下,3000000g离心30min,将游离cat与纳米粒分离,吸取上清液,通过紫外分光光度计检测在404nm下吸光度值,得上清液中游离cat的浓度(ce,mg/ml),按以下公式计算包封率:
包封率(encapsulationefficiency,ee)(%)=(ct-ce)/ct×100%
如图2所示,记录不同浓度cat溶液的a404,以浓度(c)为横坐标,a404为纵坐标进行线性回归,得回归方程a404=4.5613c-0.1203(r=0.9999),表明在0.04-1.60mg/ml范围,线性关系良好;
超速离心法测得的包封率结果显示:pgp-peg-dgl-cat纳米粒的包封率为70.69±0.46%。
实施例4pgp-peg-dgl-cat纳米粒的粒径、电位及形态考察
制备pgp-peg-dgl-cat纳米粒后,加入10mmtris(ph=7.4)缓冲液稀释到适当浓度,采用粒度/zeta电位测定仪测定纳米粒粒径分布及zeta电位,结果显示,纳米粒的平均粒径约为100nm,zeta电位为5.0mv左右,pgp肽的共价修饰对纳米粒的粒径和zeta电位无显著影响;表.1显示了纳米粒粒径和zeta电位;
表.1
将纳米粒混悬液与1%的醋酸铀溶液等体积混合,滴加到透射电镜专用的铜网上,灯下照射3min后,用滤纸吸取多余的溶液,透射电镜观察纳米粒的形貌,透射电镜结果如图3所示,显示了纳米粒的外观圆整,形态呈球形。
实施例5表面等离子共振测定pgp-peg-dgl-cat纳米粒与受体的亲和力
采用表面等离子共振(surfaceplasmonresonance,spr)测定结合常数,评价pgp修饰于纳米粒表面后与其受体的亲和性,首先将gst抗体通过酰胺键偶联在cm5芯片表面,用于捕获gst,其次将末端带有gst标签的cxcr2受体(重组白细胞介素8受体β)溶于缓冲液中,并在结合gst抗体的cm5芯片上流动使得cxcr2受体通过抗原抗体反应结合于cm5芯片表面,而缓冲液(50mmhepesph7.0,0.01%chs,0.1%chaps,0.33mm合成磷脂混合物dopc:dops[质量比7:3])用于构建磷脂双分子层结构,从而模拟跨膜细胞膜cxcr2受体,最后,将pgp-peg-dgl-cat纳米粒用缓冲液稀释成不同浓度,并在结合cxcr2受体的芯片上流动,同时记录下响应值的变化用于评价亲和力(如图4所示),以浓度和响应值拟合的kd值为1.576×10-7m,证明与游离pgp肽具有类似的亲和性(kd=2.719×10-7m),表明pgp肽修饰于纳米粒上很好的保留了cxcr2受体亲和力。
实施例6pgp-peg-dgl-cat纳米粒与体外细胞亲和性试验
hl-60细胞加入24孔板(2.0×105细胞/孔),分别与fitc荧光标记的纳米粒混合,37℃共孵育30min,以10%fbs的培养液为对照,收集细胞悬液,2000rpm离心5min,加入pbs7.4重悬,2000rpm离心5min,重复两遍,加入dmem溶液重悬细胞,流式细胞仪进行分析;
hl-60细胞对fitc标记的不同纳米粒的摄取结果如图5所示,显示不同纳米粒在hl-60细胞上均有不同程度摄取;与未修饰组纳米粒比较,pgp-peg-dgl-cat组的荧光强度更高,表明pgp靶头的修饰,有利于提高hl-60细胞对纳米粒的摄取。
实施例7pgp-peg-dgl-cat纳米粒的脑靶向性实验
建立裸鼠i/r模型12h后,将bodipy650/665标记的peg-dgl-cat、pgp-peg-dgl-cat纳米粒,尾静脉注射至裸鼠体内,给药剂量为7.5mg/kgdgl,不同时间点置于活体成像仪进行成像,bodipy荧光标记纳米粒的体内成像结果如图6a-b所示,pgp-peg-dgl-cat组给药后,荧光信号不断聚集于脑部并持续至2h,随后出现缓慢的消除。给药3h后,离体脑组织的荧光成像结果标明,相对peg-dgl-cat组,pgp-peg-dgl-cat显著提高纳米粒的脑靶向性。
实施例8pgp-peg-dgl-cat对缺血性脑卒中神经功能缺损的影响
采用clark小鼠一般功能损伤评分(0-28分),由两位观察者分别以盲法对实验的小鼠进行打分和记录,然后将两组的记录分数进行平均后的得分作为每只小鼠的最终分数;建立c57小鼠i/r模型,于再灌后3h,24h,72h进行神经功能评分,随后静脉注射给予pbs、cat、peg-dgl-cat、pgp-peg-dgl-cat(剂量为10000u/kgcat),考察i/r后不同时间点给药对神经功能损伤的影响(给药前神经功能评分作为不同病程参考);给药后48h,再次进行一般功能损伤评分;clark一般功能损伤评分从小鼠毛发、耳朵、眼睛、体态、自主运动、癫痫发作等6个方面评定小鼠神经功能损伤程度;如图7所示,再灌后3h、24h、72h给予pgp-peg-dgl-cat纳米粒,一般神经功能降为对照组的68.1%,55.8%和48.3%(p<0.001),同时,与peg-dgl-cat纳米粒相比有显著性差异(p<0.05,3h;p<0.01,24h,72h),说明pgp-peg-dgl-cat纳米粒对i/r小鼠的神经功能恢复具有明显的促进促进作用,且恢复程度显著高于peg-dgl-cat纳米粒。
表.3为clark评分小鼠一般功能损伤评分(0-28)。
表.3
实施例9活体核磁共振成像考察脑梗死面积实验
建立c57小鼠i/r模型,于再灌后3h,24h,72h进行mri成像并立即给药,考察i/r后不同时间点给药的治疗效果(给药前mri成像作为不同病程参考),2%的异氟烷气醉,置于7.0t小动物mr扫描仪,监测呼吸频率,进行t2wmri成像,用于观察缺血区域。随后静脉注射给予pbs、cat溶液和peg-dgl-cat、pgp-peg-dgl-cat,剂量为10000u/kgcat,给药后48h,进行t2wmri成像,imagej软件计算梗死体积,并计算与缺血半脑体积的比值;如图8所示,再灌后3h、24h、72h给予pgp-peg-dgl-cat纳米粒,梗死面积与对照组(pbs)比较均明显减少(p<0.001),同时,与peg-dgl-cat纳米粒相比有显著性差异(p<0.05,3h;p<0.01,24h,72h),说明pgp-peg-dgl-cat纳米粒可显著减少is造成的脑梗死面积,效果优于peg-dgl-cat纳米粒,且随着给药时间的延长而增加,对于扩宽急性脑缺血的有效治疗时间窗具有重要的意义。
- 还没有人留言评论。精彩留言会获得点赞!