脆弱拟杆菌在制备增强肠粘膜屏障功能的增强剂中的应用的制作方法
本发明涉及脆弱拟杆菌的应用
技术领域:
,具体涉及脆弱拟杆菌在制备增强肠粘膜屏障功能的增强剂中的应用。
背景技术:
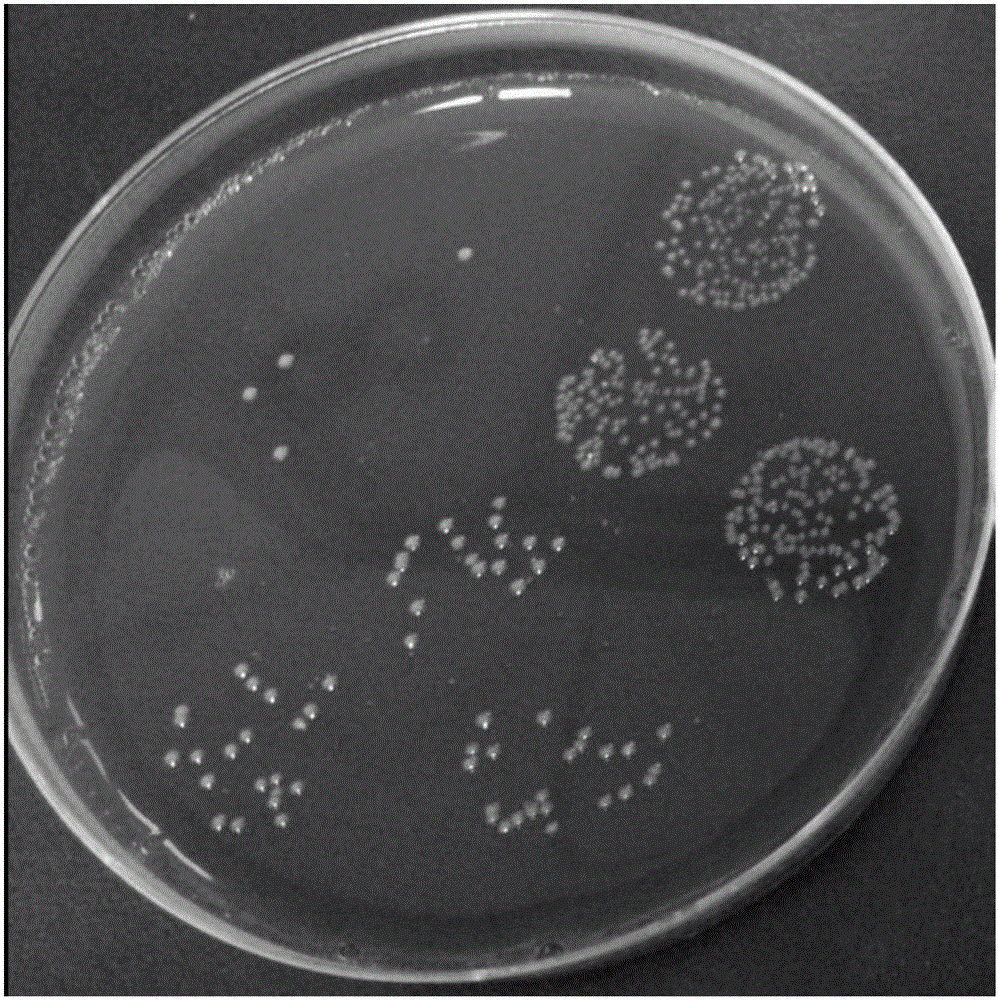
:随着基础医学研究的深入,人们逐渐认识到肠黏膜不仅仅有消化和吸收功能,而且具有重要的防御性屏障功能。肠道是人体与外界环境间最大的接触面,肠腔内有大量的细菌和多种毒素,但正常情况下,人们并不发生严重的感染或中毒性疾病。这主要是肠黏膜屏障有效地阻挡了外来微生物和毒素的侵袭,保证了机体的健康。然而,在多种应激情况下或肠黏膜局部受到破坏时,这种屏障功能减弱,存在于肠腔中的致病性微生物和毒素便可跨过肠屏障,进入淋巴系统和血循环,出现细菌易位,引起菌血症或毒血症,甚至发生出现炎性级联反应,导致多器官功能障碍。肠黏膜屏障由肠黏膜的机械屏障、化学屏障、免疫屏障和生物屏障构成。1、肠黏膜的机械屏障:肠黏膜表层有这样几个结构:不移动水层、黏液层(包括最上层的疏水层)、上皮层(包括上皮细胞的紧密联接)。此外,肠毛细血管的内皮和血流也对肠黏膜的屏障功能有重要影响。(1)不移动水层:它是机械屏障的最外层,其深度大约为100~800μm,它是许多营养物质和药物吸收的限速步骤。脂溶性物必须经过微粒化后,才能通过这一层。(2)黏膜表面的疏水层:这是一层活性磷脂层,衬于黏液的最上层。某些去垢剂,nsaids均可去除这一磷脂层,从而减少了黏膜表面的疏水性,增加了亲水大分子的黏膜渗透性。(3)黏液层:这是一层黏胶样结构。它可防止上皮绒毛的物理性摩擦、化学性消化和阻止致病菌与肠黏膜黏附、定植。此外,黏液层中有专供厌氧菌结合的受体,使专性厌氧菌栖息,发挥其定植抗力。应用秋水仙硷抑制杯状细胞产生黏液,可显著增加黏膜的渗透性。长期全胃肠外营养也会破坏黏胶层。(4)上皮层:它是一个高选择性屏障,只允许营养性物质吸收,限制有毒物质的吸收。这种选择可能与透过物质的大小和其理化性质有关。肠上皮的通透性有两个途径,即跨上皮途径和细胞旁途径(紧密联接)。后者正常情况下,仅允许2μm以下的小分子物质通过,是控制大分子物质(如内毒素和细菌代谢产物)进入体内的关键。大鼠的研究显示,肠腔内渗透压增加,可促进大分子物质的细胞旁渗透性,食入高张盐水和葡萄糖以后,肠通透性增加。维持上皮和细胞旁途径完整的主要结构是构成细胞骨架的丝状结构:肌纤维蛋白丝、微管和中间丝。秋水仙硷、乙醇均可破坏微管,氧化剂破坏肌纤蛋白,引起肠通透性增加。(5)内皮屏障:毛细血管内皮屏障在维持肠屏障功能上有重要作用。这可能与血流供应相关,足够的血液供应才可能提供营养、氧气和能量(atp),才有可能将损伤物质迅速排除(如氧自由基)。2.化学屏障:胆汁、溶菌酶以及肠道原生菌分泌的乙酸等具有一定杀菌和溶菌作用,构成了肠道的化学屏障。3.免疫屏障:肠道是人体最大的免疫器官。肠黏膜的免疫系统包括肠系膜淋巴结、浆细胞、b细胞、辅助t淋巴细胞和m细胞(肥大细胞)。m细胞在摄取细菌抗原后,将信号传给t、b淋巴母细胞,后者通过血液循环又定植在肠黏膜下层,进一步分化为成熟t、b淋巴细胞。肠黏膜平均每天分泌3giga免疫球蛋白,它可抑制肠道中细菌吸附到肠黏膜上皮细胞表面,阻止其在上皮细胞定植。此外,iga免疫球蛋白包裹细菌(可包裹肠道中60%~80%的g-细菌),减弱细菌向肠黏膜上皮细胞受体移动和结合的能力,并进一步刺激肠道分泌黏液,有助于排泄肠道中的细菌和毒素。位于肠黏膜固有层的巨噬细胞具有吞噬外来细菌和毒素的能力。巨噬细胞在受到毒素刺激后又会产生tnf-α对抗细菌。4.生物屏障:寄生于人体的细菌大约有500种,大部分存在于肠道。肠内细菌大约占粪便湿重的20%~30%,其中绝大部分(99.9%)是厌氧菌。这些人体的原籍菌(益生菌)与肠黏膜黏附、结合、嵌合形成一个完整的菌膜构成肠道的生物屏障。正常情况下,益生菌通过占位保护、产生酸性物质和细菌素、争夺营养等方式拮抗致病菌的定植,起到一种生物屏障作用。此外,无毒、无害、非致病性耗氧微生物(如蜡样芽胞杆菌、枯草芽胞杆菌等)暂时在肠道内定植,使局部环境氧分子浓度降低,氧化还原电位下降,造成适合正常肠道优势菌群-厌氧菌生长的微环境,促进厌氧菌的生长,最终恢复正常的微生态平衡,也起到了生物保护作用。肠道益生菌还可产生多种抗原性物质,促进机体免疫能力,刺激免疫细胞促进吞噬细胞活力,促进b淋巴细胞产生抗体。肠道益生菌还有制造多种维生素和蛋白质的能力,产生葡萄糖醛酸酶、硫化酶促进胆固醇进入肝肠循环。肠道益生菌还参与n-亚硝酸盐降解,发挥抗癌作用。肠黏膜屏障破坏会导致细菌易位、内毒素血症等后果。细菌易位是指:寄生于大肠的致病菌,如大肠杆菌等可以易位到小肠(横向易位),也可以跨过肠黏膜进入肠系膜淋巴结和门静脉,继而进入体循环(纵向易位)。无论是小肠细菌过度生长,还是细菌进入循环均可引起严重的全身性生理功能紊乱。内毒素血症是指:肠内细菌的大量繁殖引起过多的毒素进入门脉和肝脏,一旦肝脏清除毒素的能力下降,便发生内毒素血症。而内毒素不仅可直接损伤重要脏器,还可激活补体和凝血机制,出现呼吸窘迫综合征和弥漫性血管内凝血,甚至发生多器官功能衰竭。因此,增强肠黏膜屏障功能的药物或方法对于人们的健康非常重要。随着肠上皮细胞紧密连接的生物学功能研究的深入,对紧密连接的防治研究也渐受到许多学者的重视,但大多缺乏针对性。谷氨酰胺在维持肠上皮细胞屏障功能中具有重要作用已为大多数学者所接受,但其机制仍不十分清楚。因此,研究新的能有效增强肠黏膜屏障功能的手段具有重要意义。技术实现要素:基于此,本发明提供了一种脆弱拟杆菌的新应用。具体技术方案如下:脆弱拟杆菌(bacteroidesfragilis)在制备增强肠粘膜屏障功能的增强剂中的应用。脆弱拟杆菌(bacteroidesfragilis)是革兰氏染色阴性、无芽孢、专性厌氧的小杆菌,属于拟杆菌属,正常寄居于人体肠道、口腔、呼吸道等。根据有无携带bft1、2、3基因分为有毒株和无毒株。不产肠毒素的脆弱拟杆菌(bacteroidesfragilis)有着诸多功效,具有成为新的益生菌的潜力。在其中一些实施例中,所述脆弱拟杆菌(bacteroidesfragilis)为保藏编号为cgmccno.10685的脆弱拟杆菌(bacteroidesfragilis)zy-312。在其中一些实施例中,所述增强剂为药物或保健食品。在其中一些实施例中,所述药物的剂型为丸剂、片剂、颗粒剂、胶囊、口服液、气雾剂或管饲制剂。所述药物包括人用药或动物用药,可用于人或动物。在其中一些实施例中,所述保健食品为奶粉、冰激凌、奶基发酵食品或谷类发酵食品。所述食品还可以是动物食品,比如饲料等。在其中一些实施例中,所述奶基发酵食品为干酪、凝乳、酸奶酪。在其中一些实施例中,所述食品为婴儿食品或宠物食品。本发明还提供了一种增强肠粘膜屏障功能的增强剂。具体技术方案如下:一种增强肠粘膜屏障功能的增强剂,所述增强剂含有保藏编号为cgmccno.10685的脆弱拟杆菌(bacteroidesfragilis)zy-312。在其中一些实施例中,所述增强剂为药物或保健食品。在其中一些实施例中,所述药物的剂型为丸剂、片剂、颗粒剂、胶囊、口服液、气雾剂或管饲制剂。在其中一些实施例中,所述保健食品为奶粉、冰激凌、奶基发酵食品或谷类发酵食品。在其中一些实施例中,所述脆弱拟杆菌(bacteroidesfragilis)可以与其他调节肠粘膜屏障的药物联合使用,所述的其他调节肠粘膜屏障的药物包含但不限于:柳氮磺胺吡啶水杨酸制剂(如艾迪莎,美沙拉嗪)、皮质类固醇(如强的松,地塞米松)和/或免疫抑制剂(如硫唑嘌呤)。本发明的脆弱拟杆菌(bacteroidesfragilis)zy-312,已于2015年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),其保藏编号为cgmccno.10685,保藏地址为北京市朝阳区北辰西路1号院3号。本发明的发明人经过长期经验积累以及大量创造性实验研究发掘了脆弱拟杆菌(bacteroidesfragilis)新的用途,开拓了脆弱拟杆菌的一个新的应用领域。发明人通过大量实验证明:脆弱拟杆菌具有修复肠上皮粘液屏障,减少肠道粘膜的通透性的功能,可有效增强肠道粘膜屏障功能,保护人体健康。本发明提供的脆弱拟杆菌,对机体没有任何副作用,同时还可以与其他调节肠粘膜屏障的药物联合使用,从而预示了脆弱拟杆菌具有很好的食用和药用前景,为临床提供一种适合人体服食的保健和预防良品。附图说明图1为实施例1的脆弱拟杆菌(bacteroidesfragilis)zy-312的菌落特征图;图2为实施例1的脆弱拟杆菌(bacteroidesfragilis)zy-312进行革兰氏染色后的显微镜观察图;图3为实施例2的第0天-第14天粪便评分曲线图;图4为实施例3中各组实验的结肠he染色图;图5为实施例3中屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的表达情况图。具体实施方式以下通过具体实施例对本发明做进一步详细说明,这些实施例仅用来说明本发明,并不限制本发明的范围。以下实施例中所用的脆弱拟杆菌为脆弱拟杆菌(bacteroidesfragilis)zy-312,于2015年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),其保藏编号为cgmccno.10685,保藏地址为北京市朝阳区北辰西路1号院3号。实施例1脆弱拟杆菌的分离及样品的制备(1)脆弱拟杆菌的增菌培养及活菌液的制备将菌种划线接种于血平皿,厌氧培养48h。观察菌落形态特征、染色特性、大小、球杆状和分布情况等。菌落特征:脆弱拟杆菌zy-312在血平皿上培养48h后,呈现圆形微凸、半透明、白色、表面光滑、不溶血,菌落直径在1-3mm之间,参见图1。显微镜下形态:脆弱拟杆菌zy-312进行革兰氏染色镜检,为革兰阴性细菌,呈现典型的杆状,两端钝圆而浓染,菌体中间不着色部分形如空泡,参见图2。选取单个菌落接种于改良的胰蛋白胨肉汤中进行增菌培养,所得菌液离心沉淀,转速3000r/min,离心15min,去上清,沉淀物用生理盐水洗涤后用生理盐水稀释,用麦氏比浊管做菌数测定,稀释至106cfu/ml,108cfu/ml,1010cfu/ml,分别标记为样品a、样品b和样品c,保存备用。实施例2脆弱拟杆菌对大鼠溃疡性肠炎的疗效一、实验方法本实施例通过2,4-二硝基苯磺酸(dinitrobenzenesulfonate,dnbs)诱导建立大鼠溃疡性肠炎(ulcerativecolitis,uc)模型。本实施例110只wistar大鼠,雌雄各半,向大鼠肠道内灌注0.5ml浓度为50mg/ml的dnbs(dnbs溶解于30%乙醇中,现配现用)诱导造模。每只实验用大鼠均分配有一个唯一编号。在对大鼠进行分组之前,应在鼠笼的标签上标注项目编号、种属/品系、性别、笼号及动物号。使用biobook软件根据大鼠的初始体重进行随机分组。day-2开始,大鼠禁食48h。5%的葡萄糖盐溶液(10ml/kg)作为实验动物在禁食期间的能量补充剂。在实验的day0,禁食大鼠用舒泰(25mg/kg)麻醉之后从大鼠肛门至结肠左曲(至肛门约8cm)处注入0.5ml,50mg/ml的dnbs来诱导大鼠肠炎。group1组大鼠注入30%乙醇。大鼠均保持头朝下姿势15min直至其苏醒,以防止dnbs倒流。具体实验分组及给药方案如下:表1实验分组及给药方案二、观察指标及判定1、粪便评分及收集实验过程中,每天对大鼠粪便状态进行评分,(0=正常,1=潮湿/粘,2=松软,3=液体);每组动物分成两批,造模当天记为day0。2、血清采集,观察结直肠每批动物均在解剖前,收集外周血,室温放置30分钟后以2000g,4℃离心10分钟。分离大约1ml上清,低温保存。两批动物分别在day7和day14天经舒泰(50mg/kg)麻醉后解剖,剪开腹腔,取出结直肠,纵向剖开,对结直肠内的粪便性状进行评分,冲洗干净结直肠后,观察溃疡面,记录溃疡面积、结直肠的长度和重量,并整体拍照。大鼠结肠损伤评分标准见表2。取实验动物整段结直肠组织(从盲肠到肛门),纵分为二,其中一半结直肠组织置于液氮,-80℃保存;另一半用10%福尔马林溶液固定,以备用。表2宏观评估大鼠结肠损伤评分三、结果及分析表3第0天—第14天粪便评分表4第7天肠粘连程度、肠梗阻程度、溃疡程度、肠壁增厚程度评分表5第14天肠长度、重量及溃疡面积的宏观评价使用均值±标准误差(mean±s.e.m)统计动物的体重、结直肠的长度、重量以及溃疡面积。结直肠相关变量用anova结合dunnett’s进行多重分析。动物体重相关数据使用anova进行多重比较。当p<0.05时,则认为在统计学上有差异。本实验对wistar大鼠用dnbs结肠内给药诱导其产生溃疡性结肠炎,结肠炎表现为:结肠重量增加,结肠重量:体重比率(即cw/bw)增加,结肠溃疡面积增大,日常的粪便评分增加,肠粘连程度和肠壁增厚。在本实验中,阳性药物对照组(柳氮磺吡啶)以及本发明提供的低(106cfu/ml)、中(108cfu/ml)、高(1010cfu/ml)剂量脆弱拟杆菌均降低了wistar大鼠日常粪便评分,结肠重量及溃疡面积,表现出了显著降低肠道粘连和肠壁增厚的效果,详见表3、表4、表5以及图3。脆弱拟杆菌低(106cfu/ml)、中(108cfu/ml)、高(1010cfu/ml)剂量组表现出了很好的抑制溃疡性肠炎的药效。通过对各组实验检测结果数据分析可见,在低剂量(实验组1)即表现出抑制溃疡性肠炎的药效,通过提高剂量(实验组2、实验组3),对抑制溃疡性肠炎的药效基本接近正常对照组或阳性药物对照组。脆弱拟杆菌低(106cfu/ml)、中(108cfu/ml)、高(1010cfu/ml)剂量组均能有效降低cw/bw(结肠重量/体重*100)、cw/cl/bw(结肠重量/结肠长度/体重*1000),其中高剂量的脆弱拟杆菌显著降低cw/bw(结肠重量/体重*100)、cw/cl/bw(结肠重量/结肠长度/体重*1000),详见表5。在day7和day14的动物剖检中,脆弱拟杆菌低(106cfu/ml)、中(108cfu/ml)、高(1010cfu/ml)剂量三个剂量组均能明显地降低肠粘连度和肠壁增厚程度,对溃疡面积评分也有一定的抑制效果。综上所述,本发明提供的脆弱拟杆菌对dnbs诱导的大鼠结肠炎具有明显的治疗作用,具有增强肠粘膜屏障的作用。实施例3、肠黏膜通透性检测肠黏膜通透性处于正常水平可以有效阻挡外来微生物和毒素的侵袭,有利于机体的内环境稳定,是机体健康的保证。本实施例选择实施例2中day7、day14收集的病变最明显的结肠段检测本发明提供的脆弱拟杆菌对肠道通透性的调节作用,检测以下项目:1)组织病理变化:he染色观察组织变化,炎症浸润情况;透射电镜观察病变超微结构变化,观察上皮细胞形态、上皮间紧密连接,上皮通透性变化。本实施例选用实施例2中正常对照组、模型对照组、阳性药物对照组和实验组1中day7收集的结肠,按照常规方法进行he染色观察,结果如图4。显微镜下可以观察到,模型对照组的肠粘膜上皮层完整性受到破坏,伴有炎性细胞浸润,隐窝扭曲变形及黏膜下水肿。而正常对照组、阳性药物对照组和实验组1的大鼠结肠组织未见明显的病理改变。2)肠黏膜通透性:使用外翻肠囊法,将制备的肠囊置于添加了乳果糖和甘露醇的hbss缓冲液(ph7.4)中,收集培养后的肠囊内培养液,经高效液相色谱仪测定。具体步骤:(1)外翻肠囊的制备:分别取实施例2中模型对照组、阳性药物对照组和实验组2中day7病变最明显的结肠段,去掉肠系膜,用生理盐水(或缓冲液)冲洗干净,外翻使肠粘膜向外,结扎一端形成肠囊状,灌注hbss缓冲液(ph7.4)后结扎另一端,并做好标记。(2)将步骤(1)制备的外翻肠囊置于添加了乳果糖和甘露醇的培养液中,通入95%氧气和5%二氧化碳的混合气体,培养2h。(3)用注射器分别抽取肠囊中的培养液进行高效液相色谱仪测定。结果:模型对照组、阳性药物对照组和实验组2中乳果糖和甘露醇含量的比值为0.079±0.51、0.021±0.003和0.026±0.007,从检测结果发现阳性药物对照组和实验组2中乳果糖和甘露醇含量的比值比模型对照组中的明显降低,差异显著(p<0.05),具有统计学意义。可见,经过dnbs处理后,大鼠结肠段肠粘膜屏障的通透性明显增加,而经柳氮磺吡啶和脆弱拟杆菌治疗后均可明显降低大鼠结肠段肠粘膜屏障的通透性。3)肠壁炎症:肠组织匀浆后,检测tnf-α,ifn-γ,il-13,il-17。具体步骤如下:tnf-α,ifn-γ,il-13,il-17水平测定分别按试剂盒要求切取肠段,去除脂肪系膜组织,加冰生理盐水制备10%匀浆,-20℃贮存待测;除空白孔外,分别将样品或不同浓度的标准品(100μl/孔)加入相应孔中,用封板胶纸封住反应孔,37℃恒温箱孵育90min;甩去酶标版内液体,洗板4次,每次5分钟;除空白孔外,加入生物素抗体工作液(100μl/孔),用封板胶纸封住反应孔,37℃恒温箱孵育60min;用0.01mpbs洗板4次,每次5分钟;除空白孔外,加入亲和素-过氧化物复合物(abc)工作液(100μl/孔)用封板胶纸封住反应孔,37℃恒温箱孵育30min;用0.01mpbs洗板4次,每次5分钟;加入显色剂(100μl/孔),避光37℃恒温箱孵育10~15min;加入终止剂(100μl/孔),混匀后即刻在450nm处测量od值;每个样本od值减去空白孔的od值后,建立标准曲线,根据标准曲线计算各样品中的tnf-α,ifn-γ,il-13,il-17含量。结果如表6所示:正常对照组小鼠结肠匀浆中tnf-α,ifn-γ,il-13,il-17含量分别为9.34±3.45ng/g、7.94±1.52ng/g、8.05±1.34ng/g、15.04±3.77ng/g;模型对照组小鼠结肠匀浆中tnf-α,ifn-γ,il-13,il-17含量分别为35.42±5.36ng/g、21.84±4.96ng/g、18.09±3.12ng/g、38.97±5.67ng/g。与正常对照组大鼠相比,模型对照组大鼠结肠匀浆中tnf-a、ifn-γ的含量明显增高(p<0.01),提示大鼠肠粘膜中免疫失衡,促炎细胞因子水平明显增高。与模型对照组大鼠相比,经过柳氨磺吡啶(阳性药物对照组)和本发明提供的脆弱拟杆菌(实验组)治疗后,大鼠结肠匀浆中tnf-a、ifn-γ的含量明显降低(p<0.01),与正常对照组大鼠结肠匀浆中tnf-a、ifn-γ的含量相当,差异不显著(p>0.05)。表6结肠匀浆中tnf-α,ifn-γ,ifn-13,il-17含量细胞因子正常对照组模型对照组阳性药物对照组实验组1tnf-α(ng/g)9.34±3.4535.42±5.36*10.06±2.399.88±3.20ifn-γ(ng/g)7.94±1.5221.84±4.96*8.65±2.039.74±3.41ifn-13(ng/g)8.05±1.3418.09±3.12*8.53±1.6710.21±2.19il-17(ng/g)15.04±3.7738.97±5.67*16.78±4.3116.33±4.01注:*表示正常对照组相比p<0.05,差异显著。4)肠粘膜屏障相关蛋白主要有zo-1,occludin,b-catenin和claudin-1,本实施例使用免疫组化、westernblot法检测实施例2中day14中的正常对照组、模型对照组、阳性药物对照组和实验组1的肠粘膜屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的差异。结果如图5所示。图5结果显示:模型对照组中zo-1,occludin,b-catenin和claudin-1的肠粘膜屏障相关蛋白的表达明显低于正常对照组,而阳性药物对照组和实验组1分别经柳氨磺吡啶、脆弱拟杆菌治疗后,肠粘膜屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的表达量明显增加,其中实验组1中的表达量与正常对照组相当。可见,本发明提供的脆弱拟杆菌可明显提高肠粘膜屏障相关蛋白的表达量,可有效地增强肠粘膜屏障的作用。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1