糖类化合物的医药用途的制作方法
本发明属于生物医药领域,具体而言,本发明涉及一种糖类化合物的医药用途,尤其是涉及有效治疗和/或预防脂质代谢异常或与其相关的疾病或病症的用途。
背景技术:
脂质代谢异常是先天性或获得性因素造成的血液及其他组织器官中脂质及其代谢产物质和量的异常。脂质的代谢包括脂类在小肠内消化、吸收,由淋巴系统进入血循环(通过脂蛋白转运),经肝脏转化,储存于脂肪组织,需要时被组织利用。脂类代谢受遗传、神经体液、激素、酶以及肝脏等组织器官的调节。当这些因素出现异常,可造成脂质代谢紊乱和有关器官的病理生理变化。近年来,中国人群的血脂水平逐步升高,脂质代谢异常患病率已有明显增加。全国调查结果显示,成人血清总胆固醇(totalcholesterol,tc)平均为4.5mmol/l,高胆固醇血症的患病率4.9%;甘油三酯(triglyceride,tg)平均为1.38mmol/l,高tg血症的患病率13.1%;高密度脂蛋白胆固醇(highdensitylipoproteincholesterol,hdl-c)平均为1.19mmol/l,低hdl-c血症的患病率33.9%。流行病学调查发现,血脂异常,尤其是低密度脂蛋白胆固醇(lowdensitylipoproteincholesterol,ldl-c)持续偏高是诱发和促进动脉粥样硬化发生、发展的重要危险因素,与缺血性心脑血管疾病密切相关,严重威胁人类健康。
现已发现,某些代谢疾病如代谢综合征的发病往往由于一种或多种危险因素综合作用导致。为此,在这些疾病的治疗方案中,通常需要针对不同的危险因素(包括超重、胰岛素抵抗、高甘油三酯、高胆固醇、高血压等)有针对性地进行治疗,从而改善患者多方面的生理指标。脂质代谢异常通常与脂肪细胞的肥大化及脂质异常有关。在目前的诊疗中,通常使用血中的总胆固醇值或中性脂肪(血中甘油三酯)的值作为脂质代谢异常的指标。这些指标的升高将表明受试者罹患动脉硬化等心血管疾病的风险会变高。目前,在此类脂质代谢异常的治疗中使用他汀类(statins)、贝特类(fibrates)药物。
迄今为止,尚未发现蠕虫衍生的糖或其衍生物,特别是蠕虫衍生的聚糖和/或其糖缀合物等,例如包含lewis抗原的化合物,例如包含lewisx、lewisy、lewisa或lewisb的寡糖(如三糖、四糖、五糖等)的化合物或其衍生物用于治疗高胆固醇血症及其关联病症的报道。
技术实现要素:
为改善现有技术中存在的上述问题,本发明提供选自蠕虫衍生的糖或其衍生物中的一种或多种在制备药物中的用途,所述药物用于预防和/或治疗与脂质代谢异常或与其相关的疾病或病症。
根据本发明的实施方案,所述衍生自蠕虫的糖可以选自衍生自蠕虫的聚糖。例如,所述衍生自蠕虫的糖可以选自包含lewis抗原的化合物,例如包含lewisx、lewisy、lewisa或lewisb的寡糖(如三糖、四糖、五糖等)的化合物。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物可以选自包含lewis抗原的化合物,例如包含lewisx、lewisy、lewisa或lewisb的寡糖(如三糖、四糖、五糖等)的化合物或其衍生物。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物可以是例如sea、sea-衍生的聚糖。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物包括例如选自lnfpiii(casno.25541-09-7)、lnnt、ldn、ldnf的化合物或其衍生物,如糖缀合物;
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物包括lnfpiii或其衍生物。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物包括lnfpiii-右旋糖酐、lnfpiii-人血清白蛋白。
根据本发明的实施方案,所述衍生自蠕虫的糖的衍生物可以选自其糖缀合物,或它们的立体异构体、活性代谢产物、药学上可接受的盐、前药、多晶型物或溶剂化物。
如果合适,所述蠕虫衍生的糖或其衍生物也可以是所述化合物中两种或更多种的混合物。
根据本发明,所述蠕虫衍生的糖或其衍生物可以例如选自下式i所示的化合物、其糖缀合物、立体异构体、活性代谢产物、药学上可接受的盐、前药、多晶型物或溶剂化物:
其中,r1代表h、oh、
作为实例,所述蠕虫衍生的糖或其衍生物可以例如选自下式ii所示的化合物、其糖缀合物、立体异构体、活性代谢产物、药学上可接受的盐、前药、多晶型物或溶剂化物:
其中,r1’代表h、oh、
根据本发明的实施方案,所述蠕虫衍生的糖和/或其衍生物(如糖缀合物)可以与载体分子交联。
根据本发明的实施方案,蠕虫衍生的糖和/或其衍生物(如糖缀合物)与载体分子的缀合物的分子量为约5,000至约100,000道尔顿,优选为约10,000至约40,000道尔顿。
根据本发明示例性的实施方案,所述缀合物每个载体分子具有2至200个包含蠕虫衍生的糖和/或其糖缀合物的寡糖分子,优选为具有10至100个包含蠕虫衍生的糖和/或其糖缀合物的寡糖分子,如具有20至50个包含蠕虫衍生的糖和/或其糖缀合物的寡糖分子。
根据本发明的实施方案,所述载体选自碳水化合物聚合物、蛋白质或聚丙烯酰胺,如葡聚糖或人血清白蛋白。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物可以经胃肠外给药、腹膜内给药、静脉给药或口服给药。
根据本发明的实施方案,所述蠕虫衍生的糖或其衍生物的用药剂量,以蠕虫衍生的糖计,可以为10~2000mg/天,优选为20-1000mg/天,例如100-800mg/天,如普通成人为约250mg/天。
根据本发明,上述蠕虫衍生的糖或其衍生物每天的治疗或预防有效剂量的非限制性范围,以蠕虫衍生的糖计,分别为0.1~100mg/kg体重,优选为0.5~90mg/kg体重,更优选1.0~80mg/kg体重。值得注意的是,计量值可以随需要缓解的症状的严重程度和根据因素如受试者的疾病状态、年龄、性别和体重发生变化。
本发明还提供一种用于预防和/或治疗与脂质代谢异常或与脂质代谢异常相关的疾病或病症的药物组合物,包含选自所述蠕虫衍生的糖或其衍生物的一种或多种作为活性成分。
本发明还提供所述药物组合物在制备药物中的用途,所述药物用于预防和/或治疗脂质代谢异常或与脂质代谢异常相关的疾病或病症。
根据本发明,所述脂质代谢异常包括但不限于高脂质水平,如高胆固醇水平、低hdl胆固醇水平、高中性脂肪水平。
根据本发明,所述与脂质代谢异常相关的疾病或病症包括但不限于高脂血症(例如高胆固醇血症、低hdl胆固醇血症、高中性脂肪血症)、动脉硬化(如动脉粥样硬化)或其他相关心血管事件风险增高。
所述药物可用于降低总胆固醇、甘油三酯、低密度脂蛋白胆固醇,和/或升高高密度脂蛋白胆固醇。为此特别有利地,所述药物可用于预防和/或治疗高胆固醇血症。
优选地,所述疾病或病症是与胆固醇异常(如高胆固醇)相关的高脂血症、动脉硬化(如动脉粥样硬化)或其他相关心血管事件风险增高。
本发明还提供所述选自蠕虫衍生的糖或其衍生物中的一种或多种的用途,其用于预防和/或治疗脂质代谢异常或与脂质代谢异常相关的疾病或病症。
本发明还提供所述药物组合物的用途,其用于预防和/或治疗脂质代谢异常或与脂质代谢异常相关的疾病或病症。
发明人惊讶地发现,本文定义的蠕虫衍生的糖或其衍生物中的一种或多种可以用于预防和/或治疗与脂质代谢异常相关的疾病或病症,特别是高脂血症如高胆固醇血症,以及相关疾病或病症。迄今为止,对此类化合物的相关活性并无研究。不希望拘囿于理论,通过本文实施例证明,本发明化合物具有相似的生物活性。为此,应当理解,lewis三糖作为蠕虫衍生的糖或其衍生物,特别是lnfpⅲ的核心结构在成人血清总胆固醇的合成调节活性发挥作用,可能是此类结构具有所述生物活性的结构基础。这将为抗高血脂、抗高固醇类药物的开发提供更多的选择。
术语解释和定义
本文所用术语“蠕虫衍生的糖”,特别是“蠕虫衍生的聚糖”是指存在于真核寄生虫分类“蠕虫”中的聚糖种类,如jonhston等人,parasitology2009;136:125-47和die和cummings,glycobiology2010;20:2-12所述(例如但不限于血吸虫属,例如曼氏血吸虫;肝片吸虫属,例如肝片形吸虫;棘球绦虫属,例如房棘球绦虫的蠕虫)。该聚糖包括含lewisx抗原(例如lnfpiii)、非-lewisx抗原(例如lnnt和ldn(和ldn衍生物))的化合物、或lewisx和非-lewisx抗原的混合物(例如sea)。
本文所用的“糖缀合物”是指与载体分子交联的聚糖分子,例如脂质(如糖脂、磷脂)、蛋白的蠕虫衍生的聚糖。
在一个实施方案中,在本发明方法中使用的化合物包含蠕虫衍生的聚糖和/或其糖缀合物,例如,包含lewis抗原的化合物。lewis抗原可以是,例如,lewisx、lewisy、lewisa或lewisb寡糖,或其衍生物。在治疗高胆固醇血症的一些实施方案中,lewis抗原优选是lewisx。lewis抗原也可以存在于较大的碳水化合物结构中。例如,所述化合物的碳水化合物部分可以是乳-n-岩藻五糖iii(lnfpiii),其具有结构:{gal(β1-4)[fuc(α1-3)]glcnac(β1-3)gal(β1-4)glc}并包含lewisx寡糖。
在具体实施方案中,在本发明方法中通常使用的含蠕虫衍生的聚糖和/或其糖缀合物的化合物,其碳水化合物结构是以多价交联的形式存在的。在一个优选的实施方案中,包含蠕虫衍生的聚糖和/或其糖缀合物的化合物是载体分子与表达蠕虫衍生的聚糖和/或其糖缀合物的多种碳水化合物分子的缀合物。例如,碳水化合物分子可以缀合至蛋白载体,例如人血清白蛋白(has)和lewisx寡糖的缀合物(hsa-lewisx)。当将糖-载体蛋白缀合物给药至受试者,应选择在受试者中不会刺激载体蛋白产生免疫反应的载体蛋白(例如,应对人受试者使用人载体蛋白,等等)。
替代载体蛋白,表达lewis或非-lewis抗原的碳水化合物分子可缀合至其他载体分子,例如保护该化合物免于从体内快速消除的载体,如控释制剂,其包括移植物和微囊化递送系统。可以使用可生物降解的、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。
其它优选的载体包括聚合物,例如碳水化合物或多糖聚合物。优选的碳水化合物聚合物是葡聚糖。通常,用作载体分子的碳水化合物或多糖具有约5,000-100,000道尔顿的分子量,优选地约8,000-80,000道尔顿之间,更优选地约10,000-50,000或10,000-40,000道尔顿。
相对于缀合到载体的糖的密度,所述糖分子优选包含缀合物按重量计的至少10%,更优选缀合物按重量计的至少15%,甚至更优选缀合物按重量计的至少20%和甚至更优选缀合物按重量计的至少25%或缀合物按重量计的至少30%或缀合物按重量计的至少35%或缀合物按重量计的至少40%或缀合物按重量计的至少45%。在具体实施方案中,所述糖分子包含缀合物按重量计的约10-25%,缀合物按重量计的约15-25%或缀合物按重量计的约20-25%或缀合物按重量计的约30-35%或缀合物按重量计的约35-40%或缀合物按重量计的约40-45%。在一些实施方案中,缀合物包含10-11、12-13、14-15、16-17、18-19或20个或更多的糖/缀合物。甚至更优选地,包含表达lewis抗原的碳水化合物的化合物是包含25、30、35、40、45、50或更多糖/缀合物的缀合物。在一个优选的实施方案中,包含表达lewis抗原的碳水化合物的化合物是表达lewis抗原的多种碳水化合物分子和载体聚丙烯酰胺的缀合物。更优选地,所述聚丙烯酰胺缀合物包含25-30(或更多)的糖/缀合物,其中所述缀合物的平均分子量是约30kd。可选地,化合物或与lewis抗原组合,可以包含表达非-lewis抗原的碳水化合物。
除了上述包含含有lewis和/或非-lewis抗原的糖的缀合物,其它包含lewis和/或非-lewis抗原的化合物包括分离的蛋白,该蛋白天然地以适于抑制脂肪形成和预防或治疗fld的形式包含lewis和/或非-lewis抗原。这样的蛋白的一个实例是血吸虫卵抗原(sea),其表达lewisx和非-lewisx寡糖。
sea可以从各种物种中分离。该血吸虫属包含具有不同生命周期的21种蠕虫。其中的三个认为是导致人类血吸虫病的主要种类-曼氏血吸虫、日本血吸虫和埃及血吸虫。
可以使用标准方法生成蠕虫衍生的聚糖和/或其糖缀合物的多价形式。例如,使用本领域已知的技术将蠕虫衍生的聚糖和/或其糖缀合物的寡糖部分结合到多价载体上从而形成缀合物,其中寡糖的多于一个的单一分子共价结合到多价载体上。多价载体是足够大的,以提供多价分子寡糖部分的2-1,000(即p=2-1,000的整数),优选2-200,优选2-100,更优选10-100,更优选为2-50,更优选10-50,甚至更优选20-50个分子结合到所述多价载体上。在具体优选的实施方案中,13、25、35、45、50、100或200个包含蠕虫衍生的聚糖和/或其糖缀合物的分子,例如lnfpiii结合到多价载体上。
合适的多价载体包括具有多个结合位点的化合物,该结合位点能够与末端连接基团形成键(该末端连接基团能够结合到还原性末端糖上),或该结合位点能够与葡萄糖或n-乙酰葡萄糖胺残基的c1糖苷氧形成键。实例包括但不限于,多元醇、多糖、多聚赖氨酸抗生物素蛋白、聚丙烯酰胺、碳水化合物(例如葡聚糖)、脂质、脂质乳剂、脂质体、树枝状聚合物、蛋白质(例如人血清白蛋白(has)、牛血清白蛋白(bsa))或环糊精。
本文所用术语“lewis抗原”是指包括具有乳i型结构{gal(β1-3)glcnac}或乳ii型结构{gal(β1-4)glcnac}作为核心序列的碳水化合物,其被一个或多个岩藻糖残基取代。lewis抗原可以包含单取代的核心序列或重复序列取代的核心序列。此外,核心序列可以存在于一个较大的糖内。因此,含lewis抗原的寡糖可以是例如三糖、四糖、五糖等。lewis抗原的类型包括lewisx、lewisy、lewisa和lewisb寡糖及其衍生物。这些保留本文所述的调节脂质代谢异常的碳水化合物的合成的结构同系物也旨在通过术语“lewis抗原”所涵盖。
本文所用术语“lewisx寡糖”是指包含结构:{gal(β1-4)[fuc(α1-3)]glcnac}的乳ii型碳水化合物。
本文所用术语“lewisy寡糖”是指包含结构:{fuc(α1-2)gal(β1-4)[fuc(α1-3)]glcnac}的乳ii型碳水化合物。
本文所用术语“lewisa寡糖”是指包含结构:{gal(β1-3)[fuc(α1-4)]glcnac}的乳i型碳水化合物。
本文所用术语“lewisb寡糖”是指包含结构:{fuc(α1-2)gal(β1-3)[fuc(α1-4)]glcnac}的乳i型碳水化合物。
如本文所用的,lewis寡糖的“衍生物”是指具有一个或多个额外的取代基的lewis寡糖。衍生物的实例包括lewis寡糖的末端唾液酸化形式(例如,唾液酸化-lewisx、唾液酸化-lewisy、唾液酸化-lewisa、唾液酸化-lewisb)、lewis寡糖的硫酸化形式以及lewis寡糖的磺基-唾液酸化形式。
本文所用术语“sea”是指血吸虫卵抗原或可溶性卵抗原,其包含lewisx和非-lewisx抗原。“sea-衍生的聚糖”是指存在于sea的各种不同的多糖种类,例如但不限于,lnfpiii、lnnt、ldn和ldnf。
本文所用术语“ln”是指具有结构:{gal(β1-4)glcnac}的糖。
本文所用术语“lnfpiii”是指具有结构:{gal(β1-4)[fuc(α1-3)]glcnac(β1-3)gal(β1-4)glc}并包含lewisx抗原的化合物。
本文所用术语“lnnt”(乳-n-新四糖)是指具有核心结构:{gal(β1-4)glcnac(β1-3)gal(β1-4)glc}的聚乳糖胺糖。lnnt是lnfpiii的非岩藻糖基同系物。
本文所用术语“ldn”(lacdinac)是指具有结构:{galnac(β1-4)glcnac}的糖。岩藻糖基ldn,即本文中称为“ldnf”具有结构:
{galnac(β1-4)(fucα1-3)glcnacβ1}。ldn的其他岩藻糖基衍生物包括但不限于,ldn-df{galnac(β1-4)[fuc(α1-2)fuc(α1-3)]glcnacβ1}、f-ldn{fuc(α1-3)galnac(β1-4)glcnacβ1}、f-ldn-f{fuc(α1-3)galnac(β1-4)[fuc(α1-3)]glcnacβ1}和df-ldn-df{fuc(α1-2)fuc(α1-3)galnac(β1-4)[fuc(α1-2)fuc(α1-3)]glcnacβ1}(peterson等人,intjparasitology2009;39:1331-44;hokke等人,expparasitology2007;117:275-83)。ldn及其岩藻糖基衍生物均被认为是在本发明的范围之内。
术语“药学上可接受的盐”包括本发明化合物与酸或碱形成的盐。
术语“前药”包括在它们滞留于体内期间被(例如通过酶过程或水解过程)转化成本发明化合物的化合物。
术语“溶剂化物”是指在固态或液态下通过配位与溶剂分子形成复合物的那些化合物形式。水合物是与水发生配位的溶剂合物特殊形式。本发明范围内的溶剂合物优选水合物。
取决于其结构,根据本发明的化合物可以立体异构形式(对映体,非对映体)存在。本发明因此包含对映体或非对映体和其各自的混合物。可以用已知方法从对映体和/或非对映体的混合物分离出对映异构体一致的组分。
在本文的描述中,术语“实施例”、“实例”、“实施方案”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施方案、实例、实施例或示例中以合适的方式结合。
附图说明
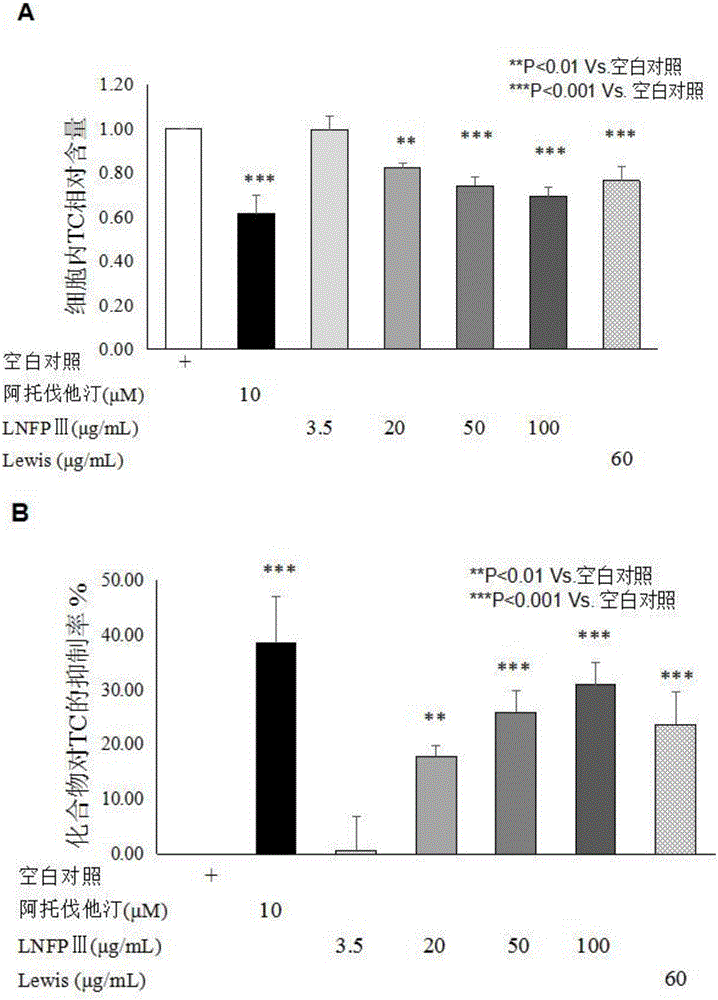
图1显示了根据本发明的实施例1,lnfpⅲ抑制hepg2细胞内胆固醇合成的情况;其中a为各化合物处理后hepg2细胞内tc的相对含量,b为各化合物对细胞内胆固醇合成的抑制率;
图2显示了根据本发明的实施例2,lnfpⅲ抑制水溶性胆固醇诱导引起的hepg2细胞内总胆固醇蓄积的情况;其中a为水溶性胆固醇诱导和各化合物处理后hepg2细胞内tc的相对含量,b为各化合物对比水溶性诱导胆固醇蓄积组,对细胞内胆固醇的抑制率;
图3显示了根据本发明的实施例3,lnfpⅲ改善tritonwr1339静脉注射诱导的大鼠高脂血症模型脂质紊乱的时间-含量曲线下面积auc对比图;
图4显示了根据本发明的实施例4,lnfpⅲ降低ldlr-ko小鼠血清tc、ldl-c水平的时间-含量曲线下面积auc对比图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明所记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本发明所限定的范围。
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
试剂和仪器
糖分析仪(dx-50),购于dionex公司。
人肝癌细胞株(hepg2细胞,bncc338070)购于北纳生物;
dmem培养基(11960-044)购于gibco公司。
胎牛血清(10091-148)购于gibco公司。
青霉素-链霉素双抗(15070-063)购于gibco公司。
阿托伐他汀(phr1422)购于sigma-aldrich公司。
pbs缓冲液(sh30256.01)购于hyclone公司。
bca蛋白定量试剂盒(p0010s)购于上海碧云天公司。
组织细胞总胆固醇检测试剂盒(e1015)购于北京普利莱公司。
水溶性胆固醇(c4951)购于sigma-aldrich公司。
tritonwr1339(25301-02-4)购于北京百灵威公司。
非诺贝特(f6020)购于sigma-aldrich公司。
总胆固醇(tc)测定试剂盒(a111-1)购于南京建成公司。
甘油三酯(tg)测定试剂盒(a110-1)购于南京建成公司。
高密度脂蛋白胆固醇(hdl-c)测定试剂盒(a112-1)购于南京建成公司。
低密度脂蛋白胆固醇(ldl-c)测定试剂盒(a113-1)购于南京建成公司。
spraguedawley大鼠(雄性)购于湖北省疾病预防控制中心。
c57bl/6j小鼠(雄性)购于南京大学-南京生物医药研究院。
ldlr-ko小鼠(雄性)购于南京大学-南京生物医药研究院。
本发明lnfpiii化合物采用现有技术进行制备(cn100342025c说明书第33页、实施例21),将能表达人来源的α1,3-岩藻糖基转移酶(生物化学杂志.,269,14730(1994))的namalwa细胞系的培养液,能从gtp的前体物质产生gtp的微生物的培养液,以及能从糖和gtp产生gdp-fuc的微生物的培养液或这些培养物的处理物作为酶源,进行酶反应,可从gmp,甘露糖,乳-n-新四糖产生乳-n-岩藻五糖iii。或者,将能表达幽门螺杆菌来源的α1,3-岩藻糖基转移酶(生物化学杂志.,272,21349和21357(1997))微生物的培养液,能从gtp的前体物质产生gtp的微生物的培养液,以及能从糖和gtp产生gdp-fuc的微生物的培养液或这些培养物的处理物作为酶源,进行酶反应,可从gmp,甘露糖,乳-n-新四糖产生乳-n-岩藻五糖iii。其中,glcnac:n-乙酰基葡糖胺;udp-gal:尿苷-5’-二磷酸半乳糖;udp-glcnac:尿苷-5’-二磷酸-n-乙酰基葡糖胺;gdp-fuc:尿苷-5’-二磷酸果糖。
实施例1lnfpiii制备
iggsepharose连接的α1,3-岩藻糖基转移酶的制备来源于用质粒pamoa-ft6转化的namalwa细胞系kjm-1(生物化学杂志.,269,14730(1994))并被用作α1,3-岩藻糖基转移酶的酶源,其中该质粒含有编码蛋白质aigg结合区与α1,3-岩藻糖基转移酶的融合蛋白的基因。在由0.25mm乳-n-四糖(oxfordglycosystems),1.0uiggsepharose连接的α1,3-岩藻糖基转移酶,6μlgdp-fuc(0.25mm)的反应液,100mmtris-hcl(ph7.9),10mmmncl2组成的50μl反应液于37℃放置24小时。反应结束后,以dionex产的糖分析仪(dx-50)对反应液中所积累的产物量进行测定。通过将产物的洗脱时间与乳-n-岩藻五糖iii的洗脱时间进行比较而对产物进行鉴定。
用于本发明方法的化合物可市售购得的或者可以通过标准方法纯化或合成。例如,含lewis抗原的糖和载体蛋白(例如hsa)的缀合物可从accuratechemicals,westbury,n.y.购买。含lewis抗原的糖和聚丙烯酰胺的缀合物可从glycotech,rockville,md购买。血吸虫卵抗原(sea)可以如harn等人,(1984)j.exp.med.159:1371-1387描述的从曼氏血吸虫卵纯化。含lewis抗原的糖或其衍生物可以通过标准方法,例如使用化学交联剂,将其缀合至载体分子。各种双官能团或多官能团的交联剂,无论是同种和异种功能的,都是本领域已知的并且是商购的(例如,piercechemicalco.,rockford,ill.)。可以将多于一种蠕虫衍生的聚糖和/或其糖缀合物缀合到单一载体上。在一个非限制性的实施方案中,可以将一个或多个lnfpiii、lnnt、ldn和ldnf缀合到相同的载体分子上。可以通过将蠕虫衍生的聚糖的混合物,而不是单一的蠕虫衍生的聚糖缀合到载体分子上实现这样的缀合。
可以使用标准方法生成蠕虫衍生的聚糖和/或其糖缀合物的多价形式。例如,使用本领域已知的技术将蠕虫衍生的聚糖和/或其糖缀合物的寡糖部分结合到多价载体上从而形成缀合物,其中寡糖的多于一个的单一分子共价结合到多价载体上。多价载体是足够大的,以提供多价分子寡糖部分的2-1,000(即p=2-1,000的整数),优选2-200,优选2-100,更优选10-100,更优选为2-50,更优选10-50,甚至更优选20-50个分子结合到所述多价载体上。在具体优选的实施方案中,13、25、35、45、50、100或200个包含蠕虫衍生的聚糖和/或其糖缀合物的分子,例如lnfpiii结合到多价载体上。
合适的多价载体包括具有多个结合位点的化合物,该结合位点能够与末端连接基团形成键(该末端连接基团能够结合到还原性末端糖上),或该结合位点能够与葡萄糖或n-乙酰葡萄糖胺残基的c1糖苷氧形成键。实例包括但不限于,多元醇、多糖、多聚赖氨酸抗生物素蛋白、聚丙烯酰胺、碳水化合物(例如葡聚糖)、脂质、脂质乳剂、脂质体、树枝状聚合物、蛋白质(例如人血清白蛋白(has)、牛血清白蛋白(bsa))或环糊精。
构建多价分子和将寡糖连接到所述多价载体所必需的化学是连接化学领域已知的。本发明连接化学的非限制性实施方案包括美国专利第5,736,533号,stowell等人(stowell等人,advancesincarbohydratechemistryandbiochemistry1980;37:225)和smith等人(smith等人,(1978)complexcarbohydratespartc,methodsinenzymology,volumel,ed.byv.ginsburg,pg.169)描述的方法,每一种方法全部引入本文作为参考。
例如,还原性末端糖与载体分子之间的键可以通过以下形成:将还原性末端糖c1的醛或羧酸或由氧化引入的还原性末端糖的任何醛或羧酸基团与载体分子反应,以形成一个合适的键,例如-nh-、-n(r'),其中r'是c1-20烷基、羟基烷胺、酰胺、酯、硫酯、硫代酰胺。还原性末端糖与载体分子之间的键也可以通过如下形成:将吡喃糖形式的c1羟基与酰化剂和分子卤反应,接着与亲核试剂反应以形成合适的键,例如形成--nh-、-n(r')-、其中r'是c1-20烷基(如stowell等人所述,同上)。该寡糖部分可以通过还原性末端糖的自由异头碳结合到多价载体上。或者,还原性末端糖可以通过smith等人所述的苯乙胺-异硫氰酸酯衍生物进行结合。可用于形成多价缀合物的各种其它的双官能和多官能交联剂是本领域已知的并且易于获得(例如,piercechemicalco.,rockford,ill.)。
实施例1:lnfpⅲ抑制hepg2细胞内胆固醇的合成
在本实施例中,研究了lnfpⅲ抑制细胞内胆固醇(tc)的合成,降低细胞裂解液中总胆固醇水平的能力。
具体研究描述如下:人肝癌细胞株(hepg2细胞,北纳生物)用含10%(v/v)胎牛血清(fbs)和1%(v/v)青霉素-链霉素双抗(ps)的dmem培养基,置于5%(v/v)co2,37℃培养箱中进行培养。当细胞密度达80%~90%时进行传代,取对数生长期细胞接种于细胞培养板中。细胞单层贴壁铺满培养板孔底时,将孔内的细胞完全培养基换成无血清的dmem培养基,使细胞饥饿培养6小时。随后设置空白对照组、阳性化合物组(阿托伐他汀,sigma)、lnfpⅲ组和lewisx组。细胞培养板中每孔按分组分别加入含有相应药物的细胞培养基,随后置于5%co2,37℃培养箱中培养24h。本实验中阿托伐他汀的使用剂量为10μm,化合物lnfpⅲ的工作剂量分别为3.5、20、50和100μg/ml,lewisx组的工作剂量为60μg/ml。化合物处理完毕后,去除孔内培养基,pbs缓冲液清洗细胞两次,每孔加入100μl细胞裂解液,轻柔震荡后,室温裂解10min,在显微镜下观察细胞是否裂解完全。用移液器吹打细胞板底,收集细胞裂解液到1.5mlep管中。取适量上清液移至另一全新的1.5mlep管中,70℃加热10min,余下的裂解液用bca法蛋白定量试剂盒(上海碧云天,p0010s)进行蛋白含量测定。上清液加热完成后,室温下2000g离心5min,取上清液用于检测。利用组织细胞总胆固醇检测试剂盒(北京普利莱,e1015)检测细胞裂解液中的tc,检测方法如表1所示。利用bca法蛋白定量试剂盒测定细胞裂解液中的总蛋白含量,检测方法如表2所示。
表1:组织细胞总胆固醇测定方法
表2:总蛋白定量检测试剂盒操作说明
实验结果:10μm的阿托伐他汀作为阳性化合物,显著的降低了hepg2细胞内的tc水平(图1a),较空白对照组,降幅可达38.67%(图1b),符合阿托伐他汀的作用描述,说明此实验模型无误。在利用不同浓度lnfpⅲ对hepg2细胞进行干预后,3.5、20、50和100μg/ml的化合物较空白对照组,分别可降低0.69%、17.84%、25.97%和30.94%细胞内的tc水平(图1a和图1b),具有明显的浓度依赖性抑制作用,经对实验结果进行统计学分析,存在显著性差异。60μg/ml的lewis对hepg2细胞进行干预后,与空白对照组相比可降低23.70%细胞内的tc水平,经对实验结果进行统计学分析,存在显著性差异(图1a和图1b)。
结论:在hepg2细胞脂质生成平台中,lnfpⅲ对细胞内tc的生成具有浓度依赖性的抑制作用,显著的抑制了细胞内tc的合成,降低细胞裂解液中tc的水平。而60μg/ml的lewis三糖(与100μg/ml的lnfpⅲ等摩尔浓度)也能够抑制细胞内tc的合成,降低细胞裂解液中tc的水平,说明lewis三糖作为lnfpⅲ的核心结构在tc合成调节中具有一定活性,可能是lnfpⅲ的生物活性结构基础。
实施例2:lnfpⅲ抑制水溶性胆固醇诱导引起的hepg2细胞内总胆固醇蓄积
以β-环糊精为载体的胆固醇(水溶性胆固醇,sigma)水溶性好,可以顺利进入细胞内部,并结合细胞自身合成的胆固醇(tc),引起hepg2细胞内tc的大量蓄积,从而构建水溶性胆固醇诱导hepg2细胞内tc蓄积模型。本实施例中,我们利用此细胞内tc蓄积模型对lnfpⅲ抑制细胞内tc蓄积的能力进行研究。
具体研究描述如下:hepg2细胞(北纳生物)用含10%(v/v)fbs和1%(v/v)ps的dmem培养基,置于5%(v/v)co2,37℃培养箱中进行培养。当细胞密度达80%~90%时进行传代,取对数生长期细胞接种于细胞培养板中。细胞单层贴壁铺满培养板孔底时,将孔内的细胞完全培养基换成无血清的dmem培养基,使细胞饥饿培养6小时。随后加入100μm的水溶性胆固醇进行诱导,同时设置空白对照组,空白模型组(水溶性胆固醇)、阳性化合物组(水溶性胆固醇和阿托伐他汀,sigma)、lnfpⅲ组(水溶性胆固醇和lnfpⅲ)和lewisx组(水溶性胆固醇和lewisx),分别加入含有相应药物的细胞培养基并在5%co2,37℃培养箱中培养24h。本实验中阿托伐他汀的使用剂量为5μm,化合物lnfpⅲ的工作剂量分别为3.5、50和100μg/ml,lewisx组的工作剂量为60μg/ml。化合物处理完毕后,去除孔内培养基,pbs缓冲液清洗细胞两次,每孔加入100μl细胞裂解液,轻柔震荡后,室温裂解10min,在显微镜下观察细胞是否裂解完全。用移液器吹打细胞板底,收集细胞裂解液到1.5mlep管中。取适量上清液移至另一全新1.5mlep管中,70℃加热10min,余下的裂解液用bca法蛋白定量试剂盒(上海碧云天,p0010s)进行蛋白含量测定。上清液加热完成后,室温下2000g离心5min,取上清液用于检测。细胞裂解液中的tc利用组织细胞总胆固醇检测试剂盒(北京普利莱,e1015)进行检测,检测方法参考实施例1中表1。细胞裂解液中的总蛋白含量利用bca法蛋白定量试剂盒进行测定,检测方法参考实施例1中表2。
实验结果:100μm的水溶性胆固醇可稳定引起细胞内tc含量升高2倍左右(图2a),5μm的阿托伐他汀对水溶性胆固醇诱导引起的细胞内tc含量升高有约46.56%的抑制率(图2a和图2b),符合阿托伐他汀的作用描述,说明此实验模型无误。而3个浓度的lnfpⅲ对细胞内蓄积的tc也具有浓度依赖性的抑制作用,抑制率分别为15.56%、28.22%和37.84%,利用单因素方差分析(one-wayanova),dunnett分析法进行统计学分析,存在显著性差异(图2a和图2b)。60μg/ml的lewis对水溶性胆固醇诱导的hepg2细胞进行干预后,与空白模型组相比可降低26.03%细胞内的tc蓄积,经对实验结果进行统计学分析,存在显著性差异(图2a和图2b)。
结论:在水溶性胆固醇诱导hepg2细胞tc蓄积模型中,lnfpⅲ对细胞内tc的蓄积具有浓度依赖性的抑制作用,可降低细胞裂解液中tc的水平,安全有效的抑制水溶性胆固醇诱导的hepg2细胞中tc蓄积现象。而60μg/ml的lewis三糖(与100μg/ml的lnfpⅲ等摩尔浓度)也能够抑制水溶性胆固醇引起的细胞内tc蓄积,降低细胞裂解液中tc的水平,说明lewis三糖作为lnfpⅲ的核心结构在调节细胞内tc代谢中具有一定活性,可能是lnfpⅲ的生物活性结构基础。
实施例3:lnfpⅲ改善tritonwr1339静脉注射诱导的大鼠高脂血症模型中脂质紊乱
tritonwr1339是一种表面活性剂,通过抑制卵磷脂胆固醇酰基转移酶,影响脂蛋白之间的脂质交换和脂蛋白复合物的形成,抑制脂质在血液中的清除,使血脂升高。利用tritonwr1339的这一特点,可在大鼠体内建立急性高脂血症模型,为调脂药物的研究提供一种快速、简便、完整、可靠的模型。本实施例中,利用tritonwr1339静脉注射诱导大鼠高脂血症模型评价了lnfpⅲ在大鼠体内改善脂质紊乱的能力。
具体研究描述如下:雄性spraguedawley大鼠接收后分笼饲养,每笼4-6只,给予普通饲料和饮水自由,适应性驯养3-7天。实验前一天,撤去大鼠饲料,饥饿过夜(约18小时),饮水自由。实验当天,标记大鼠,称量体重(体重范围170-210g),分别记录,设置空白对照组,空白模型组(tritonwr1339,北京百灵威)、阳性化合物组(tritonwr1339和非诺贝特,sigma)和待测化合物lnfpⅲ组(tritonwr1339和lnfpⅲ),化合物分组给药信息详见表3。随后从大鼠眼眶静脉丛采集0点血样,采血完成后立即腹腔注射给予溶媒、阳性化合物及目标化合物lnfpⅲ(按照化合物分组信息表3给予大鼠相应的化合物)。大鼠腹腔注射给药结束后,立即开始高脂血大鼠模型造模,根据triton造模分组,进行大鼠尾静脉注射tritonwr1339造模,空白对照组给予同等体积ph7.4生理盐水,造模分组给药信息详见表4。实验中,tritonwr1339的造模剂量为200mg/kg,阳性化合物非诺贝特的给药剂量为100mg/kg,lnfpⅲ的给药剂量为2mg/kg(低剂量组)和10mg/kg(高剂量组)。造模完成后给予正常饲料喂养。分别于triton造模后3h、6h、12h、24h、36h、48h从大鼠眼眶静脉丛采集血样,每个时间点采集约0.3-0.4ml血液置于ep管中,室温凝血后,在4℃下使用3000g离心10分钟,移取上清液至标记的ep管中,测定血生化指标。离心获得的血清分别使用南京建成的总胆固醇(tc)测定试剂盒、甘油三酯(tg)测定试剂盒、高密度脂蛋白胆固醇(hdl-c)测定试剂盒、低密度脂蛋白胆固醇(ldl-c)测定试剂盒检测血生化指标。
表3:化合物分组给药信息
表4:triton造模分组给药信息
实验结果:大鼠单次静脉输注200mg/kgtritonwr1339后,其血清tc、tg、ldl-c含量均在24小时内显著升高,hdl-c含量在24小时内显著降低,模型组各指标的浓度-时间曲线下面积auc与对照组相比均有显著性差异,由此说明tritonwr1339诱导造模成功,符合模型要求(图3)。在tritonwr1339造模的同时给予100mg/kg非诺贝特,可显著改善tritonwr1339诱导引起的血清tc、tg、ldl-c水平显著升高,轻微改善血清hdl-c水平显著降低的现象。通过计算曲线下面积,非诺贝特对triton诱导后血清tc、tg、ldl-c水平升高的抑制率分别为:56.41%、68.70%、41.37%,而对hdl-c含量降低的抑制率为11.40%。以上结果说明阳性化合物非诺贝特的单次给药能够有效地改善triton引起的大鼠高脂血症状,符合阳性化合物的预期作用,也证明tritonwr1339模型建设无误。发明人在造模同时腹腔注射给予目标化合物lnfpⅲ,结果显示低、高两种剂量的lnfpⅲ都可以降低tritonwr1339诱导引起的血清tc、tg、ldl-c水平升高,并轻微改善血清hdl-c水平降低的现象。通过计算tc、tg、ldl-c和hdl-c浓度-时间曲线下面积,2和10mg/kg的lnfpⅲ对triton诱导后血清tc、tg、ldl-c水平升高的抑制率分别为:30.40%和34.17%、29.23%和41.53%、36.08%和40.00%,而对hdl-c含量降低的抑制率分别为28.85%和38.70%,此实验结果反映出lnfpⅲ两种剂量的药效作用存在一定的剂量依赖性。
结论:在tritonwr1339诱导大鼠高脂血模型中,lnfpⅲ单次给药可以显著的抑制tritonwr1339诱导的大鼠高脂血模型中血清ldl-c和tc水平升高,对tg和hdl-c具有调节趋势。说明lnfpⅲ能够针对ldl-c和tc发挥血脂调节作用。
实施例4:lnfpⅲ降低ldlr-ko小鼠血清tc、ldl-c水平
低密度脂蛋白受体(ldlr)是负责清除血液中ldl-c的细胞膜受体,因此ldlr敲除的小鼠(ldlr-ko)在普通喂食下,其血清中的tc和ldl-c水平即可显著高于野生型小鼠。利用ldlr-ko小鼠的这一特征,构建体内评价模型,能够准确可靠的评估化合物在高胆固醇血症中的调节能力。本实施例中,利用ldlr-ko小鼠高胆固醇血症模型评价lnfpⅲ在小鼠体内改善脂质紊乱的能力。
具体研究描述如下:雄性小鼠接收后分笼饲养,每笼4只,给予普通饲料和饮水,适应性驯养3-7天。每只动物分别剪耳标记,设置空白对照组(c57bl/6j小鼠给予溶媒),空白模型组(ldlr-ko小鼠给予溶媒)、阳性化合物组(ldlr-ko小鼠给予阿托伐他汀,给药剂量为30mg/kg)和待测化合物lnfpⅲ组(ldlr-ko小鼠给予lnfpⅲ,低剂量组给药剂量为10mg/kg,高剂量组给药剂量为50mg/kg),化合物分组给药信息详见表5。每日检测ldlr-ko小鼠进食量,每周记录动物体重两次,每周从小鼠尾静脉取血50μl左右,进行生化指标检测。根据小鼠的血脂参数均衡分组,以腹腔注射的方式在每天早上9-10点间给药,具体给药方式如表5所示。每周将所收集的血样于室温静置,凝血后,4℃,3000g离心10min,移取上清液至标记的ep管中,测定血生化指标。离心获得的血清分别使用南京建成的总胆固醇(tc)测定试剂盒、高密度脂蛋白胆固醇(hdl-c)测定试剂盒、低密度脂蛋白胆固醇(ldl-c)测定试剂盒进行血生化指标检测,具体检测方法,根据各试剂盒说明书进行具体操作。
表5:化合物分组给药信息
实验结果:给予溶媒的空白模型组ldlr-ko小鼠的血清tc水平是非模型组c57bl/6j小鼠的3倍左右,而血清ldl-c含量可高达非模型组的10倍左右,符合ldlr-ko小鼠的模型介绍,证明ldlr-ko小鼠模型无误(图4)。阳性化合物阿托伐他汀连续给药4周后,可显著降低空白模型组ldlr-ko小鼠的血清tc、ldl-c水平的升高程度,计算曲线下面积,阿托伐他汀对ldlr-ko小鼠的血清tc、ldl-c含量升高的抑制率分别为:30.43%、38.27%(图4)。而目标化合物lnfpⅲ连续给药4周后,结果显示高剂量的lnfpⅲ可以显著降低ldlr-ko小鼠血清tc、ldl-c水平升高的现象。高剂量的lnfpⅲ的tc、ldl-c浓度-时间曲线与溶媒模型组相比具有显著性差异。通过计算曲线下面积,10和50mg/kg的lnfpⅲ对ldlr-ko小鼠血清tc、ldl-c含量升高的抑制率分别为:2.37%和35.12%、10.03%和39.82%,此实验结果反映出lnfpⅲ两种剂量的药效作用存在一定的剂量依赖性(图4)。
结论:在ldlr-ko小鼠高胆固醇血症模型中,lnfpⅲ连续4周给药可以显著的抑制ldlr-ko小鼠血清中ldl-c和tc水平升高,有效改善ldlr-ko小鼠模型的胆固醇代谢紊乱。
尽管上面已经示出和描述了本发明的实施例,应当理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。这样变化后的技术方案同样应当涵盖在本申请的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!