一种自靶向抗癌纳米粒子及其制备方法与流程
本发明涉及医药技术领域,尤其涉及一种自靶向抗癌纳米粒子及其制备方法。
背景技术:
雷替曲塞(raltitrexed)简称rtx,是由英国泽内卡公司研制的新型抗癌药物,其化学名称为n-{5-{n-{(3,4-二氢-2-甲基-4-氧-6-喹唑啉基)-甲基}-n-甲氨基}-2-噻吩基}-l-谷氨酸。雷替曲塞于1996年在英国上市,已成为晚期结肠癌和直肠癌治疗的一线药物。此外,国内外ⅰ、ⅱ期临床试验均已评估雷替曲塞单药或联合用药在治疗胃癌、胰腺癌、食管癌、恶性间皮瘤、头颈部恶性肿瘤和乳腺癌等肿瘤中的效果,结果表明雷替曲塞对于其他肿瘤也具有良好的治疗前景。
雷替曲塞具有和肿瘤靶向配体叶酸相似的结构,因此可以和在上皮肿瘤谱系高表达的叶酸受体结合,具有一定的靶向作用。雷替曲塞经叶酸受体介导进入细胞后,在叶酰聚谷氨酸合成酶作用下转化为多聚谷氨酸盐,作用于胸腺苷合成酶(ts)靶点的叶酸结合部位,这些多聚谷氨酸盐比雷替曲塞具有更强的抑制胸腺苷合成酶作用,其半衰期可达198h,从而抑制细胞内叶酸代谢,导致细胞死亡。由于雷替曲塞具有上述对叶酸受体的靶向性和对细胞内叶酸代谢抑制的双重作用,使其成为一种具有一定自靶向功能的抗癌药物。
但是,雷替曲塞作为一种小分子药物通常采用直接注射的方式使用,由于裸药雷替曲塞的靶向性较弱,不能有效地靶向到达肿瘤部位实现针对性的治疗,副作用较大。cn1969854a将雷替曲塞包裹于肠溶性包衣中,得到一种缓释制剂,通过口服的方式进入人体,实现了结肠定位,降低了药物的全身性副作用。但具有特异溶解性的包衣会使药物局限于治疗某一种癌症,而不具有广泛适用性,限制了雷替曲噻的治疗范围。
技术实现要素:
本发明的目的在于提供一种自靶向抗癌纳米粒子及其制备方法。本发明所提供的自靶向抗癌纳米粒子对癌细胞具有较强的靶向性,能够特异性杀死癌细胞,且对癌症细胞具有广泛适用性。
本发明提供了一种自靶向抗癌纳米粒子,由表面羧酸化的金属氧化物与活性部分通过酰胺键连接构成,所述活性部分为键合有雷替曲塞的乙酰化超支化聚乙烯亚胺;所述活性部分的质量含量为10~30%;所述乙酰化超支化聚乙烯亚胺与雷替曲塞通过酰胺键连接,所述乙酰化超支化聚乙烯亚胺与雷替曲塞的摩尔比为1:1~8。
优选的,所述表面羧酸化的金属氧化物为表面包覆有柠檬酸的fe3o4纳米粒子。
优选的,所述自靶向抗癌纳米粒子的平均粒径为100~200nm。
本发明还提供了上述自靶向抗癌纳米粒子的制备方法,包括如下步骤:
(1)将雷替曲塞、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和极性有机溶剂混合,对雷替曲塞进行活化;将所述活化所得活化液与超支化聚乙烯亚胺混合,进行第一酰胺化反应,得到键连有雷替曲塞的超支化聚乙烯亚胺;
(2)将表面羧酸化的金属氧化物、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和水混合,对所述表面羧酸化的金属氧化物进行活化,得到表面羧酸化的金属氧化物活化液;
(3)将所述步骤(2)得到的表面羧酸化的金属氧化物活化液与所述步骤(1)得到的键连有雷替曲塞的超支化聚乙烯亚胺混合,进行第二酰胺化反应,得到自靶向抗癌纳米粒子前驱体;
(4)将所述步骤(3)得到的自靶向抗癌纳米粒子前驱体与三乙胺和水混合,得到碱性前驱体溶液;向所述碱性前驱体溶液中加入乙酸酐,进行乙酰化反应,得到自靶向抗癌纳米粒子;
所述步骤(1)和步骤(2)之间没有时间顺序的限定。
优选的,所述步骤(1)中雷替曲塞与超支化聚乙烯亚胺的摩尔比为0.5~10:1。
优选的,所述步骤(2)中表面羧酸化的金属氧化物与键连有雷替曲塞的超支化聚乙烯亚胺的质量比为2~5:1。
优选的,所述第一酰胺化反应和第二酰胺化反应的反应温度独立地为15~35℃,所述第一酰胺化反应和第二酰胺化反应的反应时间独立地为20~30h。
优选的,所述步骤(4)中自靶向抗癌纳米粒子前驱体与三乙胺的质量比为1:20~30。
优选的,所述步骤(4)中自靶向抗癌纳米粒子前驱体与乙酸酐的质量比为1:20~30。
优选的,所述乙酰化反应的反应温度为15~35℃,所述乙酰化反应的反应时间为10~15h。
本发明提供了一种自靶向抗癌纳米粒子,由表面羧酸化的金属氧化物与活性部分通过酰胺键连接构成,所述活性部分为键合有雷替曲塞的乙酰化超支化聚乙烯亚胺;所述活性部分的质量含量为10~30%;所述乙酰化超支化聚乙烯亚胺与雷替曲塞通过酰胺键连接,所述乙酰化超支化聚乙烯亚胺与雷替曲塞的摩尔比为1:1~8。本发明利用多价相互作用,设计了上述自靶向抗癌纳米粒子,该自靶向抗癌纳米粒子上搭载了多个雷替曲塞,形成多价体系,通过该多价体系与受体的强结合力实现对癌细胞的高选择性,同时利用雷替曲塞自身的毒性,特异性杀死癌细胞;并且由于该自靶向抗癌纳米粒子不需要包裹具有特异溶解性的包衣,使其对癌症细胞具有广泛适用性。
实验结果表明,叶酸受体阳性细胞对本发明所提供的自靶向抗癌纳米粒子的摄取量远远大于叶酸受体阴性细胞,说明本发明所提供的自靶向抗癌纳米粒子具有优异的叶酸过表达癌细胞靶向能力,能够选择性进入癌细胞。
并且,本发明提供的自靶向抗癌纳米粒子结构中具有酰胺键,具有一定的稳定性,在蛋白酶k的作用下,能够缓慢降解,释放出雷替曲塞。实验结果表明,随释放时间的延长,雷替曲塞的累积释放量逐步增多,释放时间为20h时,雷替曲塞的累积释放量达到约70%,之后趋于稳定不再释放,说明本发明所提供的自靶向抗癌纳米粒子为一种缓释型药物。
此外,由于本发明所提供的自靶向抗癌纳米粒子为多价体系,其对叶酸受体阳性细胞的杀伤性更强,能够实现选择性杀伤叶酸过表达的癌细胞。实验结果表明,本发明所提供的自靶向抗癌纳米粒子对于叶酸受体阳性细胞的杀伤性强于叶酸受体阴性细胞,且随着用药量的增加,对上述两种细胞的杀伤性差别越大。
附图说明
图1为本发明自靶向抗癌纳米粒子的结构示意图;
图2为实施例1步骤(1)所得表面羧酸化的fe3o4的红外光谱图;
图3为实施例1步骤(2)所得键连有雷替曲塞的超支化聚乙烯亚胺及其络合物的紫外光谱图;
图4为实施例1所得自靶向抗癌纳米粒子的粒径分布图;
图5为实施例1所得自靶向抗癌纳米粒子的xrd图;
图6为实施例1步骤(1)、(3)和(4)所得产物的电势测试结果;
图7为实施例1所得自靶向抗癌纳米粒子的释放曲线;
图8为实施例1所得自靶向抗癌纳米粒子对kb和a549的毒性测试结果;
图9为裸药雷替曲塞对kb和a549的毒性测试结果;
图10为实施例1所得自靶向抗癌纳米粒子对癌细胞选择性的测试结果。
具体实施方式
本发明提供了一种自靶向抗癌纳米粒子,由表面羧酸化的金属氧化物与活性部分通过酰胺键连接构成,所述活性部分为键合有雷替曲塞的乙酰化超支化聚乙烯亚胺;所述活性部分的质量含量为10~30%;所述乙酰化超支化聚乙烯亚胺与雷替曲塞通过酰胺键连接,所述乙酰化超支化聚乙烯亚胺与雷替曲塞的摩尔比为1:1~8。
在本发明中,所述自靶向抗癌纳米粒子中活性部分的质量含量优选为14~20%。
在本发明中,所述自靶向抗癌纳米粒子中乙酰化超支化聚乙烯亚胺与雷替曲塞的摩尔比优选为1:3~5。
在本发明中,所述表面羧酸化的金属氧化物的粒径优选为纳米级别,更优选为50~80nm。在本发明中,所述表面羧酸化的金属氧化物优选为表面包覆有柠檬酸的fe3o4纳米粒子;所述柠檬酸与fe3o4纳米粒子的质量比优选为1:4~5。
在本发明中,所述自靶向抗癌纳米粒子的平均粒径优选为100~200nm,更优选为120~180nm,最优选为140~160nm。
图1为本发明所提供的自靶向抗癌纳米粒子的结构示意图,如图所示,图1左侧为所述自靶向抗癌纳米粒子的简化图,黑色粒子为表面羧酸化的金属氧化物,箭头表示活性部分,所述活性部分简称为pei-ac-rtx4,黑色粒子表面分布多个箭头表示表面羧酸化的金属氧化物与多个活性部分通过酰胺键键连;图1右侧为所述活性部分的结构示意图,如图所示,所述活性部分为键连有雷替曲塞的乙酰化超支化聚乙烯亚胺,图中所示雷替曲塞的数目仅为示意数目,在本发明中,所述乙酰化超支化聚乙烯亚胺与雷替曲塞的摩尔比为1:1~8,所述雷替曲塞上的羧基与乙酰化超支化聚乙烯亚胺上的氨基形成酰胺键;如图1右侧图所示,所述活性部分结构示意图的左端为酰胺键,该键为表面羧酸化的金属氧化物与活性部分的连接键,由表面羧酸化的金属氧化物的表面羧基与所述活性部分中的乙酰化超支化聚乙烯亚胺的氨基发生酰胺化反应形成。
本发明还提供了上述技术方案所述的自靶向抗癌纳米粒子的制备方法,包括如下步骤:
(1)将雷替曲塞、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和极性有机溶剂混合,对雷替曲塞进行活化;将所述活化所得活化液与超支化聚乙烯亚胺混合,进行第一酰胺化反应,得到键连有雷替曲塞的超支化聚乙烯亚胺;
(2)将表面羧酸化的金属氧化物、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和水混合,对所述表面羧酸化的金属氧化物进行活化,得到表面羧酸化的金属氧化物活化液;
(3)将所述步骤(2)得到的表面羧酸化的金属氧化物活化液与所述步骤(1)得到的键连有雷替曲塞的超支化聚乙烯亚胺混合,进行第二酰胺化反应,得到自靶向抗癌纳米粒子前驱体;
(4)将所述步骤(3)得到的自靶向抗癌纳米粒子前驱体与三乙胺和水混合,得到碱性前驱体溶液;向所述碱性前驱体溶液中加入乙酸酐,进行乙酰化反应,得到自靶向抗癌纳米粒子;
所述步骤(1)和步骤(2)之间没有时间顺序的限定。
本发明将雷替曲塞、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和极性有机溶剂混合后,对雷替曲塞进行活化。本发明在对雷替曲塞进行活化的过程中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的碳二亚胺键与雷替曲塞上的羧基耦合形成o-乙酰基脲结构,该结构具有较高的活性,容易与氨基反应形成酰胺键。
在本发明中,所述雷替曲塞与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺的质量比优选为1:3~7:1.5~4,更优选为1:4~6:2~3.5,最优选为1:5:2.5。
在本发明中,所述极性有机溶剂优选为二甲基亚砜、n,n-二甲基甲酰胺或二氯甲烷,更优选为二甲基亚砜。
在本发明中,所述雷替曲塞的质量与所述极性有机溶剂的体积之比优选为1g:30~70ml,更优选为1g:40~60ml,最优选为1g:50ml。
本发明对活化雷替曲塞的活化温度没有特殊限定,在本发明实施例中优选采用室温;所述活化的活化时间优选为20~50min,更优选为30~40min;所述活化优选在搅拌状态下进行;所述搅拌的转速优选为400~800r/min,更优选为500~700r/min,最优选为600r/min。
完成对雷替曲塞的活化后,本发明将所述活化得到的活化液与超支化聚乙烯亚胺混合,进行第一酰胺化反应,得到键连有雷替曲塞的超支化聚乙烯亚胺。
在本发明中,所述雷替曲塞与超支化聚乙烯亚胺的摩尔比优选为0.5~10:1,更优选为1~7:1,最优选为2~3:1。
在本发明中,所述超支化聚乙烯亚胺的分子量优选为1500~2000g/mol。本发明对所述超支化聚乙烯亚胺的氨基含量、支化程度没有特殊限定,采用市售的常规超支化聚乙烯亚胺即可;在本发明实施例中,所述超支化聚乙烯亚胺优选为alfaaesar公司的货号lot:w30b061型号超支化聚乙烯亚胺。在本发明中,所述超支化聚乙烯亚胺可以以单质的形式混合,也可以配制成水溶液再混合;在本发明实施例中,优选采用15~25mg/ml的超支化聚乙烯亚胺水溶液。
在本发明中,所述第一酰胺化反应的反应温度优选为15~35℃,更优选为20~30℃;所述第一酰胺化反应的反应时间优选为20~30h,更优选为24~27h。在本发明中,所述第一酰胺化反应中雷替曲塞上的羧基与超支化聚乙烯亚胺上的氨基发生酰胺化反应,生成酰胺键。
完成所述第一酰胺化反应后,本发明优选将所述第一酰胺化反应所得混合溶液进行透析,得到键连有雷替曲塞的超支化聚乙烯亚胺水分散液。在本发明中,通过透析可将反应体系中未反应的物质和小分子杂质去除。
本发明优选将装有第一酰胺化反应所得混合溶液的透析袋置于水中进行透析;所述水优选为去离子水;所述混合溶液与透析用水的体积比优选为1:1000~2000;所述透析的时间优选为20~30h,更优选为24~26h;所述透析过程中优选每隔1~3h换一次水,更优选每隔2h换一次水;所述透析优选采用截留分子量为1900~3000g/mol的透析袋,更优选为截留分子量为2000~2500g/mol的透析袋;本发明对所述透析袋的材质没有特殊限定,可以采用本领域技术人员所熟知的材质。
得到键连有雷替曲塞的超支化聚乙烯亚胺水分散液后,本发明优选将所述键连有雷体曲塞的超支化聚乙烯亚胺水分散液进行干燥,得到键连有雷替曲塞的超支化聚乙烯亚胺;本发明对所述干燥的方式没有特殊限定,能够将水分去除即可。在本发明实施例中优选将所述键连有雷替曲塞的超支化聚乙烯亚胺水分散液直接用于第二酰胺化反应。
本发明将表面羧酸化的金属氧化物、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和水混合,对所述表面羧酸化的金属氧化物进行活化,得到表面羧酸化的金属氧化物活化液。在本发明中,所述活化可将表面羧酸化的金属氧化物表面的羧基活化,以利于第二酰胺化反应的进行。
在本发明中,所述表面羧酸化的金属氧化物的粒径优选为50~80nm,更优选为60~70nm。
本发明对所述表面羧酸化的金属氧化物的来源没有特殊限定,采用市售产品或采用本领域技术人员所熟知的制备方法自制均可。
本发明对所述表面羧酸化的金属氧化物的种类没有特殊限定,采用本领域技术人员在制备药物时常用的表面羧酸化的金属氧化物即可。在本发明实施例中,所述表面羧酸化的金属氧化物优选为表面包覆有柠檬酸的fe3o4纳米粒子。在本发明中,所述表面包覆有柠檬酸的fe3o4纳米粒子的粒径优选为50~80nm。
本发明对所述表面包覆有柠檬酸的fe3o4纳米粒子的来源没有特殊的限定,采用本领域技术人员熟知的制备方法制备即可。在本发明实施例中,所述表面包覆有柠檬酸的fe3o4纳米粒子的制备优选包括以下步骤:
(1)将水溶性铁盐、水溶性亚铁盐、柠檬酸和水混合,得到铁盐和亚铁盐的酸性混合溶液;
(2)在惰性气体的保护下,将氨水滴加至所述铁盐和亚铁盐的酸性混合溶液中,进行沉淀反应,得到表面包覆有柠檬酸的fe3o4纳米粒子。
本发明优选将水溶性铁盐、水溶性亚铁盐、柠檬酸和水混合,得到铁盐和亚铁盐的酸性混合溶液。本发明对水溶性铁盐、水溶性亚铁盐、柠檬酸和水的混合顺序没有特殊限定,可以采用任意混合顺序。
在本发明中,所述水溶性铁盐中的fe3+与水溶性亚铁盐中的fe2+的摩尔比优选为2.5~3:1,更优选为2.6~2.7:1。在本发明中,所述水溶性铁盐优选为氯化铁、硝酸铁和硫酸铁中的一种或两种以上的混合物。在本发明中,所述水溶性亚铁盐优选为氯化亚铁、硝酸亚铁和硫酸亚铁中的一种或两种以上的混合物。
在本发明中,所述水溶性铁盐中的fe3+与柠檬酸的摩尔比优选为9~10:1,更优选为9.4~9.6:1。本发明实施例中优选采用柠檬酸的水溶液与铁盐和亚铁盐的混合水溶液混合;所述柠檬酸的水溶液的浓度优选为0.01~0.1wt.%;所述铁盐和亚铁盐的混合水溶液中,铁盐的浓度优选为0.25~0.4wt.%。
得到铁盐和亚铁盐的酸性混合溶液后,本发明优选在惰性气体的保护下,将氨水滴加至所述铁盐和亚铁盐的酸性混合溶液中,进行沉淀反应,得到表面包覆有柠檬酸的fe3o4纳米粒子。
本发明对所述惰性气体的种类没有特殊限定,采用本领域技术人员所常用的惰性气体即可,如氮气、氩气。在本发明实施例中,所述惰性气体优选为氮气。
在本发明中,所述氨水的浓度优选为4~7wt.%,更优选为5~6wt.%;所述氨水的滴加速度为1~3ml/min,优选为2~2.6ml/min。
在本发明中,所述沉淀反应的温度优选为80~90℃;所述沉淀反应的时间优选为20~40min,更优选为25~30min;所述沉淀反应的时间优选从氨水滴加结束时计起。
本发明优选先对反应体系进行氮气保护,然后将所述铁盐和亚铁盐的混合溶液加热至沉淀反应所需的温度,再滴加氨水。本发明对所述加热的速率没有特殊限定,采用本领域技术人员所常用的加热速率即可。在本发明实施例中,所述加热的速率优选为2~5℃/min。
完成沉淀反应后,本发明优选将所述沉淀反应得到的混合溶液冷却室温;所述冷却优选自然冷却。
冷却完成后,本发明优选将所述冷却的产物进行离心,得到上清液。在本发明中,通过离心将体系中颗粒较大的产物去除;所得上清液中表面包覆有柠檬酸的fe3o4的粒径优选为50~80nm。
在本发明中,所述离心的转速优选为9000~10000rpm,更优选为9500~9700rpm;所述离心的时间优选为20~40min,更优选为25~35min。
本发明优选采用倾倒的方式将离心所得体系中的上清液取出。
得到上清液后,本发明优选将所述上清液进行透析,得到表面包覆有柠檬酸的fe3o4水分散液。在本发明中,通过透析将体系中未反应的原料及杂质小分子去除。
本发明优选将装有所述上清液的透析袋置于水中进行透析;所述水优选为去离子水;所述上清液与透析用水的体积比优选为1:1000~2000;所述透析的时间优选为20~30h,更优选为24~26h;所述透析过程中优选每隔1~3h换一次水,更优选每隔2h换一次水;所述透析优选采用截留分子量为1000~3500g/mol的透析袋;本发明对所述透析袋的材质没有特殊限定,可以采用本领域技术人员所熟知的材质。
得到表面包覆有柠檬酸的fe3o4水分散液后,本发明优选将所述表面包覆有柠檬酸的fe3o4水分散液干燥,得到表面包覆有柠檬酸的fe3o4;本发明对所述干燥的方式没有特殊限定,能够将水分去除即可。在本发明实施例中,优选将经透析后所得的表面包覆有柠檬酸的fe3o4水分散液直接用于第二酰胺化反应。
在本发明中,所述表面羧酸化的金属氧化物与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺的质量比优选为1:3~7:2~4,更优选为1:4~6:2~3.5,最优选为1:5:3。
在本发明中,所述表面羧酸化的金属氧化物与水的质量之比优选为0.004~0.006:1,更优选为0.0045~0.005:1。
本发明对活化表面羧酸化的金属氧化物的活化温度没有特殊限定,在本发明实施例中优选采用室温。在本发明中,对所述表面羧酸化的金属氧化物进行活化的活化时间优选为20~50min,更优选为30~40min;所述活化优选在搅拌状态下进行,所述搅拌的转速优选为400~800r/min,更优选为500~700r/min,最优选为600r/min。
得到键连有雷替曲塞的超支化聚乙烯亚胺和表面羧酸化的金属氧化物活化液后,本发明将所述活化所述表面羧酸化的金属氧化物活化液与所述键连有雷替曲塞的超支化聚乙烯亚胺混合,进行第二酰胺化反应,得到自靶向抗癌纳米粒子前驱体。在本发明中,所述第二酰胺化反应为表面羧酸化的金属氧化物表面的羧基与键连有雷替曲塞的超支化聚乙烯亚胺上的氨基进行酰胺化反应,生成酰胺键。
在本发明中,所述表面羧酸化的金属氧化物与键连有雷替曲塞的超支化聚乙烯亚胺的质量比优选为2~5:1。在本发明中,键连有雷替曲塞的超支化聚乙烯亚胺的添加量较大,使得表面羧酸化的金属氧化物在第二酰胺化反应过程中均参与反应,经后续离心后均可沉淀。
在本发明中,所述第二酰胺化反应的反应温度优选为15~35℃,更优选为20~25℃;所述第二酰胺化反应的反应时间优选为20~30h,更优选为24~26h。
完成第二酰胺化反应后,本发明优选将第二酰胺化反应所得混合溶液进行离心,得到自靶向抗癌纳米粒子前驱体。在本发明中,所述第二酰胺化反应所得混合溶液经离心后产生沉淀,将上清液弃去,所得沉淀即为所述自靶向抗癌纳米粒子前驱体。
在本发明中,对第二酰胺化反应所得混合溶液的进行离心的转速优选为8000~10000rpm,更优选为9000~9500rpm;所述离心的时间优选为5~10min,更优选为6~8min。
得到自靶向抗癌纳米粒子前驱体后,本发明将所述自靶向抗癌纳米粒子前驱体、三乙胺和水混合,得到碱性前驱体溶液,然后向所述碱性前驱体溶液中加入乙酸酐,进行乙酰化反应,得到自靶向抗癌纳米粒子。在本发明中,所述自靶向抗癌纳米粒子前驱体中含有游离氨基,经乙酰化反应后,可将游离氨基乙酰化,进而减小自靶向抗癌纳米粒子对人体的副作用。
本发明优选将自靶向抗癌纳米粒子前驱体分散于去离子水中,再与三乙胺混合,室温搅拌20~40min,然后向所得碱性前驱体溶液中加入乙酸酐,进行乙酰化反应。
在本发明中,所述自靶向抗癌纳米粒子前驱体与三乙胺的质量比优选为1:20~30,更优选为1:22~25;所述三乙胺作为碱性催化剂,可以使自靶向抗癌纳米粒子前驱体中的氨基转化成亲核性更强的亲核基团,来进攻乙酸酐上的碳正离子,使得乙酰化反应更容易发生。
在本发明中,所述搅拌的转速优选为500~700rpm。
在本发明中,所自靶向抗癌纳米粒子前驱体与乙酸酐的质量比优选为1:20~30,更优选为1:22~25;所述乙酸酐的添加量相对于游离氨基的数目远远过量,可将自靶向抗癌纳米粒子前驱体中的游离氨基全部乙酰化。本发明优选采用滴加的方式加入乙酸酐;所述滴加的速度优选为0.006~0.015ml/min。
在本发明中,所述乙酰化反应的反应温度优选为15~35℃,更优选为20~25℃;所述乙酰化反应的反应时间为10~15h,更优选为12~14h。
完成乙酰化反应后,本发明优选将乙酰化所得混合溶液进行离心,得到自靶向抗癌纳米粒子;通过离心,所述自靶向抗癌纳米粒子沉淀于下层,未反应的小分子物质分散于上清液中,弃去上清液,所得沉淀即为自靶向抗癌纳米粒子。
在本发明中,离心乙酰化所得混合溶液的离心速率优选为8000~10000rpm,更优选为8500~9500rpm;所述离心的时间优选为5~10min。
本发明优选将所述自靶向抗癌纳米粒子保存于超纯水中;所述自靶向抗癌纳米粒子的保存浓度优选为0.5~1wt.%。本发明优选将所述自靶向抗癌纳米粒子超声分散于超纯水中进行保存;所述超声的频率优选为4~6w;所述超声的时间优选为1~5min,更优选为2~4min。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
(1)在氮气保护下,向5ml三氯化铁浓度为0.31g/ml、氯化亚铁浓度为0.09g/ml的铁盐和亚铁盐的混合溶液中加入20ml柠檬酸水溶液,所述柠檬酸水溶液的浓度为0.01g/ml;维持氮气保护状态,将所得混合溶液升温至85℃,向所述混合溶液中滴加26ml浓度为5.8wt.%的氨水,所述滴加的速度为2.6ml/min;完成所述滴加后,维持温度和氮气保护状态不变,恒温反应30min;反应完成后,自然冷却至室温,将所得混合溶液在9500rpm的转速下离心30min,取上清液;将所述上清液置于截留分子量为3500g/mol的透析袋中,放入2l去离子水中透析24h,每隔6h换一次水,得到浓度为4.9mg/ml的表面羧酸化的fe3o4水分散液;通过动态光散射法测定表面羧酸化的fe3o4的粒径,得其平均粒径为60nm;
(2)将10mg雷替曲塞、50mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、25mgn-羟基琥珀酰亚胺和5ml二甲基亚砜混合,在600rpm的转速下室温搅拌30min;将所得混合溶液与0.85ml浓度为20mg/ml的超支化聚乙烯亚胺水溶液混合,在25℃搅拌进行第一酰胺化反应,所述第一酰胺化反应的时间为24h,所述搅拌的转速为600rpm;第一酰胺化反应完成后,将所得混合溶液置于截留分子量为2000g/mol的透析袋中,置于2l去离子水中透析24h,每隔2h换一次水,得到浓度为0.8392mg/ml的键连有雷替曲塞的超支化聚乙烯亚胺水分散液;
(3)将1ml步骤(1)所述的表面羧酸化的fe3o4水分散液、30mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、15mgn-羟基琥珀酰亚胺混合,在600rpm转速下室温搅拌30min;将所得混合溶液与1.2ml步骤(2)所述的键连有雷替曲塞的超支化聚乙烯亚胺水分散液混合,在25℃下搅拌进行第二酰胺化反应,所述第二酰胺化反应的时间为24h,所述搅拌的转速为600rpm;第二酰胺化反应完成后,将所得混合溶液在9000rpm的转速下离心7min,弃去上清液,所得沉淀为自靶向抗癌纳米粒子前驱体;
(4)将步骤(3)所得自靶向抗癌纳米粒子前驱体超声分散于1ml去离子水中,所述超声的强度为5w,所述超声的时间为2min;将所得自靶向抗癌纳米粒子前驱体分散液与0.02ml三乙胺混合,在25℃搅拌30min,所述搅拌的转速为600rpm;然后维持搅拌状态和体系温度不变,向所得混合溶液中滴加0.015ml乙酸酐,所述滴加的速度为0.008ml/min,滴加结束后,在25℃进行乙酰化反应,所述乙酰化反应的反应时间为12h;将所述乙酰化反应所得混合溶液在9000rpm离心7min,所得沉淀为自靶向抗癌纳米粒子,经干燥后得其质量为5.7322mg;得到自靶向抗癌纳米粒子后,将自靶向抗癌纳米粒子分散于1ml的超纯水中,得到自靶向抗癌纳米粒子水分散液,以此状态进行保存。
自靶向抗癌纳米粒子中的活性部分的质量含量采用如下公式计算:
经计算,本实施例所得自靶向抗癌纳米粒子中的活性部分的质量含量为14.5%。
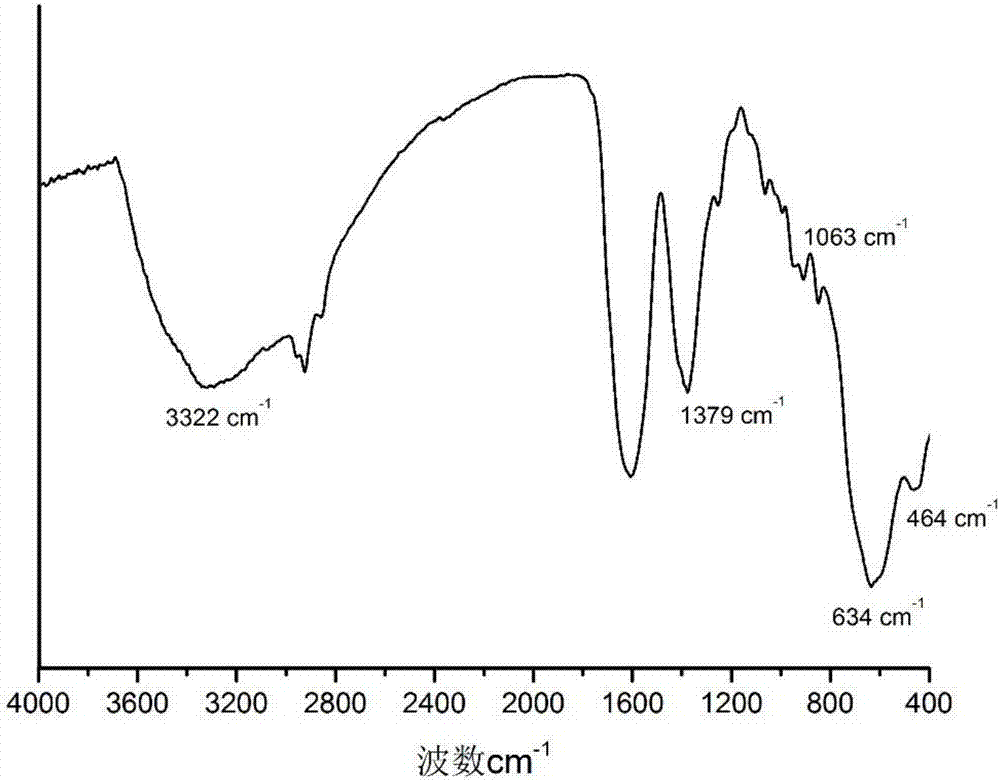
取步骤(1)所得表面羧酸化的fe3o4水分散液,经冷冻干燥,得到表面羧酸化的fe3o4粉体,测得其红外光谱,如图2所示,谱图中634cm-1和464cm-1处为fe-o的伸缩振动吸收峰,1379cm-1为coo的对称伸缩振动峰,3322cm-1为oh的伸缩振动峰和1063cm-1处为c-h的弯曲振动峰,说明得到的fe3o4样品表面包覆有柠檬酸;柠檬酸的羧酸根在水中带负电,因而能够阻止fe3o4纳米粒子发生团聚,提高其在水溶液中的单分散性;同时,柠檬酸使fe3o4粒子表面带有羧基以利于进一步修饰。
使用紫外光谱测定键连有雷替曲塞的超支化聚乙烯亚胺的价态和浓度,具体测试方法如下:
1、测定一系列不同浓度的超支化聚乙烯亚胺和cu2+络合物在265nm处的吸光度,以超支化聚乙烯亚胺的浓度(单位为μg/ml)为x1,所对应的吸光度为y1,得到标准曲线a,y1=0.0187x1+0.0046,相关性系数r2=0.998;
2、测定一系列不同浓度雷替曲塞(rtx)水溶液在351nm处的吸光度,以rtx浓度(单位为mg/ml)为x2,所对应的吸光度为y2,得到标准曲线b,y2=26.869x2+0.0157,相关性系数r2=0.996;
3、取200μl步骤(2)所得键连有雷替曲塞的超支化聚乙烯亚胺水分散液,加入1ml硫酸铜溶液(2mg/ml)使得超支化聚乙烯亚胺和cu2+发生络合,然后用水稀释6倍,测试所得溶液在265nm的紫外吸光度a1;另取200μl步骤(2)所得键连有雷替曲塞的超支化聚乙烯亚胺水分散液加入1ml去离子水,然后用水稀释6倍,测试所得溶液在351nm处的吸光度a2,在265nm处的吸光度a3;
测试结果如图3所示,键连有雷替曲塞的超支化聚乙烯亚胺简写为pei-rtx4,其与cu2+的络合物简写为络合,其中a1=2.153,a2=1.881,a3=0.881,将a2带入标准曲线b,可得原溶液中rtx的浓度为0.4165mg/ml,将a1-a3的数值带入标准曲线a,可得原溶液中pei浓度为0.4227mg/ml,已知pei分子量为1800g/mol,rtx分子量为458.49g/mol,计算可得pei和rtx的摩尔比为1:4。
采用动态光散射法测定所得自靶向抗癌纳米粒子的粒径分布,如图4所示,本实施例所得自靶向抗癌纳米粒子的粒径范围为60~300nm,平均粒径为148nm,落在了可在肿瘤组织产生高通透和滞留效应的纳米粒子的粒径范围内,说明本实施例所得自靶向抗癌纳米粒子能够通过肿瘤组织,并具有滞留效应。
对本实施例所得产物进行xrd测试,结果如图5所示,图中出现了2θ角为30.1°、35.5°、43.3°、53.5°、56.9°和62.6°处的衍射峰,其分别对应着磁性纳米粒子中fe3o4面心立方晶格中(220)、(311)、(400)、(422)、(511)、(440)的晶面,对比标准图谱jcpds(65-3107)表明所制备的磁性粒子属于立方晶系的fe3o4纳米晶体。
对本实施例步骤(1)、(3)和(4)所得产物的电势进行测试,如图6所示,其中fe3o4@ca表示表面羧酸化的fe3o4,fe3o4@pei-rtx4表示自靶向抗癌纳米粒子前驱体,fe3o4@pei-ac-rtx4表示自靶向抗癌纳米粒子,由图6可知,fe3o4@pei-rtx4较fe3o4@ca电势提高了大约20mv,而fe3o4@pei-ac-rtx4的zeta电位又比fe3o4@pei-rtx4降低了5mv左右。
实施例2
(1)在氮气保护下,向5ml三氯化铁浓度为0.31g/ml、氯化亚铁浓度为0.09g/ml的铁盐和亚铁盐的混合溶液中加入20ml柠檬酸水溶液,所述柠檬酸水溶液的浓度为0.01g/ml;维持氮气保护状态,将所得混合溶液升温至85℃,向所述混合溶液中滴加26ml浓度为5.8wt.%的氨水,所述滴加的速度为2.6ml/min;完成所述滴加后,维持温度和氮气保护状态不变,恒温反应30min;反应完成后,自然冷却至室温,将所得混合溶液在9500rpm的转速下离心30min,取上清液;将所述上清液置于截留分子量为3500g/mol的透析袋中,放入2l去离子水中透析24h,每隔6h换一次水,得到浓度为4.9mg/ml的表面羧酸化的fe3o4水分散液;通过动态光散射法测定表面羧酸化的fe3o4的粒径,得其平均粒径为60nm;
(2)将10mg雷替曲塞、50mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、25mgn-羟基琥珀酰亚胺和5ml二甲基亚砜混合,在600rpm的转速下室温搅拌30min;将所得混合溶液与2.5ml浓度为20mg/ml的超支化聚乙烯亚胺水溶液混合,在30℃搅拌进行第一酰胺化反应,所述第一酰胺化反应的时间为20h,所述搅拌的转速为600rpm;第一酰胺化反应完成后,将所得混合溶液置于截留分子量为2000g/mol的透析袋中,置于2l去离子水中透析24h,每隔2h换一次水,得到浓度为0.40571mg/ml的键连有雷替曲塞的超支化聚乙烯亚胺水分散液;
(3)将1ml步骤(1)所述的表面羧酸化的fe3o4水分散液、30mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、15mgn-羟基琥珀酰亚胺混合,在600rpm转速下室温搅拌30min;将所得混合溶液与5ml步骤(2)所述的键连有雷替曲塞的超支化聚乙烯亚胺水分散液混合,在20℃下搅拌进行第二酰胺化反应,所述第二酰胺化反应的时间为24h,所述搅拌的转速为600rpm;第二酰胺化反应完成后,将所得混合溶液在9000rpm的转速下离心7min,弃去上清液,所得沉淀为自靶向抗癌纳米粒子前驱体;
(4)将步骤(3)所得自靶向抗癌纳米粒子前驱体超声分散于1ml去离子水中,所述超声的强度为5w,所述超声的时间为2min;将所得自靶向抗癌纳米粒子前驱体分散液与0.02ml三乙胺混合,在30℃搅拌30min,所述搅拌的转速为600rpm;然后维持搅拌状态和体系温度不变,向所得混合溶液中滴加0.015ml乙酸酐,所述滴加的速度为0.008ml/min,滴加结束后,在30℃进行乙酰化反应,所述乙酰化反应的反应时间为12h;将所述乙酰化反应所得混合溶液在9000rpm离心5min,所得沉淀为自靶向抗癌纳米粒子,经干燥后得其质量为6.9634mg;得到自靶向抗癌纳米粒子后,将自靶向抗癌纳米粒子分散于1ml的超纯水中,得到自靶向抗癌纳米粒子水分散液,以此状态进行保存。
经计算,本实施例所得自靶向抗癌纳米粒子中的活性部分的质量含量为29.6%。
采用实施例1所述的方法测试步骤(2)所得键连有雷替曲塞的超支化聚乙烯亚胺中的超支化聚乙烯亚胺与雷替曲塞的摩尔比,结果为1:1。
采用动态光散射法测定所得自靶向抗癌纳米粒子的粒径分布,本实施例所得自靶向抗癌纳米粒子的粒径范围为75~200nm,平均粒径为150nm,落在了可在肿瘤组织产生高通透和滞留效应的纳米粒子的粒径范围内,说明本实施例所得自靶向抗癌纳米粒子能够通过肿瘤组织,并具有滞留效应。
对本实施例所得产物进行xrd测试,结果同实施例1。
实施例3
(1)在氮气保护下,向5ml三氯化铁浓度为0.31g/ml、氯化亚铁浓度为0.09g/ml的铁盐和亚铁盐的混合溶液中加入20ml柠檬酸水溶液,所述柠檬酸水溶液的浓度为0.01g/ml;维持氮气保护状态,将所得混合溶液升温至85℃,向所述混合溶液中滴加26ml浓度为5.8wt.%的氨水,所述滴加的速度为2.6ml/min;完成所述滴加后,维持温度和氮气保护状态不变,恒温反应30min;反应完成后,自然冷却至室温,将所得混合溶液在9500rpm的转速下离心30min,取上清液;将所述上清液置于截留分子量为3500g/mol的透析袋中,放入2l去离子水中透析24h,每隔6h换一次水,得到浓度为4.9mg/ml的表面羧酸化的fe3o4水分散液;通过动态光散射法测定表面羧酸化的fe3o4的粒径,得其平均粒径为60nm;
(2)将25mg雷替曲塞、50mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、25mgn-羟基琥珀酰亚胺和12ml二甲基亚砜混合,在600rpm的转速下室温搅拌30min;将所得混合溶液与0.6ml浓度为20mg/ml的超支化聚乙烯亚胺水溶液混合,在20℃搅拌进行第一酰胺化反应,所述第一酰胺化反应的时间为24h,所述搅拌的转速为600rpm;第一酰胺化反应完成后,将所得混合溶液置于截留分子量为2000g/mol的透析袋中,置于2l去离子水中透析24h,每隔2h换一次水,得到浓度为1.230mg/ml的键连有雷替曲塞的超支化聚乙烯亚胺水分散液;
(3)将1ml步骤(1)所述的表面羧酸化的fe3o4水分散液、30mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、15mgn-羟基琥珀酰亚胺混合,在600rpm转速下室温搅拌30min;将所得混合溶液与1ml步骤(2)所述的键连有雷替曲塞的超支化聚乙烯亚胺水分散液混合,在20℃下搅拌进行第二酰胺化反应,所述第二酰胺化反应的时间为24h,所述搅拌的转速为600rpm;第二酰胺化反应完成后,将所得混合溶液在9000rpm的转速下离心7min,弃去上清液,所得沉淀为自靶向抗癌纳米粒子前驱体;
(4)将步骤(3)所得自靶向抗癌纳米粒子前驱体超声分散于1ml去离子水中,所述超声的强度为5w,所述超声的时间为2min;将所得自靶向抗癌纳米粒子前驱体分散液与0.02ml三乙胺混合,在25℃搅拌30min,所述搅拌的转速为600rpm;然后维持搅拌状态和体系温度不变,向所得混合溶液中滴加0.015ml乙酸酐,所述滴加的速度为0.008ml/min,滴加结束后,在25℃进行乙酰化反应,所述乙酰化反应的反应时间为12h;将所述乙酰化反应所得混合溶液在9000rpm离心5min,所得沉淀为自靶向抗癌纳米粒子,经干燥后得其质量为5.5307mg;得到自靶向抗癌纳米粒子后,将自靶向抗癌纳米粒子分散于1ml的超纯水中,得到自靶向抗癌纳米粒子水分散液,以此状态进行保存。
经计算,本实施例所得自靶向抗癌纳米粒子中的活性部分的质量含量为11.4%。
采用实施例1所述的方法测试步骤(2)所得键连有雷替曲塞的超支化聚乙烯亚胺中的超支化聚乙烯亚胺与雷替曲塞的摩尔比,结果为1:8。
采用动态光散射法测定所得自靶向抗癌纳米粒子的粒径分布,本实施例所得自靶向抗癌纳米粒子的粒径范围为75~300nm,平均粒径为160nm,落在了可在肿瘤组织产生高通透和滞留效应的纳米粒子的粒径范围内,说明本实施例所得自靶向抗癌纳米粒子能够通过肿瘤组织,并具有滞留效应。
对本实施例所得产物进行xrd测试,结果同实施例1。
应用例1
将1ml本发明实施例1所得自靶向抗癌纳米粒子水分散液(7.6mg/ml)、400ultris-hcl(即三(羟甲基)氨基甲烷盐酸盐)缓冲液(浓度为0.05mol/l)、200ul蛋白酶k溶液(2mg/ml)混合,将所得混合溶液置于截留分子量为3500g/mol的透析袋中,将透析袋置于20mlph值为7.4的磷酸缓冲溶液中。每隔一定时间取出释放液1ml,用紫外可见光谱测定释放液中rtx浓度,得到药物释放曲线,如图7所示,可以看出该释放曲线在20h之前药物释放浓度逐步增强,20h后rtx释放量达到rtx总量的70%左右,然后基本趋于稳定不再释放,可以得出该自靶向抗癌纳米粒子属于缓释型。
采用上述方法测试本发明实施例2~4所得的自靶向抗癌纳米粒子的释放性能,所得结果与实施例1所得的自靶向抗癌纳米粒子类似。
应用例2
以kb细胞(叶酸受体阳性细胞)和a549细胞(叶酸受体阴性细胞)为模型细胞评价本发明实施例1所得的自靶向抗癌纳米粒子对叶酸受体阳性细胞和叶酸受体阴性细胞的毒性。
采用rpmi.1640培养基在相同条件下培养kb细胞和a549细胞,培养基含有10wt.%胎牛血清、1wt.%双抗(青霉素和链霉素的混合水溶液,青霉素的浓度为60μg/ml,链霉素的浓度为60μg/ml),培养箱温度为37℃,培养箱内二氧化碳的体积浓度为5%;取对数期生长良好的kb细胞和a549细胞,以每孔1万细胞的数量种植于96孔板中,24h后显微镜观察细胞贴壁良好;依次向孔中加入用培养基稀释过的雷替曲塞浓度为1.25、2.5、5、10、15μg/ml的自靶向抗癌纳米粒子和裸药雷替曲塞120μl;培养24h后,吸走培养基,各加入120μl浓度为5mg/ml的噻唑蓝水溶液,继续培养4h后,吸走噻唑蓝溶液,各加入120μl二甲基亚砜,15min后,用酶标仪测定各孔的吸光度,计算细胞存活率,结果如图8和图9所示。
图8为本发明所提供自靶向抗癌纳米粒子对kb和a549的毒性测试结果,由图8可知,本发明所提供自靶向抗癌纳米粒子对于kb和a549的杀伤性有显著区别,对kb的杀伤性明显优于对a549,且随着雷替曲塞浓度的增大,杀伤性的差别越大,说明本发明所提供的自靶向抗癌纳米粒子对于叶酸受体阳性细胞具有更强的毒性。
图9为裸药雷替曲塞对kb和a549的毒性测试结果,由图9可知,裸药雷替曲塞对于kb和a549的杀伤性类似,随着浓度的增大,裸药雷替曲塞对两者的杀伤性表现出了一定差别,但该差别小于本发明所提供的自靶向抗癌纳米粒子对两种细胞的杀伤性差别。由此说明,本发明所提供的自靶向抗癌纳米粒子对叶酸受体阳性细胞的毒性强于裸药雷替曲塞。
采用上述方法测试本发明实施例2~4所得的自靶向抗癌纳米粒子对叶酸受体阳性细胞和叶酸受体阴性细胞的毒性,结果与实施例1相同。
应用例3
对癌细胞选择性的测试:
采用应用例2所述的培养细胞的方法培养kb和a549细胞;取对数期生长良好的kb和a549,以每孔10万细胞的数量种植于6孔板中,培养24h后,使用显微镜观察细胞贴壁良好,然后加入用培养基稀释过的rtx浓度为15μg/ml的自靶向抗癌纳米粒子液体1ml;继续培养4h后,加入200μl胰酶,室温消化3min后细胞开始剥离孔板底部,再加入800μl培养基用移液枪吹打冲洗孔板底部使细胞悬浮,将细胞悬浮液加入15ml离心管,在1000rpm转速下离心5min,弃去上清液,得到底部细胞;将所得细胞分散于1ml磷酸缓冲盐溶液(ph值为7.4)中,加入200μl浓盐酸,在20000hz超声5min,使得细胞破裂,自靶向抗癌纳米粒子释放出。用等离子体发射光谱仪(icp)测定铁浓度,得到两种细胞对自靶向抗癌纳米粒子的摄取量,该摄取量以铁的含量表示,如图10所示。
由图10可知,a549和kb对自靶向抗癌纳米粒子的摄取量有显著差别,kb对自靶向抗癌纳米粒子的摄取量是a549对自靶向抗癌纳米粒子摄取量的2倍,说明本发明所提供的自靶向抗癌纳米粒子其具有优越的叶酸过表达癌细胞靶向能力,能够选择性地进入癌细胞。
采用上述方法测试本发明实施例2~4所得的自靶向抗癌纳米粒子对癌细胞的选择性,结果与实施例1相同。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!