含有在环内包含至少两个(-CH2-CH2-O-)单元的接头的缀合物和缀合试剂的制作方法
本发明涉及新的缀合物和新的缀合试剂。
背景技术:
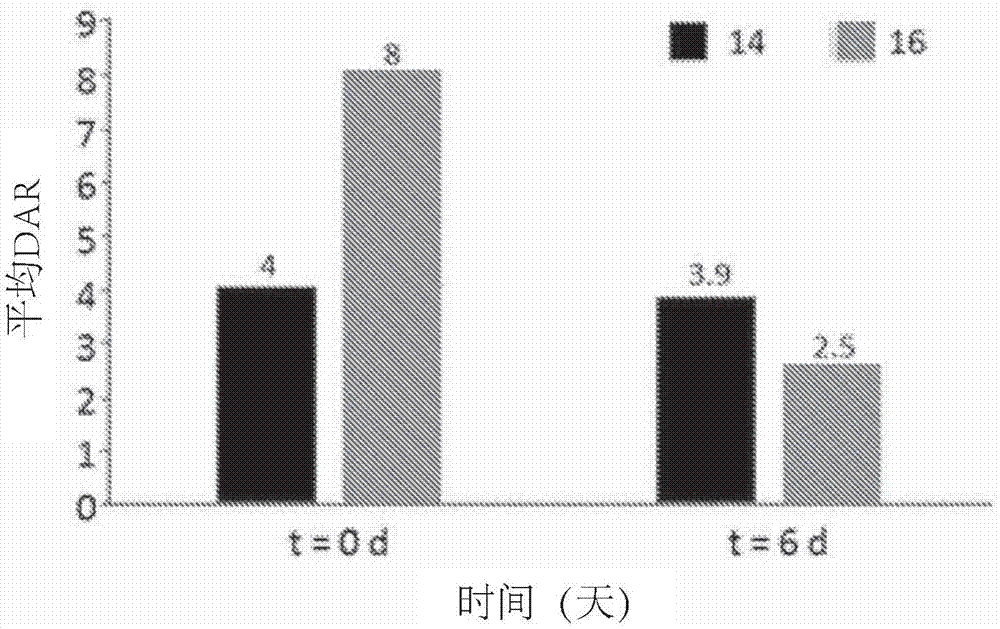
:近年来,许多研究致力于将多种有效载荷(例如治疗剂、诊断剂和标记剂)与肽和蛋白质缀合,以用于宽泛的应用。蛋白质和肽本身可具有治疗特性,和/或其可为结合蛋白。肽和蛋白质具有作为治疗剂的潜在用途,并且缀合是改善其性能的一种方法。例如,水溶性合成聚合物,特别是聚亚烷基二醇,广泛用于治疗性缀合活性肽或蛋白质。已显示这些治疗性缀合物通过延长循环时间和降低清除率、降低全身毒性以及在一些情况下显示出增加的临床功效而有利地改变药代动力学。将聚乙二醇peg与蛋白质共价缀合的方法通常称为“peg化”。peg链可携带有效载荷,例如治疗剂、诊断剂或标记剂。结合蛋白,特别是抗体或抗体片段通常是缀合的。结合蛋白对靶细胞和分子表面上的特定标记物的特异性使得它们自身被广泛用作治疗剂或诊断剂,或被用作有效载荷的载体,所述有效载荷可包括治疗剂、诊断剂或标记剂。与标记物和报道基团(例如荧光基团、放射性同位素和酶)缀合的这些蛋白质用于标记和成像应用,而与诸如细胞毒性剂和化疗药物的药物缀合以产生抗体-药物缀合物(adc)时,能够将这类药剂靶向递送至特定组织或结构(例如特定细胞类型或生长因子),从而使得对正常的健康组织的影响最小化,并显著降低与化疗治疗相关的副作用。这种缀合物在一些疾病领域(特别是癌症)中具有广泛的潜在治疗应用。含有结合蛋白的缀合物通常含有peg。在文献中已报道了许多缀合蛋白质和肽的方法。可能最常用的方法包括使用基于马来酰亚胺或琥珀酰亚胺的缀合试剂。这种试剂记载于许多出版物中,例如wo2004/060965和wo2013/090590。另一种产生更均匀的产物的方法记载于liberatore等人,bioconj.chem1990,1,36-50和delrosario等人,bioconj.chem.1990,1,51-59中,其记载了可用于交联蛋白质(包括抗体)中的二硫键的试剂的用途。wo2005/007197记载了一种使用新的缀合试剂将聚合物与蛋白质缀合的方法,所述缀合试剂能够与源自蛋白质中的二硫键的两个硫原子缀合以产生新的硫醚缀合物,而wo2009/047500记载了相同的缀合试剂与附接于蛋白质的多组氨酸标记键合的用途。wo2010/100430记载了能够在蛋白质中形成横跨二硫键的单碳桥的试剂。与蛋白质缀合相关的其他文献包括wo2014/064423、wo2013/190292、wo2013/190272和ep2260873。wo2014/064424记载了特异性adc,其中药物为美坦辛(maytansine),并且抗体通过交联二硫键而键合。wo2014/064423记载了特异性adc,其中药物为奥瑞斯他汀(auristatin),并且抗体通过交联二硫键而键合。这些文献的实施例中示出的接头含有peg部分作为接头骨架的一部分,其中线性peg链的一端通过接头的另一部分附接于药物上,而peg链的另一端通过接头的另一部分附接于抗体上。这是adc的常见结构模式。wo2015/057699和us2016/0000933记载了其中线性peg链附接于接头的骨架上的替代结构。wo2009/152440记载了一种小分子缀合化合物,其包含靶向配体、治疗剂和/或成像剂;以及将配体与治疗剂和/或成像剂连接的接头。其包括了非常长的可能的接头的列表(第0060段),其中包括冠醚(用于与金属螯合)。wo2007/055700涉及由具有两个乙基亚氨基二乙酸侧链的二氮杂冠醚衍生的镧系元素螯合物。同样,冠醚因其螯合能力而存在。近年来,缀合物中的将有效载荷与蛋白质或肽连接的接头的重要性已变得显而易见。通常,要做的关键性决定是:需要具有可裂解的接头,即在给予缀合物时降解以释放游离有效载荷的接头,还是需要具有不可裂解的接头。另一关键性决定是是否在接头中包含peg。在这些考虑的前提下,原则上可使用任意的接头。然而,在实践中,接头结构的变化可导致缀合试剂或所得缀合物的特性差异。一个经常发现的问题是,缀合物的储存稳定性可能比所期望的低。当使用可裂解的接头时,在期望缀合物在给予前应具有长的储存期但在应用时应快速裂解时,尤其如此,但对于任何接头都是如此。需要提高缀合物的储存稳定性。此外,还需要提高体内稳定性,因为这可产生增加的生物活性。还需要增加生物活性。最后,需要在制备缀合物时提高缀合效率,以提供高度均匀的产物,并使缀合过程中的聚集最小化。现已发现,对于特定类型的缀合物,使用特定结构的含peg的接头提供了有利的特性。具体而言,可获得具有高稳定性和/或效力的缀合物。技术实现要素:本发明提供一种缀合物,其包含通过接头与治疗剂、诊断剂或标记剂缀合的蛋白质或肽,其特征在于接头在环内包含至少两个~(ch2-ch2-o-)~单元,所述环经由环内的单个束缚(tethering)原子附接于接头的其余部分,或者所述环经由环内的两个或更多个束缚原子在单个位点处附接于接头的其余部分。本发明还提供一种缀合试剂,其包含能与蛋白质或肽反应的官能团,该试剂还包含治疗剂、诊断剂或标记剂以及在环内包含至少两个~(ch2-ch2-o-)~单元的接头,所述环经由环内的单个束缚原子附接于接头的其余部分,或者所述环经由环内的两个或更多个束缚原子在单个位点处附接于接头的其余部分。本发明还提供一种制备本发明的缀合物的方法,其包括将蛋白质或肽与本发明的缀合试剂反应,所述环经由环内的单个束缚原子附接于接头的其余部分,或者所述环经由环内的两个或更多个束缚原子在单个位点处附接于接头的其余部分。具体实施方式本发明的试剂可通过下式示意性地表示:其中d代表治疗剂、诊断剂或标记剂,f代表能与蛋白质或肽键合的官能团,并且代表包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。官能团f能与蛋白质或肽反应,如下文更为详细地说明。本发明的缀合物可通过下式示意性地表示:其中d代表治疗剂、诊断剂或标记剂,f'代表蛋白质或肽,其通过接头的蛋白质或肽键合部分与缀合物的其余部分键合,并且代表包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。聚乙二醇环在本说明书中,“聚乙二醇环”应理解为意指包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。所述环可包含两个或更多个单独的~(ch2-ch2-o-)~单元,或其可包含一个或更多个式~(ch2-ch2-o-)x~的单元,其中x为至少2的数值。所述环可包含一个或更多个另外的原子来完成环状结构。另外的原子可为例如氮原子、碳原子、氧原子、硫原子、硅原子和/或磷原子。本发明的一个特征是环垂悬于接头的其余部分,而不是形成接头的骨架的一部分,即,它附接于接头的其余部分并且在溶液中能相对于接头的其余部分灵活移动。可以认为,相比于如wo2007/055700中所记载的环形成接头的骨架的一部分的情况,这使得缀合物在溶液中采用比在环被刚性地固定于接头的骨架内时更灵活的构型,从而提供改进的特性。wo2007/055700和wo2009/152440均在接头中包含环以螯合金属离子,这与本发明的目的完全不同。为此,环可经由环内的单个束缚原子在单个位点处附接于接头的其余部分,或可在两个或更多个位点处附接。或者,环可经由环内的两个或更多个束缚原子在单个位点处附接于接头的其余部分。束缚原子可为例如氮原子、碳原子、磷原子或硅原子,尤其是氮原子和/或碳原子,并且在与接头的其余部分附接的位点处存在的原子可为例如氮原子或碳原子。以下为在本发明的缀合物或试剂中环与接头的其余部分的可能的附接方式的示意图,t代表环内的束缚原子,peg代表至少两个~(ch2-ch2-o-)~单元:合适的环的具体实例包括以下环,其中符号~表示环并入接头中的点:优选地,环在单个位点处附接于接头的其余部分,并且最优选环经由环内的单个束缚原子在单个位点处附接于接头的其余部分。环可例如由其中x至少为2、优选2至20的~(ch2-ch2-o-)x~单元组成。或者,环可包含其中x至少为2、优选2至50、尤其是2至20的~(ch2-ch2-o-)x~单元,但是还可包含上述一个或更多个另外的原子,或者可以以一些其他方式衍生化。缀合物和试剂可以容易地由冠醚合成。冠醚是乙二醇的环状低聚物,并且已知许多不同的冠醚,其中一些完全由乙二醇单元组成,并且其中一些在环内包含另外的原子。例如,氮杂冠醚包含氮原子,而二氮杂冠醚包含两个氮原子。许多冠醚是市售的,并且这些冠醚为合成本发明的缀合物和试剂提供了方便的起始点。带有可与其它化合物反应的官能团的冠醚是已知的,例如带有羧基、羟基、氨基或醛基的冠醚是已知的,与任选带有官能团(例如羧基、羟基、氨基、异氰酸酯基团、硝基或醛基)的苯环稠合的冠醚也是已知的。已知冠醚螯合阳离子,并且us4,838,274中记载了全氟冠醚用于mri。因此,本发明的缀合物可用于成像技术应用中,如mri或pet。可并入本发明的缀合物和试剂中的常见冠醚包括以下所示的结构。通过存在于环内的原子(尤其是氮原子)或经由存在于侧链上的基团(例如羟基、氨基、羧基、醛基、异氰酸酯基团或硝基)进行反应,可使这些冠醚附接于本发明的缀合物和试剂的接头的骨架上。常见的连接如下所示:除了由冠醚衍生的环之外,由穴状配体衍生的环也可用于本发明中。这种环记载于例如us2014/0072900中,并且包括以下环:本发明的缀合物和试剂可包含一个含有至少两个~(ch2-ch2-o-)~单元的环,或者其可包含两个或更多个这样的环。环可为单环,或者可为双环或多环。两个或更多个环可以附接于接头的骨架,或者它们可以彼此附接,因此:应理解,环可具有许多不同的尺寸和结构。本发明的重要特征在于peg链形成环状结构的一部分:该链不是形成接头的骨架的一部分的线性peg链,也不是一端束缚于接头上但具有自由的未束缚端的垂悬peg链。相反,它是垂悬的含peg的环状结构,其不形成接头的骨架的一部分。在一个优选的实施方案中,本发明的缀合物或试剂中的全部peg存在于一个或更多个环内。在另一个实施方案中,peg还可存在于接头的其他位置,尤其是在接头的骨架中或在将环与接头的骨架连接的基团中,这将在下文中更详细地论述。在本发明的缀合物和试剂中存在的~(ch2-ch2-o-)~单元的总数当然取决于预期的应用。对于某些应用,可使用高分子量的peg,例如数均分子量可为最高达约75000,例如最高达50000、40000或30000g/摩尔。例如,数均分子量可在500g/摩尔至约75000的范围内。然而,对于某些应用,可优选较小的peg部分。与本发明的缀合物或试剂中存在的peg的总量一样,存在于环内的~(ch2-ch2-o-)~单元的数目取决于预期的应用。例如环状peg部分的分子量可最高达3000g/摩尔。然而,在本发明的一个优选的实施方案中,含有最少至2个乙二醇单元(例如2至50个乙二醇单元)的环状基团对于某些应用而言是有用的,并且以环状peg基团的形式存在。例如可使用具有2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个重复单元,或24、36、40或48个重复单元的含peg的环。有效载荷本发明的缀合物和试剂携带有效载荷,所述有效载荷为治疗剂、诊断剂或标记剂。可存在单分子的治疗剂、诊断剂或标记剂,或可存在两个或更多个分子的治疗剂、诊断剂或标记剂。优选包括一个或更多个药物分子,例如细胞毒性剂或毒素。奥瑞斯他汀类(auristatins)、美登木素类(maytansinoids)和多卡米星类(duocarmycins)是常见的细胞毒性药物。通常优选药物缀合物,特别是抗体药物缀合物,应含有多拷贝的药物。标记剂(其应理解为包括成像剂)可包括例如放射性核素、荧光剂(例如胺衍生的荧光探针,例如5-二甲基氨基萘-1-(n-(2-氨基乙基))磺酰胺-丹磺酰基乙二胺、oregon488尸胺(目录号o-10465,分子探针)、丹磺酰基尸胺、n-(2-氨基乙基)-4-氨基-3,6-二磺基-1,8-萘酰亚胺、二钾盐(荧光黄乙二胺),或罗丹明b乙二胺(目录号l2424,分子探针),或硫醇衍生化的荧光探针,例如fll-胱氨酸(目录号b-20340,分子探针))。还可使用生物素。优选地,有效载荷为治疗剂,特别是上述那些中的一种。蛋白质在该部分和其他部分,为了方便起见,“蛋白质”应理解为包括“蛋白质和肽”,除非上下文另有要求。可存在于本发明的缀合物中的合适的蛋白质包括例如肽、多肽、抗体、抗体片段、酶、细胞因子、趋化因子、受体、血液因子、肽激素、毒素、转录蛋白或多亚基蛋白。酶包括碳水化合物特异性酶、蛋白水解酶等,如us4,179,337公开的氧化还原酶、转移酶、水解酶、裂合酶、异构酶和连接酶。受关注的特异性酶包括天冬酰胺酶、精氨酸酶、腺苷脱氨酶、超氧化物歧化酶、过氧化氢酶、胰凝乳蛋白酶、脂肪酶、尿酸酶、胆红素氧化酶、葡萄糖氧化酶、葡糖醛酸糖苷酶、半乳糖苷酶、葡糖脑苷脂酶(glucocerbrosidase)、葡糖醛酸糖苷酶和谷氨酰胺酶。血液蛋白包括白蛋白、转铁蛋白、因子vii、因子viii或因子ix、血管性血友病因子(vonwillebrandfactor)、胰岛素、acth、胰高血糖素、生长抑素、生长激素、胸腺素、甲状旁腺激素、色素激素、生长调节素类、红细胞生成素、黄体化激素、下丘脑释放因子、抗利尿激素、催乳素、白介素、干扰素如ifn-α或ifn-β、集落刺激因子、血红蛋白、细胞因子、抗体、抗体片段、绒毛膜促性腺激素、促卵泡激素、促甲状腺激素和组织纤溶酶原激活剂。其他受关注的蛋白质是由dreborgetalcrit.rev.therap.drugcarriersyst.(1990)6315-365公开的变应原蛋白,其与诸如聚(环氧烷)的聚合物缀合时具有降低的变应原性,因此适合用作耐受诱导剂。在公开的变应原中有豚草抗原e、蜜蜂毒液、螨变应原等。受关注的是糖蛋白多肽,例如免疫球蛋白、卵白蛋白、脂肪酶、葡糖脑苷脂酶、凝集素、组织纤溶酶原激活剂和糖基化的白介素、干扰素和集落刺激因子,以及免疫球蛋白,例如igg、ige、igm、iga、igd及其片段。特别关注的是在临床医学中用于诊断和治疗目的的受体和配体结合蛋白以及抗体和抗体片段。本发明特别优选的实施方案是基于抗体或抗体片段的抗体-药物缀合物,特别是在药物为细胞毒性药物(例如奥瑞斯他汀、美登木素类或多卡米星类)时。除非上下文另有要求,本说明书中对本发明的缀合物的任何提及均应理解为包括对抗体药物缀合物的特别提及。可用于本发明的缀合物中的抗体的实例是抗cd30抗体,例如嵌合单克隆抗体cac10,例如brentuximab。brentuximab是brentuximabvedotin(inn)的抗体部分,商品名为brentuximabvedotin由who定义如下:免疫球蛋白g1-κ奥瑞斯他汀e缀合物,抗[智人(homosapiens)tnfrsf8(肿瘤坏死因子受体超家族成员8,ki-1,cd30)],与奥瑞斯他汀e缀合的嵌合单克隆抗体;γ1重链(1-446)[小家鼠(musmusculus)vh(ighv1-84*02-(ighd)-ighj3*01)[8.8.10](1-117)-智人ighg1*01ch3k130>del(118-446)],具有κ轻链(1'-218')的(220-218')-二硫化物(如果不是缀合的)[小家鼠v-kappa(igkv3-4*01-igkj1*01)[10.3.9](1'-111')-智人igkc*01(112'-218')];(226-226”)-二硫化物二聚体;经由马来酰亚胺己酰基-缬氨酰基-瓜氨酰基(citrullinyl)-对氨基苄基氨基甲酸酯(mc-valcit-pabc)接头,以平均3至5个半胱氨酰基,缀合至单甲基奥瑞斯他汀e(mmae)。对于vedotin部分,请参阅文献“innforpharmaceuticalsubstances:namesforradicals,groupsandothers”*。重链qiqlqqsgpevvkpgasvkisckasgytftdyyitwvkqkpgqglewigw50iypgsgntkynekfkgkatltvdtssstafmqlssltsedtavyfcanyg100nywfaywgqgtqvtvsaastkgpsvfplapsskstsggtaalgclvkdyf150pepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyic200nvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdt250lmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynsty300rvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvyt350lppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvlds400dgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg446轻链divltqspaslavslgqratisckasqsvdfdgdsymnwyqqkpgqppkv50liyaasnlesgiparfsgsgsgtdftlnihpveeedaatyycqqsnedpw100tfgggtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakv150qwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacev200thqglsspvtksfnrgec218二硫桥键位点h内22-96144-200261-321367-42522”-96”144”-200”261”-321”367”-425”l内23'-92'138'-198'23”'-92”'138”'-198”'h-l间*220-218'220”-218”'h-h间*226-226”229-229”*不存在两个或三个链间二硫桥键,抗体各自经由硫醚键缀合至平均3或5个药物接头。n-糖基化位点297,297”(whodruginformation,vo.25,no.1,2011;internationalnonproprietarynamesforpharmaceuticalsubstances(inn),recommendedinternationalnonproprietarynames,list65)蛋白质可以视需要衍生化或官能化。特别地,在缀合之前,可使蛋白质如天然蛋白质与多种保护基团反应以保护其上的敏感基团;或者,其可以预先与一个或更多个聚合物或其它分子缀合。蛋白质可含有多组氨酸标记,其在缀合反应期间可通过缀合试剂靶向。缀合试剂和方法可用于将有效载荷与蛋白质缀合的许多缀合试剂是已知的,本发明的新的缀合试剂与这些已知试剂的区别在于其包含的接头的性质。这种试剂含有至少一个能与蛋白质或肽反应的官能团f。例如,缀合试剂可包含能与蛋白质中存在的至少一个亲电基团或尤其是亲核基团反应的官能团,所述官能团通过接头附接于有效载荷。任何已知类型的缀合反应均可用于形成本发明的缀合物。例如,可以使用已知的硫醇键合、胺缀合或点击化学的方法进行反应。例如,试剂可含有马来酰亚胺基团、n-羟基琥珀酰亚胺基团、点击化学基团(例如叠氮基或炔基)、胺基、羧基、羰基或活性酯基。其他可行的方法包括使用已被氨基酸(特别是用于缀合的氨基酸,例如工程化半胱氨酸或非天然氨基酸)重组工程化的蛋白质,以及通过特定的酶促反应(例如使用转谷氨酰胺酶)进行的酶促缀合。蛋白质上的反应位点本质上可以是亲核的或亲电子的。常见的蛋白质缀合位点处于赖氨酸或半胱氨酸氨基酸残基或碳水化合物部分。或者,可在已附接于结合蛋白的多组氨酸标记处发生缀合。有利地,本发明的缀合试剂能与蛋白质中的亲核基团反应,并因此与其化学键合。因此,缀合试剂通常包含至少一个离去基团,其在与亲核基团反应时脱去。缀合试剂可以例如包含两个或更多个离去基团。优选地,本发明的缀合试剂能与两个亲核基团反应。有利地,本发明的缀合试剂包含至少两个离去基团。如果存在两个或更多个离去基团,则它们可以相同或不同。或者,缀合试剂可以包含在化学上等同于两个离去基团的单个基团,并且该单个基团能与两个亲核基团反应。亲核基团包括硫原子和胺基团,并且蛋白质中的亲核基团例如由半胱氨酸、赖氨酸或组氨酸残基提供。在本发明的一个优选的实施方案中,亲核基团是存在于蛋白质的半胱氨酸残基中的硫原子。这种结构可通过还原蛋白质中存在的二硫键来获得。在另一个实施方案中,亲核基团可以是存在于附接于蛋白质上的多组氨酸标记中存在的组氨酸残基中的咪唑基团。一组试剂基于双卤代或双硫代马来酰亚胺或其衍生物,如smithetal,j.am.chem.soc.2010,132,1960-1965和schumakeretal,bioconj.chem.,2011,22,132-136中所记载的。这些试剂包含以下官能团:其中每个l均为离去基团。马来酰亚胺环的氮原子与接头连接。类似地,可使用含有单个离去基团l的马来酰亚胺:同样,马来酰亚胺环的氮原子与接头连接。此外,可使用不含离去基团的马来酰亚胺:同样,马来酰亚胺环的氮原子与接头连接。另一组试剂为记载于wo201173391中的那些。这些试剂的实例包含以下官能团:其中每个l均为离去基团。在本发明的特别优选的实施方案中,缀合试剂包含官能团f:其中w代表吸电子基团,例如酮基、酯基-o-co-或砜基-so2-;a和b各自独立地代表c1-5亚烷基链或亚烯基链;且每个l独立地代表离去基团,或者两个l一起代表离去基团。当包含这类基团的试剂与蛋白质反应时,第一离去基团l脱去以原位形成包含下式的官能团的缀合试剂:其中m为0至4,所述官能团f与第一亲核基团反应。然后脱去第二离去基团l,并且与第二亲核基团发生反应。作为将包含官能团i的试剂用作原料的替代方案,可使用包含官能团ii的试剂,因为官能团i和ii是彼此的化学等同物。本发明的这些缀合试剂为在wo2005/007197和wo2010/100430中公开的一般类型。这些试剂可以例如用于靶向通过还原蛋白质中的二硫键获得的两个硫原子,或者靶向存在于与蛋白质连接的多组氨酸标记中存在的组氨酸残基中的咪唑基团。已发现,根据本发明,将环状peg基团并入这种类型的试剂中产生特别好的结果,其中有效地发生缀合反应以产生具有高度均匀性的稳定的缀合物。离去基团l可为例如-sp、-op、-so2p、-oso2p、-n+pr2r3、卤素或-o其中p代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基),或为包含部分-(ch2ch2o)n-的基团,其中n为2以上的数值,r2和r3各自独立地代表氢原子、c1-4烷基或基团p,并且代表含有至少一个取代基的取代的芳基,特别是苯基,所述取代基为例如-cn、cf3、-no2、-co2ra、-coh、-ch2oh、-cora、-ora、-ocora、-oco2ra、-sra、-sora、-so2ra、-nhcora、-nracora、-nhco2ra、-nraco2ra、-no、-nhoh、-nraoh、-ch=n-nracora、-n+ra3、卤素(特别是氯,或特别是氟)、-c≡cra和-c=cra2,其中每个ra独立地代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基)。优选存在吸电子取代基。申请人共同未决的申请gb1418186(公开为wo2016/059377)的主题是这样的缀合试剂,其中p代表包含部分-(ch2ch2o)n-的基团,其中n为2以上的数值。该申请公开了以下内容:离去基团可包含例如-(ch2ch2o)n-r1,其中r1为封端基团。可使用非常广泛的封端基团。r1可为例如氢原子、烷基,特别是c1-4烷基,特别是甲基,或任选取代的芳基,例如任选取代的苯基,例如甲苯基。或者,封端基团可包含诸如羧基或氨基的官能团。所述封端基团可例如具有式-ch2ch2co2h或-ch2ch2nh2,且可通过将-(ch2ch2o)n-链的末端单元官能化来制备。或者,在缀合试剂中-(ch2ch2o)n-基团可具有两个连接点,而不是被封端基团封端,使得存在两个离去基团的化学等同物,其能与两个亲核基团反应。离去基团的-(ch2ch2o)n-部分基于peg,聚乙二醇。peg可为直链或支链的,并且其可以以任何方式衍生化或官能化。n为2以上的数值,例如2、3、4、5、6、7、8、9或10。例如,n可为5至9。或者,n可为10以上的数值。n没有特别的上限。n可为例如150以下的数值,例如120以下的数值,例如100以下的数值。例如n可为2至150,例如7至150,例如7至120。离去基团的peg部分-(ch2ch2o)n-的分子量可为例如1至5kda;其可为例如1kda、2kda、3kda、4kda或5kda。视需要,离去基团可含有两个或更多个被一个或更多个间隔基分隔的部分-(ch2ch2o)n-。在本发明的缀合试剂中,离去基团适合地为式-sp、-op、-so2p、-oso2p、-n+pr2r3,其中p为包含部分-(ch2ch2o)n-的基团,且r2和r3各自独立地代表氢原子、c1-4烷基或基团p。优选地,r2和r3各自代表c1-4烷基,特别是甲基,或特别是氢原子。或者,缀合试剂可包含式-s-p-s-、-o-p-o-、-so2-p-so2-、-oso2-p-oso2-和-n+r2r3-p-n+r2r3-的基团。该类型的具体基团包括-s-(ch2ch2o)n-s-、-o-(ch2ch2o)n-o-、-so2-(ch2ch2o)n-so2-、-oso2-(ch2ch2o)n-oso2-或-n+r2r3-(ch2ch2o)n-n+r2r3-。其还可包括以下类型的基团:其中-(ch2ch2o)n-基团由任何合适的连接基团(例如烷基)携带。这些二价基团在化学上相当于两个能与两个亲核基团反应的离去基团。存在于本发明的新的缀合试剂中的特别优选的离去基团l为-sp或-so2p,特别是-so2p。在该基团中,一个优选的实施方案是p代表苯基,或特别是甲苯基。另一个优选的实施方案是p代表包含部分-(ch2ch2o)n-、特别是其中n为上述值之一(尤其是7)的部分-(ch2ch2o)n-的基团。特别优选的离去基团l为-so2-(ch2ch2o)n-h/me,特别是-so2-(ch2ch2o)7-h/me。在本说明书中,对离去基团l的任何提及应理解为包括对这些优选基团、特别是-so2-(ch2ch2o)n-h/me且更特别是-so2-(ch2ch2o)7-h/me的特别提及。优选地,w代表酮基。优选a和b各自代表-ch2-。上述式i和ii的试剂形成了包含基团f’的缀合物:其中w'代表吸电子基团或通过还原吸电子基团而获得的基团,pr代表经由亲核基团nu与a和b键合的蛋白质或肽。缀合方法(下文将更详细地描述)的直接产物为包含吸电子基团w的缀合物。但是,缀合方法在合适的条件下是可逆的。这对于某些应用来说可能是期望的,例如在需要快速释放蛋白质的情况下,但对于其他应用而言,快速释放蛋白质可能是不期望的。因此,可能需要通过将吸电子部分还原成阻止蛋白质释放的部分来稳定缀合物。因此,缀合方法可包含另外的任选步骤:还原缀合物中的吸电子基团。特别优选使用硼氢化物,例如硼氢化钠、氰基硼氢化钠、硼氢化钾或三乙酰氧基硼氢化钠作为还原剂。可使用的其他还原剂包括例如氯化锡(ii)、醇盐如烷醇铝,以及氢化铝锂。因此,例如,含有酮基的部分w可被还原成含有ch(oh)基团的部分;醚基ch.ora可通过羟基和醚化剂反应得到;酯基ch.o.c(o)ra可通过羟基和酰化剂反应得到;氨基ch.nh2、ch.nhra或ch.nra2可由酮通过还原胺化反应制得;或酰胺ch.nhc(o)ra或ch.n(c(o)ra)2可通过胺的酰化形成,其中ra代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基)。砜可被还原成亚砜、硫化物或硫醚。基团f’和f优选具有下式:尤其是在上式中,优选的离去基团如上所述。优选每个nu均为硫原子。另一组优选的缀合试剂含有官能团:~w-cr4r4'-cr4.l.l'(iv)其中w具有上文给出的含义和优选含义,并且每个r4代表氢原子或c1-4烷基,r4'代表氢原子,并且每个l独立地代表离去基团,或者两个l一起代表离去基团;或每个r4代表氢原子或c1-4烷基,l代表离去基团,并且r4'和l'一起代表键。另一组缀合试剂包含以下官能团:~w-(ch=ch)p-(ch2)2-l(v)或~w-(ch=ch)p-ch=ch2(vi)其中w具有上文给出的含义和优选含义,并且p代表0或1至4的整数,优选0。这种类型的特别优选的试剂包含以下官能团:~nh-co-ar-co-(ch2)2-l(va)或~nh-co-ar-co-ch=ch2(via)其中ar代表任选取代的芳基,特别是苯基。在所有情形下,离去基团l和l’的优选含义如上所述。本发明的缀合试剂可包含多于一种与蛋白质反应的官能团。例如,试剂可在分子的一端包含官能团、优选式i或ii的官能团,且在分子的其他位置包含一个或更多个另外的官能团。这样的结构记载于例如belchevaetal,j.biomater.scipolymeredn.9(3),207-226,并且适用于合成包含多种蛋白质的缀合物。可通过与已知方法类似的方法来制备本发明的新的缀合试剂。具体的合成反应将在以下实施例中进行说明。本发明的缀合试剂可与蛋白质或肽反应以形成本发明的缀合物,并且这种反应构成本发明的另一方面。因此,将包含合适的官能团、尤其是官能团i或ii的缀合试剂与蛋白质或肽、尤其是抗体或抗体片段反应以形成缀合物、尤其是包含基团iii的缀合物。使用式i或ii的缀合试剂的关键特征在于,α-亚甲基离去基团和双键与充当迈克尔活化部分的吸电子官能团交叉共轭。如果离去基团易于在交叉官能化试剂中消除而非直接置换,并且吸电子基团为适合于迈克尔反应的活化部分,则相继的分子内双烷基化可通过连续的迈克尔反应和逆迈克尔反应进行。在含有官能团i的试剂中,离去基团用于掩蔽潜在的共轭双键,其直到发生第一次烷基化反应以得到包含官能团ii的试剂后才暴露,且双烷基化反应是由相继的和交互的迈克尔反应和逆迈克尔反应产生的。交叉官能化的烷基化试剂可包含与双键共轭的或位于离去基团和吸电子基团之间的多重键。当经由源自蛋白质中的二硫键的两个硫原子与蛋白质键合时,所述方法可通过还原二硫键随后将还原产物与本发明的试剂反应而进行。优选地,在引入缀合试剂之前还原二硫键,并例如通过缓冲液交换来除去任何过量的还原剂。可使用常规的方法来还原二硫键,例如使用二硫苏糖醇、巯基乙醇或三羧基乙基膦(tris-carboxyethylphosphine)。可在与已知的缀合方法类似的条件下进行缀合反应,包括wo2005/007197、wo2009/047500、wo2014/064423、wo2014/064424和wo2015/057699中公开的条件。所述方法例如可在溶剂或溶剂混合物中进行,其中所有反应物均可溶于所述溶剂或溶剂混合物。例如,可使蛋白质与聚合物缀合试剂在水性反应介质中直接反应。该反应介质还可以是缓冲的,这取决于亲核基团的ph要求。反应的最佳ph通常为至少4.5,通常为约5.0至约8.5,优选约6.0至7.5。最佳的反应条件当然取决于所用的具体反应物。当使用水性反应介质时,3-40℃的反应温度通常是合适的。在有机介质(例如thf、乙酸乙酯、丙酮、dmso、dmf、mecn)中进行的反应通常在最高达环境温度的温度下进行。在一个优选的实施方案中,反应在水性缓冲液中进行,所述水性缓冲液可包含一定比例的有机溶剂,例如最高达20体积%的有机溶剂,通常5至20体积%的有机溶剂。可使用化学计量相当或稍微过量的缀合试剂来有效地缀合蛋白质。但是,还可使用化学计量过量的缀合试剂来进行缀合反应,并且这对于一些蛋白质而言可能是期望的。过量的试剂可例如在随后的缀合物纯化过程中通过离子交换色谱法或hplc容易地除去。当然,当蛋白质包含足够的合适的连接位点时,可将多于一种缀合试剂与蛋白质缀合。例如,在含有两种不同的二硫键的蛋白质中,或在含有一个二硫键并且还携带多组氨酸标记的蛋白质中,每分子蛋白质可缀合两分子的试剂,并且这种缀合物构成本发明的一部分。接头本发明的缀合物和试剂含有接头,所述接头将治疗剂、诊断剂或标记剂与本发明的缀合物中的蛋白质或肽连接,或者与本发明的缀合试剂中的官能团连接。接头的骨架为连续的原子链,其从一端的治疗剂、诊断剂或标记剂延伸到另一端的蛋白质或肽。该接头需包含一个或更多个环状peg部分,即如上所述的包含至少两个-(ch2-ch2-o)-单元的环。其还可含有任何其他所需的基团,特别是在本领域常见的任何常规基团。分部(i).在一个实施方案中,位于有效载荷和式f'/f的基团之间的接头,特别是紧邻式f'/f的基团的那部分接头,可包含亚烷基基团(优选c1-10亚烷基基团)或任选取代的芳基或杂芳基,其中任何一个基团可被以下封端或间隔:一个或更多个氧原子、硫原子、-nra基团(其中ra代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基)或烷基芳基(优选c1-6烷基苯基))、酮基、-o-co-基团、-co-o-基团、-o-co-o、-o-co-nra-、-nr-co-o-、-co-nra-和/或-nra.co-基团。合适的芳基包括苯基和萘基,而合适的杂芳基包括吡啶、吡咯、呋喃、吡喃、咪唑、吡唑、噁唑、哒嗪、嘧啶和嘌呤。特别合适的连接基团为杂芳基,或特别是芳基,特别是苯基。其可与另一部分的连接基团相邻,所述另一部分的连接基团为或包含-nra.co-或-co.nra-基团,例如-nh.co-或-co.nh-基团。在此处和本说明书的其他地方,当存在基团ra时,其优选为c1-4烷基、特别是甲基,或特别是氢原子。可存在于任选取代的芳基、特别是苯基或杂芳基上的取代基包括例如一个或更多个相同或不同的取代基,所述取代基选自:烷基(优选c1-4烷基,特别是甲基,其任选被oh或co2h取代)、cf3、nra2、-cn、-no2、-co2ra、-coh、-ch2oh、-cora、-ora、-ocora、-oco2ra、-sra、-sora、-so2ra、-nracora、-nra.co2ra、-no、-nra.oh、-ch=n-nra.cora、-n+ra3、卤素如氟或氯、-c≡cra和-c=cra2,其中每个ra独立地代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基)。特别优选存在吸电子取代基。优选的取代基包括例如cn、no2、-ora、-ocora、-sra、-nra.cora、-nhoh和-nra.cora,特别是cn和no2。优选地,接头包含与基团f'/f相邻的上述基团中的一个。一组优选的缀合物和试剂包括其中缀合物/试剂包含位于治疗剂、诊断剂或标记剂与式f'/f的基团之间的接头的那些,所述接头包含与基团f'/f紧邻的任选取代的芳基或杂芳基;并且所述接头还包含与所述芳基或杂芳基相邻的-nra.c(o)-或-c(o).nra-基团;因此具有式-nra.c(o)-(杂)芳基-f'或-c(o).nra-(杂)芳基-f,其中ra代表c1-4烷基或氢。特别优选的是其中包含以下基团的缀合物和缀合试剂:或,特别是:在上式中,优选f具有式i或ii,例如上式ia、ib、iia或iib,并且优选f'具有式iii,例如上式iiia、iiib或iiic。在替代的实施方案中,本发明的缀合物和试剂包括包含位于治疗剂、诊断剂或标记剂与式f'/f基团之间的接头的那些,所述接头包含与基团f'/f紧邻的任选取代的芳基或杂芳基;并且所述接头还包含与所述芳基或杂芳基相邻的-nrb.c(o)-或-c(o).nrb-基团;因此具有式-nrb.c(o)-(杂)芳基-f'或-c(o).nrb-(杂)芳基-f,其中rb代表含有聚乙二醇环的基团。分部(ii).在一个实施方案中,接头可含有可降解基团,即其可含有在生理条件下断裂的基团,将有效载荷与其所键合或待键合的蛋白质分离。或者,其可为在生理条件下不可裂解的接头。当接头在生理条件下断裂时,其优选在细胞内条件下裂解。当靶标在细胞内时,优选接头对细胞外条件基本不敏感(即,使得不会阻止向细胞内靶标递送足够剂量的治疗剂)。当接头含有可降解基团时,其通常对水解条件敏感,例如其可为在一定ph值(例如酸性条件)下降解的基团。水解/酸性条件可见于例如核内体和溶酶体中。在酸性条件下易于水解的基团的实例包括腙类、缩氨基脲类、缩氨基硫脲类、顺式乌头酰胺类、原酸酯类和缩酮类。易受水解条件影响的基团的实例包括:在优选的实施方案中,接头包括例如,其可包括:接头还可在还原条件下易于降解。例如,其可含有在暴露于生物还原剂例如硫醇时可裂解的二硫化物基团。二硫化物基团的实例包括:其中r、r’、r”和r”’各自独立地为氢或c1-4烷基。在优选的实施方案中,接头包括例如,其可包括接头还可含有易受酶促降解影响的基团,例如其可易于被蛋白酶(例如溶酶体或核内体蛋白酶)或肽酶裂解。例如,其可含有肽基,所述肽基含有至少一个、例如至少两个或至少三个氨基酸残基(例如phe-leu、gly-phe-leu-gly、val-ala、val-cit、phe-lys、glu-glu-glu)。例如,其可包含具有1至5个、例如2至4个氨基酸的氨基酸链。易受酶促降解影响的基团的另一实例为:其中aa代表蛋白酶特异性氨基酸序列,例如val-cit。在优选的实施方案中,接头包括:例如,其可包括接头可携带单个有效载荷d,或多于一个基团d。可通过使用支化接头并入多个基团d,所述支化接头可例如包含天冬氨酸、谷氨酸或类似的残基。这引入下式的支化元素:其中b为1、2或3,b=1为天冬氨酸,b=2为谷氨酸,且b=3代表一个优选的实施方案。在上式中每个酰基部分可与基团d偶联。因此,上述支化基团可包含-co.ch2-基团,因此:视需要,天冬氨酸或谷氨酸或类似的残基可与其他天冬氨酸和/或谷氨酸和/或类似的残基偶联,例如:等。以类似的方式,可以引入氨基酸赖氨酸、丝氨酸、苏氨酸、半胱氨酸、精氨酸或酪氨酸或类似的残基以形成支化基团,因此:其中对于赖氨酸而言,b为4,并且其中对于丝氨酸而言,b为1。可使用类似的支化基团将环状peg基团并入接头中。因此,例如,可存在上述支化元素之一,例如天冬氨酸、谷氨酸、赖氨酸或丝氨酸或类似残基,其中一条分支通向药物d,而另一条分支通向含有环状peg基团的分支。上述各种接头部分可存在于支化基团之前或之后的任何位置。显然,位于基团f/f'和有效载荷之间的接头可存在许多替代的构型。一个优选的构型可由下式示意性地表示:其中e代表在上文分部(i)中提及的基团之一,b代表在该分部(ii)中提及的基团之一。具体的特别优选的构造如下所示:其中f'和f具有上文给出的含义和优选含义。这类结构的特别优选的实例如下:分部(iii).将治疗剂、诊断剂或标记剂与本发明的缀合物中的蛋白质或肽连接,或者与本发明的缀合试剂中的官能团连接的接头,可含有除环状peg基团之外的另外的peg。例如,其可在接头的骨架中含有peg,因此示意性地表示为:在这些式中,p和q代表在缀合物或试剂的接头中的各种peg链中存在的乙二醇单元的数目,除了在环内存在的n个乙二醇单元。为了清楚起见,peg单元显示为直链单元,但应理解任何单元均可包括支链。类似地,在此处和其他地方,为了清楚起见,基团表示从环至接头的其余部分仅具有单个连接点,但应理解,除非上下文另有要求,如上所述的多个连接点同样是可行的。分部(iv).将治疗剂、诊断剂或标记剂与本发明的缀合物中的蛋白质或肽连接,或者与本发明的缀合试剂中的官能团连接的接头,可含有两个或更多个环状peg基团。其可用两个环状peg基团示意性地表示,因此:并且显然可以类似地存在多于两个环状peg基团。如在上文的分部(iii)中所描述的,除了环状peg基团外,接头可含有或可不含有另外的peg。使用任何合适的方法,可向接头中并入多个环状peg基团。例如可通过与存在于上述任何接头部分中的任何反应性基团反应来引入环状peg基团。可使用上述式的支化基团。例如,在一个具体的实施方案中,可通过使用以下结构引入两个环状peg基团:或者,可通过使用多元醇官能团引入分支,例如:~chs[(ch2)to]3-s~其中s为0、1或2,且t为1至4。例如,在一个具体的实施方案中,可通过使用以下结构并入三个环状peg基团:在缀合物的一些优选的实施方案中,缀合物包含以下部分:其中w'代表吸电子基团或通过还原吸电子基团而得到的基团,pr代表经由亲核基团nu键合的蛋白质或肽,并且其包含与式iiia的基团紧邻的任选取代的芳基或杂芳基;所述接头还包含与所述芳基或杂芳基相邻的-nra.c(o)-或-c(o).nra-基团,其中ra代表c1-4烷基或氢;蛋白质或肽为抗体(例如抗cd30抗体,如brentuximab);接头包含基团并且治疗剂、诊断剂或标记剂为细胞毒性试剂(例如,奥瑞斯他汀、美登木素和多卡米星)。在缀合物的一些优选的实施方案中,缀合物包含以下部分:其中w'代表吸电子基团或通过还原吸电子基团而得到的基团,pr代表经由亲核基团nu键合的蛋白质或肽,并且其包含与式iiia的基团紧邻的任选取代的芳基或杂芳基;所述接头还包含与所述芳基或杂芳基相邻的-nra.c(o)-或-c(o).nra-基团,其中ra代表c1-4烷基或氢;蛋白质或肽为抗体(例如抗cd30抗体,如brentuximab);接头包含基团其中环包含2至20个-ch2ch2-o-单元(例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20)。接头包含可降解的基团,其为接头包含支化基团以将环状peg基团并入接头中,所述支化基团为天冬氨酸、谷氨酸,赖氨酸或丝氨酸残基;并且治疗剂、诊断剂或标记剂为单甲基奥瑞斯他汀e(mmae)。在缀合物的一些优选的实施方案中,缀合物包含以下部分:其中w'代表吸电子基团或通过还原吸电子基团而得到的基团,pr代表经由亲核基团nu键合的蛋白质或肽,并且其包含与式iiia的基团紧邻的任选取代的芳基或杂芳基;接头还包含与所述芳基或杂芳基相邻的-nra.c(o)-或-c(o).nra-基团,其中ra代表c1-4烷基或氢;蛋白质或肽为抗体(例如抗cd30抗体,如brentuximab);接头包含基团接头包含可降解的基团,其为接头包含支化基团以将环状peg基团并入接头中,所述支化基团为谷氨酸残基;并且治疗剂、诊断剂或标记剂为单甲基奥瑞斯他汀e(mmae)。在一些优选实施方案中,缀合物具有下式:其中d为细胞毒性试剂(例如奥瑞斯他汀、美登木素和多卡米星)代表包含至少两个乙二醇(~(ch2-ch2-o-)~)单元的环;f’为式的基团;并且pr代表经由亲核基团nu键合的蛋白质或肽,其为抗体(例如抗cd30抗体,如brentuximab)。在一些优选的实施方案中,缀合物具有下式:其中d为单甲基奥瑞斯他汀e;代表基团其中环包含2至20个-ch2ch2-o-单元(例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20);f’为式的基团;并且pr代表经由亲核基团nu键合的蛋白质或肽,其为抗体(例如抗cd30抗体,如brentuximab)。在一些优选的实施方案中,缀合物具有下式:其中d为单甲基奥瑞斯他汀e;代表f’为式的基团;并且pr代表经由亲核基团nu键合的蛋白质或肽,其为抗体(例如抗cd30抗体,如brentuximab)。药物组合物和实用性本发明的其中有效负载是治疗剂的缀合物根据有效负载的性质可用于治疗各种医学病症。通常,有效负载是细胞毒性试剂,并且本发明可用于治疗癌症。因此,本发明还提供本发明的缀合物,特别是其中有效负载是治疗剂的缀合物,且尤其是作为抗体-药物缀合物的缀合物,其包含药学上可接受的载体以及任选地另外的活性成分。本发明还提供所述缀合物在治疗中的用途,并且可用于一种治疗患者的方法中,所述方法包括给予患者本发明的缀合物或药物组合物。本发明还提供本发明的缀合物在制备用于治疗例如癌症的药物中的用途。附图说明图1示出了实施例8的结果。图2示出了小鼠异种移植研究的结果,示出了(a)在肿瘤植入后第12天,以1mg/kg给予载体或(brentuximabvedotin)(比较物)之后,cb17-scid小鼠中的平均肿瘤体积±标准误差随时间变化的曲线;以及(b)在肿瘤植入后第12天,以1mg/kg给予载体或(brentuximabvedotin)(比较物)之后,cb17-scid小鼠中的个体肿瘤体积随时间变化的曲线。图3示出了小鼠异种移植研究的结果,示出了(a)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物32(比较物)之后,cb17-scid小鼠中的平均肿瘤体积±标准误差随时间变化的曲线;以及(b)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物32(比较物)之后,cb17-scid小鼠中的个体肿瘤体积随时间变化的曲线。图4示出了小鼠异种移植研究的结果,示出了(a)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物14之后,cb17-scid小鼠中的平均肿瘤体积±标准误差随时间变化的曲线;以及(b)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物14之后,cb17-scid小鼠中的个体肿瘤体积随时间变化的曲线。图5示出了小鼠异种移植研究的结果,示出了(a)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物31之后,cb17-scid小鼠中的平均肿瘤体积±标准误差随时间变化的曲线;以及(b)在肿瘤植入后第12天,以0.8mg/kg给予载体或缀合物31之后,cb17-scid小鼠中的个体肿瘤体积随时间变化的曲线。以下实施例阐述了本发明实施例1:合成含有奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂1步骤1:合成化合物2在室温下,向搅拌的二乙醇胺(2.5g)和三乙胺(6.05g)的二氯甲烷(15ml)溶液中缓慢加入甲苯磺酰氯(3.8g)的二氯甲烷(15ml)溶液。2h后,将水(25ml)加入反应混合物中,并且用二氯甲烷(5×30ml)萃取产物。将合并的有机萃取物用硫酸镁干燥,然后过滤溶液,真空除去挥发物,得到白色固体的化合物2(4.7g)。1hnmr(400mhz,cdcl3)δh7.68(d,j=8.3hz,2h),7.30(d,j=8.3hz,2h),3.84(t,j=5.0hz,4h),3.56(s,2h),3.24(t,j=5.0hz,4h),2.41(s,3h).m/z[m+na]+(282,95%),[m+h]+(260,100%)。步骤2:合成化合物3在室温下,在1h内,将化合物2(176mg)的无水thf(2ml)溶液逐滴加入氢化钠(80mg,60%矿物油分散体)的无水thf(8ml)溶液中。在搅拌1h后,在2h内加入六乙二醇二对甲苯磺酸酯(400mg)的无水thf(2ml)溶液,并且在室温下将反应混合物搅拌72h。加入水(30ml)并且在真空下除去thf。将水溶液用氯仿(4×25ml)萃取,将有机相合并,并用硫酸镁干燥,然后过滤溶液并在真空下浓缩。随后通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。真空除去有机溶剂并通过冷冻干燥除去水性溶剂,得到无色油状的化合物3(78mg)。1hnmr(400mhz,cdcl3)δh7.68(d,j=8.3hz,2h),7.26(d,j=8.3hz,4h),3.67–3.58(m,24h),3.58–3.53(m,4h),3.38(t,j=6.0hz,4h),2.40(s,3h).m/z[m+na]+(528,80%),[m+h]+(506,50%)。步骤3:合成化合物4向化合物3(78mg)的无水thf(6ml)溶液中加入氢化铝锂(1.13ml,1mthf溶液),在回流下将溶液加热16h,然后将反应混合物冷却至0℃,并逐滴加入水以淬灭反应。过滤悬浮液,将沉淀物用氯仿:乙醇(9:1v/v,5x6ml)洗涤。将滤液和洗出液合并,在真空下浓缩得到无色油状的化合物4(50mg)。m/z[m+na]+(374,70%),[m+h]+(352,100%)。步骤4:合成化合物5向fmoc-glu-(oh)-oall(48mg)的dmf(1.0ml)溶液中加入hatu(110mg),并且在0℃下将溶液搅拌30min。向其中加入val-cit-pab-mmae.tfa盐(levenabiopharma,120mg)和nmm(32μl)的dmf(1ml)溶液。在0℃下将反应混合物搅拌2.5h。将溶剂在真空下浓缩,并且将粗品溶于dmf(1.5ml)中,之后加入nmm(32μl)。将四(三苯基膦)钯(0)(45mg)加入反应混合物中,然后在室温下搅拌20h。将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。在真空下除去有机溶剂,并通过冷冻干燥除去水性溶剂,得到白色固体的化合物5(98.0mg)。m/z[m+h]+(1475da,100%),[m+2h]2+(738,50%)。步骤5:合成化合物6在0℃下,向化合物5(15mg)的dmf(0.5ml)溶液中加入hatu(4.3mg)。在0℃下将溶液搅拌20min,然后加入nmm(1.3μl),将溶液再搅拌10min。向单独的化合物4(5mg)的dmf(0.3ml)溶液中加入nmm(1.3μl),并在室温下将溶液搅拌30min。然后将两种溶液合并,并向合并的溶液中加入另外量的hatu(4.3mg)和nmm(1.3μl),并在室温下搅拌16h。将反应溶液在真空下浓缩得到粗品fmoc-l-glu-[val-cit-pab-mmae]-氮杂-24-冠-8(18mg)。m/z[m+na]+(1831,20%),[m+h]+(1809,20%),[m+2h]2+(905,100%)。向fmoc-l-glu-[val-cit-pab-mmae]-氮杂-24-冠-8(18mg)的dmf(0.4ml)溶液中加入哌啶(5μl),并且在室温下将溶液搅拌20min。加入另外的哌啶(5μl),并在室温下将溶液再搅拌25min。将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。在真空下除去有机溶剂,并且通过冷冻干燥除去水性溶剂,得到无色油状的化合物6(8.5mg)。m/z[m+na]+(1609,10%),[m+h]+(1587,20%),[m+2h]2+(794,100%)。步骤6:合成化合物7向搅拌的4-[2,2-二[(对甲苯磺酰基)甲基]乙酰基]苯甲酸(1.5g,natureprotocols,2006,1(54),2241-2252)的dmf(70ml)溶液中加入α-甲氧基-ω-巯基七(乙二醇)(3.2g)和三乙胺(2.5ml)。在室温下,在惰性氮气气氛下搅拌所得的反应混合物。19h后,在真空下除去挥发物。将所得的残留物溶于水(2.4ml),并且通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。在真空下除去有机溶剂并且通过冷冻干燥除去水性溶剂,得到粘稠澄清的无色油状化合物7(1.77g)。m/z[m+h]+901。步骤7:合成试剂8在室温下,向搅拌的7(1.32g)的甲醇:水(18ml,9:1v/v)溶液中加入(2.7g)。2.5h后,在真空下除去挥发物,并将水与乙腈(2x15ml)共沸除去。将所得的残留物溶于二氯甲烷(3x10ml),通过硫酸镁柱过滤并用二氯甲烷(2x7ml)洗涤。将洗脱液和洗出液合并,并且在真空下除去挥发物,得到粘稠澄清的浅黄色油状物(1.3g)。将一部分残留物(700mg)溶解于水:乙腈(1.5ml,3:1v/v)中,并且通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到粘稠澄清的无色油状试剂8(524mg)。m/z[m+h]+965。步骤8:合成试剂1在0℃下,向试剂8(6mg)的dmf(0.3ml)溶液中加入hatu(2.3mg)。在0℃下将溶液搅拌20min,然后加入nmm(0.6μl),并将溶液再搅拌10min。向单独的化合物6(8.5mg)的dmf(0.3ml)溶液中加入nmm(0.6μl),并在室温下将溶液搅拌30min。然后将两种溶液合并,并且加入另外量的hatu(2.3mg)和nmm(0.6μl),在室温下将溶液搅拌1h。然后加入另外的量的hatu(1.2mg)和nmm(0.3μl),在室温下将溶液搅拌1.5h。将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到无色油状试剂1(10.7mg)。m/z[m+na]+(2557,5%),[m+2h]2+(1268,40%),[m+3h]3+(845,45%)。实施例2:合成含有奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂9步骤1:合成化合物10向甲苯磺酰氯(307mg)的二氯甲烷(5ml)溶液中加入十二乙二醇(400mg)、三乙胺(255μl)和dmap(13mg)的二氯甲烷(5ml)溶液,并在室温下将合并的溶液搅拌16h。加入另外的dmap(13mg)和三乙胺(255μl),并将反应混合物在室温下再搅拌24h。将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到无色油状化合物10(287mg)。1hnmr(400mhz,cdcl3)δh7.78(d,j=8.5hz,4h),7.32(d,j=8.5hz,4h),4.13(t,j=4.9hz,4h),3.66(t,j=4.9hz,4h),3.62(br.s,24h),3.61-3.58(m,8h),3.56(s,8h),2.42(s,6h)。m/z[m+na]+(877,100%),[m+h]+(855,75%)。步骤2:合成化合物11在室温下,在1h内,将化合物2(85mg)的无水thf(2ml)溶液逐滴加入到氢化钠(40mg,60%矿物油分散体)的无水thf(8ml)溶液中。在搅拌1h后,在2h内,加入化合物10(280mg)的无水thf(20ml)溶液,并且在室温下将反应混合物搅拌96h。加入水(30ml)并在真空下除去thf。将水溶液用氯仿(4×25ml)萃取,然后用氯仿:异丙醇(9:1v/v,2×25ml)萃取。将有机相合并,并用硫酸镁干燥,然后过滤溶液,并在真空下浓缩。随后通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。真空下除去有机溶剂,并通过冷冻干燥除去水性溶剂,得到无色油状化合物11(58mg)。1hnmr(400mhz,cdcl3)δh7.68(d,j=8.4hz,2h),7.27(d,j=8.4hz,4h),3.66–3.52(m,52h),3.35(t,j=6.3hz,4h),2.40(s,3h).m/z[m+na]+(792,100%),[m+h]+(770,55%)。步骤3:合成化合物12向化合物11(54mg)的无水thf(3ml)溶液中加入氢化铝锂(513μl,1mthf溶液),在回流下将溶液加热4h,然后将反应混合物冷却至0℃并逐滴加入水以淬灭反应。过滤悬浮液,用氯仿:乙醇(9:1v/v,3x6ml)洗涤沉淀物。将滤液和洗出液合并,并在真空下浓缩得到白色固体化合物12(34mg)。m/z[m+na]+(639,10%),[m+h]+(617,100%)。步骤4:合成化合物13。在0℃下,向化合物5(25mg)的dmf(0.4ml)溶液中加入hatu(7mg)。在0℃下将溶液搅拌20min,然后加入nmm(2μl),并将溶液再搅拌10min。向单独的化合物12(17mg)的dmf(0.4ml)溶液中加入nmm(2μl),并在室温下将溶液搅拌30min。然后将两种溶液合并,并且向合并的溶液中加入另外量的hatu(7mg)和nmm(2μl),在室温下搅拌1h。加入另外的hatu(7mg)和nmm(2μl),并且将溶液搅拌0.5h,然后将反应溶液在真空下浓缩得到粗品fmoc-l-glu-[val-cit-pab-mmae]-氮杂-42-冠-14(35mg)。m/z[m+na]+(2095,25%),[m+h]+(2073,15%,[m+2h]2+(1037,100%)。向粗品fmoc-l-glu-[val-cit-pab-mmae]-氮杂-42-冠-14(35mg)的dmf(0.5ml)溶液中加入哌啶(5μl),并且在室温下将溶液搅拌30min。加入另外的哌啶(10μl),并在室温下将溶液再搅拌30min。将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到无色油状化合物13(22mg)。m/z[m+na]+(1873,10%),[m+h]+(1851,50%),[m+2h]2+(926,100%)。步骤5:合成试剂9在0℃下,向试剂8(11.5mg)的dmf(0.3ml)溶液中加入hatu(3.3mg)。在0℃下将溶液搅拌20min,然后加入nmm(0.9μl),将溶液再搅拌10min。向单独的化合物13(15mg)的dmf(0.3ml)溶液中加入nmm(0.9μl),并在室温下将溶液搅拌30min。然后将两种溶液合并,并且加入另外量的hatu(3.3mg)和nmm(0.9μl),在室温下将溶液搅拌1h。加入另外量的hatu(3.3mg)和nmm(0.9μl),在室温下将溶液搅拌1h。另外加入hatu(3.3mg)和nmm(0.92μl),并且在室温下将溶液搅拌2h,随后将反应溶液在真空下浓缩,并通过反相c18柱色谱法,用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱来纯化残留物。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到无色油状的试剂9(11mg)。m/z[m+na]+(2822,10%),[m+h]+(2800,20%),[m+2h]2+(1400,80%),[m+3h]3+(933,100%)。实施例3:试剂1和17(比较)与brentuximab和抗psma抗体的缀合以分别得到抗体药物缀合物(adc)14和18(比较)以及21和22(比较),其中dar为4。使用类似于wo2014064423和wo2014064424中记载的那些方法,将缀合试剂1和17与brentuximab或抗psma抗体缀合,分别得到adc14、18、21和22。简言之,将于ph7.5的20mm磷酸钠(含有150mmnacl和20mmedta)中的5.2mg/ml浓度的抗体(brentuximab或抗psma抗体)在加热块中加热至40℃,保持15min。将tcep(6当量/mab)加入mab溶液中,轻轻混合并在40℃下温育1h,然后使其冷却到22℃。将缀合试剂溶于mecn或dmf中得到3mm溶液。将还原的mab溶液用ph7.5的20mm磷酸钠(含有150mmnacl和20mmedta)稀释至4.2mg/ml。将缀合试剂(5.6当量/mab)加入mab溶液中,将反应液轻轻混合并在22℃下温育22h。此后,在22℃下用50mmn-乙酰基-l-半胱氨酸(相对于试剂为20当量)处理反应1h。通过疏水作用色谱法(hic)对粗品缀合混合物进行分析。将粗品反应物与等体积的ph7的50mm磷酸钠(4mnacl)混合,并将所得溶液加载到用ph7的50mm磷酸钠(2mnacl)平衡的toyopearl苯基-650shic柱上。采用ph7的50mm磷酸钠(20%异丙醇)的梯度从柱中洗脱adc。将含有dar4adc的馏分合并并浓缩(vivaspin20,10kdapes膜)。将浓缩的样品缓冲交换到ph7.1-7.5的pbs中并进行无菌过滤(0.22μmpvdf膜)。基于a248/a280吸收比确定dar。缀合物的平均dar由在280nm处hic分析后的各dar样品的相对峰面积计算。实施例4:合成含有奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂15(比较)如wo2015057699所记载的,合成含有马来酰亚胺官能团的缀合试剂15。实施例5:合成含有奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂17(比较)步骤1:合成化合物19在氩气气氛下,将fmoc-l-glu-(otbu)-oh(36mg)的dmf(2ml)溶液冷却到0℃,并加入(苯并三唑-1-基氧基)三-(二甲基氨基)膦六氟磷酸盐(bop)(41mg),然后加入nh2-peg(24u)-ome(100mg)和dipea(19μl)。使溶液温热至室温,22h后在真空下除去挥发物。将所得的残留物溶于二氯甲烷(1ml)中,并且通过正相柱色谱法使用二氯甲烷:甲醇(100:0v/v至80:20v/v)洗脱纯化。在真空下除去有机溶剂得到无色油状的fmoc-l-glu-[otbu]-[peg(24u)-ome](84mg)。在氩气气氛下,将哌啶(49μl)加入化合物fmoc-l-glu-[otbu]-[peg(24u)-ome](74mg)的dmf(2ml)溶液中,在室温下将所得的溶液搅拌22h,之后在真空下除去挥发物。将所得的残留物用己烷(3×0.7ml)研磨。每次研磨后将有机溶剂倾析出,并将所得的残留物在真空下干燥,得到白色固体化合物19(61mg)。m/z[m+h]+(1274,70%),[m+2h]2+(638,100%)。步骤2:合成试剂20向在氩气气氛下冷却到0℃的试剂8(26.6mg)的dmf(550μl)溶液中加入hatu(10.5mg),并且在0℃下将溶液搅拌0.5h。向其中加入化合物19(32mg)的dmf(550μl)溶液。在0℃下将所得的溶液搅拌5min,然后加入nmm(2.9μl)和hatu(10.5mg)。将反应溶液在0℃下搅拌2h,然后将其温热至室温,并再搅拌3.5h。之后在真空下除去挥发物。将所得的残留物溶于水:乙腈(1.2ml,1:1v/v)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.1%甲酸和缓冲液b(v/v):乙腈:0.1%甲酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到无色油状的二-mpeg(7u)砜-丙酰基-苯甲酰胺-l-glu-[otbu]-[peg(24u)-ome](30.5mg)。1hnmr(400mhz,meoh-)8.19(2h,d),8.04(2h,d),4.83–4.71(1h,m),4.58(1h,dd),3.92–3.83(6h,m),3.78–3.56(140h,m),3.57-3.51(6h,m),3.40(4h,dd),3.36(3h,s),3.35(6h,s),2.41(2h,t),2.24–2.13(1h,m),2.10–1.98(1h,m),1.45(9h,s)。m/z[m+na]+(2243,50%),[m+h]+(2221,40%),[m+na+2h]3+(747,100%)。在氩气气氛下将二-mpeg(7u)砜-丙酰基-苯甲酰胺-l-glu-[otbu]-[peg(24u)-ome](30mg)的二氯甲烷(2ml)溶液冷却至0℃,向其中加入三氟乙酸(500μl),并且将所得的溶液搅拌1.5h。将反应混合物温热至室温,并且再搅拌1h。此后在真空下除去挥发物。将所得的残留物溶于水:乙腈(0.6ml,1:1v/v)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到无色油状试剂20(20mg)。1hnmr(400mhz,meoh-)8.19(2h,d),8.04(2h,d),4.81–4.72(1h,m),4.59(1h,dd),3.92–3.84(6h,m),3.67–3.50(146h,m),3.40(4h,dd),3.36(3h,s),3.35(6h,s),2.48(2h,t),2.26–2.15(1h,m),2.15–2.03(1h,m)。m/z[m+2h]2+(1083,60%),[m+2h+na]3+(729,100%)。步骤3:合成缀合试剂17在氩气气氛下,将化合物20(12.4mg)的dmf(500μl)溶液冷却到0℃。加入hatu(2.4mg)并在0℃下将溶液搅拌0.5h。向其中加入val-cit-pab-mmaetfa盐(7.8mg)和nmm(0.7μl)的dmf(500μl)溶液,将其在室温下搅拌0.5h。5min后,加入另外量的hatu(1.2mg)和nmm(0.4μl),并在室温下搅拌反应混合物。2h后,加入另外量的hatu(1.2mg)和nmm(0.4μl),并在室温下搅拌反应混合物。另外1h后,将反应溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到无色油状试剂17。m/z[m+h]+(3270,12%),[m+2h]2+(1636,50%),[m+3h]3+(1091,100%)。实施例6:试剂15(比较)与brentuximab缀合得到dar为8的抗体药物缀合物16(比较)。使用wo2015057699、us7090843、lyon等人,(2015)naturebiotechnology,33(7)第733-736页和lyon等人,(2012),methodsinenzymology,第502卷,第123-137页中记载的方法,将缀合试剂15与brentuximab缀合,得到adc16。简言之,在40℃下,用tcep(6当量)将于ph6.5的20mm磷酸钠缓冲液(150mmnacl,20mmedta)中的brentuximab还原,持续1h。然后将还原的抗体与每游离巯基2.0摩尔当量的试剂15缀合。将试剂15加入mab中以得到4mg/ml的最终抗体浓度。将溶液轻轻混合,并在22℃下温育2h。2h后,加入另外的试剂15(0.2摩尔当量),并将混合物在22℃下再温育1h。过量的试剂15用n-乙酰基-l-半胱氨酸(相对于试剂20当量)淬灭,并通过用ph7的50mm磷酸钠(2mnacl)平衡的1mltoyopearl苯基-650shic柱纯化粗反应物。用ph7的50mm磷酸钠(20%异丙醇)的梯度从柱中洗脱adc。将含有adc的馏分合并并浓缩(vivaspin20,10kdapes膜)以得到平均dar为8的产物。将浓缩的样品缓冲交换到dpbs(ph7.1-7.5)中并进行无菌过滤。由于反应产物(dar变体的数目)的异质性,adc16难以纯化和表征,导致制备型hic对单个dar样品的分辨率差。结果显示,最终反应产物含有显著量的大于和小于dar8的dar样品。从这些大于和小于dar8样品中完全纯化dar8样品将导致最终产物中dar8的产率显著降低。实施例7:通过热应力测试比较抗体药物缀合物14和16(比较)通过用ph7.1-7.5的dpbs稀释来分别制备0.5mg/ml的adc样品14和16。将两个adc样品在65℃下温育30min,之后在冰浴中温育5min,然后进行尺寸排阻色谱法(sec)。使用tosohbiosciencetskgelsupersw3000柱进行sec。在用ph6.8的0.2m磷酸钾缓冲液(0.2m氯化钾和15%异丙醇)等度洗脱过程中,监测在280nm处的uv吸收。下表1a和1b示出了热应力测试之前和之后,adc14和16的构型,如在sec之后通过abs280nm处的各峰的曲线下的面积来测量。表1a和1b中的结果显示,在热应力测试之后adc14比adc16更大程度地保持非聚集状态。此外,结果还显示16比缀合物14更大程度地解离成更轻分子量的组分。表1a热应力测试前的adc构型(%总adc)1416非聚集的98.197.4聚集的1.91.8解离的00.7表1b热应力测试后的adc构型(%总adc)1416非聚集的62.011.1聚集的37.471解离的0.617.9实施例8:在人血清中温育后,adc14和16(比较)的平均dar的比较将adc14和16在人血清(88%(v/v)血清含量)中稀释至0.1mg/ml。立即将每种溶液再等分至4x0.5ml低结合eppendorf管内。将对应于‘0’时间点的两个eppendorf管立即转移至-80℃冷柜中,而将剩余样品在37℃下温育6天。6天后,从冷柜和/或培养箱中取出样品,通过亲和捕获(cd30-涂覆的磁珠)纯化缀合物,并使用疏水作用色谱法(hic)进行分析。用于平均dar测定的cd30亲和捕获和hic如下所述进行:用于平均dar测定的cd30亲和捕获。使用抗生蛋白链菌素涂覆的磁珠(dynabeads-抗生蛋白链菌素t1,lifetechnologies)进行亲和捕获。将cd30(重组人cd30,sinobiologicalinc.)生物素化并通过抗生蛋白链菌素-生物素结合将其固定在珠粒上,最后使用脱脂乳肽封闭。将500μl于pbs中的血浆样品加到cd30涂覆的珠粒上,并在4℃下温育过夜,最终使用pbs洗涤。在4℃下使用酸性洗脱缓冲液将捕获的抗体洗脱5分钟。随后使用ph8的乙酸钠缓冲液将洗脱液中和至ph7。将洗脱的样品再次与hic上样缓冲液混合,并使用疏水作用色谱法采用uv检测(hic-uv)进行分析。用于平均dar测定的疏水作用色谱法。使用疏水作用色谱法分析亲和捕获的adc,以测定药物与抗体的平均比率(dar)。该方法包括使用tosohtsk凝胶丁基-nprhic分离柱在280nm处检测,并且使用在30min内从100%缓冲液a(ph7.0的50mm磷酸钠,1.5m硫酸铵)至100%缓冲液b(ph7.0的50mm磷酸钠,20%异丙醇)的线性梯度。图1示出了在37℃下在人血清中6天后,缀合物16失去了其大部分细胞毒性有效载荷,而缀合物14基本保持不变,如样品的平均dar值降低所示。这表明,本发明的缀合物具有改进的稳定性。实施例9:通过体外细胞存活率试验分析dar4adc14和18(比较)以及21和22(比较)。可通过在药物浓度逐渐增加的情况下培养细胞系并使用cell-titer发光试剂(promega)对增殖或代谢活性的丧失进行量化,从而测量采用细胞毒性药物进行体外治疗后肿瘤细胞存活率的损失。psma和cd30过表达细胞系的方案描述了基于atp合成的细胞接种、药物治疗以及相对于未处理细胞的细胞存活率的测定,所述atp合成与孔中存在的细胞数目直接相关。表2中列出的细胞系按照供应商的建议保存。表2将粘附的psma-阳性lncap和c4-2细胞利用tryple分离,并再悬浮于完全培养基中。使用一次性纽鲍尔(neubauer)计数池对细胞进行计数,并且对lncap和c4-2而言,分别将细胞密度调节至10x104细胞/ml和2x104细胞/ml。将细胞接种(100μl/孔)至聚-d-赖氨酸涂覆的不透明壁的96孔白板中,并在37℃和5%co2下培育24小时。在完全生长培养基中,对人t细胞淋巴瘤karpas299细胞进行计数,并将细胞密度调节为5x104细胞/ml。将细胞接种(50μl/孔)至不透明壁的96孔板中,并在37℃和5%co2下培育24小时。在相关培养基中制备各化合物的八点连续稀释液。用表3中指定的化合物和浓度范围处理细胞。表3细胞系药物-缀合物浓度范围karpas299141nm–0.06pmkarpas29918(比较)0.5nm–0.2pmlncap和c4-22110nm–5pmlncap和c4-222(比较)10nm–5pmlncap和c4-2mmae(游离药物)10nm–5pm将培养基从含有粘附的lncap和c4-2细胞的板中除去,并用100μl/孔的1x连续稀释的化合物代替。将karpas-299细胞通过加入50μl/孔的2x连续稀释的化合物进行处理。然后将细胞在37℃和5%co2下培育另外96小时。使用cell-titer发光试剂进行细胞存活率试验,如制造商的说明书所描述的(promegacorp.technicalbulletintb288;lewisphillipsg.d,cancerres2008;68:9280-9290)。使用moleculardevicesspectramaxi3x读板仪记录发光,随后使用graphpadprism四参数非线性回归模型分析数据。存活率表示为未处理细胞的%并使用以下公式计算:将%存活率相对于药物浓度的对数(以nm为单位)来制图,以推断ic50值。表示药物缀合物的抗增殖作用的ic50值总结于表4中。其表明本发明的缀合物具有改进的功效。表4细胞系药物-缀合物ic50(nm)karpas299140.04karpas29918(比较)0.06lncap210.61lncap22(比较)0.76lncapmmae(游离药物)2.14c4-2210.19c4-222(比较)0.27c4-2mmae(游离药物)0.71实施例10:合成包含奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂23(比较)步骤1:合成试剂24在氮气气氛下,将4-[2,2-二[(对甲苯磺酰基)-甲基]乙酰基]苯甲酸(1.0g)的溶液加入到n-羟基苯并三唑水合物(306mg)的无水thf(10ml)中。将所得溶液冷却至0℃,并且逐滴加入二异丙基碳二亚胺(310μl)。在0℃下将反应混合物搅拌20min,然后温热至室温。1h后,将另外的无水thf(10ml)加入反应混合物中。18h后,将形成的沉淀物过滤,并用冷的thf(2×5ml)洗涤,之后进行真空干燥。在室温下,将固体与meoh(10ml)搅拌1h,通过过滤收集,并用meoh(2×5ml)和et2o(5ml)相继洗涤。然后在真空下干燥固体,得到白色固体化合物24(1.1g)。m/z[m+h]+(618,100%)。步骤2:合成试剂25在氮气气氛下,向搅拌的l-谷氨酸5-叔丁基酯(198mg)的无水dmf(20ml)悬浮液中加入nmm(107μl)。将反应混合物冷却至0℃,然后加入试剂24(603mg)。在0℃下将所得的悬浮液搅拌1h,之后将反应混合物温热至室温。19h后,将所得的溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.1%甲酸和缓冲液b(v/v):乙腈:0.1%甲酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到白色固体试剂25(198mg)。1hnmr(400mhz,cdcl3)δ7.98(1h,d),7.86(2h),7.71–7.65(6h,m),7.36(4h,d),4.68(1h,ddd),4.34(1h,q),3.62(2h,ddd),3.50(2h,ddd),2.69(1hddd),2.55–2.45(1h,m),2.48(6h,s),2.34-2.16(2h,m),1.46(9h,s);m/z[2m+h]+(1371,74%),[2m+h-tbu]+(1315,70%),[m+h-tbu]+(630,100%)。步骤3:合成试剂26将试剂25(50mg)和bop(40mg)溶于无水dmf(3ml)中,冷却到0℃,并且将其加入nh2-peg(24u)-ome(99mg)和nmm(10μl)的无水dmf(2ml)溶液中。在0℃下搅拌反应混合物,并在4h后,将另外量的bop(10mg)和nmm(2.5μl)加入反应混合物中,再搅拌15min,之后在-20℃下储存18h。然后将反应混合物在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.1%甲酸和缓冲液b(v/v):乙腈:0.1%甲酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到无色油状的二甲苯磺酰基-丙酰基-苯甲酰胺-l-glu-[otbu]-[peg(24u)-ome](128mg)。m/z[m+h]+(1757,100%),[m+2h]2+(879,100%)。在室温下,在氮气气氛下,将二甲苯磺酰基-丙酰基-苯甲酰胺-l-glu-[otbu]-[peg(24u)-ome](126.5mg)溶于甲酸(2.5ml)中并搅拌。20h后,将反应混合物在真空下浓缩并在高真空下干燥18h,得到无色油状试剂26(122mg,视为定量产率)。m/z[m+na]+(1723,15%),[m+h]+(1700,100%)。步骤4:合成试剂23在氩气气氛下,将试剂26(13mg)、hatu(4.1mg)和val-cit-pab-mmae.tfa盐(9mg)的无水dmf(1ml)溶液冷却到0℃。向其中加入nmm(2μl)。1h后,加入另外量的hatu(4.1mg)和nmm(2μl),并且在另外的1.5h后,将溶液在-20℃下储存72h。将反应溶液在真空下浓缩,溶于乙腈(1ml),并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到粘稠澄清的无色油状试剂23(11.4mg)。m/z[m+h]+(2805,20%),[m+2h]2+(1403,75%),[m+3h]3+(936,100%)。实施例11:合成包含奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂27(比较)步骤1:合成化合物28向nh2-peg(7u)-ome(300mg)的乙醇(2.5ml)溶液中加入丙烯酸叔丁酯(194μl),并在室温下将反应混合物搅拌72h。将溶液在真空下浓缩,并且通过正相色谱法使用二氯甲烷:甲醇(100:0v/v至70:30v/v)洗脱纯化。在真空下除去溶剂得到浅黄色油状化合物28(324mg)。m/z[m+h]+(468,100%)。步骤2:合成试剂29在0℃下,向4-[2,2-二[(对甲苯磺酰基)甲基]乙酰基]苯甲酸(257mg)的无水dmf(2.5ml)溶液中加入hatu(204mg),并且在0℃下将反应混合物搅拌10min。加入nmm(57μl),并且在0℃下将反应溶液再搅拌20min。加入另外的hatu(102mg)和nmm(29μl),将溶液温热至室温,并搅拌30min。此后,加入化合物28(200mg)的无水dmf(2.5ml)溶液。将反应混合物搅拌5h。然后将溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到无色固体试剂29(173mg)。m/z[m+na]+(973,40%)[m+h]+(951,100%),[m+h-tbu]+(895,90%)。步骤3:合成试剂30在0℃下,向试剂29(160mg)的二氯甲烷(1.6ml)溶液中加入三氟乙酸(0.5ml),并在0℃下将溶液搅拌1h,然后在4℃下储存16h。随后将挥发物在真空下除去,将残留物溶于乙腈(1ml)中并用含水缓冲液(v/v):水:5%乙腈:0.05%三氟乙酸(5ml)稀释。之后,通过冷冻干燥除去溶剂,得到琥珀色油状试剂30(定量产率)。m/z[m+na]+(916,50%),[m+h]+(894,100%)。步骤4:合成试剂27在0℃下,向试剂30(15mg)的无水dmf(0.6ml)溶液中加入hatu(7.3mg),并在0℃下将反应混合物搅拌20min。加入nmm(2μl),并在0℃下将溶液再搅拌20min。然后加入另外的hatu(7.3mg)和nmm(2μl),将溶液温热至室温并搅拌30min。然后,向反应溶液中加入单独的已预先在室温下搅拌10min的val-cit-pab-mmae.tfa盐(21.8mg)和nmm(2μl)的无水dmf(0.6ml)溶液。在室温下搅拌3h后,将反应溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并且通过冷冻干燥除去水性溶剂,得到白色固体试剂27(23.7mg)。m/z[m+h]+(2000,10%),[m+2h]2+(1000,100%)。实施例12:试剂9和27(比较)分别与brentuximab缀合得到抗体药物缀合物(adc)31和32(比较),其中dar为4。使用类似于实施例3中描述的方法,将缀合试剂9和27(比较)分别与brentuximab缀合,得到adc31和32(比较)。简言之,将brentuximab(5.0mg/ml,于20mm磷酸钠、150mmnacl和20mmedta(ph7.5)中)在加热块中加热至40℃,持续15min。将tcep(6当量/mab)加入mab溶液中,轻轻混合并在40℃下温育1h,然后使其冷却到22℃。将缀合试剂9溶于乙腈中,并将缀合试剂27溶于dmf中,分别得到3mm和1.6mm原液。将还原的mab溶液用20mm磷酸钠、150mmnacl和20mmedta(ph7.5)稀释到约4.3mg/ml。将缀合试剂(5.6至6.0当量/mab)加入已还原的mab溶液中得到最终抗体浓度4mg/ml。将反应溶液轻轻混合,并在22℃下温育16至24h。此后,在22℃下将每一种反应溶液用50mmn-乙酰基-l-半胱氨酸(相对于试剂20当量)处理1h。通过疏水作用色谱法(hic)对每种粗品缀合混合物进行分析。将粗品反应物与等体积的50mm磷酸钠和4mnacl(ph7)混合,并将所得的溶液加载到用50mm磷酸钠和2mnacl(ph7)平衡的toyopearl苯基-650shic柱上。采用ph7的50mm磷酸钠(20%异丙醇)的梯度从柱中洗脱adc。将含有dar为4的adc馏分合并并浓缩(vivaspin20,10kdapes膜)。将浓缩的样品缓冲交换到ph7.1-7.5的pbs中并进行无菌过滤(0.22μmpvdf膜)。实施例13:合成包含多卡米星细胞毒性有效载荷的缀合试剂33步骤1:合成化合物34在0℃下,向fmoc-glu(otbu)-oh(78mg)的无水dmf(500μl)溶液中加入hatu(108mg)和nmm(34μl),并在0℃下将混合物搅拌10min。向其中加入化合物4(44mg)的无水dmf(500μl)溶液,并在氩气氛围下,在0℃下将混合物搅拌15min。然后将反应混合物在真空下浓缩,并将残留物溶于无水dmf(500μl)中。加入哌啶(70μl),并将溶液在室温下搅拌90min。将反应溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并且通过冷冻干燥除去水性溶剂,得到橙色油状化合物34(44mg)。m/z[m+h]+(537,45%)。步骤2:合成试剂35在0℃下,向4-[2,2-二[(对甲苯磺酰基)甲基]乙酰基]苯甲酸(257mg)的无水dmf(500μl)溶液中加入hatu(65mg)和nmm(20μl),并且在0℃下将混合物搅拌10min。向其中加入化合物34(44.3mg)的无水dmf(500μl)溶液,并在氩气气氛下在0℃下将混合物搅拌1h。然后将反应混合物在真空下浓缩,将残留物溶于dmf(1ml)中并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(60:40v/v至0:100v/v)洗脱纯化。通过冷冻干燥除去溶剂,得到白色固体二甲苯磺酰基-丙酰基-苯甲酰胺-l-glu-(otbu)-氮杂-24-冠-8(28.5mg)。m/z[m+na]+(1041,20%),[m+h]+(1019,5%)。向二甲苯磺酰基-丙酰基-苯甲酰胺-l-glu-(otbu)-氮杂-24-冠-8(26.5mg)的无水二氯甲烷(1ml)溶液中加入三氟乙酸(500μl),并在氩气气氛下在室温下将溶液搅拌1h。将挥发物在真空下除去,得到白色固体试剂35(视为定量产率)。m/z[m+na]+(985,35%),[m+h]+(963,30%)。步骤3:合成化合物36在0℃下,向boc-val-cit-pab-多卡米星(abzena,tcrs,17mg)的无水二氯甲烷(2ml)悬浮液中加入三氟乙酸(1ml),并在0℃下将所得溶液搅拌75min。然后在真空下除去挥发物,得到黄色固体化合物36(视为定量产率)。m/z[m+h]+(798,100%)。步骤3:合成试剂33在0℃下,向试剂35(13.4mg)的无水dmf(500μl)溶液中加入hatu(13.2mg)和nmm(4μl),并在0℃下将混合物搅拌10min。向其中加入化合物36(12.7mg)的无水dmf(500μl)溶液,并且在氩气气氛下在0℃下将混合物搅拌20min。加入另外量的hatu(7.9mg)和nmm(2.6μl),并将反应混合物再搅拌80min。然后将溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。通过冷冻干燥除去溶剂,得到黄色固体试剂33(5.1mg)。m/z[m+na]+(1766,60%),[m+h]+(1744,70%),[m+na+h]2+(884,90%),[m+2h]2+(872,100%)。实施例14:合成包含多卡米星细胞毒性有效载荷的缀合试剂37(比较)在0℃下,向试剂30(14.1mg)的无水dmf(500μl)溶液中加入hatu(24mg)和nmm(7.6μl),并在0℃下将混合物搅拌5min。向其中加入化合物36(14.4mg)的无水dmf(500μl)溶液,并且在氩气气氛下在0℃下将混合物搅拌40min。然后将溶液在真空下浓缩,将残留物溶于水:乙腈(3:7v/v,1ml)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。通过冷冻干燥除去溶剂,得到黄色固体试剂37(8.9mg)。m/z[m+na]+(1696,10%),[m+h]+(1675,50%),[m+na+h]2+(848,40%),[m+2h]2+(838,85%)。实施例15:试剂33和37(比较)分别与brentuximab的缀合以得到抗体药物缀合物(adc)38和39(比较),其中dar为4。使用类似于实施例3中描述的方法,将缀合试剂33和37(比较)分别与brentuximab缀合,得到adc38和39(比较)。简言之,将brentuximab(8.5mg/ml,于20mm磷酸钠、150mmnacl和20mmedta(ph7.5)中)在加热块中加热至40℃,持续15min。将tcep(6当量/mab)加入mab溶液中,轻轻混合并在40℃下温育1h,然后使其冷却到22℃。将缀合试剂溶于丙二醇中得到0.3mm溶液。然后将缀合试剂(5.6当量/mab)加入mab溶液中,并将反应液轻轻混合,并在22℃下温育42至78h,在此期间根据需要向反应液中加入另外的试剂(至多1.2当量/mab)。随后将粗品反应溶液与等体积的50mm磷酸钠和4mnacl(ph7)以及5倍粗品反应混合物体积的50mm磷酸钠和4mnacl(ph7)混合。将所得的溶液加载到经50mm磷酸钠和2mnacl(ph7)平衡的toyopearl苯基-650shic柱上。采用ph7的50mm磷酸钠(20%异丙醇)的梯度从柱中洗脱adc。将含有dar为4的adc馏分合并并浓缩(vivaspin20,10kdapes膜),然后缓冲交换到ph7.1-7.5的pbs中并进行无菌过滤(0.22μmpvdf膜)。使用superdex200pgsec柱通过用ph7.1-7.5的pbs(10%或20%异丙醇)等度洗脱来进一步纯化样品。将含有dar为4的adc的馏分合并并浓缩(vivaspin20,30kdapes膜),然后缓冲交换到ph7.1-7.5的pbs中并进行无菌过滤(0.22μmpvdf膜)。实施例16:合成包含奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂40步骤1:合成化合物41在0℃下,向fmoc-glu(otbu)-oh(469mg)的无水dmf(8ml)溶液中加入hatu(419mg),并在0℃下将混合物搅拌20min。然后加入nmm(121μl),并在0℃下将溶液再搅拌15min。向单独的2-氨基甲基-15-冠-5(250mg)的无水dmf(2ml)溶液中加入nmm(121μl),并在0℃下将溶液搅拌20min。然后将两种溶液合并,加入另外量的hatu(419mg)和nmm(121μl),并在室温下将混合物搅拌3h。然后将反应溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(95:5v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并通过冷冻干燥除去水性溶剂,得到白色固体fmoc-l-glu(otbu)-酰氨基甲基-15-冠-5(440mg)。m/z[m+na]+(679,25%),[m+h]+(657,30%),[m+h-tbu]+(601,100%)。向fmoc-l-glu(otbu)-酰氨基甲基-15-冠-5(440mg)的二氯甲烷(20ml)溶液中加入哌啶(463μl),并在室温下将溶液搅拌3.5h。加入另外的哌啶(198μl),并在室温下将混合物再搅拌1.5h。然后将反应混合物在真空下浓缩,并将残留物悬浮于乙腈(4ml)中。将乙腈混合物用己烷(50ml)萃取,随后在真空下减少乙腈层以得到油状残留物。然后通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(95:5v/v至0:100v/v)洗脱来纯化残留物。将有机溶剂在真空下除去并通过冷冻干燥除去水性溶剂,得到试剂41。m/z[m+na]+(457,10%),[m+h]+(435,100%),[m+h-tbu]+(379,30%)。步骤2:合成试剂42向化合物24(82mg)的无水dmf(2ml)溶液中加入化合物41(50mg)和nmm(12.7μl),并在氩气气氛下在室温下将混合物搅拌2h。然后在真空下浓缩反应溶液,将残留物溶于乙腈(500μl)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(70:30v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并通过冷冻干燥除去水性溶剂,得到白色固体试剂42(37.4mg)。m/z[m+na]+(939,80%),[m+h]+(917,100%),[m+h-tbu]+(861,50%)。步骤3:合成试剂43向试剂42(36mg)的无水二氯甲烷(2ml)溶液中加入三氟乙酸(1ml)。在室温下将溶液搅拌80min,然后在真空下浓缩反应混合物。随后将残留物溶于乙腈:水(1:2v/v,1.5ml)中,并通过冷冻干燥除去溶剂,得到白色固体试剂43(视为定量产率)。m/z[m+na]+(883,75%),[m+h]+(861,100%)。步骤4:合成试剂40在0℃下,向试剂43(5.6mg)的无水dmf(300μl)溶液中加入hatu(2.4mg),并在0℃下将混合物搅拌20min。加入nmm(1μl),并在0℃下将溶液再搅拌10min。在0℃下,向单独的val-cit-pab-mmae.tfa盐(6.6mg)的无水dmf(300μl)溶液中加入nmm(1μl),并在0℃下将溶液搅拌30min。然后将两种溶液合并,加入另外量的hatu(2.4mg)和nmm(1μl),并使混合物在搅拌下温热至室温,持续3.25h。随后将反应溶液在真空下浓缩,将残留物溶于乙腈:dmso(6:1v:v,350μl)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(70:30v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并通过冷冻干燥除去水性溶剂,得到白色固体试剂40(7mg)。m/z[m+na]+(1989,20%),[m+h]+(1967,30%),[m+2na]2+(1006,30%),[m+h+na]2+(995,90%),[m+2h]2+(984,100%)。实施例17:合成包含奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂44步骤1:合成化合物45在0℃下,向fmoc-glu(otbu)-oh(216mg)的无水dmf(8ml)溶液中加入hatu(193mg),并在0℃下将混合物搅拌20min。加入nmm(56μl),并在室温下将溶液再搅拌15min。向单独的化合物12(284mg)的无水dmf(2ml)溶液中加入nmm(56μl),并在0℃下将溶液搅拌20min。然后将两种溶液合并,加入另外量的hatu(192mg)和nmm(56μl),并在室温下将混合物搅拌3.5h。然后将反应溶液在真空下浓缩,然后将残留物溶于乙酸乙酯(50ml)中。随后将溶液用饱和碳酸氢钠溶液(2×10ml)洗涤,接着用饱和盐水溶液(10ml)洗涤。然后将有机相在真空下浓缩以得到粗品fmoc-l-glu(otbu)-氮杂-42-冠-14。m/z[m+na]+(1046,20%),[m+h]+(1023,100%)。向粗品fmoc-l-glu(otbu)-氮杂-42-冠-14的dmf(7ml)溶液中加入哌啶(320μl),并在室温下将溶液搅拌2h。然后将反应混合物在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(95:5v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并通过冷冻干燥除去水性溶剂。随后将固体残留物用己烷(3×10ml)研磨,通过过滤分离固体,然后在真空下干燥得到灰白色固体化合物45(201mg)。m/z[m+h]+(801,100%)。步骤2:合成试剂46向化合物45(86mg)的无水二氯甲烷(3ml)溶液中加入6-马来酰亚胺基己酸n-琥珀酰亚胺酯(47mg),并在室温下搅拌溶液。在17.5、22.5和24h后,将dipea(3×19μl)加入反应溶液中。然后在室温下将溶液再搅拌18h,随后将反应混合物在真空下浓缩,将残留物溶于乙腈:dmso(2:1v/v)中,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(90:10v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并通过冷冻干燥除去水性溶剂,得到白色固体试剂46(38mg)。m/z[m+na]+(1016,30%),[m+h]+(994,20%)。步骤3:合成试剂47向试剂46(32mg)的无水二氯甲烷(1.4ml)溶液中加入三氟乙酸(375μl),并在室温下将溶液搅拌2.5h。然后加入另外的三氟乙酸(375μl),并在室温下将溶液再搅拌2h,之后在真空下浓缩溶液,并在高度真空下干燥残留物,持续18h。然后将残留物溶于水(1ml)中,并通过冷冻干燥除去溶剂,得到无色固体试剂47(视为定量产率)。m/z[m+na]+(960,20%),[m+h]+(938,20%)。步骤4:合成试剂44在0℃下,向试剂47(33.3mg)的无水dmf(750μl)溶液中加入hatu(14.8mg),并在0℃下将混合物搅拌20min。加入nmm(4.3μl),并在0℃下将溶液再搅拌15min。在0℃下,向单独的val-cit-pab-mmae.tfa盐(45.7mg)的无水dmf(500μl)溶液中加入nmm(4.3μl),并在0℃下将溶液搅拌25min。然后将两种溶液合并,加入另外量的hatu(14.8mg)和nmm(4.3μl),并且使混合物在搅拌下温热至室温,持续3.5h。随后将溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:5%乙腈:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(100:0v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去并通过冷冻干燥除去水性溶剂,得到白色固体试剂44(48.3mg)。m/z[m+na]+(2066,20%),[m+h]+(2044,25%),[m+h+na]2+(1033,50%),[m+2h]2+(1022,100%)。实施例18:合成包含奥瑞斯他汀细胞毒性有效载荷(mmae)的缀合试剂48向搅拌的化合物13(21.8mg)的无水dmf(500μl)溶液中加入nmm(7.8μl)。然后在室温下在氩气气氛下,在20min内将该溶液逐滴加入搅拌的辛二酸二(n-羟基琥珀酰亚胺酯)(43.8mg)的无水dmf(1.5ml)溶液中。随后将反应混合物在室温下搅拌20h,之后将溶液在真空下浓缩,并通过反相c18柱色谱法用缓冲液a(v/v):水:0.05%三氟乙酸和缓冲液b(v/v):乙腈:0.05%三氟乙酸(90:10v/v至0:100v/v)洗脱纯化。将有机溶剂在真空下除去,并通过冷冻干燥除去水性溶剂,得到白色固体试剂48(15.2mg)。m/z[m+na]+(2126,10%),[m+h]+(2104,20%),[m+2na]2+(1074,50%),[m+na+h]2+(1063,50%)[m+2h]2+(1052,100%)。实施例19:试剂44与brentuximab缀合以得到抗体药物缀合物(adc)49,其中dar为4.6。使用类似于实施例6中描述的方法,将缀合试剂44与brentuximab缀合得到adc49。简言之,在40℃下,将于20mm磷酸钠缓冲液、150mmnacl和20mmedta(ph7.5)中的brentuximab用tcep(2当量/mab)还原1h。然后将还原的抗体与试剂44(6当量/mab)缀合。将试剂44溶于乙腈中得到4.8mm原液。将还原的mab溶液用20mm磷酸钠缓冲液、150mmnacl和20mmedta(ph7.5)稀释到4.2mg/ml。将试剂44和另外的乙腈加入mab溶液中以得到最终抗体浓度4mg/ml。将溶液轻轻混合,并在22℃下温育1h。将过量的试剂44用n-乙酰基-l-半胱氨酸(相对于试剂为20当量)淬灭,并且使用经ph6.7的10mm磷酸钠平衡的羟磷灰石柱对粗品反应混合物进行纯化。采用10mm磷酸钠和2mmnacl(ph6.7)的梯度从柱中洗脱adc。将含有adc的馏分合并并浓缩(vivaspin20,30kdapes膜),并将浓缩的样品缓冲交换到ph7.1-7.5的dpbs中并进行无菌过滤。使用如实施例3中所述的方法确定缀合物的平均dar为4.6。实施例20:试剂48与brentuximab缀合以得到抗体药物缀合物(adc)50将缀合试剂48与brentuximab缀合以得到adc50。简言之,将试剂48溶于dmf中得到5.3mm原液。向brentuximab溶液(4.4mg/ml,于20mm磷酸钠缓冲液、150mmnacl和20mmedta(ph7.5)中)中加入试剂48(10当量/mab)和另外的dmf以得到最终抗体浓度4mg/ml。将溶液轻轻混合,并在22℃下温育1h。使用经ph6.7的10mm磷酸钠平衡的羟磷灰石柱纯化粗品反应溶液。采用10mm磷酸钠和2mnacl(ph6.7)的梯度从柱中洗脱adc。将含有adc的馏分合并并浓缩(vivaspin20,30kdapes膜),并将浓缩的样品缓冲交换到ph7.1-7.5的dpbs中并进行无菌过滤。根据质谱由各dar样品的相对峰强度计算缀合物的平均dar为4.1。实施例21:试剂40与brentuximab缀合以得到抗体药物缀合物(adc)51,其中dar为4。使用类似于实施例3中描述的方法,将缀合试剂40与brentuximab缀合得到adc51。简言之,将brentuximab(5.2mg/ml,于20mm磷酸钠、150mmnacl和20mmedta(ph7.5)中)在加热块中加热至40℃,持续15min。将tcep(6当量/mab)加入mab溶液中,轻轻混合并在40℃下温育1h,然后使其冷却到22℃。将缀合试剂40溶于dmf中得到1.5mm溶液。将试剂40(5.6当量/mab)加入mab溶液中,并将反应液轻轻混合,并在22℃下温育16h。将粗品反应混合物与等体积的50mm磷酸钠和4mnacl(ph7)缓冲液混合,并且将所得的溶液加载到经50mm磷酸钠和2mnacl(ph7)平衡的toyopearl苯基-650shic柱上。采用ph7的50mm磷酸钠(20%异丙醇)的梯度从柱中洗脱adc。将含有dar为4的adc馏分合并并浓缩(vivaspin20,30kdapes膜),然后将浓缩的样品缓冲交换到ph7.1-7.5的pbs中,并进行无菌过滤(0.22μmpvdf膜)。实施例22:通过体外细胞存活率试验分析adc31如实施例12中所述,制备含有有效载荷mmae的brentuximab缀合物31。如实施例9中所述,使用karpas-299细胞进行细胞存活率试验。所用的浓度范围记载于表5中。所得的ic50值列于表6中。表5细胞系药物-缀合物浓度范围karpas299310.4nm–0.7pmkarpas299mmae(游离药物)2.5nm–1pm表6细胞系药物-缀合物ic50(nm)karpas299310.02karpas299mmae(游离药物)0.15所得的缀合物31的ic50值表明本发明的adc具有潜在的杀体外细胞特性。实施例23:通过体外细胞存活率试验分析adc38如实施例15中所述,制备含有多卡米星有效载荷的brentuximab缀合物38。如实施例9中所述,使用karpas-299细胞进行细胞存活率试验。所用的缀合物的浓度范围为50nm-0.6pm,所得的ic50值为0.14nm。所得的缀合物38的ic50值表明本发明的adc具有潜在的杀体外细胞特性。实施例24:通过体外细胞存活率试验分析adc49、50和51如实施例19、20和21中所述,分别制备含有有效载荷mmae的brentuximab缀合物49、50和51。如实施例9中所述,使用karpas-299细胞进行细胞存活率试验。对于每一种缀合物,所使用的浓度范围描述于表7中。对于每一种缀合物,所得的ic50值列于表8中。表7表8细胞系药物-缀合物ic50(nm)karpas299490.02karpas299500.04karpas299510.03karpas299mmae(游离药物)0.20所得的ic50值表明本发明的adc具有潜在的杀体外细胞特性。实施例25:比较brentuximab-药物缀合物14、31、32(比较)和(比较)的karpas-299小鼠异种移植研究。使用平均体重为18.1g的健康雌性cb17-scid小鼠(cbysmn.cb17-prkdcscid/j,charlesriverlaboratories)进行细胞接种(第0天)。在肿瘤细胞注射前24至72小时,对小鼠进行γ-照射(1.44gy,60co)。依据felasa指南,在饲养室中在受控的环境条件下使动物保持spf健康状态。通过向右侧肋腹皮下注入于200μlrpmi1640中的107karpas-299细胞(t-间变性大细胞淋巴瘤,alcl)来诱发肿瘤。每周两次采用卡尺测量肿瘤,并使用下式估计体积:在肿瘤植入12天后(第12天),使用vivo软件(211mm3平均肿瘤体积)将动物随机分组,每组八只小鼠,并开始治疗。载体组的动物接受单次静脉内(i.v.)注射pbs。治疗组采用单次静脉内注射0.8mg/kg的adc或1mg/kg的(brentuximabvedotin)。通过每两周一次的体重测量和每日观察与治疗相关的副作用的临床症状来评估治疗耐受性。当达到人道终点时(例如,1600mm3肿瘤体积)或在给药后最长9周后对小鼠实施安乐死。图中的星号表示对动物实施安乐死。每个治疗组的平均肿瘤体积±标准误差在图2a、3a、4a和5a中呈现,而每个治疗组的个体肿瘤体积在图2b、3b、4b和5b中呈现。所有化合物均被很好地耐受。在肿瘤诱导后第12天,给予小鼠0.8mg/kgadc14、31或32或1mg/kg以更高剂量使用以确保可以观察到该组肿瘤体积的减小。给药各组在至多约20天时显示出肿瘤体积的初始减小。然而,在第20天后,给予(比较)的动物中有7/8的动物显示出肿瘤再生长,如图2a和2b中分别示出的增加的平均肿瘤体积和个体肿瘤体积。根据公认的实践,当一半动物由于肿瘤体积大于1600mm3而被安乐死时,不再绘制示出该组的平均肿瘤体积的图(图2a)。在该组中,在第71天研究结束时,仅有1/8的动物没有可测量的肿瘤。对于adc32(比较),在肿瘤诱导后第22天,4/8的动物具有肿瘤再生长。这在图3a和3b中示出,其显示从第22天至第71天,平均肿瘤体积和个体肿瘤体积均有增加。在该组中,在第41天和第68天对两只小鼠实施安乐死(如星号所示),因为它们的肿瘤体积已达到该模型的最大允许尺寸。在第71天仅有4/8的动物未显示可测量的肿瘤。对于adc14,响应速率显著优于adc32(比较),其中在第71天研究结束时,7/8的动物未显示可测量的肿瘤体积(参见图4a和4b)。仅有一只小鼠显示出任何肿瘤再生长,其在肿瘤诱导后第48天被安乐死(如星号所示)。甚至更令人印象深刻的是,对于给予adc31的组,在给药后没有动物显示任何肿瘤再生长。在第71天研究结束时,8/8的动物均存活,没有可测量的肿瘤(参见图5a和5b)。从这些研究可以清楚地看出,本发明的adc比现有技术的比较adc更有效,其中14和31均显示出比32和更好的杀肿瘤效力。其他发明方面在研究该领域时,发明者发现,当使用一种特定形式的缀合技术将治疗剂、诊断剂和标记剂与肽或蛋白质缀合时,可以获得特别有利的结果。因此,本文公开了由下列项目描述的发明。1.一种缀合物,其包含通过接头与治疗剂、诊断剂或标记剂缀合的蛋白质或肽,其特征在于接头在环内包含至少两个~(ch2-ch2-o-)~单元,并且还包含以下部分:其中w'代表吸电子基团或通过还原吸电子基团而获得的基团,a和b各自独立地代表c1-5亚烷基链或亚烯基链,并且pr代表所述蛋白质或肽,其经由亲核基团nu与a和b键合。2.如项目1所述的缀合物,其包含以下部分:3.如项目1或项目2所述的缀合物,其中每个nu代表在蛋白质或肽pr的半胱氨酸残基中存在的硫原子;或其中每个nu代表附接于蛋白质或肽pr上的多组氨酸标记中存在的咪唑基团。4.如前述项目中任一项所述的缀合物,其中w’代表-co-或-ch(oh)-基团。5.如前述项目中任一项所述的缀合物,其在所述环内包含式~(ch2-ch2-o-)x~的单元,其中x为至少2的数值。6.如项目5所述的缀合物,其中x为2至50。7.如前述项目中任一项所述的缀合物,其中环经由环内单个束缚原子在单个位点处或在两个或更多个位点处附接于接头的其余部分;或其中环经由环内两个或更多个束缚原子在单个位点处或在两个或更多个位点处附接于接头的其余部分。8.如项目7所述的缀合物,其中所述环具有下式:9.如项目7所述的缀合物,其中环经由环内两个或更多个束缚原子在两个或更多个位点处附接于接头的其余部分。10.如项目9所述的缀合物,其中所述环具有下式:11.如前述项目中任一项所述的缀合物,其包含与式iii或iiia的基团紧邻的任选取代的芳基或杂芳基;并且接头还包含与所述芳基或杂芳基相邻的-nra.c(o)-或-c(o).nra-基团,其中ra代表c1-4烷基或氢。12.如前述项目中任一项所述的缀合物,其包含治疗剂。13.如前述项目中任一项所述的缀合物,其中蛋白质或肽为抗体或抗体片段。14.一种缀合试剂,其包含能与蛋白质或肽反应的官能团,所述试剂还包含治疗剂、诊断剂或标记剂以及在环内包含至少两个~(ch2-ch2-o-)~单元的接头,并且其中所述官能团具有下式:其中w代表吸电子基团;a和b各自独立地代表c1-5亚烷基链或亚烯基链;并且每个l独立地代表离去基团,或者两个l一起代表离去基团;或其中w和a具有上文给出的含义,l代表离去基团,且m为0至4。15.如项目14所述的缀合试剂,其中所述官能团具有下式:16.如项目14或项目15所述的缀合试剂,其中w代表-co-基团。17.如项目14至16中任一项所述的缀合试剂,其包含项目2至11中任一项所述的特征。18.如项目14至17中任一项所述的缀合试剂,其中所述离去基团或每个离去基团包含部分-(ch2ch2o)n-,其中n为2以上的数值。19.如项目18所述的缀合试剂,其中所述离去基团或每个离去基团具有式-sp或-so2p,其中p代表包含部分-(ch2ch2o)n-的基团,其中n为2以上的数值。20.一种制备如项目1至13中任一项所述的缀合物的方法,其包括使蛋白质或肽与项目14至19中任一项所述的缀合试剂反应。21.药物组合物,其包含如项目1至13中任一项所述的缀合物,其中有效载荷为治疗剂;以及药学上可接受的载体;以及任选地其他活性成分。本发明方面的具体说明本发明的试剂可通过下式示意性地表示:其中d代表治疗剂、诊断剂或标记剂,f代表能与蛋白质或肽键合的官能团,并且代表包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。官能团f能与蛋白质或肽反应,如下文更为详细的说明。本发明的缀合物可通过下式示意性地表示:其中d代表治疗剂、诊断剂或标记剂,f'代表蛋白质或肽,其通过接头的蛋白质或肽键合部分与缀合物的其余部分键合,并且代表包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。聚乙二醇环在本说明书中,“聚乙二醇环”应理解为意指包含至少两个乙二醇~(ch2-ch2-o-)~单元的环。所述环可包含两个或更多个单独的~(ch2-ch2-o-)~单元,或者其可包含一个或更多个式~(ch2-ch2-o-)x~的单元,其中x为至少2的数值。所述环可包含一个或更多个另外的原子以完成环状结构。另外的原子可为例如氮原子、碳原子、氧原子、硫原子、硅原子和/或磷原子。环可通过环内的单个束缚原子在单个位点处附接于接头的其余部分,或者其可在两个或更多个位点处附接。或者,环可通过环内的两个或更多个束缚原子在单个位点处附接于接头的其余部分,或者其可在两个或更多个位点处附接。束缚原子可为例如氮原子、碳原子、磷原子或硅原子,尤其是氮原子和/或碳原子,并且在与接头的其余部分连接的位点处存在的原子可为例如氮原子或碳原子。以下为在本发明的缀合物或试剂中环与接头的其余部分的可能的附接方式的示意图,t代表环内的束缚原子,peg代表至少两个~(ch2-ch2-o-)~单元:合适的环的具体实例包括以下环,其中符号~表示环并入接头的位点:优选地,环通过环内的单个束缚原子在单个位点处附接于接头的其余部分。在另一个优选的实施方案中,环通过环内的两个或更多个束缚原子在两个或更多个位点处附接于接头的其余部分。环可例如由其中x至少为2、优选2至20的~(ch2-ch2-o-)x~单元组成。或者,环可含有其中x至少为2、优选2至50、尤其是2至20的~(ch2-ch2-o-)x~单元,但是还可包含如上所述的一个或更多个另外的原子,或可以一些其他方式衍生化。缀合物和试剂可以容易地由冠醚合成。冠醚是乙二醇的环状低聚物,并且已知许多不同的冠醚,其中一些完全由乙二醇单元组成,并且其中一些在环内含有另外的原子。例如,氮杂冠醚含有氮原子,而二氮杂冠醚含有两个氮原子。许多冠醚是市售的,并且这些冠醚为本发明的缀合物和试剂的合成提供了方便的起始点。带有可与其他化合物反应的官能团的冠醚是已知的,例如带有羧基、羟基、氨基或醛基的冠醚是已知的,与任选带有官能团(如羧基、羟基、氨基、异氰酸酯基团、硝基或醛基)的苯环稠合的冠醚也是已知的。已知冠醚螯合阳离子,并且us4,838,274中记载了全氟冠醚用于mri。因此,本发明的缀合物可用于成像技术的应用中,例如mri或pet。可并入本发明的缀合物和试剂中的常见冠醚包括以下所示的结构:通过存在于环内的原子、尤其是氮原子,或经由存在于侧链上的基团,例如羟基、氨基、羧基、醛基、异氰酸酯基团或硝基,可将这些冠醚通过反应并入本发明的缀合物和试剂的接头中。可将具有两个官能团或原子的环在两个单独的连接位点处附接于本发明的缀合物和试剂的接头的其余部分,因此并入接头的骨架中。常见的连接如下所示:除了由冠醚衍生的环以外,由穴状配体衍生的环也可用于本发明中。这种环记载于例如us2014/0072900中,并且包括以下环:作为由冠醚或穴状配体起始合成本发明的缀合物和试剂的替代方案,可以制备具有peg链的缀合物或试剂,所述peg链的一端附接于接头的其余部分,然后利用常规化学方法,使链的自由端与接头上其他位置存在的官能团进行反应。在另一种替代的合成方法中,可以制备含有两个垂悬peg链的缀合物或试剂,然后通过每条链上的合适的反应性基团的反应产生环。例如,可以使用烯烃和炔烃闭环易位反应。所有这些合成方法都为本领域技术人员所知晓,并且可制备非常宽范围的本发明的缀合物和试剂,包括其中将环并入接头的骨架中的那些。本发明的缀合物和试剂可含有一个包含至少两个~(ch2-ch2-o-)~单元的环,或者它们可含有两个或更多个这样的环。所述环可为单环,或者可为双环或多环。两个或更多个环可以附接于或并入接头的骨架中,或者它们可以彼此附接,因此:应理解,环可具有许多不同的尺寸和结构。本发明的重要特征在于peg链形成环状结构的一部分:该链不是形成接头的骨架的一部分的线性peg链,也不是一端束缚于接头上但具有自由的未束缚端的垂悬peg链。在一个优选的实施方案中,本发明的缀合物或试剂中的全部peg存在于一个或更多个环内。在另一个实施方案中,peg还可存在于接头的其他位置,尤其是接头的骨架中或将环与接头的骨架连接的基团中,这将在下文更详细地论述。存在于本发明的缀合物和试剂中的~(ch2-ch2-o-)~单元的总数当然取决于预期的应用。对于某些应用来说,可使用高分子量的peg,例如数均分子量可最高达约75000,例如最高达50000、40000或30000g/摩尔。例如,数均分子量可在500g/摩尔至约75000g/摩尔的范围内。但是,对于某些应用来说,可优选较小的peg部分。与本发明的缀合物或试剂中存在的peg的总量一样,存在于环内的~(ch2-ch2-o-)~单元的数目取决于预期的应用。例如,环状peg部分的分子量可最高达3000g/摩尔。然而,在本发明的一个优选的实施方案中,含有少至2个乙二醇单元、例如2至50个乙二醇单元的环状基团对于某些应用来说是有用的,并且作为环状peg基团存在。例如可使用具有2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个重复单元,或24、36、40或48个重复单元的含peg的环。缀合试剂和方法本发明的缀合试剂能与两个亲核基团反应。如果存在两个或更多个离去基团,则它们可以相同或不同。或者,缀合试剂可包含在化学上等同于两个离去基团的单个基团,所述单个基团能与两个亲核基团反应。亲核基团包括硫原子和胺基,蛋白质中的亲核基团例如由半胱氨酸、赖氨酸或组氨酸残基提供。在本发明的一个优选的实施方案中,亲核基团是存在于蛋白质的半胱氨酸残基中的硫原子。这种结构可通过还原存在于蛋白质中的二硫键而获得。在另一个实施方案中,亲核基团可为在附接于蛋白质上的多组氨酸标记中存在的组氨酸残基中的咪唑基团。缀合试剂包含官能团f:其中w代表吸电子基团,例如酮基、酯基-o-co-或砜基-so2-;a和b各自独立地代表c1-5亚烷基链或亚烯基链;并且每个l独立地代表离去基团,或者两个l一起代表离去基团。当包含这类基团的试剂与蛋白质反应时,第一离去基团l脱去以原位形成包含下式的官能团的缀合试剂:其中m为0至4,所述官能团f与第一亲核基团反应。然后脱去第二离去基团l,并且与第二亲核基团发生反应。作为将包含官能团i的试剂用作原料的替代方案,可使用包含官能团ii的试剂,因为官能团i和ii是彼此化学等同的。本发明的这些缀合试剂为在wo2005/007197和wo2010/100430中公开的一般类型。这些试剂可以例如用于靶向通过还原蛋白质中的二硫键而获得的两个硫原子,或者靶向在附接于蛋白质上的多组氨酸标记中存在的组氨酸残基中的咪唑基团。已发现,将本发明的环状peg基团并入这种类型的试剂中,得到特别好的结果,其中有效地发生缀合反应以产生具有高度均匀性的稳定的缀合物。离去基团l可为例如-sp、-op、-so2p、-oso2p、-n+pr2r3、卤素或-o其中p代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基),或为包含部分-(ch2ch2o)n-的基团,其中n为2以上的数值,r2和r3各自独立地代表氢原子、c1-4烷基或基团p,并且代表含有至少一个取代基的取代的芳基,特别是苯基,所述取代基为例如-cn、cf3、-no2、-co2ra、-coh、-ch2oh、-cora、-ora、-ocora、-oco2ra、-sra、-sora、-so2ra、-nhcora、-nracora、-nhco2ra、-nraco2ra、-no、-nhoh、-nraoh、-ch=n-nracora、-n+ra3、卤素(特别是氯,或特别是氟)、-c≡cra和-c=cra2,其中每个ra独立地代表氢原子或烷基(优选c1-6烷基)、芳基(优选苯基),或烷基芳基(优选c1-6烷基苯基)。优选存在吸电子取代基。申请人共同未决的申请gb1418186(公开为wo2016/059377)的主题是这样的缀合试剂,其中p代表包含部分-(ch2ch2o)n-的基团,其中n为2以上的数值,并且如上所述。存在于本发明的新的缀合试剂中的特别优选的离去基团l为-sp或-so2p,特别是-so2p。在该基团中,一个优选的实施方案是p代表苯基,或特别是甲苯基。另一优选的实施方案是p代表包含部分-(ch2ch2o)n-的基团,特别是其中n为上述值之一(尤其是7)的基团。特别优选的离去基团l为-so2-(ch2ch2o)n-h/me,特别是-so2-(ch2ch2o)7-h/me。在本说明书中,对离去基团l的任何提及应理解为包括对这些优选的基团、特别是-so2-(ch2ch2o)n-h/me且更特别是-so2-(ch2ch2o)7-h/me的特别提及。优选地,w代表酮基。优选a和b各自代表-ch2-。上述式i和ii的试剂形成了包含基团f’的缀合物:其中w'代表吸电子基团或通过还原吸电子基团而获得的基团,pr代表经由亲核基团nu与a和b键合的蛋白质或肽。缀合方法(下文将更详细地描述)的直接产物为包含吸电子基团w的缀合物。但是,缀合方法在合适的条件下是可逆的。这对于某些应用来说可能是期望的,例如在需要快速释放蛋白质的情形下,但对于其他应用而言,快速释放蛋白质可能是不期望的。因此,可能需要通过将吸电子部分还原成阻止蛋白质释放的部分来稳定缀合物。因此,缀合方法可包括另外的任选步骤:还原缀合物中的吸电子基团。特别优选使用硼氢化物,例如硼氢化钠、氰基硼氢化钠、硼氢化钾或三乙酰氧基硼氢化钠作为还原剂。可使用的其他还原剂包括例如氯化锡(ii)、醇盐如烷醇铝,以及氢化铝锂。因此,例如,含有酮基的部分w可被还原成含有ch(oh)基团的部分;醚基ch.ora可通过羟基与醚化剂反应得到;酯基ch.o.c(o)ra可通过羟基与酰化剂反应得到;氨基ch.nh2、ch.nhra或ch.nra2可由酮通过还原胺化反应制得;或酰胺ch.nhc(o)ra或ch.n(c(o)ra)2可通过胺的酰化形成。砜可被还原成亚砜、硫化物或硫醚。优选基团f’和f具有下式:尤其是在上式中,优选的离去基团如上所述。优选每个nu为硫原子。本发明的缀合试剂可包含多于一种与蛋白质反应的官能团。例如,试剂可在分子的一端包含官能团、优选式i或ii的官能团,并在分子的其他位置包含一个或更多个另外的官能团。这样的结构记载于例如belcheva等人,j.biomater.scipolymeredn.9(3),207-226,并且适用于合成包含多个蛋白质的缀合物。可通过与已知方法类似的方法来制备本发明的新的缀合试剂。具体的反应在实施例中说明。本发明的缀合试剂可与蛋白质或肽反应以形成本发明的缀合物,并且这种反应构成本发明的另一方面。使用式i或ii的缀合试剂的关键特征在于,α-亚甲基离去基团和双键与充当迈克尔活化部分的吸电子官能团交叉共轭。如果离去基团易于在交叉官能化试剂中消除而非直接置换,并且吸电子基团为适合迈克尔反应的活化部分,则相继的分子内双烷基化可通过连续的迈克尔反应和逆迈克尔反应进行。在含有官能团i的试剂中,离去基团用于掩蔽潜在的共轭双键,其直到发生第一次烷基化反应从而得到包含官能团ii的试剂后才暴露,并且双烷基化反应是由相继的和交互的迈克尔反应和逆迈克尔反应产生的。交叉官能化的烷基化试剂可包含与双键共轭的或位于离去基团和吸电子基团之间的多重键。当经由源自蛋白质中的二硫键的两个硫原子与蛋白质键合时,所述方法可通过还原二硫键随后将还原产物与本发明的试剂反应而进行。优选地,在引入缀合试剂之前还原二硫键,并例如通过缓冲液交换来除去任何过量的还原剂。可使用常规方法,使用例如二硫苏糖醇、巯基乙醇或三羧基乙基膦来还原二硫键。可在与已知缀合方法类似的条件下进行缀合反应,包括wo2005/007197、wo2009/047500、wo2014/064423、wo2014/064424和wo2015/057699中公开的条件。所述方法例如可在溶剂或溶剂混合物中进行,其中所有反应物均可溶于所述溶剂或溶剂混合物。例如,可使蛋白质与聚合物缀合试剂在水性反应介质中直接反应。该反应介质还可以是缓冲的,这取决于亲核基团的ph要求。反应的最佳ph通常为至少4.5,经常为约5.0至约8.5,优选约6.0至7.5。最佳的反应条件当然取决于所用的具体反应物。当使用水性反应介质时,3-40℃的反应温度通常是合适的。在有机介质(例如thf、乙酸乙酯、丙酮、dmso、dmf、mecn)中进行的反应通常在最高达环境温度的温度下进行。在一个优选的实施方案中,反应在水性缓冲液中进行,所述水性缓冲液可包含一定比例的有机溶剂,例如最高达20体积%的有机溶剂,通常5至20体积%的有机溶剂。使用化学计量相当或稍微过量的缀合试剂可有效地缀合蛋白质。然而,还可使用化学计量过量的缀合试剂进行缀合反应,这对于一些蛋白质而言可能是期望的。可将过量的试剂例如通过离子交换色谱法或hplc在随后的缀合物纯化过程中容易地除去。当然,当蛋白质包含足够的合适的连接位点时,可将多于一种缀合试剂与蛋白质缀合。例如,在含有两种不同的二硫键的蛋白质中,或在含有一个二硫键以及携带多组氨酸标记的蛋白质中,每分子蛋白质可缀合两分子试剂,并且这种缀合物构成本发明的一部分。有效载荷、蛋白质、接头和药物组合物以及实用性上述“有效载荷”、“蛋白质”、“接头”和“药物组合物以及实用性”部分中存在的全部材料均适用于本发明的这方面。序列表<110>宝力泰锐克斯有限公司<120>新的缀合物和新的缀合试剂<130>p025013wo<150>gb1606543.5<151>2016-04-14<160>2<170>siposequencelisting1.0<210>1<211>446<212>prt<213>人工的(artificial)<400>1glnileglnleuglnglnserglyprogluvalvallysproglyala151015servallysilesercyslysalaserglytyrthrphethrasptyr202530tyrilethrtrpvallysglnlysproglyglnglyleuglutrpile354045glytrpiletyrproglyserglyasnthrlystyrasnglulysphe505560lysglylysalathrleuthrvalaspthrserserserthralaphe65707580metglnleuserserleuthrsergluaspthralavaltyrphecys859095alaasntyrglyasntyrtrpphealatyrtrpglyglnglythrgln100105110valthrvalseralaalaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysasplysthrhis210215220thrcysproprocysproalaprogluleuleuglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserhisgluaspproglu260265270vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglntyrasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysalaleuproalaproileglulysthrile325330335serlysalalysglyglnproarggluproglnvaltyrthrleupro340345350proserargaspgluleuthrlysasnglnvalserleuthrcysleu355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleutyrserlysleuthrvalasplysserarg405410415trpglnglnglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserprogly435440445<210>2<211>218<212>prt<213>人工的(artificial)<400>2aspilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasppheasp202530glyaspsertyrmetasntrptyrglnglnlysproglyglnpropro354045lysvalleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuasnilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnserasn859095gluaspprotrpthrpheglyglyglythrlysleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1